一种浓缩脂肪干细胞培养上清制剂、其制备方法及应用与流程
本发明属于医疗卫生
技术领域:
,具体涉及一种浓缩脂肪干细胞培养上清制剂、其制备方法及应用。
背景技术:
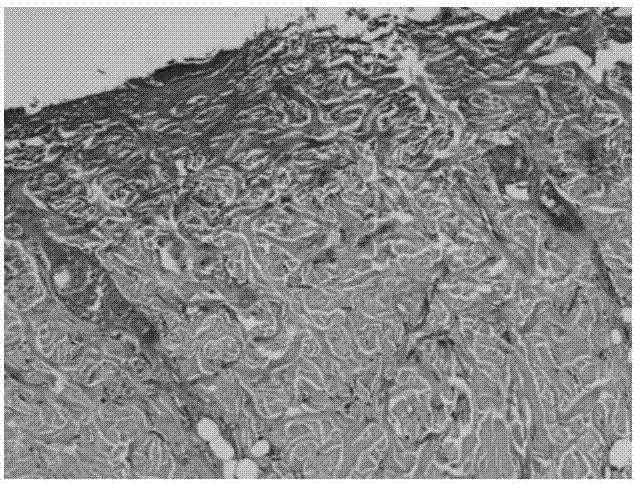
:由火焰、热液、电等物理因素和强酸、强碱等化学物质引起的组织损伤统称为烧烫伤,它是日常生活与工作中的常见病。烫伤严重时会造成深部组织坏死,如果处理不当,严重会发生溃烂,长时间都无法愈合。烫伤创面愈合过程主要包括炎症反应期、细胞增殖期及结构重塑期。组织损伤后,炎性渗出后逐渐出现成纤维细胞和毛细血管内皮细胞的增殖,随着肉芽组织的形成,新生上皮向创面中心推进,逐渐填补创口覆盖创面直至创面愈合。目前针对烫伤后的处理手段主要包括:物理降温、创面消毒与灭菌和使用抗生素预防感染。显然,这些处理手段仅属于急性期的预防措施,并不能对烫伤后创面修复产生直接作用。更有甚者,处理不当会加重伤情。例如,以流水冲洗降温可能导致的不良反应包括:由流水细菌造成并发感染、因流水作用使伤口开裂或皮肤皱缩,愈合后遗留疤痕、因体温降低过多导致休克等。现有医疗手段也有尝试采用干细胞对创面进行修复治疗,但是现有这种治疗方式需要保持干细胞正常生长,因此常常需要现用现配置,很难保质,使用非常受限。综上所述,现有对于烫伤创面的修复手段不合理,不良反应多,操作繁琐,应用受限。因此一种能够对皮肤烫伤创面修复具有良好效果且使用方便的治疗制剂亟待开发研究。技术实现要素:为了解决现有技术存在的上述问题,本发明提供一种浓缩脂肪干细胞培养上清制剂,本发明目的是通过大量的细胞因子的生物活性强烈促进有丝分裂和参与干细胞诱导分化,继而参与组织细胞的生长、再生和重建,迅速完成对于创面的修复。本发明中还相对应的提供的所述浓缩脂肪干细胞培养上清制剂的制备方法以及应用。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂,所述浓缩脂肪干细胞培养上清制剂主要由脂肪组织来源的间充质干细胞培养的细胞培养液的上清液浓缩而得。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂,优选的方案是,所述浓缩脂肪干细胞培养上清制剂还添加有hregf、vegf和bfgf。进一步优选的,hregf、vegf和bfgf添加后的浓度各自分别依次为0.08~0.15μg/ml、0.05~0.11μg/ml和0.01~0.10μg/ml。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂,优选的方案是,所述浓缩的倍数为3~6倍,所述浓缩的方法为透析法。根据本发明的具体实施方式,本发明的另一目的是提供所述浓缩脂肪干细胞培养上清制剂的制备方法,包括以下步骤:s1取脂肪细胞,使用生理盐水进行清洗,然后加入等体积的胶原酶消化,消化后离心,去上清液;s2置入脂肪干细胞无血清培养基,重悬后转入细胞培养瓶进行培育;s3收集传代前的上清液,将上清液浓缩后制成细胞培养液,添加hregf、vegf和bfgf即得。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂的制备方法,优选的方案是,s1中,所述胶原酶为i型胶原酶,所述消化的时间为30~60min,所述i型胶原酶的浓度为0.1%~0.5%。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂的制备方法,优选的方案是,s1中,所述离心具体为:将消化后的脂肪细胞用直径为70μm的滤膜过滤,再在2000rpm/min的条件下离心5~10min。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂的制备方法,优选的方案是,s2中,所述脂肪干细胞无血清培养基中添加有hregf、vegf和bfgf,hregf、vegf和bfgf添加后的培养基中的浓度分别为0.08~0.15μg/ml、0.05~0.11μg/ml和0.01~0.10μg/ml。根据本发明的具体实施方式的浓缩脂肪干细胞培养上清制剂的制备方法,优选的方案是,s3中,浓缩后经直径0.22μm滤膜过滤除菌,添加hregf、vegf和bfgf后所得浓缩脂肪干细胞培养上清制剂中hregf、vegf和bfgf的浓度分别为0.08~0.15μg/ml、0.05~0.11μg/ml和0.01~0.10μg/ml。根据本发明的具体实施方式,本发明的再一目的是提供所述浓缩脂肪干细胞培养上清制剂在制备治疗烫伤的药物中的应用。优选的,所述烫伤包括但不限制于火焰、热液、电等物理因素以及强酸和强碱等化学物质所引起的组织损伤。所述药物包括但不限制于液剂、粉剂、雾剂、丸剂和贴敷药膏等剂型。本发明中,脂肪干细胞经体外培养可分泌多种细胞因子,如vegf、hgf、bfgf、igf-i、sdf-1α等。这些细胞因子主要的生物学活性是强烈促进有丝分裂和参与干细胞诱导分化,因而能够参与组织细胞的生长、再生和重建。本发明的具体有益效果如下:其一,本发明选用脂肪干细胞的浓缩培养上清制剂作为治疗烫伤的核心内容,能够有效迅速修复烫伤创面,并且修复过程副作用低、见效快,填补了市面上直接促进烫伤后创面修复的外用药缺乏的空缺。其二,本发明的浓缩脂肪干细胞培养上清制剂促进烫伤创面修复效果明显,与rhegf阳性对照例、浓缩倍数与细胞因子浓度不同的两对比例相比,使用7d后,创面表皮完整且厚,并且已经有分泌细胞出现,且分泌能力强;皮下胶原排列有序;毛囊、血管再生规律且较多。其三,本发明的浓缩脂肪干细胞培养上清制剂来源于人,无种属问题;并且成品中不含活细胞成分,不存在伦理学或免疫安全问题,并且无需现用现配,应用方便。其四,本发明的浓缩脂肪干细胞培养上清制剂在培养脂肪干细胞时所用的培养基中添加细胞因子,更有益于烫伤后创面的高效修复。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为烫伤后皮肤使用本发明实施例1治疗7d后皮肤40倍h&e染色切片。图2为烫伤后皮肤使用hregf阳性对照例治疗7d后皮肤40倍h&e染色切片。图3为烫伤后皮肤使用本发明实施例2治疗7d后皮肤40倍h&e染色切片。图4为烫伤后皮肤使用本发明实施例3中实例一治疗7d后皮肤40倍h&e染色切片。图5为烫伤后皮肤使用本发明实施例3中实例二治疗7d后皮肤40倍h&e染色切片。图6为烫伤后皮肤使用本发明实施例4治疗7d后皮肤40倍h&e染色切片。具体实施方式为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行详细的描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。实施例1:本实施例提供一种浓缩脂肪干细胞培养上清制剂,其是主要由脂肪组织来源的间充质干细胞培养的细胞培养液的上清液浓缩而得。本实施例的浓缩脂肪干细胞培养上清制剂的具体制备方法为:取脂肪组织40ml(脂肪组织来源于动物,优选来源于人),加入浓度为0.1%~0.5%的i型胶原酶消化30~60min,用生理盐水洗涤后,在2000rpm/min的条件下离心5~10min,取沉淀细胞,用生理盐水清洗重悬,用直径为70μm的滤膜过滤,得到脂肪干细胞用添加gmp标准的hregf、vegf与bfgf(浓度依次分别为0.08~0.15μg/ml、0.05~0.11μg/ml与0.01~0.10μg/ml)的脂肪干细胞无血清培养基进行培养;本实施例中的脂肪干细胞无血清培养基在co2含量为5%的潮湿无菌气体环境,温度为37℃的孵箱中进行培养。细胞培养传代至第三代的脂肪干细胞经表型鉴定,cd49d、cd105表达为阳性,而cd106为阴性,成脂成骨诱导实验证实其具有多向分化潜能细胞的特质。细胞培养至第三~五代,收集细胞生长至90%融合状态时的上清液,透析浓缩3~6倍并经直径0.22μm滤膜过滤除菌,最后添加gmp标准的hregf、vegf与bfgf(添加后终浓度依次分别为0.08~0.15μg/ml、0.05~0.11μg/ml与0.01~0.10μg/ml)制成成品。实施例2:本实施例提供一种浓缩脂肪干细胞培养上清制剂,与实施例1的区别在于,本实施例的浓缩脂肪干细胞培养上清制剂的最后步骤中去除了使用添加细胞因子hregf、vegf与bfgf的步骤。本实施例的具体步骤为:取脂肪组织40ml,加入浓度为0.1%~0.5%的i型胶原酶消化30~60min,用生理盐水洗涤后,在2000rpm/min的条件下离心5~10min,取沉淀细胞,用生理盐水清洗重悬,用直径为70μm的滤膜过滤,得到脂肪干细胞用添加gmp标准的hregf、vegf与bfgf(浓度分别为0.08~0.15μg/ml、0.05~0.11μg/ml与0.01~0.10μg/ml)的脂肪干细胞无血清培养基进行培养;本实施例中的脂肪干细胞无血清培养基在co2含量为5%的潮湿无菌气体环境,温度为37℃的孵箱中进行培养。细胞培养传代至第三代的脂肪干细胞经表型鉴定,cd49d、cd105表达为阳性,而cd106为阴性,成脂成骨诱导实验证实其具有多向分化潜能细胞的特质。细胞培养至第三~五代,收集细胞生长至90%融合状态时的上清液,透析浓缩3~6倍并经直径0.22μm滤膜过滤除菌制成成品。实施例3:本实施例提供一种浓缩脂肪干细胞培养上清制剂,与实施例1的区别在于,成品制备中最后添加的gmp标准的hregf、vegf与bfgf与实施例1不同。本实施例3分为两个实例,分别如下:实例一:本实例一的具体步骤为:取脂肪组织40ml,加入浓度为0.3%的i型胶原酶消化30~60min,用生理盐水洗涤后,在2000rpm/min的条件下离心5~10min,取沉淀细胞,用生理盐水清洗重悬,用直径为70μm的滤膜过滤,得到脂肪干细胞用添加gmp标准的hregf、vegf与bfgf(浓度分别为浓度分别为0.08~0.15μg/ml、0.05~0.11μg/ml与0.01~0.10μg/ml)的脂肪干细胞无血清培养基;本实施例中的脂肪干细胞无血清培养基为在co2含量为5%的潮湿无菌气体环境,温度为37℃的孵箱中进行培养。细胞培养传代至第三代的脂肪干细胞经表型鉴定,cd49d、cd105表达为阳性,而cd106为阴性,成脂成骨诱导实验证实其具有多向分化潜能细胞的特质。细胞培养至第三~五代,收集细胞生长至90%融合状态时的上清液,透析浓缩3~5倍并经直径0.22μm滤膜过滤除菌,最后添加gmp标准的hregf、vegf与bfgf(最终含量浓度依次分别为0.25μg/ml、0.15μg/ml与0.20μg/ml)制成成品。实例二:本实例二的具体步骤为:取脂肪组织40ml,加入浓度为0.3%的i型胶原酶消化30~60min,用生理盐水洗涤后,在2000rpm/min的条件下离心5~10min,取沉淀细胞,用生理盐水清洗重悬,用直径为70μm的滤膜过滤,得到脂肪干细胞用添加gmp标准的hregf、vegf与bfgf(浓度分别为浓度分别为0.08~0.15μg/ml、0.05~0.11μg/ml与0.01~0.10μg/ml)的脂肪干细胞无血清培养基进行培养;本实施例中的脂肪干细胞无血清培养基为在co2含量为5%的潮湿无菌气体环境,温度为37℃的孵箱中进行培养。细胞培养传代至第三代的脂肪干细胞经表型鉴定,cd49d、cd105表达为阳性,而cd106为阴性,成脂成骨诱导实验证实其具有多向分化潜能细胞的特质。细胞培养至第三~五代,收集细胞生长至90%融合状态时的上清液,透析浓缩3~5倍并经直径0.22μm滤膜过滤除菌,最后添加gmp标准的hregf、vegf与bfgf(最终含量浓度依次分别为0.025μg/ml、0.01μg/ml与0.005μg/ml)制成成品。实施例4:本实施例提供一种浓缩脂肪干细胞培养上清制剂,与实施例1的区别仅在于,去除透析浓缩的步骤。实施例5:本实施例提供一种浓缩脂肪干细胞培养上清制剂,包括四个平行试验,与实施例1的区别仅在于,四个平行试验中最后添加gmp标准的hregf的终浓度分别依次为0.08μg/ml、0.10μg/ml、0.12μg/ml和0.15μg/ml。实施例6:本实施例提供一种浓缩脂肪干细胞培养上清制剂,包括四个平行试验,与实施例1的区别仅在于,四个平行试验中最后添加gmp标准的bfgf的终浓度分别依次为0.01μg/ml、0.04μg/ml、0.07μg/ml和0.10μg/ml。实施例7:本实施例提供一种浓缩脂肪干细胞培养上清制剂,包括四个平行试验,与实施例1的区别仅在于,四个平行试验中最后添加gmp标准的vegf的终浓度分别依次为0.05μg/ml、0.06μg/ml、0.08μg/ml和0.11μg/ml。采用上述实施例1~7所制得的成品对大鼠进行试验,试验方式如下:一、建立大鼠皮肤深二度烫伤模型1.大鼠采用水合氯醛麻醉后的方式,采用98摄氏度水蒸汽烫伤10秒,使烫伤达到深ⅱ度。2.治疗方法:每组重复三次。每天两次,取定量的药物涂抹于烫伤表面,轻轻打圈至完全吸收,连续使用7d,治疗过程观察皮肤感染与修复情况,以及大鼠饮食行动等其它反应。3.治疗效果检测治疗时间结束后处死大鼠,取皮肤全层及附带部分皮下组织送病理切片,每一份标本进行h&e染色;检测结果如下:3.1实施例1表皮完整且厚,已经有分泌细胞生成,且分泌能力强;胶原排列有序;有毛囊,血管规律生长且较多;皮下胶原生成且排列整齐,效果较hregf组和实施例2与3的都好;hregf对照组:表皮层完全缺损,皮下胶原排列紊乱;阴性对照组:表皮层缺损,胶原紊乱;实施例2:上皮细胞不够延续,且数量少,胶原层较缺失,炎性浸润集中在局部,新生血管数量多,少许毛囊,提示形成难愈合疤痕;实施例3中的实例一和二:上皮完整连续,但分泌细胞较少,胶原排列整齐,炎性细胞浸润,血管较多,无新生毛囊,提示形成肉芽组织;结论:实施例1有良好的促进烫伤创面修复的功能,且效果明显优于其余对照组。治疗全程家兔饮食行动正常。3.2根据h&e染色的结果整理出修复情况表,修复情况如表1所示,表1中的+代表修复程度,+越多,修复效果越好,-代表未有修复。表1表皮胶原炎性浸润血管毛囊实施例1++++++++-++++hregf-++-++实施例2+++++++++实施例3实例一+++++++++++-实施例3实例二+++++++++-注:“+”的多少代表治疗后组织修复的程度。综上可知:通过附图1~5以及表1中的数据可知,实施例2和3的结果可以证明在只有在本发明的浓度范围值内才能达到最好的修复效果,实施例3的两个实例以及实施例2相互比较可见,以最终成品阶段不添加rhegf、vegf和bfgf的实施例1对应的组织修复效果最差,以较高添加浓度的实施例3中的实例二对应的组织修复效果相对较好,但是都没有本发明预定范围内实施例所对应细胞因子添加浓度下的组织修复效果好,本发明的细胞培养液与rhegf、vegf和bfgf之间存在相互促进的效果,并且对于其各自含量有一定的要求。本发明的效果均十分显著。对比附图1与附图6可知,附图1中的治疗效果较之于附图6有显著的提升。表明实施例1中进行了浓缩步骤处理后,对烫伤的治疗效果有了显著的提升。实施例5中的四个平行试验进行了hregf最终浓度对治疗效果的影响,四个平行试验依据前述大鼠试验方式进行效果比对验证,分析结果列于下表2。表2注:“+”的多少代表代表治疗后组织修复的程度。分析表2可知,hregf在预定浓度范围(0.08μg/ml~0.15μg/ml)内时,均能起到预定的烫伤修复治疗效果,并且当hregf浓度在范围内浓度越高时,治疗修复效果越好。实施例6中的四个平行试验进行了bfgf最终浓度对治疗效果的影响,四个平行试验依据前述大鼠试验方式进行效果比对验证,分析结果列于下表3。表3注:“+”的多少代表代表治疗后组织修复的程度。分析表3可知,bfgf在预定浓度范围(0.06μg/ml~0.15μg/ml)内时,均能起到预定的烫伤修复治疗效果,并且当bfgf浓度在0.13μg/ml时,治疗修复效果最好,尤其对于表皮的修复作用,有较大提高。实施例7中的四个平行试验进行了vegf最终浓度对治疗效果的影响,四个平行试验依据前述大鼠试验方式进行效果比对验证,分析结果列于下表4。表4注:“+”的多少代表代表治疗后组织修复的程度。分析表4可知,vegf在预定浓度范围(0.05μg/ml~0.11μg/ml)内时,均能起到预定的烫伤修复治疗效果,并且当vegf浓度在0.08μg/ml时,治疗修复效果最好,尤其对于血管的再生作用,有较大提高。以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本
技术领域:
的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。因此,本发明的保护范围应以所述权利要求的保护范围为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1