一种去除富含细胞因子血清中促炎因子的方法与流程
本发明属于生物医药技术领域,具体涉及一种去除富含细胞因子血清中促炎因子的方法。
背景技术:
骨关节炎为一种退行性病变,系由于增龄、肥胖、劳损、创伤、关节先天性异常、关节畸形等诸多因素引起的关节软骨退化损伤、关节边缘和软骨下骨反应性增生等。临床表现为缓慢发展的关节疼痛、压痛、僵硬、关节肿胀、活动受限和关节畸形等。
骨关节炎的常规治疗手段分为保守治疗和手术疗法。保守治疗以全身用药和关节内局部用药为主。早期骨关节炎患者,可对症给予口服消炎镇痛药或活血化瘀的药物治疗,关节软骨保护剂透明质酸或水凝胶的关节内注射也能起到一定的缓解效果,以上药物的运用以达到改善症状、提高生活质量的目的。对于关节疼痛、肿胀明显,行走功能障碍,核磁共振显示有软骨破坏,关节内有游离体、骨赘增生或伴有半月板损伤的骨关节炎病人,则应求助于外科手术。外科治疗骨关节炎的手术方法有关节镜清理术、软骨全层损伤区钻孔减压微骨折术、胫骨高位截骨矫正力线术和人工关节置换术。
但是,鉴于保守治疗的效果欠佳,外科手术治疗的风险较大,近年来,基础科研阶段和临床运用阶段新兴了多种骨关节炎类似疾病的治疗方法,比如富血小板血浆(prp)法、干细胞移植疗法、软骨细胞移植疗法、生长因子及凝胶载体的应用,多种新兴疗法在基础科研及临床试验阶段取得了不错的疗效。
acs技术是利用自身的血液,加以医疗级玻璃小珠和特殊物质的共同刺激,通过离心手段,提取出富含细胞因子的血清的最新生物技术。大量研究和临床实验表明:提取的富细胞因子血清在缓解组织炎症方面具有显著的作用,并且操作简单、具有很高的安全性。经过对acs血清中成分的定量浓度测定,结果发现acs中含有il-1ra、il-6、il-8、tnfα等,并且用了细胞因子抗体芯片的检测方法对36种细胞因子进行了半定量的含量检测,结果证明制备的自体血清当中,含有大量的il-1ra和多种抗炎因子,另外,自体血清中还含有一部分的趋化因子和促炎因子,这些趋化因子能够招募更多的免疫细胞来到炎症部位,加快炎症反应进程。自体血清用于临床治疗的文献报道非常多。frisbie等证明了自体血清技术对膝关节炎的治疗具有显著作用;astolfi等证明了自体血清技术在骨关节炎治疗中的积极作用;baltzer等证明了自体血清对于髋关节炎有积极临床作用;baltzer等证明了自体血清对骨关节炎有非常好的疗效,并且从副作用发生率上看,自体血清治疗组和安慰剂组没有明显差别,但是透明质酸治疗组发生的副作用反应明显增多。但是根据结果,我们发现在il-1ra生成的同时,il-6和tnfα的变化也非常剧烈,因il-6和tnfα属于促炎因子,所以该技术在此基础上可以再进行优化,选择合理可行的方法将自体血清中大量的il-6和tnfα去除,并保留有用的il-1ra和其余的多种生长因子,以此取得更好的临床治疗效果。
抗原抗体反应指抗原与相应抗体之间所发生的特异性结合反应。这种反应既可在机体内进行,也可以在机体外进行。抗原抗体反应的过程是经过一系列的化学和物理变化,包括抗原抗体特异性结合和非特异性促凝聚两个阶段,以及由亲水胶体转为疏水胶体的变化。抗原抗体体外发生的特异性结合反应后出现凝集(agglutination)、沉淀(precipitation)等现象验来检测相应的抗体或抗原。
技术实现要素:
本发明的目的是为了解决现有技术的不足,提供一种去除富含细胞因子血清中促炎因子的方法,该方法是采用一种特殊的琼脂糖凝胶微球作为抗原-抗体结合的链接物,因其具有一定的重量,可通过离心的方式将其从溶液中去除,这种微球的表面偶联了高密度的rproteina/g,可以高效的与抗体相结合,并具有较低的蛋白非特异吸附力,通过微球和抗体的结合,再与acs共同孵育,则可通过微球表面的特异性抗体将acs中的抗原吸附掉,达到去除促炎因子的效果,以保证acs在临床使用时的有效性和低副作用特性。
为实现上述目的,本发明采用的技术方案如下:
一种去除富含细胞因子血清中促炎因子的方法,包括如下步骤:
步骤(1),采血设备的准备:将3mm医疗级玻璃小珠用超纯水洗净后烘干,按每3ml全血加入10颗的比例将玻璃小珠预先放置于直接获得富含细胞因子血清的采血器中,之后进行高压灭菌,65~70℃烘干,备用;
同时对抗原抗体结合反应试剂进行准备,所述的抗原抗体结合反应试剂为结合/清洗buffer,含有0.15mnacl和20mmna2hpo4,ph为7.0;
步骤(2),富细胞因子血清的获得:采用步骤(1)准备好的采血器采集静脉血液,摇匀后放置于37℃的恒温培养箱内孵育20~24h,之后将采血器内的上层血清离心,去沉淀后使用0.22μm无菌滤器过滤,滤液即为富含细胞因子的血清;
步骤(3),rproteina/g微球的预处理:取rproteina/g微球离心,弃上清后,加入结合/清洗buffer悬浮微球,再次离心,弃上清,再重复加入结合/清洗buffer悬浮微球到弃上清这一过程多次;
步骤(4),抗体工作溶液的配制:采用步骤(1)中配制好的结合/清洗buffer分别对il-6、tnfα的抗体进行稀释,稀释至il-6的抗体浓度为0.7~1μg/ml,tnf-α的抗体浓度为1.2~1.8μg/ml,得到il-6抗体溶液和tnfα抗体溶液;
步骤(5),rproteina/g微球与抗体的结合:采用步骤(4)中配制好的il-6抗体溶液和tnfα抗体溶液将经步骤(3)中预处理好的微球悬浮,室温下混合使微球与抗体充分结合,离心,弃上清;
每100μl微球需加入il-6抗体溶液1ml和tnfα抗体溶液tnfα抗体溶液1ml;
步骤(6),清洗:采用步骤(1)中配制好的结合/清洗buffer将经步骤(5)处理得到微球悬浮,离心,弃上清,重复采用步骤(1)中配制好的结合/清洗buffer微球悬浮到弃上清这一过程多次,得到微球-抗体复合物;
步骤(7),rproteina/g微球-抗体结合物与抗原的结合反应:将步骤(2)中得到的富含细胞因子的血清加入步骤(6)中制备好的微球-抗体复合物,按照100μl微球-抗体复合物加1ml富含细胞因子的血清的比例,在室温下混合使抗原与抗体充分结合,离心,取上清用0.22μm无菌滤器过滤,即得到去除了促炎因子il-6和tnfα的富含细胞因子的血清。
进一步,优选的是,步骤(2)所述的离心速度为3000~3500r/min,离心时间为5min。
进一步,优选的是,步骤(2)所述的离心速度为3000~3500r/min,离心时间为5~8min。
进一步,优选的是,步骤(3)中离心速度为450~500r/min,每次离心时间均为1min。
进一步,优选的是,步骤(3)和步骤(6)中所述的多次均为两次。
进一步,优选的是,步骤(4)中稀释的体积比都为1:200~300。
进一步,优选的是,步骤(5)中室温下混合是采用翻转混合仪或盘旋混合仪混合,混合时间为30~60min。
进一步,优选的是,步骤(5)和步骤(6)中离心速度均为450~500r/min,每次离心时间为1min。
进一步,优选的是,步骤(7)中室温下混合是采用翻转混合仪或盘旋混合仪混合,混合时间为30~60min。
进一步,优选的是,步骤(7)中离心速度均为450~500r/min,离心时间为1min。
本发明方法中进行悬浮时,对所采用液体体积没有限制,只要能达到悬浮效果即可。
本发明与现有技术相比,其有益效果为:
采用本发明技术方案,可将富细胞因子的自体血清中中大量的il-6和tnfα特异性的去除,跟未经此技术处理的富细胞因子的自体血清中细胞因子的浓度相比,il-6的去除效率为9.2倍,tnfα的去除效率为12.1倍,并保留有用的il-1ra和其余的多种生长因子,il-1ra在去除前后的浓度基本维持不变,以此取得更好的临床治疗效果。通过此方法去除的acs血清经检测符合临床应用标准,能在临床应用中表现出更好的疗效和更少的副作用。
附图说明
图1抗体吸附方法去除前后acs中il-6的含量图;
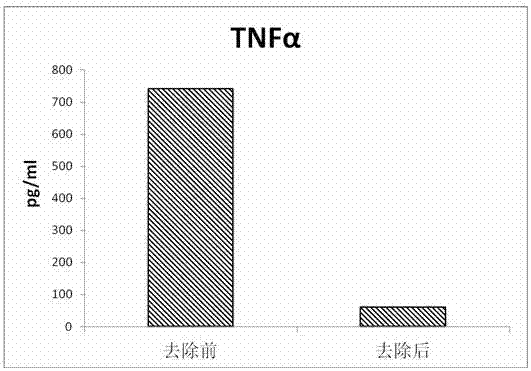
图2抗体吸附方法去除前后acs中tnfα的含量图;
图3抗体吸附方法去除前后acs中il-1ra的含量图。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用材料或设备未注明生产厂商者,均为可以通过购买获得的常规产品。
本发明中所述的直接获得富含细胞因子血清的采血器为zl201610314952.x产品。
本发明中rproteina/g微球购自北京索莱宝科技有限公司;
il-6的抗体购自美国proteintech公司;
tnfα的抗体购自美国proteintech公司;
翻转混合仪购自海门市其林贝尔仪器制造有限公司;
盘旋混合仪购自海门市其林贝尔仪器制造有限公司.
实施例1
一种去除富含细胞因子血清中促炎因子的方法,包括如下步骤:
步骤(1),采血设备的准备:将3mm医疗级玻璃小珠(vwrinternational)用超纯水洗净后烘干按每3ml全血加入10颗的比例将玻璃小珠预先放置于直接获得富含细胞因子血清的采血器中,之后进行高压灭菌,65℃烘干,备用;其中,高压灭菌的温度为121℃,压力为100kpa,灭菌时间为20分钟;
同时对抗原抗体结合反应试剂进行准备,所述的抗原抗体结合反应试剂为结合/清洗buffer,含有0.15mnacl和20mmna2hpo4,ph为7.0;
步骤(2),富细胞因子血清的获得:静脉血液采集后,充分缓慢摇匀,保证玻璃小珠与新鲜全血充分接触,将装有全血和玻璃小珠的特制采血套装放置于37℃的恒温培养箱内,进行22h的恒温孵育,经过恒温放置,血液凝固后会出现分层,将上层血清转移至15ml离心管,用离心机,以3000r/min的转速,离心5min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,滤液即为富含细胞因子的血清(acs);
步骤(3),rproteina/g微球的预处理:
用步骤(1)中配制好的结合/清洗buffer进行琼脂糖微球的预处理,具体为:取适量的rproteina/g微球加入到2ml离心管中,480rpm离心1分钟,吸弃上清;加入1ml结合/清洗buffer,悬浮微球,480rpm离心1分钟,吸弃上清,再重复两次;
步骤(4),抗体工作溶液的配制:
用步骤(1)中配制好的结合/清洗buffer进行抗体的配制,具体为:抗体稀释的比例按照不同的抗体说明书会有所不同,本实验中,il-6、tnfα的抗体稀释比例都为1:300,il-6的抗体浓度为1μg/ml,tnf-α的抗体浓度为1.8μg/ml;
步骤(5),rproteina/g微球与抗体的结合:采用步骤(4)中配制好的il-6抗体溶液和tnfα抗体溶液将经步骤(3)中预处理好的微球悬浮,室温下放置于翻转混合仪或盘旋混合仪上,缓慢晃动离心管,30分钟后,500rpm离心1分钟,吸弃上清;
每100μl微球需加入il-6抗体溶液1ml和tnfα抗体溶液tnfα抗体溶液1ml;
步骤(6),清洗:采用步骤(1)中配制好的结合/清洗buffer将经步骤(5)处理得到微球悬浮,500rpm离心1分钟,弃上清,重复采用步骤(1)中配制好的结合/清洗buffer微球悬浮到弃上清这一过程多次,得到微球-抗体复合物;
清洗的目的是去除非特异性吸附的杂蛋白;
步骤(7),rproteina/g微球-抗体结合物与抗原的结合反应:将步骤(2)中得到的富含细胞因子的血清(acs)加入步骤(6)中制备好的微球-抗体复合物,按照100μl微球-抗体复合物加1ml富含细胞因子的血清的比例,并用移液器轻轻吹打混匀,在室温下放置于翻转混合仪或盘旋混合仪上,缓慢翻转离心管,使抗原与抗体充分结合,60分钟后,500rpm离心1分钟,保留上清,并使用使用0.22μm无菌滤器过滤,即得到去除了促炎因子il-6和tnfα的自体血清(acs),将其分装至灭菌的1.5ml离心管中,-80度保存备用,另外留取500ul放置于-20℃作为检测待用。
实施例2
一种去除富含细胞因子血清中促炎因子的方法,包括如下步骤:
步骤(1),采血设备的准备:将3mm医疗级玻璃小珠(vwrinternational)用超纯水洗净后烘干按每3ml全血加入10颗的比例将玻璃小珠预先放置于直接获得富含细胞因子血清的采血器中,之后进行高压灭菌,70℃烘干,备用;其中,高压灭菌的温度为121℃,压力为100kpa,灭菌时间为20分钟;
同时对抗原抗体结合反应试剂进行准备,所述的抗原抗体结合反应试剂为结合/清洗buffer,含有0.15mnacl和20mmna2hpo4,ph为7.0;
步骤(2),富细胞因子血清的获得:静脉血液采集后,充分缓慢摇匀,保证玻璃小珠与新鲜全血充分接触,将装有全血和玻璃小珠的特制采血套装放置于37℃的恒温培养箱内,进行20h的恒温孵育,经过恒温放置,血液凝固后会出现分层,将上层血清转移至15ml离心管,用离心机,以3500r/min的转速,离心8min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,滤液即为富含细胞因子的血清(acs);
步骤(3),rproteina/g微球的预处理:
用步骤(1)中配制好的结合/清洗buffer进行琼脂糖微球的预处理,具体为:取适量的rproteina/g微球加入到2ml离心管中,500rpm离心1分钟,吸弃上清;加入1ml结合/清洗buffer,悬浮微球,500rpm离心1分钟,吸弃上清,再重复三次;
步骤(4),抗体工作溶液的配制:
用步骤(1)中配制好的结合/清洗buffer进行抗体的配制,具体为:抗体稀释的比例按照不同的抗体说明书会有所不同,本实验中,il-6、tnfα的抗体稀释比例都为1:250,il-6的抗体浓度为0.7μg/ml,tnf-α的抗体浓度为1.2μg/ml;
步骤(5),rproteina/g微球与抗体的结合:采用步骤(4)中配制好的il-6抗体溶液和tnfα抗体溶液将经步骤(3)中预处理好的微球悬浮,室温下放置于翻转混合仪或盘旋混合仪上,缓慢晃动离心管,60分钟后,480rpm离心1分钟,吸弃上清;
每100μl微球需加入il-6抗体溶液1ml和tnfα抗体溶液tnfα抗体溶液1ml;
步骤(6),清洗:采用步骤(1)中配制好的结合/清洗buffer将经步骤(5)处理得到微球悬浮,480rpm离心1分钟,弃上清,重复采用步骤(1)中配制好的结合/清洗buffer微球悬浮到弃上清这一过程两次,得到微球-抗体复合物;
清洗的目的是去除非特异性吸附的杂蛋白;
步骤(7),rproteina/g微球-抗体结合物与抗原的结合反应:将步骤(2)中得到的富含细胞因子的血清(acs)加入步骤(6)中制备好的微球-抗体复合物,按照100μl微球-抗体复合物加1ml富含细胞因子的血清的比例,并用移液器轻轻吹打混匀,在室温下放置于翻转混合仪或盘旋混合仪上,缓慢翻转离心管,使抗原与抗体充分结合,45分钟后,480rpm离心1分钟,保留上清,并使用使用0.22μm无菌滤器过滤,即得到去除了促炎因子il-6和tnfα的自体血清(acs),将其分装至灭菌的1.5ml离心管中,-80度保存备用,另外留取500ul放置于-20℃作为检测待用。
实施例3
一种去除富含细胞因子血清中促炎因子的方法,包括如下步骤:
步骤(1),采血设备的准备:将3mm医疗级玻璃小珠(vwrinternational)用超纯水洗净后烘干按每3ml全血加入10颗的比例将玻璃小珠预先放置于直接获得富含细胞因子血清的采血器中,之后进行高压灭菌,68℃烘干,备用;其中,高压灭菌的温度为121℃,压力为100kpa,灭菌时间为20分钟;
同时对抗原抗体结合反应试剂进行准备,所述的抗原抗体结合反应试剂为结合/清洗buffer,含有0.15mnacl和20mmna2hpo4,ph为7.0;
步骤(2),富细胞因子血清的获得:静脉血液采集后,充分缓慢摇匀,保证玻璃小珠与新鲜全血充分接触,将装有全血和玻璃小珠的特制采血套装放置于37℃的恒温培养箱内,进行24h的恒温孵育,经过恒温放置,血液凝固后会出现分层,将上层血清转移至15ml离心管,用离心机,以3300r/min的转速,离心6min,将多余的红细胞沉淀去除,最后使用0.22μm无菌滤器过滤上层血清,滤液即为富含细胞因子的血清(acs);
步骤(3),rproteina/g微球的预处理:
用步骤(1)中配制好的结合/清洗buffer进行琼脂糖微球的预处理,具体为:取适量的rproteina/g微球加入到2ml离心管中,450rpm离心1分钟,吸弃上清;加入1ml结合/清洗buffer,悬浮微球,450rpm离心1分钟,吸弃上清,再重复两次;
步骤(4),抗体工作溶液的配制:
用步骤(1)中配制好的结合/清洗buffer进行抗体的配制,具体为:抗体稀释的比例按照不同的抗体说明书会有所不同,本实验中,il-6、tnfα的抗体稀释比例都为1:200,il-6的抗体浓度为0.8μg/ml,tnf-α的抗体浓度为1.5μg/ml;
步骤(5),rproteina/g微球与抗体的结合:采用步骤(4)中配制好的il-6抗体溶液和tnfα抗体溶液将经步骤(3)中预处理好的微球悬浮,室温下放置于翻转混合仪或盘旋混合仪上,缓慢晃动离心管,40分钟后,450rpm离心1分钟,吸弃上清;
每100μl微球需加入il-6抗体溶液1ml和tnfα抗体溶液tnfα抗体溶液1ml;
步骤(6),清洗:采用步骤(1)中配制好的结合/清洗buffer将经步骤(5)处理得到微球悬浮,450rpm离心1分钟,弃上清,重复采用步骤(1)中配制好的结合/清洗buffer微球悬浮到弃上清这一过程两次,得到微球-抗体复合物;
清洗的目的是去除非特异性吸附的杂蛋白;
步骤(7),rproteina/g微球-抗体结合物与抗原的结合反应:将步骤(2)中得到的富含细胞因子的血清(acs)加入步骤(6)中制备好的微球-抗体复合物,按照100μl微球-抗体复合物加1ml富含细胞因子的血清的比例,并用移液器轻轻吹打混匀,在室温下放置于翻转混合仪或盘旋混合仪上,缓慢翻转离心管,使抗原与抗体充分结合,60分钟后,450rpm离心1分钟,保留上清,并使用使用0.22μm无菌滤器过滤,即得到去除了促炎因子il-6和tnfα的自体血清(acs),将其分装至灭菌的1.5ml离心管中,-80度保存备用,另外留取500ul放置于-20℃作为检测待用。
本实验使用了elisa检测方法,采用联科生物的il-6、tnfα和il-1ra的elisa试剂盒,检测结果表明,通过使用特异抗体吸附的方法,富含细胞因子的血清中,il-6的含量从原来的2633.9pg/ml下降至285.7pg/ml,tnfα的含量从原来的742pg/ml下降至61.3pg/ml,il-1ra的含量去除前为1125pg/ml,去除后为1113pg/ml,基本维持不变,如附图1-3所示。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!