CompoundC在制备治疗非酒精性脂肪肝药物中的应用的制作方法
本发明属于医学和生物化学技术领域,涉及一种compound C在制备治疗非酒精性脂肪肝药物中的应用,具体地说,涉及腺苷酸激活的蛋白激酶(AMPK)抑制剂compound C在制备治疗非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)制剂中的新应用。
背景技术:
Compound C(6-[4-(2-piperidin-1-yl-etoxy)-phenyl]-3-pyridin-4-yl-pyrrazolo[1,5-a]pyrimidine),又称dorsomorphin,分子式为C24H25N5O,属于吡唑并嘧啶类蛋白激酶抑制剂,已有的研究证明,compound C不仅是AMPK的抑制剂,而且还具有抑制其他信号转导通路的作用,并且这种作用不依赖于对AMPK的抑制。据报道,compound C可通过抑制粘着斑激酶、核因子-κB(NF-κB)途径而抑制巨噬细胞的趋化作用,此外,compound C预处理可明显抑制LPS或脂肪细胞培养基刺激RAW264.7巨噬细胞株分泌促炎性因子,如TNFα、IL-6、IL-1β和MCP-1,新近研究发现,在肿瘤坏死因子α激活的内皮细胞中,compound C可通过PI3K/p38MAPK通路抑制细胞间粘附分子-1(ICAM-1)和血管细胞粘附分子-1(VCAM-1),在体外实验中,compound C可抑制内毒素血症小鼠主动脉中ICAM-1和VCAM-1的表达,这些研究结果均表明compound C具有抑制炎症反应的潜在作用。但是,至今为止尚未见到有关AMPK抑制剂compound C,通过抑制慢性炎症反应,从而用于制备防治NAFLD药物的报道。
技术实现要素:
本发明的目的在于提供一种compound C在制备治疗非酒精性脂肪肝药物中的应用,为开发治疗NAFLD的药物提供研究基础及理论依据。
其具体技术方案为:
一种compound C在制备治疗非酒精性脂肪肝药物中的应用,所述compound C的结构式为:
与现有技术相比,本发明的有益效果:
经过实验证明:本发明compound C可有效抑制NLRP3炎性体及炎症反应,从而明显改善非酒精性脂肪肝的形成。
附图说明
图1为compound C抑制LPS+PA刺激THP-1细胞分泌多种炎症因子的示意图;
图1A为compound C抑制LPS+PA刺激THP-1细胞分泌IL-1β的示意图;
图1B为compound C抑制LPS+PA刺激THP-1细胞分泌IL-18的示意图;
图1C为compound C抑制LPS+PA刺激THP-1细胞分泌TNF-α的示意图;
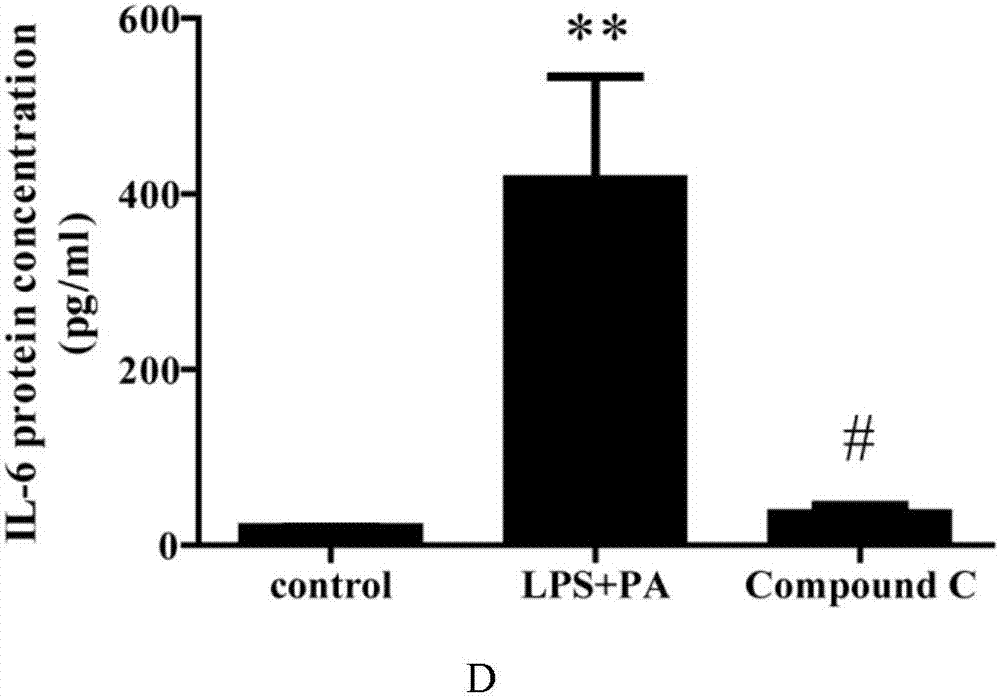
图1D为compound C抑制LPS+PA刺激THP-1细胞分泌IL-6的示意图;
图2为compound C抑制LPS+PA刺激THP-1细胞表达NLRP3炎性体的示意图;
图2A为compound C抑制LPS+PA刺激THP-1细胞表达NLRP3蛋白的示意图;
图2B为compound C抑制LPS+PA刺激THP-1细胞表达ASC蛋白的示意图;
图2C为compound C抑制LPS+PA刺激THP-1细胞表达pro-caspase-1蛋白的示意图;
图2D为compound C抑制LPS+PA刺激THP-1细胞caspase-1活性的示意图;
图2E为compound C抑制LPS+PA刺激THP-1细胞表达p-AMPK的示意图;
图3为compound C对NLRP3炎性体的抑制作用不依赖于AMPK的示意图;
图3A为AMPKα1敲除后compound C对p-AMPK的作用示意图;
图3B为AMPKα1敲除后compound C对NLRP3蛋白的作用示意图;
图3C为AMPKα1敲除后compound C对ASC蛋白的作用示意图;
图3D为AMPKα1敲除后compound C对caspase-1活性的作用示意图;
图4为compound C抑制LPS+PA诱导THP-1细胞线粒体ROS产生的示意图;
图5为compound C减少高脂小鼠体重及摄食量的示意图;
图5A为compound C减少高脂小鼠体重增加幅度的示意图;
图5B为compound C减少高脂小鼠摄食量的示意图;
图6为compound C改善高脂小鼠NAFLD形成的示意图;
图7为compound C改善高脂小鼠糖耐量及胰岛素敏感性的示意图;
图7A为compound C改善高脂小鼠葡萄糖耐量实验的示意图;
图7B为compound C改善高脂小鼠胰岛素敏感性的示意图。
具体实施方式
下面结合附图和具体实施方案对本发明的技术方案作进一步详细地说明。
实施例1本发明涉及Compound C片剂的制备
取5克Compound C,加入糊精195克,混匀,常规压片成1000片。
实施例2本发明涉及Compound C胶囊的制备
取5克Compound C,加入淀粉195克,混匀,装胶囊制成1000粒。
实施例3Compound C抑制LPS+PA刺激THP-1细胞分泌多种炎症因子
配置5mM储存液:①Compound C(25mg)购于Selleck公司,1000r/min离心5mins;②在超净工作台中,吸取1ml DMSO到药品管中,反复吹打混匀;③取新的50ml离心管,加入11.52ml DMSO,将药品管中所得液体全部移入50ml离心管中,混匀;④将50ml离心管盖紧,在涡旋仪上短暂涡旋混匀;⑤将混匀后的液体分装,-20度保存。
配置25uM工作液:①取分装的compound C储存液置于37度水浴箱中复温;②按照每1ml培基,加入5ul储存液的比例配制成工作液,用于以下细胞实验。
在六孔板中使用1640培养基培养THP-1细胞,隔天换液,当细胞密度1*10^6时,将其分为正常组(N)、LPS+PA刺激组(M)及compound C干预组(C),M和C组分别加入100ng/ml LPS刺激3小时后,加入0.5mM PA继续刺激8小时,C组在加入LPS之前1小时加入25uM compound C干预。收取各组细胞上清液,使用ELISA方法检测各组细胞上清中炎性因子IL-1β、IL-18、TNF-α和IL-6的表达情况。
参见图1,各数值表示为三次检测的平均值±SD。*,与未经处理的正常组细胞相比p<0.05;#,与LPS+PA的刺激组细胞相比p<0.05。
从图1-A可以看出,与正常组细胞相比,LPS+PA的刺激组细胞上清中IL-1β分泌明显增加,而加入了compound C干预的细胞上清中IL-1β分泌明显受到抑制;从图1-B可以看出,与正常组细胞相比,LPS+PA的刺激组细胞上清中IL-18分泌明显增加,而加入了compound C干预的细胞上清中IL-18分泌明显受到抑制;从图1-C可以看出,与正常组细胞相比,LPS+PA的刺激组细胞上清中TNF-α分泌明显增加,而加入了compound C干预的细胞上清中TNF-α分泌明显受到抑制;从图1-D可以看出,与正常组细胞相比,LPS+PA的刺激组细胞上清中IL-6分泌明显增加,而加入了compound C干预的细胞上清中IL-6分泌明显受到抑制。此结果表明,compound C可抑制LPS+PA刺激THP-1分泌IL-1β、IL-18、TNF-α、IL-6等炎性因子,具有抗炎的有效作用。
实施例4 Compound C抑制LPS+PA刺激THP-1细胞表达NLRP3炎性体
在六孔板中使用1640培养基培养THP-1细胞,隔天换液,当细胞密度1*10^6时,将其分为正常组(N)、LPS+PA刺激组(M)及compound C干预组(C),M和C组分别加入100ng/ml LPS刺激3小时后,加入0.5uM PA继续刺激8小时,C组在加入LPS之前1小时加入25uM compound C干预。提取各组细胞的总蛋白进行蛋白定量,使用western-blotting的方法检测各组细胞中NLRP3炎性体三个组成性蛋白NLRP3、ASC、pro-caspase-1的表达,并采用caspase-1活性检测试剂盒检测caspase-1的活性。
参见图2,各数值表示为三次检测的平均值±SD。*,与未经处理的正常组细胞相比p<0.05;#,与LPS+PA的刺激组细胞相比p<0.05。
从图2-A,C可以看出,与正常组细胞相比,LPS+PA的刺激组细胞中NLRP3、pro-caspase-1表达均明显升高,而compound C干预组中的表达明显降低,而2-B中ASC的表达无明显变化,与此同时,图2-D中显示,LPS+PA组中的caspase-1活性明显增加,而compound C处理组的caspase-1活性明显下降。由于IL-1β和IL-18的成熟和分泌依赖于NLRP3炎性体的活化,图1中已显示compound C可抑制IL-1β和IL-18的产生,通过图2中的结果,证明了compound C可通过抑制NLRP3活化而抑制炎症因子IL-1β和IL-18的分泌,在此过程中,compound C处理组中的AMPK磷酸化水平亦受抑制(图2-E)。
实施例5 Compound C对NLRP3炎性体的抑制作用不依赖于AMPK
由于compound C是AMPK的抑制剂,进一步说明compound C的抗炎作用是否依赖于对AMPK的抑制,使用AMPK si RNA转染THP-1细胞,并同时转入空质粒,再按照实施例1的实验步骤重复实验过程。
参见图3,各数值表示为三次检测的平均值±SD。*,与未经处理的正常组细胞相比p<0.05;#,与LPS+PA的刺激组细胞相比p<0.05。
从图3可以看出,当敲低AMPK后,compound C对LPS+PA诱导的THP-1细胞NLRP3炎性体活化仍然具有抑制作用,说明compound C对NLRP3的抑制为非AMPK依赖性。
实施例6 Compound C抑制LPS+PA刺激THP-1细胞生成ROS
由于compound C对NLRP3炎性体的抑制作用为非AMPK依赖性,试图进一步阐明compound C通过何种途径抑制NLRP3炎性体,通过查阅文献,发现NLRP3炎性体的活化需要线粒体ROS产生,即ROS为NLRP3炎性体活化的上游,因此,通过流式细胞仪检测正常组(N)、LPS+PA刺激组(M)及compound C干预组(C)各组细胞中的ROS产生。
参见图4,各数值表示为三次检测的平均值±SD。*,与未经处理的正常组细胞相比p<0.05;#,与LPS+PA的刺激组细胞相比p<0.05。
从图4可以看出,模型组中ROS产生较正常组明显增加,而compound C干预后ROS产生明显减少,其效应可比拟ROS的抑制剂NAC,说明compound C可能通过抑制ROS而抑制了NLRP3炎性体活化,compound C可能对线粒体氧化应激具有抑制作用。
实施例7 Compound C可减少高脂小鼠体重及摄食量;
实施例8 Compound C可改善高脂小鼠NAFLD形成;
实施例9 Compound C可改善高脂小鼠糖耐量及胰岛素敏感性。
大量文献显示,非酒精性脂肪肝(NAFLD)是一种低度的慢性炎症性疾病,伴随着肝脏中大量炎性因子的产生,且NLRP3炎性体在脂肪肝的发生发展中起到重要的促进作用,NAFLD可进一步导致糖耐量异常及胰岛素抵抗,甚至糖尿病的发生。由于前期观察到compound C具有显著的抗炎作用且可明显抑制NLRP3炎性体,因此进一步猜想它对NAFLD的慢性炎症模型是否具有改善作用。将15只C57BL/C小鼠进行适应性喂养1周后,分为正常组、高脂喂养组和compound C(CC)干预组,每组5只,正常组予以普通饲料喂养,高脂组和CC干预组予以60%高脂饲料喂养,3个月后,CC组小鼠每天进行6mg/kg compoundC腹腔注射,每周称量各组小鼠体重及摄食量,摄食量由加入每笼的饲料重量减去所剩的饲料重量而获得,并以每周每笼小鼠摄食的总重量占每笼小鼠自身体重的百分比来表示,1个月后,对各组小鼠进行糖耐量试验及胰岛素耐量试验,实验结束后处死各组小鼠,留取肝脏组织,进行包埋、切片及HE染色。
参见图5-7,各数值表示为三次检测的平均值±SD。*,与高脂喂养的模型组小鼠相比p<0.05;**,与高脂喂养的模型组小鼠相比p<0.01。
从图5-A及5-B中可看出,与高脂组相比,CC组小鼠体重增加幅度及摄食量明显减少;如图6所见,高脂组小鼠体型及肝脏大小均较正常组增大,而CC干预组小鼠体型及肝脏大小均较高脂组缩小,且HE染色结果提示,与正常小鼠相比,高脂组小鼠肝脏出现了脂肪变性,肝脏组织被脂肪组织充填浸润,而CC处理后肝脏脂肪变性较高脂组明显缓解,说明compound C对脂肪肝具有明显的改善和缓解作用;如图7-A及7-B显示,CC干预后可明显改善高脂小鼠的糖耐量、增加胰岛素敏感性。
以上所述,仅为本发明较佳的具体实施方式,本发明的保护范围不限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,可显而易见地得到的技术方案的简单变化或等效替换均落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!