一种检测猪NLRP12的核苷酸序列及应用的制作方法
本发明属于畜牧业动物医学技术研究领域,涉及基于TaqMan水解探针荧光RT-PCR检测猪NLRP12的核苷酸序列和方法,适用于猪组织样本,包括胃、小肠、大肠等消化道组织以及肝脏、脾脏、淋巴结、肺脏等组织器官中NLRP12的准确检测,更具体的说是用于猪组织器官中NLRP12mRNA的表达分析、炎症反应机制研究和肠道屏障功能研究等方面的应用。
背景技术:
NOD-样受体(NOD-like receptors,NLRs)是先天性免疫中的一大类病原模式识别受体。机体依靠NLRs识别病原感染的信号,启动免疫应答,发挥抵抗病原微生物感染的作用。NLRP12是NLRs家族的一个成员,广泛存在于消化道组织、免疫器官组织以及免疫细胞中,参与病原识别和炎性体组成。炎性体活化后激活胱冬肽酶(caspase-1),调控白细胞介素1(interleukin-1,IL-1)家族中促炎性细胞因子IL-1b、IL-18和IL-33的生成,参与调节机体炎症反应和肠道黏膜屏障功能。
促炎性细胞因子的释放,能够促进局部炎性细胞浸润,减轻或加重组织炎性损伤状态。适度炎症反应有助于消除内外源致病因素,使机体内环境处于稳态;慢性、失调的炎症反应则持续地损伤细胞和组织,促使组织器官异常重构,最终导致器官功能衰竭甚至丧失。因此,研究不同病原体引起炎症的机制,有利于控制炎症的发生以及炎症的进程,使炎症反应朝向对机体有益的方向发展,促进机体顺利恢复到健康的状态和水平。
NLRP12是近两年来研究较多的一种病原识别受体,主要集中在模型动物小鼠的研究上,在人上的研究也仅有少量报道,但是在猪上的研究还未见报道。很多动物病原体感染猪后,都会引起炎症反应,但不同的感染类型其引起炎症反应的机制也各不相同。中国是养猪大国,猪的健康养殖关系和影响着食品安全问题。因此,研究研究猪疫病炎症反应的发生机制,控制炎症反应的进程,使猪只早日恢复健康,就显得非常重要。一方面,可以减少药物尤其是抗生素类药物的使用量,保证猪肉食品的安全,另一方面,还可以降低养殖成本,提高养猪业的经济效益。
在本研究中,我们采用TaqMan荧光RT-PCR方法建立了检测猪NLRP12的检测技术,对反应的各种条件进行了优化,其中包括引物探针的筛选、Mg2+使用浓度的优化、引物及探针使用浓度的优化。建立了灵敏、特异,能够用于检测猪NLRP12 mRNA表达的方法。
技术实现要素:
本发明的一个目的是提供一组特异性强、灵敏度高的检测猪NLRP12的核苷酸序列,包括引物序列和基于MGB修饰的短探针序列。
本发明的另一个目的是提供快速、准确、使用方便的基于MGB修饰的检测猪NLRP12 mRNA表达的方法。
为实现上述目的,本发明公开了如下的技术方案:
一组检测猪NLRP12的核苷酸序列,其特征在于,其核苷酸序列如序列表SEQ ID NO.1至SEQ ID NO.3所示,其中SEQ ID NO.1至SEQ ID NO.2分别为检测猪NLRP12的正义引物和反义引物,序列SEQ ID NO.3为检测猪NLRP12的荧光探针。
本发明所所述探针序列SEQ ID NO.3的5’端标记报告荧光基团FAM,3’端标记淬灭荧光基团MGB。
本发明进一步公开了采用检测猪NLRP12的核苷酸序列进行检测的方法,其特征在于,由以下组分作为检测NLRP12所用的必备材料:
1)裂解液;
2)RT反应液,包括:5´RT缓冲液、25 mM MgCl2、2.5 mM dNTPs(each)、200 mM随机引物、40 U/mL RNase抑制剂、200 U/mL反转录酶M-MLV;
3)qPCR反应液,包括:10´PCR缓冲液、25 mM MgCl2、2.5 mM dNTPs(each)、2.5 U/mL Taq DNA聚合酶、20 mM正义引物、20 mM反义引物、20 mM荧光探针;
4)DEPC水:用自来水三次蒸馏获取三蒸水,在三蒸水中加入DEPC至终浓度为0.1%,37°C搅拌处理12 h,121°C高压蒸汽灭菌15 min;
5)猪NLRP12标准品:为体外转录的RNA片段,猪NLRP12标准品的序列为序列表SEQ ID NO.4所示的核苷酸序列;
其中,正义引物为序列表SEQ ID NO.1所示的核苷酸序列,反义引物为序列表SEQ ID NO.2所示的核苷酸序列,荧光探针为序列表SEQ ID NO.3所示的核苷酸序列,其中5’端标记报告荧光基团FAM,3’端标记淬灭荧光基团MGB。
所述RT反应液中各成分的使用浓度为1´RT缓冲液、2.5 mM MgCl2、0.25 mM dNTPs、20 mM随机引物、1 U/mL的RNase抑制剂、5 U/mL的反转录酶M-MLV;所述qPCR反应液中各成分的使用浓度为1´PCR缓冲液、3.5 mM MgCl2、0.2 mMdNTPs、0.05 U/mLTaq DNA聚合酶、0.2 mM正义引物、0.2 mM反义引物、0.1 mM荧光探针;
本发明更进一步公开了采用检测猪NLRP12的核苷酸序列检测猪NLRP12的方法在猪组织器官中NLRP12 mRNA表达方面的应用。实验结果显示:本发明建立的荧光qPCR检测方法可以对病毒RNA进行相对定量,根据标准曲线Y=-4.67X+38.51(X代表Ct值,Y代表NLRP12的相对含量),可知Ct值越小,NLRP12的表达量相对越高。发病猪不同组织中NLRP12的表达均高于正常猪不同组织中NLRP12的表达,并且以发病猪淋巴结中NLRP12的表达量为最高。
本发明更加详细的描述如下:
选择猪NLRP12基因的特定序列作为靶区域,在多重序列比对的基础上,进行引物和探针设计。引物长度为21个碱基左右,引物内无二级结构和重复性,引物间和引物内无互补序列,引物的熔解温度(Tm值)在60°C左右,引物间的Tm值相差小于2°C。探针的长度为16个碱基。
一组检测猪NLRP12的核苷酸序列,如下:
1)5ʹ-CACAAGGTGATGCTGGATTGG-3ʹ(SEQ ID NO.1)
2)5ʹ-CCCGGCAGTTGATGTAGAAGAC-3ʹ(SEQ ID NO.2)
3)5ʹ-[FAM]-ACGGGAAGCTCTTCCA-[MGB]-3ʹ(SEQ ID NO.3)
其中序列1)和2)分别为检测猪NLRP12基因的正义引物和反义引物,序列3)为检测猪NLRP12基因的MGB修饰的荧光短探针,探针的5ʹ端标记报告荧光基团FAM(6-carboxy-荧光素),3ʹ端标记淬灭基团MGB。
我们采用TaqMan荧光RT-PCR检测技术建立了检测猪NLRP12的检测方法,对反应的各种条件进行了优化,其中包括引物探针的筛选、Mg2+使用浓度的优化、引物及探针使用浓度的优化,得到以下检测方法。
本发明提供的一种检测猪NLRP12的方法,由以下内容组成:
1)RNA提取试剂盒:购自天根生化科技(北京)有限公司。
2)RT反应液,表1为RT反应液配方:
表1 RT反应液配方
反转录酶M-MLV(200 U/mL)、5´RT缓冲液、随机引物(200 mM)、RNase抑制剂(40 U/mL)购自大连宝生物生物工程有限公司;dNTPs(2.5 mM each)、MgCl2(25 mM)购自天根生化科技(北京)有限公司。
3)qPCR反应液,表2为qPCR反应液配方:
表2 qPCR反应液配方
Taq DNA聚合酶(2.5 U/mL)、10´PCR缓冲液、dNTPs(2.5 mM each)、MgCl2(25 mM)自天根生化科技(北京)有限公司,引物和探针均委托生工生物工程(上海)股份有限公司合成。
4)DEPC水,用自来水三次蒸馏获取三蒸水,在三蒸水中加入DEPC至终浓度为0.1%,37°C搅拌处理12 h,121°C高压蒸汽灭菌15 min。
5)猪NLRP12标准品:为体外转录的RNA片段。将RT-PCR扩增获得的NLRP12长度为240 bp编码序列克隆于pGEM-T载体,转化TOP10感受态细胞,用质粒小提试剂盒提取质粒DNA,经PCR和酶切鉴定后获得阳性重组质粒,命名为pGEM-NLRP12。以纯化的质粒为模板,酶切线性化之后,用Promega公司的Ribo MAXTM Large Scale RNA Production System-T7试剂盒进行体外转录;将体外转录产物用DNase除去其中的DNA模板后经Trizol提取后进行测定,即得到制备猪NLRP12标准品所需的RNA标准品母液。
6)猪NLRP12标准品的基因序列如SEQ ID NO.4所示。
7)对合成的引物和探针做HPLC分析,如得到单吸收峰图谱、而且用紫外分光光度计测定OD260nm/OD280nm的比值在1.6-2.0之间,即视为合格引物。
将筛选好的引物浓度从0.1 mM至0.8 mM以0.1 mM为间距递增,探针浓度从0.025 mM至0.2mM以0.025 mM为间距递增。对引物和探针不同浓度的配比进行了比较,从多次重复试验中发现:采用表2所列引物浓度和探针浓度时荧光增幅相对较高。
7)RT反应条件:30°C 10 min,42°C 1 h,99°C 5 min,16°C 1 min。
8)qPCR反应条件:95°C 4 min;95°C 10 sec,61°C 15 sec,72°C 15 sec,40个循环,每次循环退火延伸时收集荧光。
研究表明,Mg2+浓度对荧光PCR扩增结果有影响,故应用筛选好的引物探针,将Mg2+的浓度从0.5 mM至5.0 mM以0.5 mM为间距递增,对不同Mg2+浓度条件下的扩增进行了比较。优化后的Mg2+浓度见表1。
本发明的优点是:本发明选择猪NLRP12基因保守序列,设计引物和MGB探针,建立并优化了检测组NLRP12的荧光RT-PCR检测方法,该法特异性好,灵敏度高,能够快速、准确的检测猪组织器官样本中NLRP12,在研究NLRP12炎性体时能够对NLRP12进行实时监测,及时了解和掌握炎症的发生过程和发展进程,以及采用抗炎药物干预炎症反应的效果,具有重要的理论意义和实践意义。
附图说明
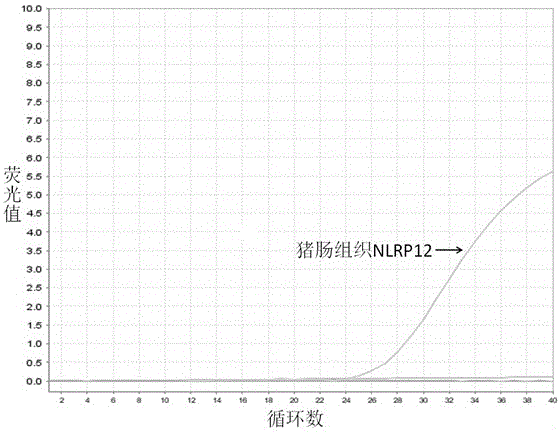
图1猪不同组织中NLRP12 mRNA相对定量试验和线性回归结果;
图2 NLRP12荧光PCR检测方法的特异性试验结果。
具体实施方式
下面通过具体的实施方案叙述本发明。除非特别说明,本发明中所用的技术手段均为本领域技术人员所公知的方法。另外,实施方案应理解为说明性的,而非限制本发明的范围,本发明的实质和范围仅由权利要求书所限定。对于本领域技术人员而言,在不背离本发明实质和范围的前提下,对这些实施方案中的物料成分和用量进行的各种改变或改动也属于本发明的保护范围。本发明所用原料及试剂均有市售。
实施例1 猪不同组织中NLRP12 mRNA相对定量试验
(1)猪组织样品处理:用无菌的剪刀和镊子剪去待检组织样品约1.0 g于研钵中充分研磨,再加入5 mL PBS混匀,然后将组织悬液转入无菌Eppendorf管中,编号备用。
(2)RNA的提取:用RNA提取试剂盒提取不同组织的RNA,按照试剂盒操作说明书进行,提取的RNA冰上保存备用。
(3)RNA反转录为cDNA:从冰箱中取出M-MLV(200 U/mL)、5´RT缓冲液、随机引物(200 mM)、RNase抑制剂(40 U/mL)、dNTPs(2.5 mM each)、MgCl2(25 mM),在室温下融化后,2 000 rpm离心10 sec。设所需PCR管数为n(n=样本数+1管阴性对照),每个测试反应体系需要10 mL RT反应液,其中含有4 mL 5´RT缓冲液,2mLMgCl2(25 mM),2 mL dNTPs(2.5 mM each),1 mL随机引物(200 mM),0.5mLRNase抑制剂(40 U/mL),0.5mL反转录酶M-MLV(200 U/mL)。计算好各试剂的使用量,加入一适当体积试管中,充分混合均匀,向每个PCR管中各分装10 mL。在各设定的普通PCR管中分别加入制备的RNA溶液各10 mL,盖紧管盖,于1000 rpm离心10 sec。将PCR管排好放入普通PCR仪内进行反转录。反应参数设置:30°C 10 min,42°C 1 h,99°C 5 min,16°C 1 min。反转录结束后,取出cDNA冰上保存备用。
(4)qPCR反应:从冰箱中取出Taq DNA聚合酶(2.5 U/mL)、10´PCR缓冲液、正义引物(20 mM)、反义引物(20 mM)、MGB探针(20 mM)、dNTPs(2.5 mM each)、MgCl2(25 mM),在室温下融化后,2 000 rpm离心10 sec。设所需PCR管数为n(n=样本数+1管阴性对照+10管阳性标准品),每个测试反应体系需要15mL qPCR反应液,其中含有2 mL 10´PCR缓冲液、2.8mL MgCl2(25 mM),1.6 mL dNTPs(2.5 mM each),0.4 mLTaq DNA聚合酶(2.5 U/mL),0.2 mL正义引物(20 mM),0.2 mL反义引物(20 mM),0.1 mL MGB探针(20 mM),7.7mL DEPC水。计算好各试剂的使用量,加入一适当体积试管中,充分混合均匀,向每个qPCR管中各分装15mL。在各设定的qPCR管中分别加入制备的cDNA各5mL,盖紧管盖,于1000 rpm离心10 sec。将qPCR管排好放入荧光PCR检测仪内,记录样本摆放顺序。反应参数设置:95°C 4 min;95°C 10 sec,61°C 15 sec,72°C 15 sec,40个循环,每次循环退火延伸时收集荧光。
(5)结果的判定:结果分析条件设定,读取检测结果。阈值设定原则以阈值线刚好超过正常阴性对照品扩增曲线的最高点。不同仪器可根据仪器噪音情况进行调整。质控标准,阴性对照无Ct值并且无扩增曲线。阳性对照的Ct值应£35.0,并出现特定的扩增曲线。如阴性对照和阳性对照条件不满足以上条件,此次实验视为无效。
(6)猪不同组织中NLRP12 mRNA相对定量统计分析:对3头健康猪和3头致病性大肠杆菌感染猪不同的组织脏器qPCR的检测数据进行统计分析,结果见表3。
表3 NLRP12 qPCR检测同一头猪不同组织脏器的结果统计
我们建立的荧光qPCR检测方法可以对病毒RNA进行相对定量,根据标准曲线Y=-4.67X+38.51(X代表Ct值,Y代表NLRP12的相对含量),可知Ct值越小,NLRP12的表达量相对越高。从表3可以看出,发病猪不同组织中NLRP12的表达均高于正常猪不同组织中NLRP12的表达,并且以发病猪淋巴结中NLRP12的表达量为最高。
实施例2
检测方法的特异性试验
用实施例1中所述方法对猪肠组织及环境中常见的几种病原体(包括大肠杆菌、沙门氏菌、葡萄球菌和猪繁殖与呼吸综合征病毒)进行检测,结果表明所建立的方法与病原体均无交叉反应,特异性良好(图2)。
<110> 天津市畜牧兽医研究所
<120> 一种检测猪NLRP12的核苷酸序列及应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<400> 1
cacaaggtga tgctggattg g 21
<210> 2
<211> 22
<212> DNA
<213> 人工序列
<400> 2
cccggcagtt gatgtagaag ac 22
<210> 3
<211> 18
<212> DNA
<213> 人工序列
<400> 3
acgggaagct cttccagg 18
<210> 4
<211> 240
<212> DNA
<213> 人工序列
<400> 4
atgctggccc acaaggtgat gctggattgg gccgacggga agctcttcca ggacaggttt 60
gattatgtct tctacatcaa ctgccgggag atgaaccaga gcaccgtgga gcggagcgca 120
cgagacctca tctccagttg ctggcccgag cccagcgtgc ccctccagga gctcgtccgg 180
gcccccgagc gcctcctctt tatcatcgac ggctttgacg aactcaaacc ctctttccac 240
- 还没有人留言评论。精彩留言会获得点赞!