一种抗菌肽改性丝蛋白膜材料的制备方法与流程
本发明涉及生物医用材料领域,特别涉及一种通过共价修饰制得新型的抗菌性丝蛋白膜材料的制备方法。
背景技术:
在医用材料的实际应用中,由生物材料引发的感染(biomaterialcenteredinfection,BCI)是生物医用材料发展的一大障碍。这些感染给患者在身体上和经济上都造成很大的负担,并限制了生物植入材料更广泛的应用。因此,生物材料表面的抗菌性能的研究已经成为当前研究的热点。为了避免由生物材料引发的感染,传统的方法是在生物医用材料表面涂抹一层抗生素。这种做法虽然在一定程度上避免了BCI,促进了生物材料在临床上的应用,但同时也存在着不可忽视的问题:
(1)采用传统的在生物材料表面涂抹抗生药物的方式在一定程度上可以减少生物材料引发的感染。但有时抗生素浓度太低,对预防BCI效果不明显;而抗生素浓度太高,对人体有较大的毒副作用。另外,抗生素的长时间使用可能会使病菌产生抗药性。
(2)在生物材料表面涂抹抗生药物的方式,抗菌药物的抗菌作用直接,但作用周期短,持续稳定性不强,对材料表面要求具有较长时间的抗菌性存在局限性。
抗菌肽是一类广泛存在于生物体中的小分子多肽,是生物体自身防御系统的一部分。抗菌肽地作用机理不同于抗生素,部分抗菌肽通过静电作用和细胞膜结合,使膜结构发生变化,氨基酸残基和细胞膜带负电荷的磷脂相互作用形成横跨细胞膜的孔道或者形成瞬间空洞,从而引起细胞死亡。它具有以下作用特点:(1)抗菌肽具有广谱的抗菌性;(2)选择性毒性;(3)高效性;(4)理化稳定性;(5)不会产生耐药性。因此,把抗菌肽分子结合到生物材料上,可以避免产生耐药性,且可以使生物材料表面的抗菌性持久、稳定。
丝蛋白是一类非生理活性的结构性高分子材料,它来源丰富,许多昆虫如家蚕、柞蚕等及许多种类的蜘蛛都能够生产大量丝蛋白。丝蛋白通常包含了丝素和丝胶,丝胶蛋白具有较差的生物相容性以及容易引发过敏反应,而丝素蛋白由于其优越的力学性能和相对良好的生体适应性,易降解且降解产物易被人体吸收而不产生炎症反应等优点,近年来,以其为基材的各种细胞生长支架材料的研究应运而生,成为组织工程中的一个热门研究领域(KimUJ,Park J,Kim HJ etal..Three-dimensional aqueous-derived biomaterial scaffolds from silkfibroin.Biomaterials 2005,26:2775-2785)。因此,本发明中所用的丝蛋白材料为脱胶以后获得的丝素蛋白。同时,随着现代生物技术的发展,人们能够从分子水平上对丝蛋白进行研究,并通过转基因技术经济、高效地获得各类丝蛋白(Yao JM,Zhu YQ,Li Y et al..Solid-state structure of Bombyx morisilk fibroin-RGD fusion proteins and their cell adhesive ability.Ac taChimica Sinica,2006,64(12):1273-1278)。
将抗菌肽分子结合到丝蛋白材料上,使丝蛋白材料表面的抗菌性持久、稳定,是在医用材料的实际应用研究中的一个新的方向,但目前尚未有成熟的技术出现。
技术实现要素:
本发明的目的在于克服现有技术中的不足,提供一种抗菌肽改性丝蛋白膜材料的制备方法。
为了解决上述技术问题,本发明是通过以下技术方案实现的:
本发明中的抗菌肽改性丝蛋白膜材料的制备方法,包括下列步骤:
(1)用浓度为1~8g/L的Na2CO3溶液精练丝蛋白原料3次,除去丝蛋白表面的可溶性蛋白丝胶和杂质,每次30分钟,精练温度98℃,浴比1∶100;
(2)经清洗干燥后,在30~70℃条件下,将丝蛋白溶解在8~10mol/L溴化锂水溶液中,所得溶液在蒸馏水中透析3天以除去溴化锂,制得丝蛋白的水溶液,溶液的浓度(w/v)为0.1~20%;
(3)将丝蛋白溶液平铺于聚苯乙烯培养皿中,在37℃条件下自然干燥得丝蛋白膜;
(4)将丝蛋白膜在酒精与水的混合液中浸泡10~40分钟,使丝蛋白膜难溶于水,其中,酒精的体积百分比(v/v)为50~100%;
(5)将浸泡并干燥后的丝蛋白膜在磷酸缓冲液中浸泡15~45分钟,缓冲液pH值6.5,缓冲液组分及浓度:Na2HPO4为0.1mol/L、NaCl为0.5mol/L;
(6)再将丝蛋白膜在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐/N-羟基琥珀酰亚胺混合溶液室温下浸泡15~45分钟,混合溶液组分及浓度:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐为0.1~1mg/mL,N-羟基琥珀酰亚胺为0.1~1mg/mL;
(7)将丝蛋白膜用磷酸缓冲液冲洗,然后与溶于磷酸缓冲液中的抗菌肽在室温下反应0.5~2小时,抗菌肽在缓冲液中浓度为0.01~1mg/mL;
(8)反应后的丝蛋白膜在磷酸缓冲液中浸泡5分钟,接着用磷酸缓冲液冲洗2次,再用去离子水冲洗1次以除去多余的多肽和杂质,然后在空气中自然干燥,即可得到抗菌性丝蛋白膜材料。
作为本发明的一种改进,所述丝蛋白原料是家蚕丝、野蚕丝、柞蚕丝、天蚕丝、蓖麻蚕丝、樗蚕丝、蓑袋蛾昆虫丝、蜘蛛丝或通过基因工程方法制得的转基因丝中的任意一种。
作为本发明的一种改进,所述丝蛋白原料中的丝蛋白是丝素蛋白。
作为本发明的一种改进,所述抗菌肽是可通过与细菌的细胞膜作用产生抑菌、杀菌作用的一类多肽。
作为本发明的一种改进,所述抗菌肽是Cecropin B,其氨基酸序列为:
Asn-Gly-Ile-Val-Lys-Ala-Gly-Pro-Ala-Ile-Ala-Val-Leu-Gly-Glu-Ala-Ala-Leu-NH2。
与现有技术相比,本发明的有益效果是:
(1)本发明提供了利用共价修饰来制备一种新型的具有良好、持久抗菌性能的抗菌肽改性丝蛋白膜材料的方法,通过调节丝蛋白的浓度、抗菌肽溶液的浓度和共价修饰的条件,可以达到有效控制材料抗菌性能的目的。
(2)该抗菌肽改性丝蛋白膜材料既具有天然动物丝蛋白的结构和功能,又具有表面抗菌活性,并且抗菌性持久、温和,不会产生耐药性。从而解决了天然动物丝蛋白材料在临床实际运用中可能出现的细菌感染问题。
附图说明
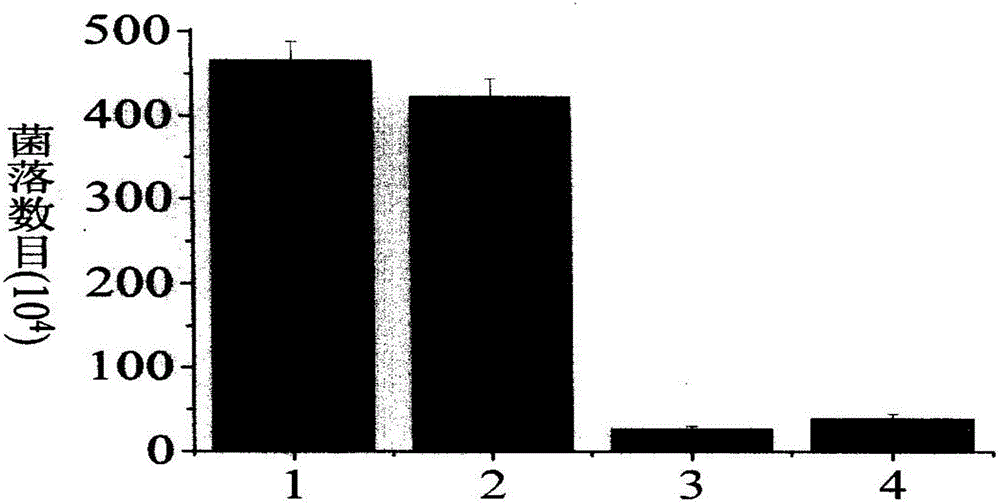
图1为本发明制备的抗菌肽改性丝蛋白膜材料抗大肠杆菌Escherichiacoli(E.coli)效果与其它材料的比较;
图2为本发明制备的抗菌肽改性丝蛋白膜材料抗金黄葡萄球菌Staphylococcus aureus(S.aureus)效果与其它材料的比较;
图3为抗菌肽改性丝蛋白膜材料抗大肠杆菌E.coli持久性测试结果;
图4抗菌肽改性丝蛋白膜材料抗金黄葡萄球菌S.aureus持久性测试结果;
图1中:1为空白对照试样,2为纯丝蛋白膜,3为纯抗菌肽,4为抗菌肽改性丝蛋白膜;
图2中:1为空白对照试样,2为纯丝蛋白膜,3为纯抗菌肽,4为抗菌肽改性丝蛋白膜;
图3中:◆为抗菌肽改性丝蛋白膜,▲为抗菌肽溶液浸渍丝蛋白膜(未共价修饰);
图4中:◆为抗菌肽改性丝素膜,▲为抗菌肽溶液浸渍丝蛋白膜(未共价修饰)。
具体实施方式
下面结合实施例来说明本发明的技术方案:
本实施例中所使用的丝蛋白为天然家蚕丝经脱胶后的丝素蛋白,抗菌肽为Cecropin B,其氨基酸序列为:
Asn-Gly-Ile-Val-Lys-Ala-Gly-Pro-Ala-Ile-Ala-Val-Leu-Gly-Glu-Ala-Ala-Leu-NH2。
该抗菌肽通过共价修饰制备抗菌性丝蛋白膜材料的应用效果对比如图1所示。其特殊之处在于,丝蛋白分子形成材料的结构区,提供材料的骨架;抗菌肽分子形成材料的功能区,提供材料的抗菌性能。
实施例1:
(1)用Na2CO3溶液(浓度5g/L)精练茧层3次,以去除丝蛋白表面的可溶性蛋白——丝胶和其它杂质,每次30min,精练温度98℃,浴比1∶100;
(2)经清洗干燥后,在40℃条件下,将丝蛋白溶解在9mol/L溴化锂水溶液中。所得溶液在蒸馏水中透析3天以除去溴化锂,制得丝蛋白的水溶液,溶液浓度(w/v)为2%;
(3)将丝蛋白溶液平铺于聚苯乙烯培养皿中,在37℃条件下自然干燥得丝蛋白膜;
(4)将丝蛋白膜在酒精与水的混合液中浸泡20分钟,使膜难溶于水,其中,酒精的体积百分比为60%;
(5)将浸泡并干燥后的丝蛋白膜在磷酸缓冲液中(0.1mol/L Na2HPO4,0.5mol/L NaCl,pH6.5)浸泡30分钟;
(6)再将丝蛋白膜在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)/N-羟基琥珀酰亚胺(NHS)溶液(0.5mg/mL EDC,0.7mg/mL NHS的磷酸缓冲液)室温下浸泡15分钟;
(7)丝蛋白膜用磷酸缓冲液冲洗,然后与溶于磷酸缓冲液中的抗菌肽(0.1mg/mL)在室温下反应2小时;
(8)反应后的丝蛋白膜在磷酸缓冲液中浸泡5分钟,接着用磷酸缓冲液冲洗2次,再用去离子水冲洗1次以除去多余的多肽和其它化学物质,然后在空气中自然干燥,即可得到抗菌性丝蛋白膜。
实施例2:
本实施例的步骤均与实施例1相同,其中:
步骤(1)中,Na2CO3溶液的浓度为1g/L;
步骤(2)中,丝蛋白溶解温度为30℃,溴化锂水溶液浓度为8mol/L中,制得丝蛋白水溶液的浓度(w/v)为0.1%;
步骤(4)中,酒精的体积百分比为50%,浸泡时间为40分钟;
步骤(5)中,丝蛋白膜在磷酸缓冲液中浸泡时间为45分钟;
步骤(6)中,丝蛋白膜在混合溶液浸泡时间为25分钟,混合溶液组分及浓度:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐为0.1mg/mL,N-羟基琥珀酰亚胺为0.1mg/mL;
步骤(7)中,反应时间为0.5小时,抗菌肽在缓冲液中浓度为0.01mg/mL。
实施例3:
本实施例的步骤均与实施例1相同,其中:
步骤(1)中,Na2CO3溶液的浓度为8g/L;
步骤(2)中,丝蛋白溶解温度为70℃,溴化锂水溶液浓度为10mol/L中,制得丝蛋白水溶液的浓度(w/v)为20%;
步骤(4)中,采用100%的纯酒精,浸泡时间为10分钟;
步骤(5)中,丝蛋白膜在磷酸缓冲液中浸泡时间为15分钟;
步骤(6)中,丝蛋白膜在混合溶液浸泡时间为45分钟,混合溶液组分及浓度:1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐为1mg/mL,N-羟基琥珀酰亚胺为1mg/mL;
步骤(7)中,反应时间为1小时,抗菌肽在缓冲液中浓度为1mg/mL。
本发明的特殊之处在于:通过共价修饰的方式可以使丝蛋白表面的抗菌性能较为稳定和持久。
抗菌肽改性丝蛋白膜材料应用效果试验如下所示:
1、抗菌肽改性丝蛋白膜材料抗大肠杆菌E.coli测试:
(1)取直径为1cm的抗菌肽改性丝蛋白膜和纯丝素蛋白膜,紫外照射灭菌(照射时间为30分钟),无菌水浸润;取直径为1cm的过滤纸两片,分别用ddH2O和抗菌肽溶液浸润。在图1和图2中,依次为试样4,试样2,试样1和试样3;
(2)将上述四个样品分别放至无菌细胞培养皿中,随后各加入50μL大肠杆菌培养液(106CFU/mL),并在37℃恒温箱中培养2小时;
(3)向每个培养皿中加入1mL磷酸缓冲液,并用超声波清洗(64kHz,2分钟),然后各取50μL梯度稀释,把50μL不同稀释度的细菌缓冲液加到培养皿中,用涂布棒将菌液均匀涂布在固体琼脂培养基上,并置于37℃恒温箱中培养24小时;
(4)根据固体琼脂培养基上菌落的数目来计算各个样品的抗菌能力。
其中,抗菌肽改性丝蛋白膜可以有效杀死93.5%的大肠杆菌E.coli。
2、抗菌肽改性丝蛋白膜抗金黄葡萄球菌S.aureus测试:
(1)取直径为1cm的抗菌肽改性丝蛋白膜和纯丝素蛋白膜,紫外照射灭菌(照射时间为30分钟),无菌水浸润;取直径为1cm的过滤纸两片,分别用ddH2O和抗菌肽溶液浸润。在图1和图2中,依次为试样4,试样2,试样1和试样3;
(2)将上述四个样品分别放至无菌细胞培养皿中,随后各加入50μL金黄葡萄球菌培养液(106CFU/mL),并在37℃恒温箱中培养2小时;
(3)向每个培养皿中加入1mL磷酸缓冲液,并用超声波清洗(64kHz,2分钟),然后各取50μL梯度稀释,把50μL不同稀释度的细菌缓冲液加到培养皿中,用涂布棒将菌液均匀涂布在固体琼脂培养基上,并置于37℃恒温箱中培养24小时;
(4)根据固体琼脂培养基上菌落的数目来计算各个样品的抗菌能力。
其中,抗菌肽改性丝蛋白膜可以有效杀死91.6%的金黄葡萄球菌S.aureus。
3、抗菌肽改性丝蛋白膜对大肠杆菌E.coli的抗菌持久性测试:
(1)将抗菌肽改性丝蛋白膜和抗菌肽溶液浸渍丝蛋白膜(未共价修饰)分别浸泡在磷酸缓冲液中不同时间(2小时,4小时,8小时,12小时,24小时,48小时,72小时,144小时);
(2)用与应用效果试验1相同的方法测试抗E.coli能力,以检验其抗菌持久性。测试膜杀菌活性用细菌减少率来表征,细菌减少率=(空白对照试样上菌落数-蛋白膜菌落数)/空白对照试样上菌落数。每种情况下的抗菌测试均为3个平行样品测试,取其平均值。
其中,抗菌肽改性丝蛋白膜在磷酸缓冲液中浸泡144小时后,仍然保持对E.coli 88.2%的杀菌活性;作为对照的抗菌肽浸渍丝蛋白膜(未共价修饰)在24小时后对E.coli的杀菌活性就下降到49.7%,144小时后下降到21.3%。表明抗菌肽改性丝蛋白膜抗E.coli活性的稳定持久性。
4、抗菌肽改性丝蛋白膜对金黄葡萄球菌S.aureus抗菌持久性测试:
(1)将抗菌肽改性丝蛋白膜和抗菌肽溶液浸渍丝蛋白膜(未共价修饰)分别浸泡在磷酸缓冲液中不同时间(2小时,4小时,8小时,12小时,24小时,48小时,72小时,144小时);
(2)用与应用效果试验2相同的方法测试抗S.aureus能力,以检验其抗菌持久性。测试膜杀菌活性用细菌减少率来表征,细菌减少率=(空白对照试样上菌落数-蛋白膜菌落数)/空白对照试样上菌落数。每种情况下的抗菌测试均为3个平行样品测试,取其平均值。
其中,抗菌肽改性丝蛋白膜在磷酸缓冲液中浸泡144小时后,仍然保持对Saureus 83.4%的杀菌活性;作为对照的抗菌肽浸渍丝蛋白膜(未共价修饰)在24小时后对S.aureus的杀菌活性就下降到44.6%,144小时后下降到18.0%。这表明抗菌肽接枝丝素蛋白膜抗S.aureus活性的稳定持久性。
最后,还需要注意的是,以上列举的仅是本发明的具体实施例子。显然,本发明不限于以上实施例子,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!