一种用于猪抗病育种的遗传分子标记方法和应用与流程
本发明属于猪遗传育种及分子标记辅助选择技术领域,具体涉及一种用于猪抗病育种的遗传分子标记方法和应用。
背景技术:
仔猪腹泻和水肿病是规模化猪场最常见的一类疾病,给养猪业带来巨大的经济损失。产肠毒素性大肠杆菌(Enterotoxigenic Escherichia coli,ETEC 18)是初生和断奶仔猪腹泻病最常见和最重要的病原菌,其中F18大肠杆菌(E.coli F18)又是发生最普遍、危害最大的大肠杆菌病原之一。研究表明,E.coli F18能否致病直接取决于仔猪小肠黏膜上皮细胞刷状缘有无与其黏附素相应的受体。
Snoeck等研究发现α-(1,2)岩藻糖转移酶1(FUT1基因编码)是E.coli F18受体形成的关键酶,其催化的H-2血型抗原是受体形成主要的糖类物质。Meijerink等研究进一步发现,FUT1基因M307处存在G/A突变位点,可以作为E.coli F18的重要遗传标记。但是Coddens等根据FUT1基因M307位点这一遗传标记,通过薄层色谱法(TLC)、负离子质谱、质子核磁共振光谱等技术,对FUT1酶参与调控的ABH血型抗原进行了验证,发现E.coli F18受体为FUT2基因编码的α-(1,2)岩藻糖转移酶2催化的1型H抗原,而并非FUT1基因编码的α-(1,2)岩藻糖转移酶1催化的2型H抗原。此外,包文斌等前期运用表达谱芯片,发现球系列—鞘糖脂生物合成通路对苏太猪断奶仔猪E.coli F18抗性可能具有重要的调控作用,并初步确定FUT2基因是球系列—鞘糖脂生物合成通路中的关键基因。
技术实现要素:
本发明的目的提供一种用于猪抗病育种的遗传分子标记方法和应用。具体采用大白猪FUT2基因转录起始密码子-84bp多态位点作为抗病育种的分子标记方法和应用。
实现本发明目的的技术方案是:
一种用于猪抗病育种的遗传分子标记方法,包括以下步骤:
1)猪FUT2基因变异位点的筛选和确定
提取待测样本的耳组织DNA;以包含FUT2基因的待测样本基因组DNA为模板,进行PCR扩增,PCR扩增的DNA模板采用混合DNA,每5个个体的DNA样作为1个DNA池,一共构建10个DNA池作为扩增模板,上下游引物序列为:
上游引物为:5’-CACAGCCATGCAAGACAAGG-3’
下游引物为:5’-AAAGAAGAATGGGGAGCCGA-3’;
测序结果进行Blast比对,发现在FUT2基因扩增片段的编码区中并未存在变异位点,但是在该基因ATG起始密码子上游-84bp处存在1个SNP位点;
2)利用FUT2基因ATG起始密码子上游-84bp标记对猪核心群全面检测基因型
对每个个体样品猪提取基因组DNA为模板进行PCR扩增,扩增片段包含ATG起始密码子上游195bp序列的PCR引物,目的片段长度203bp,上下游引物序列为:
上游引物为:5’-AGGGGAAACACACCCTCAAAA-3’
下游引物为:5’-GGGAGAACAGGGAGCGGTTA-3’;
3)扩增产物用SSCP方法进行分析,选择引物扩增产物出现3条带中间的第2和第3这2条带的样本为抗病育种中的有利个体;
4)对FUT2基因-84bp(C→T)突变与F18大肠杆菌抗性之间进行关联分析及抗性标记的确定。
其中,待测样本选择大白猪,每个个体采取耳组织样约1.0g,放入1.5mL的离心管内,置-20℃存放。采用常规酚-氯仿法提取基因组DNA,超纯水溶解后用NanoDrop-1000微量核酸测定仪测定其浓度和纯度,根据其浓度用超纯水稀释成100mg/μL,-20℃保存备用。
所述PCR扩增体系:基因组混合DNA(100ng/μL)1.0μL,PCR Master-Mix 10.0μL,上下游引物(10pmol/L)F1/R1各1.0μL,加ddH2O补足至20μL;条件为:95℃预变性5min,95℃变性30s,63℃退火30s,72℃延伸50s,35个循环,72℃延伸10min,最后4℃保存备用。
本发明为从遗传素质上永久性地提高大白猪断奶仔猪大肠杆菌抗性和部分经济性状提供了有效的分子标记育种手段。
本发明的优点体现在:
1)本发明为大白猪抗病育种工作的分子标记辅助选择提供一个更加高效准确、简便易行的分子遗传标记,为提高仔猪对大肠杆菌病的抵抗能力和部分经济性状提供了一种有效的分子标记育种手段。用该遗传标记对猪的大肠杆菌抗性进行标记辅助选择,可有效地缓解实际生产中的仔猪腹泻病问题,同时可以提高猪的部分经济性状。
2)使用该遗传标记进行分子选育,不仅加快育种进程,而且对于大白猪的免疫应答能力和一般抗病力没有任何不利的影响。
3)本发明的检测方法操作简单,费用较为低廉,准确度高,并可实现自动化的直接检测,本发明将在大白猪的抗病育种中发挥巨大作用。
附图说明
图1为FUT2基因转录起始密码子上游序列PCR-SSCP带型。
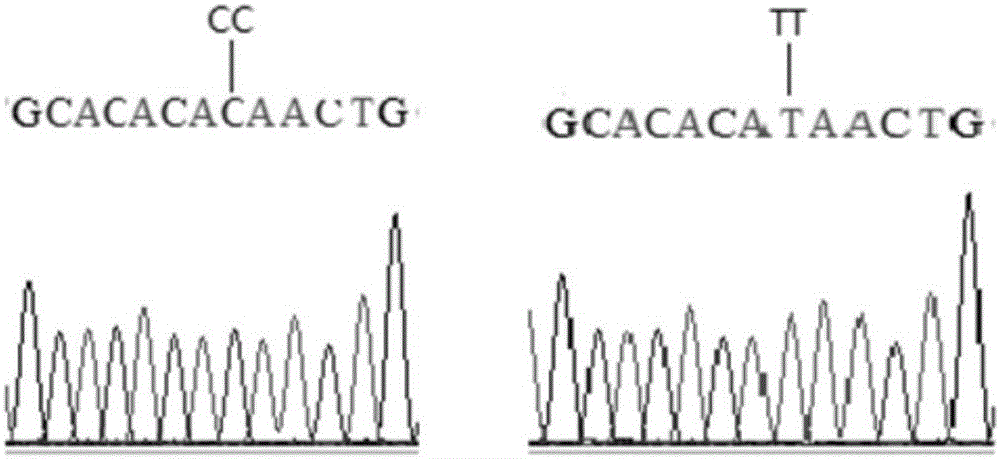
图2为FUT2基因转录起始密码子上游序列突变测序峰图。
图3为大肠杆菌易感型判定结果(A:标准菌株107/86;B:rE.coli1534;C:pnirBMisL-fedF(照片均使用油镜镜头,以1000倍放大比例拍摄))。
图4为大肠杆菌抗性型判定结果(A:标准菌株107/86;B:rE.coli1534;C:pnirBMisL-fedF的能力丧失(照片均使用油镜镜头,以1000倍放大比例拍摄))。
具体实施方式
为了更好地理解本发明,下面通过具体的实施例来具体说明本发明的技术方案。
实施例1大白猪FUT2基因变异位点的筛选和确定
所有大白猪(242头)来自常州康乐农牧有限公司(国家生猪核心育种场)。每个个体采取耳组织样约1.0g,放入1.5mL的离心管内,置-20℃存放。采用常规酚-氯仿法提取基因组DNA,超纯水溶解后用NanoDrop-1000微量核酸测定仪测定其浓度和纯度,根据其浓度用超纯水稀释成100mg/μL,-20℃保存备用。根据GenBank公布的猪FUT2基因序列(登录号:U70881.2)设计引物F:F1:CACAGCCATGCAAGACAAGG/R:AAAGAAGAATGGGGAGCCGA(5′→3′)。PCR扩增的DNA模板采用混合DNA,每5个个体的DNA样作为1个DNA池,一共构建10个DNA池作为扩增模板。PCR扩增体系:基因组混合DNA(100ng/μL)1.0μL,PCR Master-Mix 10.0μL,上下游引物(10pmol/L)F1/R1各1.0μL,加ddH2O补足至20μL;条件为:95℃预变性5min,95℃变性30s,63℃退火30s,72℃延伸50s,35个循环,72℃延伸10min,最后4℃保存备用。PCR扩增产物经1%琼脂糖凝胶电泳检测之后,直接送往上海生工生物工程技术服务有限公司进行双向测序分析,并根据测序结果进行Blast比对,发现在FUT2基因扩增片段的编码区中并未存在变异位点,但是在该基因ATG起始密码子上游-84bp处存在1个SNP位点。
实施例2利用FUT2基因ATG起始密码子上游-84bp标记对大白猪核心群全面检测基因型。
设计扩增片段包含ATG起始密码子上游195bp序列的PCR引物,利用Primer Premier5.0软件进行引物设计。扩增引物,F:5’-AGGGGAAACACACCCTCAAAA-3’(SEQ ID NO.1);R:5’-GGGAGAACAGGGAGCGGTTA-3’(SEQ ID NO.2),目的片段长度203bp。引物由上海生工生物工程有限公司合成。
以提取的基因组DNA为模板进行PCR扩增。PCR扩增体系:基因组混合DNA(100ng/μL)1.0μL,PCR Master-Mix 10.0μL,上下游引物(10pmol/L)F1/R1各1.0μL,加ddH2O补足至20μL;条件为:95℃预变性5min,95℃变性30s,63℃退火30s,72℃延伸50s,35个循环,72℃延伸10min,最后4℃保存备用。
SSCP检测:取3μLPCR产物与8μL变性剂混合,98℃变性15min,冰浴15min,然后取10μL经过冰浴的变性混合样加到聚丙烯酰胺凝胶(Acr:Bis=29:1)中,120V电压电泳11h。利用0.1%AgNO3进行银染,然后利用1.5%NaOH进行显色。
根据PCR-SSCP检测结果,选取不同基因型个体交由上海生工生物工程技术服务有限公司ABI PRISM 377DNA自动测序仪进行双向测序分析。
PCR-SSCP结果发现,检测到3种基因型,分别定义为TT、CT、CC(出现3条带的为CT型,出现3条带中间的第1和第3这2条带的为CC型,出现3条带中间的第2和第3这2条带的为TT型)(图1),经直接测序确定确实在ATG起始密码子上游-84bp存在C→T突变(图2)。
根据Hardy-Weinberg平衡定律计算FUT2基因目的突变位点的基因型频率,结果见表1,大白猪群体中CC基因型为优势基因型,基因型频率达到0.653;等位基因C为优势等位基因,基因频率为0.773。经卡方适合性检验,该突变(C>T)偏离Hardy-Weinberg平衡状态。
表1大白猪FUT2基因-84bp(C→T)突变基因型和等位基因频率分布
注:χ2表示不同基因型分布是否符合哈代温伯格平衡:χ20.05(1)=3.84,χ20.01(1)=6.63
实施例3仔猪小肠上皮细胞的黏附试验确定个体大肠杆菌F18菌株抗性/易感性
在仔猪断奶前后,也是最易感染大肠杆菌F18菌株而表现出腹泻症状的35日龄阶段屠宰取十二指肠、空肠肠段15cm用于小肠上皮细胞的制备,
产F18ab菌毛标准菌株107/86(O139:K12:H1)由美国宾夕法尼亚大学兽医学院微生物实验室惠赠。能诱导表达F18ac菌毛含fed操纵子全基因的重组大肠菌rE.coli1534由本实验室构建并保存,能表面分泌表达F18ab菌毛FedF亚单位的重组大肠杆菌pnirBMisL-fedF也由本实验室构建。将厌氧诱导的细菌用PBS反复离心洗涤3次,调整细菌浓度至约1×109CFU/ml。分别取上述野生菌或诱导表达的重组菌菌液0.5ml,在其中添加终浓度为1%甘露糖于37℃作用30min后和0.5ml小肠上皮细胞混合,再于37℃孵育30min,1000r/min离心5min,用PBR溶液悬浮后取50μl滴于洁净玻片上,自然干燥,火焰固定,用美兰染色3-5min,油镜观察结果。
断奶仔猪的小肠上皮细胞如均能与表达F18ab菌毛标准菌株107/86、诱导表达的重组大肠杆菌rE.coli1534及诱导表达的重组大肠杆菌pnirBMisL-fedF发生黏附作用(图3),将其定义为大肠杆菌F18菌株敏感型;而如仔猪小肠上皮细胞对上述3株大肠杆菌的黏附能力几乎为零(图4),则将其定义为抗性型。
实施例4大白猪FUT2基因-84bp(C→T)突变与F18大肠杆菌抗性的关系分析及抗性标记的确定
大白猪FUT2基因-84bp(C→T)突变3种基因型个体大肠杆菌F18菌株抗性/易感性进行分析,3种基因型个体大肠杆菌F18菌株抗性/易感性的频率见表2;可见,TT基因型中大肠杆菌F18菌株抗性型个体的频率为88.5%,显著或极显著地高于CT基因型(38.5%)和CC基因型(15.4%)的个体。可以将大白猪FUT2基因-84bp(C→T)突变TT基因型确定为抗大肠杆菌的有利基因型。
表2 3种基因型个体大肠杆菌F18菌株抗性/易感性的频率表
实施例5猪重要经济性状的测定
在仔猪断奶35日龄时随机选取80头仔猪,前腔静脉采血5ml,利用猪多细胞因子检测试剂盒(Procarta Immunoassay Kits)(Affymetrix,USA)对上述样本血清中部分重要细胞因子(IL-2、IL-4、IL-6、IL-10、IL-12、IFN-α、IFN-β、IFN-γ)水平进行测定,具体操作步骤严格按照说明书进行。
随机选取产仔6胎以上的大白经产母猪200头,整理各个母猪的繁殖性能和生长性能数据,用于后续遗传变异对部分经济性状的影响分析。在185-195日龄,B超活体测定大白猪的眼肌厚、背膘厚(母猪左侧第10肋处的背膘厚),称量体重。详细记录繁殖性能较为稳定的第3~5胎产活仔数、断奶仔猪数、出生窝重、断奶窝重。“100kg体重日龄”和“100kg活体背膘厚”分别按如下公式校正:100kg体重日龄=测定时日龄-(实测体重-100)/CF1,CF1=(实测体重/测定日龄)×1.715(母猪);100kg背膘厚=实测背膘厚×CF2,其中:CF2=A/{A+[B×(实测体重-100)]},大白母猪的A值和B值分别为13.706、0.119。对3个胎次的各项经济指标数据统计处理、取平均值,作为经济性状的分析数据。
实施例6大白猪FUT2基因-84bp(C→T)突变及其与重要经济性状间的关系分析
基于FUT2基因-84bp(C→T)位点3种基因型个体间8种细胞免疫因子在外周血液中的水平均不存在显著性差异(表3),表明该位点对于免疫应答能力和一般抗病力无显著性的影响。
表3FUT2基因不同基因型个体间部分重要免疫因子水平
本试验共挑选了200头(CC:130头、CT:46头和TT:24头)经产母猪测定部分经济性状数据。分析结果如表4所示,在初生仔猪数和断奶仔猪数指标上,呈现TT>CT>CC基因型的趋势,且TT基因型个体的初生仔猪数和断奶仔猪数显著高于CC基因型(P<0.05);在初生重、校正100Kg体重日龄、眼肌厚和校正100Kg背膘厚等指标上,3种基因型差异不显著。表明TT基因型对于重要的繁殖性状初生仔猪数和断奶仔猪数而言也是有利基因型,这可能与TT基因型具有较强的抗病力有关。
表4FUT2基因不同基因型个体之间的部分重要经济性状
注:右上标有不同字母的数值代表差异显著(P<0.05)。
- 还没有人留言评论。精彩留言会获得点赞!