白介素‑21在制备干细胞样记忆T细胞体外扩增诱导剂中的应用的制作方法
本发明属于T细胞体外扩增技术领域,更具体地,涉及一种体外扩增干细胞样记忆T细胞的诱导剂及方法。
背景技术:
细胞过继免疫治疗是通过体外活化和扩增自体或异体免疫细胞后输注到患者体内的一种治疗方法,被认为是当前最具潜力的免疫治疗手段。T细胞在人体免疫系统中扮演着重要的角色,其在体内处于抑制和耐受状态会导致免疫力下降,从而引发感染与肿瘤的发生。近年来,越来越多研究者将T细胞应用于细胞过继免疫治疗中,但是T细胞过继回输仍面临一些难题,如,终末阶段的细胞很难在体外培养的条件下长期生存,难以获得足够量的细胞、体内存活时间不长等。
近年来,干细胞样记忆性T细胞(T Stem Memory Cell, TSCM) 陆续在小鼠、猕猴等模式生物及人体中发现。这群细胞由初始T细胞发育而来,随后发育为中枢性记忆性T细胞和效应性记忆性T细胞。TSCM既具有产生细胞因子、快速增殖的记忆性T细胞的特征,又具有较强的存活、自我更新和多潜能分化能力的干细胞特征。其强大的生存能力克服了移植细胞体内存活时间不长的问题,且其自身可产生具有抗肿瘤作用的细胞因子,将有望成为过继性免疫治疗肿瘤的重要细胞来源。
基于TSCM在过继免疫治疗中的广阔应用前景,探索如何诱导这种细胞快速扩增的方法显得尤为重要和迫切。因此,有针对性地探索体外扩增TSCM的技术方法,找到成本低廉、安全性高的细胞因子或者药物非常有现实意义。
技术实现要素:
本发明的目的在于提供白介素-21在制备干细胞样记忆T细胞体外扩增诱导剂中的应用,同时提供一种体外扩增干细胞样记忆T细胞的方法。
本发明所采取的技术方案是:
一种体外扩增干细胞样记忆T细胞的方法,其步骤包括:
(1)将分选获得的Naïve CD8+ T细胞置于添加有1μg/mL (终浓度) Anti-CD3抗体、1μg/mL (终浓度) Anti-CD28抗体的T细胞培养液中培养;
(2)在培养液中加入诱导剂白介素-21进行诱导培养,每3天补充一次Anti-CD3抗体、Anti-CD28抗体和白介素-21;
(3)诱导培养完成后,分选出需要的CD8+ TSCM。
作为上述体外扩增干细胞样记忆T细胞的方法的进一步改进,白介素-21在培养基中的终浓度为5~40ng/mL,最适浓度为20ng/mL。
本发明的有益效果是:
本发明通过研究发现了低剂量白介素-21可作为体外扩增干细胞样记忆T细胞的诱导剂,快速诱导Naïve CD8+ T细胞扩增为TSCM,有效提高CD8+ TSCM的绝对数和形成比例,其诱导效果优于细胞过继免疫治疗通用的诱导剂白介素-2。
本发明所涉及的白介素-21是一种机体天然分泌的细胞因子,安全性高,不存在药物毒性等问题,能为过继免疫治疗的广泛开展提供了良好的技术支持。
附图说明
图1:IL-21浓度在5~40ng/mL时,CD8+ TSCM的形成比例与IL-21处理浓度呈正相关;
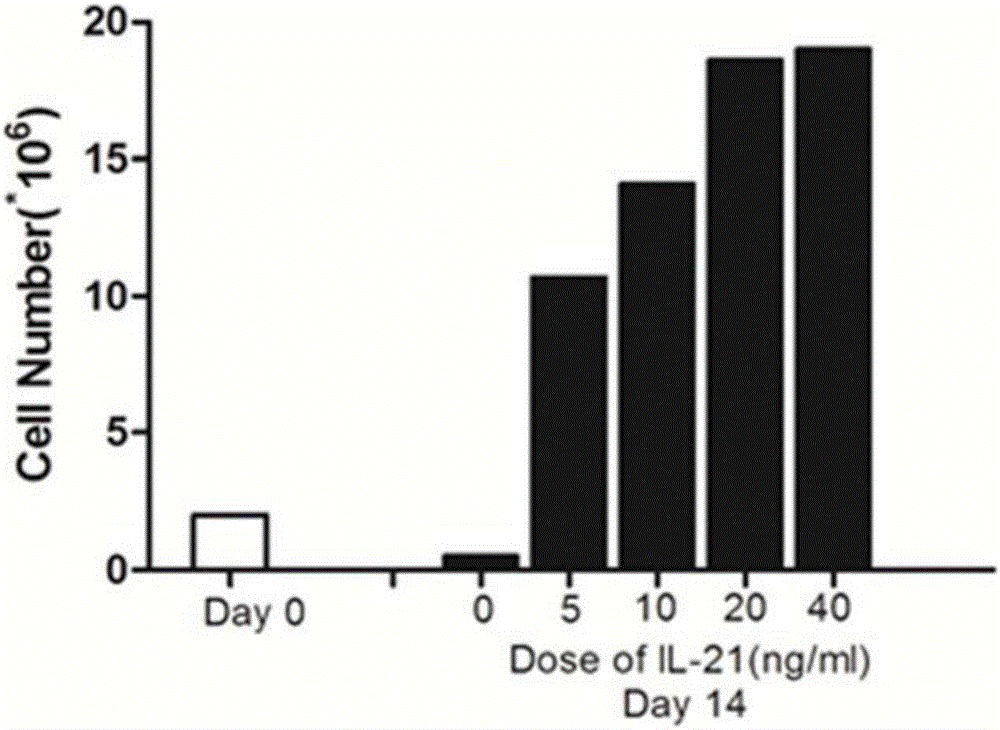
图2:IL-21浓度在5~40ng/mL时,CD8+ TSCM绝对数逐步增加,其中IL-21的终浓度为20ng/mL时最适;
图3:10ng/mL IL-2和20ng/mL IL-21分别扩增CD8+ TSCM的流式细胞对比图;
图4:20ng/mL IL-21扩增CD8+ TSCM的形成比例显著高于10ng/mL IL-2的形成比例,图中NC为仅用Anti-CD3/28激活的处理组,UD(Undetected)表示未能检测到有效信号,细胞大部分凋亡。
具体实施方式
下面结合附图和具体实施例进一步详细说明本发明。人的外周成分血由广州市血液中心提供。除非特别说明,本发明采用的试剂、设备和方法为本技术领域常规的市购试剂、设备和常规使用方法。
不同浓度诱导剂对TSCM体外扩增的效果
(1)将流式细胞仪分选出Naïve CD8+ T细胞(CD8+ CD45RO- CD62L+)铺在12孔板中,每孔预期的细胞数为1×106个,添加含有1μg/mL (终浓度) Anti-CD3抗体、1μg/mL (终浓度) Anti-CD28抗体的T细胞培养液;
(2)随后进行5种不同的处理,每组分别添加终浓度为0、5、10、20、40ng/mL的IL-21,每种处理设置三个复孔作为平行对照,并在细胞培养的第4、7、10、13天施加相应浓度的Anti-CD3抗体、Anti-CD28抗体和IL-21;
(3)细胞培养14天后,运用流式细胞仪检测。采用CD8、CD45RA、CD45RO、CD62L、CCR7、CD122、CD95等7个表面分子对 CD8+ T 细胞中的TSCM进行细胞群确定。首先,依次圈定淋巴细胞群和 CD8+ T细胞;然后,依次圈定 naïve表型的表面分子:CD45RA+、CD45RO-、CD62L+、CCR7+;最后,圈定记忆表型的表面分子:CD122+、CD95+。对照组与实验组均为同一供体的CD8+ T细胞,每个时间点分别取不同供体的细胞进行检测。
实验结果如图1和图2所示,在加入IL-21依次为5、10、20、40ng/mL四个浓度的处理条件下,CD8+ TSCM 细胞比例与IL-21处理浓度有正相关关系,相关系数r2=0.924;由于细胞因子诱导调节是有限的,IL-21的终浓度为20ng/mL时最适。
不同诱导剂对TSCM体外扩增效果的对比
(1)将流式细胞仪分选出Naïve CD8+ T细胞(CD8+ CD45RO- CD62L+)铺在12孔板中,每孔预期的细胞数为1×106个,添加有1μg/mL (终浓度) Anti-CD3抗体、1μg/mL (终浓度) Anti-CD28抗体的T细胞培养液;
(2)随后进行3种不同的处理,NC组为不做任何处理,IL-2组添加终浓度为10ng/mL 的IL-2,IL-21组添加终浓度为20ng/mL 的IL-21,每种处理设置三个复孔作为平行对照,并在细胞培养的第4、7、10、13天施加相应浓度的Anti-CD3抗体、Anti-CD28抗体和诱导剂(IL-2或IL-21);
(3)细胞培养14天后,运用流式细胞仪检测。采用CD8、CD45RA、CD45RO、CD62L、CCR7、CD122、CD95等7个表面分子对 CD8+ T 细胞中的TSCM进行细胞群确定。首先,依次圈定淋巴细胞群和 CD8+ T细胞;然后,依次圈定 naïve表型的表面分子:CD45RA+CD45RO-、CD62L+CCR7+;最后,圈定记忆表型的表面分子:CD122+CD95+。对照组与实验组均为同一供体的CD8+ T细胞,每个时间点分别取不同供体的细胞进行检测。
实验结果如图3和图4所示,与不加白介素组及细胞过继免疫治疗通用的诱导剂IL-2组相比,20ng/mL的 IL-21对CD8+ TSCM的形成比例显著提高(统计分析具有显著性差异),达1.62%±0.67;而IL-2组的形成比例仅0.30%±0.20;仅用Anti-CD3/28激活的对照组不能检测到有效信号,细胞大部分凋亡。
- 还没有人留言评论。精彩留言会获得点赞!
- 从人胎盘羊膜制备羊膜间充质干细胞的方法及其应用与流程
- 一种脐疗贴的制备方法及应用与流程
- 一种干细胞制剂及其在制备治疗慢性肾炎的药物中的应用的制作方法与工艺
- 脐带间充质干细胞在制备治疗角膜损伤的干细胞制剂中的应用的制作方法与工艺
- 脐带间充质干细胞联合黄芪多糖在制备治疗高血糖和糖尿病肾病药物中的应用的制作方法与工艺
- 由脐带间充质干细胞制备CD34阳性细胞的方法与流程
- 基因重组干细胞制剂的制备方法及其在皮肤损伤修复、瘢痕抑制中的应用与流程
- 一种大规模制备人脐带间充质干细胞因子用诱导分泌培养基的制作方法与工艺
- 一种人母乳干细胞的制备方法及其应用与流程
- 间充质干细胞联合维生素E在制备肾脏组织细胞修复药物中的应用的制作方法与工艺