利用地衣芽孢杆菌生物合成纳米硒的方法及其应用与流程
本发明涉及微生物学及生物纳米硒制备技术领域,具体地说,涉及一种利用地衣芽孢杆菌生物合成纳米硒的方法及其应用。
背景技术:
硒(Selenium,Se)元素是许多有机体必需的微量元素之一,是生物体内硫氧还原蛋白酶、脱碘酶、谷胱甘肽过氧化酶等多种含硒酶蛋白的必需组分,并且参与人体多种代谢途径。研究发现,人体缺硒会导致多种疾病,并且增加患癌风险。我国具有丰富硒资源,但硒在自然界分布极不均匀,导致我国三分之二以上地区缺硒。中国营养学会及FAO/WHO/IAEA联合专家委员会确定人体硒摄入量适宜范围为60-250μg/d,安全剂量为400μg/d,中毒剂量为800μg/d。硒过量也会造成人体危害。因此亟待为缺硒人群开发安全高效硒源。自然界中硒形态包括负二价、零价、四价及六价四种形态,研究表明,负二价、四价及六价形态的硒毒性巨大,作为补硒源具有潜在危险;块状零价单质硒不具有生物学活性,而纳米级别的单质硒具有显著生物学活性,并且能显著抑制肿瘤,因此开发纳米硒作为补硒源具有明显优势。
国内外研究人员对微生物参与的硒的各价态间的转化及有机硒的形成有较明确的认识。相对于化学或物理方法制备单质纳米硒过程中的高能耗高污染,通过微生物对无机硒转化,可得到更为简便、经济、绿色环保获取单质纳米硒的方法。近十年来,发现许多细菌可以耐受高浓度的硒盐,并转化硒盐为低毒的红色单质纳米硒。涵盖的种属极其丰富,已有报道约30个属,包括大肠杆菌(Escherichia coli)、荚膜红细菌(Rhodobacter capsulatus)、枯草芽孢杆菌(Bacillus subtilis)、荧光假单胞菌(Pseudomonas fluorescens)等,总体上它们属于变形菌门和厚壁菌门。
技术实现要素:
本发明的目的是提供一种利用地衣芽孢杆菌生物合成纳米硒的方法及其应用。
为了实现本发明目的,本发明从土壤中分离得到一株可耐受较高浓度亚硒酸盐、硒酸盐的地衣芽孢杆菌(Bacillus licheniformis)S13,菌株S13现已保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101,保藏编号CGMCC No.11742,保藏日期2015年11月26日。
地衣芽孢杆菌S13为芽孢杆菌目、芽孢杆菌科,革兰氏阳性菌,棒状,内生孢子,广泛存在于土壤中。地衣芽孢杆菌能够促进肠道内正常生理性厌氧菌的生长,调整肠道菌群失调,恢复肠道功能;对肠道细菌感染具有特效,对轻型或重型急性肠炎,轻型及普通型的急性菌痢等,均有明显疗效;能产生抗菌活性物质,抑制致病菌的生长繁殖。在水产养殖、饲料添加以及医药领域具有广泛应用。
本发明还提供含有所述地衣芽孢杆菌S13的复合微生物菌剂。
本发明还提供利用所述地衣芽孢杆菌S13生物合成纳米硒的方法,所述方法是向发酵培养基中添加亚硒酸盐和/或硒酸盐,发酵培养地衣芽孢杆菌S13,并从发酵产物中分离纯化纳米硒。所述发酵产物包括发酵液经离心所得菌体沉淀,菌悬液以及菌体裂解液。
本发明所述亚硒酸盐、硒酸盐包括亚硒酸/硒酸的钠盐、钾盐等无机盐。优选亚硒酸钠、硒酸钠。
所述发酵培养基中亚硒酸盐的浓度为0.001-70mM,优选1-3mM,更优选3mM;所述发酵培养基中硒酸盐的浓度为0.001-600mM,优选0.1-500mM,更优选1-150mM。
本发明提供的利用地衣芽孢杆菌S13生物合成纳米硒的方法,包括以下步骤:
S1、菌种活化
用SOC培养基对菌株进行活化培养,SOC培养基配方为:胰蛋白胨16g/L,酵母提取物5g/L,氯化钠5g/L,氯化钾2.5mM,氯化镁10mM,葡萄糖20mM,琼脂15g/L,pH 7.0-7.2;将菌株S13接种于SOC培养基斜面上,37℃培养48小时;
S2、种子液的制备
种子培养用SOB液体培养基,SOB液体培养基配方为:胰蛋白胨20g/L,酵母提取物5g/L,氯化钠5g/L,氯化钾2.5mM,氯化镁10mM,pH 7.0-7.2;将活化好的菌株S13用无菌生理盐水配制成108CFU/mL的菌悬液,以1%的接种量接种于SOB液体培养基中,37℃摇床震荡培养,转速为150rpm,培养时间为24-36h;
S3、发酵罐发酵
发酵培养采用TB发酵培养基,TB发酵培养基配方为胰蛋白胨10-15g/L,酵母提取物8-15g/L,甘油4-6ml/L,KH2PO4 2-5g/L,K2HPO4 15-20g/L,亚硒酸盐3mM,pH 7.0;控制培养基体积为发酵罐体积的60-80%,将种子液按照2-4%的接种量接入发酵罐,控制发酵温度为35-38℃,搅拌速度为160-260rpm,通气量为1:0.4-0.8,罐压1.3-1.7F/cm2,发酵80-120小时;
S4、从发酵产物中分离纯化纳米硒。
从发酵产物中分离纯化生物纳米硒的方法如下:
方案I:
发酵液下罐,4500-12000rpm离心10-20min收集菌体沉淀,用无菌生理盐水4500-12000rpm离心10-20min清洗2-3遍,并用发酵液1/10体积的水(优选无菌纯净水)重悬沉淀,所得菌悬液经冷冻干燥,即得纳米硒干粉。
方案II:
a、发酵液下罐,将发酵液置于冰上进行超声破碎细胞,设置变幅杆为Φ10,占空比40-80%,功率500-800W,频率20KHz,启停间隔5-10s,破碎30-40min,得到菌体裂解液;
b、菌体裂解液于4000-10000rpm离心10-30min,所得沉淀用无菌生理盐水4000-10000rpm离心20-30min清洗3-5遍;将沉淀重悬于发酵液1/2体积的水(优选无菌纯净水)中,得到纳米硒悬液;
c、将纳米硒悬液转移至萃取塔中,按照发酵液0.4-0.7倍体积的量加入正己烷萃取3-6次,收集下层水相,冷冻干燥,即得纳米硒干粉;
d、获得高纯度、分散性较好生物纳米硒悬液。
冷冻干燥与生物纳米硒制备:将方案I中制备的生物纳米硒,用液氮冷冻10-15min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强20-100Pa,加热板温度为20-35℃,样品厚度为10-25mm;干燥时间在48-72小时,得到生物纳米硒干粉A。
将方案II中制备的生物纳米硒,用液氮冷冻1015min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强20-65Pa,加热板温度为20-25℃,样品厚度为10-14mm;干燥时间在36-48小时,得到纯生物纳米硒干粉B。
本发明还提供由所述地衣芽孢杆菌S13发酵制备的生物纳米硒。其中,所述生物纳米硒的粒径为50-300nm,主要粒径为150-200nm。
本发明进一步提供由所述地衣芽孢杆菌S13生物合成的纳米硒在制备食品、保健品、药品、畜禽饲料以及农用肥料中的应用。
本发明还提供由所述生物纳米硒制备的富硒功能食品、富硒保健品和硒药片以及富硒饲料、富硒肥料。其中,生物纳米硒所占含量分别为10-2500μg/kg、10-500mg/kg、50-800mg/kg、50-800μg/kg和1-5g/kg。
在本发明的一个具体实施方式中,将生物纳米硒干粉A和B分别悬浮于纯净水中,配制成1-5g/L的富硒肥料A和富硒肥料B。将肥料A和B用于小麦、水稻、玉米等粮食作物种植,用于大豆、花生、谷子、红薯等杂粮的种植,并在金针菇、香菇、木耳等食用菌养殖中施用,用于番茄、茄子、黄瓜等蔬菜的种植,以及用于苹果、猕猴桃等水果和茶叶种植中,获得可再加工的富硒作物、富硒食用菌、富硒水果、富硒茶叶。
在本发明的另一个具体实施方式中,将生物纳米硒干粉A或B按照50-800μg/kg比例与饲料原料混合均匀,配制成富硒饲料A和富硒饲料B。将饲料A和B饲喂蛋鸡、肉鸡、猪、羊、牛等畜禽后,获得可再加工的富硒鸡蛋、富硒鸡肉、富硒猪肉、富硒羊肉、富硒牛肉。
在本发明的又一个具体实施方式中,将生物纳米硒干粉B按照10-2500μg/kg的比例与小米面粉、植物油和纯净水(三者的重量百分比为55%、10%和35%)混合均匀,投入膨化机中挤压膨化,烘干装袋,获得膨化小米富硒功能食品。或者,将小米面粉替换为玉米粉、荞麦粉或豆粉,可获得膨化玉米、荞麦或豆粉富硒功能食品。
在本发明的再一个具体实施方式中,将生物纳米硒干粉B(10-500mg/Kg)与淀粉(972.50-999.99g/Kg)、维生素E(0-22g/Kg)和β胡萝卜素(0-5g/Kg)混合均匀,加入润湿剂,在制粒机中制成微粒,将微粒烘干并填充到胶囊壳中,控制每粒胶囊重0.3-0.6g,按100粒每瓶装瓶,封口包装入库。
将生物纳米硒干粉B(50-800mg/Kg)与淀粉和植物蛋白粉(淀粉和植物蛋白粉的重量比为95:4.9)混合均匀,将粘合剂HPMC加入到上述混合物中,在混合机中搅拌均匀,将原料投入压片机中开车压片,烘干,每粒片重0.4-0.6g,按100粒每瓶装瓶,封口包装入库。
本发明对纳米硒合成菌--地衣芽孢杆菌S13生物合成纳米硒的发酵工艺条件进行优化,对亚硒酸盐、硒酸盐的耐受范围,对不同浓度亚硒酸盐的转化效率,不同时间点的转化效率变化,以及对其生长曲线、致病性、发酵工艺、纳米硒分离纯化技术等进行研究,探索出可进行工厂化生产生物纳米硒的一套技术。为获得可进行再加工的富硒产品,本发明还进行了纯化后生物纳米硒的深加工研究,开发出了富硒肥料、富硒饲料、富硒功能食品、富硒保健品以及硒药片等。
本发明利用地衣芽孢杆菌S13合成生物纳米硒,对生物纳米硒进行分离纯化,大量制备生物纳米硒,并在肥料、饲料、富硒功能食品加工、保健品及医药产品中应用。采用生物发酵工艺制备纳米硒,具有环境友好,产率高,安全高效等特点,生产获得的生物纳米硒用于富硒肥料、富硒饲料,施肥或饲喂后,作物、瓜果、蔬菜、肉蛋奶富硒效果显著。
附图说明
图1为本发明实施例1中菌株S13系统进化树,A为16S rRNA基因进化树,B为gyrB基因进化树。
图2为本发明实施例2中菌株S13对不同浓度亚硒酸钠的耐受性。
图3为本发明实施例3中菌株S13对不同浓度硒酸盐的耐受性。
图4为本发明实施例4中菌株S13在不同亚硒酸盐浓度下的纳米硒产量(A)及对应浓度下的转化率(B)。
图5为本发明实施例5中菌株S13在3mM亚硒酸盐存在时,不同时间点的纳米硒产量(A)及对应时间点的转化效率(B)。
图6为本发明实施例6中培养基中添加3mM亚硒酸盐时,S13透射电子显微镜(TEM)照片(A)和生物纳米硒能谱(EDX)分析图(B);其中,B是对A图中箭头所指颗粒进行分析的结果。
图7为本发明实施例7中地衣芽孢杆菌S13转化生成的纳米硒颗粒纯化后透射电子显微镜(TEM)照片。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(Sambrook J&Russell DW,Molecular Cloning:a Laboratory Manual,2001),或按照制造厂商说明书建议的条件。
以下实施例中所述亚硒酸盐是指亚硒酸钠,所述硒酸盐是指硒酸钠。
实施例1地衣芽孢杆菌S13的分离纯化及鉴定
1、菌株S13的分离纯化
从土壤中分离得到一株可耐受较高浓度亚硒酸盐、硒酸盐的菌株S13。
2、菌株S13的鉴定
1.2.1 PCR扩增16S rRNA、gyrB基因序列并测序:
将菌株S13接种于LB固体培养基培养24h,取0.2mL灭菌PCR管,加入10μL ddH2O,无菌牙签挑取单个菌落到PCR管中搅拌混匀。
1.2.2构建PCR反应体系:
16S rRNA:以8F(5’-CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3’)及1506R(5’-CGGGATCCTACGGCTACCTTGTTACGACTTCACCCC-3’)为引物,PCR扩增获得16S rRNA基因序列。PCR反应体系为:ddH2O,18.5μL;10×Buffer,2.5μL,dNTP Mix,2μL;引物8F,0.5μL;引物1506R,0.5μL;菌液,0.5μL;rTaq DNA聚合酶,0.5μL。
PCR反应条件为:94℃10min;94℃40s,56℃40s,72℃1min,共30个循环;72℃10min;4℃保存。
gyrB:以gyrB UP-1Sf(5’-GAAGTCATCATGACCGTTCTGCA-3’)及gyrB UP-1Sr(5’-AGCAGGGTACGGATGTGCGAGCC-3’)为引物,PCR扩增获得gyrB基因序列。PCR反应体系为:ddH2O,18.5μL;10×Buffer,2.5μL;Dntp Mix,2μL;引物gyrB UP-1Sf,0.5μL;引物gyrB UP-1Sr,0.5μL;菌液,0.5μL;rTaq DNA聚合酶,0.5μL;
PCR反应条件为:95℃5min;94℃1min,55~62℃1min,72℃2min,共30个循环;72℃10min;4℃保存。
将PCR扩增获得的DNA片段进行纯化,并测序,测序结果用DNAMAN软件拼接。测得16S rRNA基因序列见SEQ ID NO:1,gyrB基因序列见SEQ ID NO:2。将测得的16S rRNA基因序列登录GenBank,获得的登录号为KX812811,并应用BLAST程序与GenBank数据库(http://www.ncbi.blm.nih.gov/blast.cgi)中已有细菌的16S rRNA基因、gyrB基因序列进行相似性比较分析,结果显示S13菌株16S rRNA基因序列与Bacillus licheniformis ATCC14579的一致性达到100%,gyrB基因序列与Bacillus licheniformis ATCC14580一致性达到99%。S13菌株16S rRNA基因进化树见图1A,gyrB基因进化树见图1B。由此确定S13菌株为地衣芽孢杆菌。
实施例2地衣芽孢杆菌S13对亚硒酸盐的耐受浓度
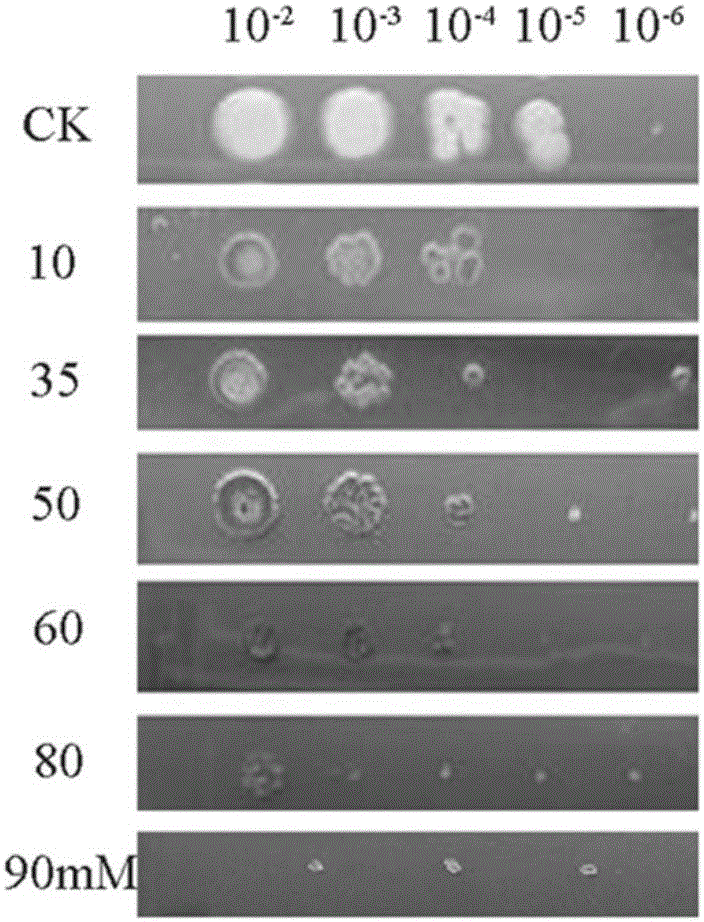
制备固体LB不同浓度含硒培养基(每升培养基含NaCl 10g,胰蛋白胨10g,酵母提取物5g,琼脂15g,去离子水1L),121℃高压灭菌20min;配制亚硒酸盐母液,过滤灭菌,加入亚硒酸盐溶液,使培养基中亚硒酸盐含量分别为0mM、10mM、25mM、35mM、55mM、70mM、80mM。
将S13菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,37℃),取上述菌液,稀释为OD600=0.8的母液备用;将母液分别稀释至10-2、10-3、10-4、10-5、10-6,分别在含硒平板上滴加2.5μL不同浓度的菌液,每个浓度6个重复,37℃培养48h,观察菌落生长及颜色变化。
结果见图2,可知10mM、25mM、35mM亚硒酸盐对地衣芽孢杆菌生长没有明显抑制作用并能合成纳米硒;55mM亚硒酸盐存在时,地衣芽孢杆菌S13仍能很好生长并合成纳米硒;70mM亚硒酸盐存在时,地衣芽孢杆菌S13仍能够较好的生长。由此得到地衣芽孢杆菌S13对亚硒酸盐耐受浓度范围为0-70mM。
实施例3地衣芽孢杆菌S13对硒酸盐的耐受浓度
制备固体LB不同浓度含硒培养基(每升培养基含NaCl 10g,胰蛋白胨10g,酵母提取物5g,琼脂15g,去离子水1L),121℃高压灭菌20min;配制硒酸盐母液,过滤灭菌,加入硒酸盐溶液,使培养基中硒酸盐含量分别0mM、50mM、100mM、150mM、、400mM、500Mm、600mM。
将S13菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,37℃),取上述菌液,稀释为OD600=0.8的母液,再将母液稀释至10-2,10-3,10-4,10-5,10-6,分别在不同浓度的含硒平板上滴加菌液,每个浓度3个重复,37℃培养48h,观察菌落生长及颜色变化。
结果见图3,可知50mM硒酸盐对地衣芽孢杆菌生长不受影响;100mM、150mM、400mM、500mM硒酸盐存在时,地衣芽孢杆菌S13生长能较好生长并且合成纳米硒;600mM硒酸盐存在时,地衣芽孢杆菌S13仍能存活且产生纳米硒,由此得到地衣芽孢杆菌S13对硒酸盐耐受浓度范围为0-600mM。
实施例4地衣芽孢杆菌S13对生物纳米硒的合成效率
制备不同浓度含硒液体LB培养基,121℃高压灭菌20min;配制亚硒酸盐母液,过滤灭菌,加入亚硒酸盐溶液,使培养基中亚硒酸盐含量分别为1mM、3mM、5mM、7mM、10mM、15mM、20mM,每个浓度梯度3个重复。
将S13菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,37℃),取上述菌液,稀释至OD600=0.8;将稀释好的菌液按照0.1%接种量接种于LB培养基(含有亚硒酸盐)中,摇培48小时。
用蒸馏水配置1M的Na2S溶液(现配现用);将发酵液6000-12000rprn离心8-15min,去上清,清洗3-5次,然后加入与原发酵液体积比为1:2的1M Na2S溶液,混匀后充分反应1h,再6000-12000rprn离心5-8min;然后取上清液在500nm波长处测定吸光度。每个样品3个重复,每个样品测定3次。
根据纳米硒吸光度标准曲线换算可知样品中纳米硒含量及S13菌株在不同亚硒酸盐浓度下的转化率(图4)。S13菌株在较低亚硒酸盐浓度下可将亚硒酸盐全部转化为纳米硒,对1mM亚硒酸盐的转化率为98.5%,产量为0.985mM;培养基中含有3mM亚硒酸盐时,S13菌株转化纳米硒达到最高产量,为2.47mM,并且对亚硒酸盐的转化率仍能达到82.4%。
实施例5地衣芽孢杆菌S13合成纳米硒的最佳培养时间
1、制备含硒液体LB培养基,121℃高压灭菌20min;配制亚硒酸盐母液,过滤灭菌,加入亚硒酸盐溶液,使培养基中亚硒酸盐含量3mM。
2、将S13菌株挑取单菌落接种于LB液体培养基中摇培8h(150rpm,37℃),取上述菌液,稀释至OD600=0.8;将稀释好的菌液按照0.1%接种量接种于空白与3mM亚硒酸盐LB培养基中,37℃,150rpm摇培,对照与处理各3个重复。分别于摇培0h、4h、8h、12h、24h、30h、36h、48h、60h、72h、84h取样,每个处理3个重复。
3、将培养好的菌液6000-12000rpm离心8-15min,弃上清,清洗3次,然后加入1:2体积的1M Na2S溶液,混匀后充分反应1h,再6000-12000rpm离心5-8min;然后取上清液在500nm处测定吸光度。每个样品3个重复,每个样品测定3次。
4、根据纳米硒吸光度标准曲线换算可知,S13菌株在3mM亚硒酸盐浓度下的不同时间纳米硒产量(图5A)及对应的纳米硒转化效率(图5B)。S13菌株在摇培60h后合成纳米硒单位体积的产量达到最高并保持稳定。由此说明在地衣芽孢杆菌S13合成纳米硒的最佳生长时间为60-72h。
实施例6地衣芽孢杆菌S13合成生物纳米硒特征分析
活化地衣芽孢杆菌S13,转接0.1%的菌液(OD600=0.8)于灭菌后的含LB液体培养基的锥形瓶中,加入一定体积已过滤灭菌后的亚硒酸盐母液,保证锥形瓶内亚硒酸盐终浓度为3mM,置于摇床内37℃,150rpm培养48h。
将摇培48h后的红色菌液取出,在常温下6000-10000rpm离心5-10min,去上清,用生理盐水重悬浮沉淀,离心冲洗3-5遍,取菌与纳米硒的红色混合液,滴加一滴在铜网上,用滤纸吸去多余水分,晾干,在透射电镜下(TEM,JEM-1230,Japan)观察,并利用能谱分析仪(EDX)对该纳米颗粒进行分析。
结果如图6A和6B所示:透射电镜下,S13细胞膜上与细胞外可见球形纳米硒颗粒,粒径为50-300nm,主要粒径为150-200nm。通过EDX能谱分析箭头所指的纳米颗粒可知,出现在1.37、11.22和12.49KeV处特定吸收峰为硒的特征峰,说明S13菌将亚硒酸盐还原后形成的纳米颗粒是纳米硒。
实施例7地衣芽孢杆菌S13合成生物纳米硒发酵工艺
1、菌种活化
用SOC培养基对菌株进行活化培养,SOC培养基配方为:胰蛋白胨16g/L,酵母提取物5g/L,氯化钠5g/L,氯化钾2.5mM,氯化镁10mM,葡萄糖20mM,琼脂15g/L,pH 7.0-7.2;将菌株S13接种于SOC培养基斜面上,37℃培养48小时;
2、种子液的制备
种子培养用SOB液体培养基,SOB液体培养基配方为:胰蛋白胨20g/L,酵母提取物5g/L,氯化钠5g/L,氯化钾2.5mM,氯化镁10mM,pH 7.0-7.2;将活化好的菌株S13用无菌生理盐水配制成108CFU/mL的菌悬液,以1%的接种量接种于SOB液体培养基中,37℃摇床震荡培养,转速为150rpm,培养时间为24-36h;
3、发酵罐发酵
发酵培养采用TB发酵培养基,TB发酵培养基配方为:胰蛋白胨10-15g/L,酵母提取物8-15g/L,甘油4-6ml/L,KH2PO4 2-5g/L,K2HPO415-20g/L,亚硒酸盐3mM,pH 7.0;控制培养基体积为发酵罐体积的60-80%,将种子液按照2-4%的接种量接入发酵罐,控制发酵温度为35-38℃,搅拌速度为160-260rpm,通气量为1:0.4-0.8,罐压1.3-1.7F/cm2,发酵80-120小时。发酵液下罐,测得发酵液中纳米硒含量为2.6mM。
4、生物纳米硒的分离纯化
(1)纳米硒的收集、清洗与浓缩
发酵液下罐,4500-12000rpm离心10-20min收集菌体沉淀,用无菌生理盐水4500-12000rpm离心10-20min清洗2-3遍,并用发酵液1/10体积的无菌纯净水重悬沉淀,将纳米硒浓缩至发酵液浓度的10倍,达到26mM。
(2)生物纳米硒的分离纯化
a、发酵液下罐,将发酵液置于冰上进行超声破碎细胞,设置变幅杆为Φ10,占空比40-80%,功率500-800W,频率20KHz,启停间隔5-10s,破碎30-40min,得到菌体裂解液;
b、菌体裂解液于4000-10000rpm离心10-30min,所得沉淀用无菌生理盐水4000-10000rpm离心20-30min清洗3-5遍;将沉淀重悬于发酵液1/2体积的无菌纯净水中,得到纳米硒悬液;
c、将纳米硒悬液转移至萃取塔中,按照发酵液0.4-0.7倍体积的量加入正己烷萃取3-6次,收集下层水相,冷冻干燥,即得纳米硒干粉;
d、获得高纯度、分散性较好生物纳米硒悬液,透射电子显微镜观察结果见图7。
(3)冷冻干燥与生物纳米硒制备
将步骤(1)中制备的生物纳米硒,用液氮冷冻10-15min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强20-100Pa,加热板温度为20-35℃,样品厚度为10-25mm;干燥时间在48-72小时,得到生物纳米硒干粉A。
将步骤(2)中制备的生物纳米硒,用液氮冷冻10-15min,放入冷冻干燥机中进行冷冻干燥,冷冻干燥参数为压强20-65Pa,加热板温度为20-25℃,样品厚度为10-14mm;干燥时间在36-48小时,得到纯生物纳米硒干粉B。
实施例8生物纳米硒在富硒肥料、饲料、功能食品、保健品和药品中的应用
1、将生物纳米硒干粉A和B分别悬浮于纯净水中,配制成1-5g/L的富硒肥料A和富硒肥料B。将肥料A和B用于小麦、水稻、玉米等粮食作物种植,用于大豆、花生、谷子、红薯等杂粮的种植,并在金针菇、香菇、木耳等食用菌养殖中施用,用于番茄、茄子、黄瓜等蔬菜的种植,以及用于苹果、猕猴桃等水果和茶叶种植中,获得可再加工的富硒作物、富硒食用菌、富硒水果、富硒茶叶。富硒粮食和杂粮硒含量为100-300μg/kg,富硒蔬菜和水果硒含量为20-100μg/kg,富硒食用菌硒含量为150-5000μg/kg。
2、将生物纳米硒干粉A或B按照50-800μg/kg比例与饲料原料混合均匀,配制成富硒饲料A和富硒饲料B。将饲料A和B饲喂蛋鸡、肉鸡、猪、羊、牛等畜禽后,获得可再加工的富硒鸡蛋、富硒鸡肉、富硒猪肉、富硒羊肉、富硒牛肉。富硒鸡蛋硒含量为200-1000μg/kg,富硒畜禽肉硒含量为200-800μg/kg。
3、将生物纳米硒干粉B按照10-2500μg/kg的比例与小米面粉、植物油和纯净水(三者的重量百分比为55%、10%和35%)混合均匀,投入膨化机中挤压膨化,烘干装袋,获得膨化小米富硒功能食品。或者,将小米面粉替换为玉米粉、荞麦粉或豆粉,可获得膨化玉米、荞麦或豆粉富硒功能食品。
4、将生物纳米硒干粉B(10-500mg/Kg)与淀粉(g/Kg)、维生素E(0-22g/Kg)和β胡萝卜素(0-5g/Kg)混合均匀,加入润湿剂,在制粒机中制成微粒,将微粒烘干并填充到胶囊壳中,控制每粒胶囊重0.3-0.6g,按100粒每瓶装瓶,封口包装入库。
5、将生物纳米硒干粉B(50-800mg/Kg)与淀粉和植物蛋白粉(淀粉和植物蛋白粉的重量比为95:4.9)混合均匀,将粘合剂HPMC加入到上述混合物中,在混合机中搅拌均匀,将原料投入压片机中开车压片,烘干,每粒片重0.4-0.6g,按100粒每瓶装瓶,封口包装入库。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110> 中国农业大学
<120> 利用地衣芽孢杆菌生物合成纳米硒的方法及其应用
<130> KHP161117069.3
<160> 2
<170> PatentIn version 3.3
<210> 1
<211> 1344
<212> DNA
<213> 地衣芽孢杆菌
<400> 1
ggaccgacgg gagcttgctc ccttaggtca gcggcggacg ggtgagtaac acgtgggtaa 60
cctgcctgta agactgggat aactccggga aaccggggct aataccggat gcttgattga 120
accgcatggt tcaatcataa aaggtggctt ttagctacca cttgcagatg gacccgcggc 180
gcattagcta gttggtgagg taacggctca ccaaggcgac gatgcgtagc cgacctgaga 240
gggtgatcgg ccacactggg actgagacac ggcccagact cctacgggag gcagcagtag 300
ggaatcttcc gcaatggacg aaagtctgac ggagcaacgc cgcgtgagtg atgaaggttt 360
tcggatcgta aaactctgtt gttagggaag aacaagtacc gttcgaatag ggcggtacct 420
tgacggtacc taaccagaaa gccacggcta actacgtgcc agcagccgcg gtaatacgta 480
ggtggcaagc gttgtccgga attattgggc gtaaagcgcg cgcaggcggt ttcttaagtc 540
tgatgtgaaa gcccccggct caaccgggga gggtcattgg aaactgggga acttgagtgc 600
agaagaggag agtggaattc cacgtgtagc ggtgaaatgc gtagagatgt ggaggaacac 660
cagtggcgaa ggcgactctc tggtctgtaa ctgacgctga ggcgcgaaag cgtggggagc 720
gaacaggatt agataccctg gtagtccacg ccgtaaacga tgagtgctaa gtgttagagg 780
gtttccgccc tttagtgctg cagcaaacgc attaagcact ccgcctgggg agtacggtcg 840
caagactgaa actcaaagga attgacgggg gcccgcacaa gcggtggagc atgtggttta 900
attcgaagca acgcgaagaa ccttaccagg tcttgacatc ctctgacaac cctagagata 960
gggcttcccc ttcgggggca gagtgacagg tggtgcatgg ttgtcgtcag ctcgtgtcgt 1020
gagatgttgg gttaagtccc gcaacgagcg caacccttga tcttagttgc cagcattcag 1080
ttgggcactc taaggtgact gccggtgaca aaccggagga aggtggggat gacgtcaaat 1140
catcatgccc cttatgacct gggctacaca cgtgctacaa tgggcagaac aaagggcagc 1200
gaagccgcga ggctaagcca atcccacaaa tctgttctca gttcggatcg cagtctgcaa 1260
ctcgactgcg tgaagctgga atcgctagta atcgcggatc agcatgccgc ggtgaatacg 1320
ttcccgggcc ttgtacacac cgcc 1344
<210> 2
<211> 1282
<212> DNA
<213> 地衣芽孢杆菌
<400> 2
gattgggcga ttgagctgcc cttgaagtca tcatgaccgt tctgcacgct ggtgggaagt 60
ttgacggaag cggatataaa gtttcaggcg gtttgcacgg cgttggtgca tctgttgtta 120
acgccctttc aaccgagctc gatgtaacgg tttacagaga tggaaaagtc cattaccagg 180
aatttgaacg gggcgttccg aaagctgatt tgaaagtcat cggagatacg gaagtgacgg 240
gaacgaccac tcacttcaag cctgatccgg aaatattcac ggaaacgacg gaatacgact 300
atgatacgct tgccactcgt gtccgggagc tcgctttctt gacaaaaggc gtcaaaatca 360
cgattgaaga caagcgagaa ggaaaagaac gcaagaatga ttactgctat gaaggcggta 420
ttaaaagcta tgttgaacac ttgaaccgtt cacgggaagt ggttcatgaa gagccagtct 480
atattgaagg atccaaagac ggcattacgg tcgaggtggc tcttcaatac aacgacagtt 540
ataccagcaa catttattcg tttgccaata acattcatac gtatgaaggc ggaacgcatg 600
aagccggctt taagaccggt ttgacgagag tcatcaatga ttacgcgaga aggaacggtg 660
tcttcaaaga aagcgatccg aacttaagcg gggaagacgt ccgtgaaggt ttgacagcga 720
tcatttcaat caagcatccg gatcctcaat ttgaagggca gacgaaaaca aagcttggca 780
actcagaagc gcggacgata acagatgcgc tattttcaga agcgctcgaa aagtttctgc 840
ttgaaaaccc ggattcggcg aaaaaaatcg ttgaaaaagg ggttatggcc gccagagcac 900
gaatggctgc aaagaaagca cgcgaactga cgcgcagaaa aagcgccctt gaagtgtcga 960
atctgccggg gaaactggct gactgttctt ctaaagaccc gacgatttcc gaactttaca 1020
tcgttgaggg tgactctgcg ggcggatcgg caaaacaggg ccgcgatcgt catttccaag 1080
ccattttgcc tttgagaggg aaaatcttga acgtcgaaaa agcacgcctg gacaaaattt 1140
tgtccaacaa tgaggttcgt tctatgatca ccgcgcttgg caccgggatc ggggaagatt 1200
tcaatcttga aaaagcccgc taccacaaag tcgtgattat gaccgacgct gatgtagatg 1260
gctcgcacat ccgactgcaa gg 1282
- 还没有人留言评论。精彩留言会获得点赞!