一种用双酶串联制备β‑丙氨酸的方法与流程
本发明涉及一种用双酶串联制备β-丙氨酸的方法,属于生物工程领域。
背景技术:
β-丙氨酸在医药食品化工等领域都有着广泛的应用,尤其是可以作为具有高附加值的医药中间体。目前在工业生产中,β-丙氨酸的主要合成方式是丙烯酸、丙烯腈氨化法,或β-氨基丙腈水解法,这些方法多需要在高温、高压、强酸或强碱的条件下,而且产物纯化繁琐,存在环境污染问题,因此使用生物催化法替代化学合成法制备β-丙氨酸是发展趋势。
而目,前生物合成法主要有两种,一种是优化代谢途径,在培养微生物过程中合成β-丙氨酸,此法虽然较简便,但是由于微生物代谢过程中会产生大量副产物,对产物的分离纯化带来较大困难,增加了后期纯化成本;另一种方法是生物酶法合成β-丙氨酸,即通过表达L-天冬氨酸α-脱羧酶,以L-天冬氨酸作为底物,合成β-丙氨酸,虽然此法分离纯化简便,但是底物价格相对较高,不适合工业化生产。
技术实现要素:
本发明提供了一种以富马酸为底物,以双酶串联体系合成β-丙氨酸的方法。
所述双酶是天冬氨酸酶、L-天冬氨酸α-脱羧酶。
所述天冬氨酸酶的制备方法,是大肠肝菌来源的编码天冬氨酸酶的基因aspA,通过NdeⅠ和HindⅢ双酶切后连接到用同样限制性内切酶酶切的质粒载体pET 28a(+)上,获得重组质粒pET 28a-aspA;将重组质粒转化大肠杆菌BL21,筛选获得重组大肠杆菌BL21/pET28a-aspA;以该重组菌生产得到天冬氨酸酶。
所述L-天冬氨酸α-脱羧酶的制备方法,是将谷氨酸棒杆菌来源的编码L-天冬氨酸α-脱羧酶的基因panD通过NdeⅠ和HindⅢ双酶切后连接到用同样限制性内切酶酶切的表达载体pET 24a(+)上,获得重组质粒pET 24a-panD;将重组质粒转化大肠杆菌BL21,筛选获得重组大肠杆菌BL21/pET24a-panD;以该重组菌生产得到L-天冬氨酸α-脱羧酶。
所述天冬氨酸酶、L-天冬氨酸α-脱羧酶的制备方法,还包括收集培养得到的重组菌的菌体,进行破碎、分离纯化目标蛋白质,获得电泳纯的酶。
所述双酶串联体系中,底物富马酸的浓度为50~100mmol/L;两种酶按照质量比天冬氨酸酶:L-天冬氨酸α-脱羧酶为1:80~100的比例添加至反应体系中;其中,天冬氨酸酶的用量为10~15μg/mL。
所述双酶串联体系中,底物富马酸的浓度为50mmol/L;两种酶按照质量比天冬氨酸酶:L-天冬氨酸α-脱羧酶为1:80的比例添加至反应体系中;其中,天冬氨酸酶的用量为10μg/mL。
在本发明的一种实施方式中,所述双酶串联体系还中含有1mmol/L的MgCl2,以及50mmol/L pH 7.0的NaH2PO4/Na2HPO4缓冲液。
在本发明的一种实施方式中,所用天冬氨酸酶、L-天冬氨酸α-脱羧酶的纯酶的比酶活分别为168mmol/g·min、156mmol/g·h。
在本发明的一种实施方式中,所述底物富马酸是配制50-500mmol/L富马酸母液,用氨水调节pH至7.0,然后作为反应底物。
在本发明的一种实施方式中,将底物和酶混合好后,置于30~37℃、100-200rpm的条件下,反应6-24h。
本发明首次实现了双酶串联反应,可在较短时间内将底物富马酸完全转化为β-丙氨酸,β-丙氨酸的产率>95%,中间产物L-天冬氨酸无残余。本发明方法采用的底物价格相对低廉,而且,中间产物L-天冬氨酸无残余,可见本发明能显著降低目前生物合成β-丙氨酸的成本。
附图说明
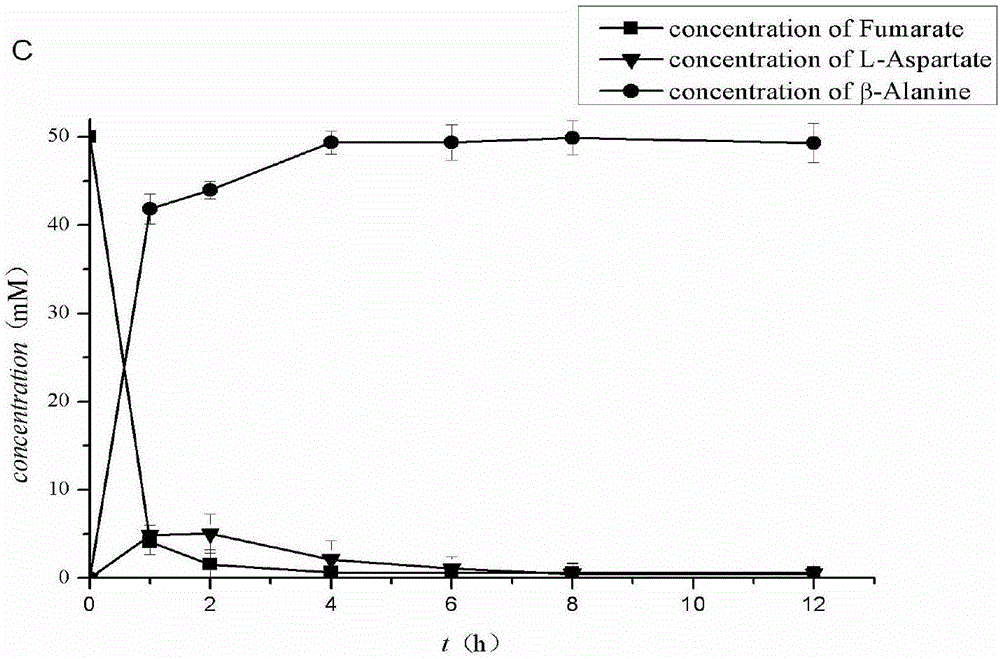
图1不同的天冬氨酸酶、L-天冬氨酸α-脱羧酶的加酶量的双酶偶联反应进程,A:天冬氨酸酶与L-天冬氨酸α-脱羧酶的加酶质量比为1:40;B:天冬氨酸酶与L-天冬氨酸α-脱羧酶的加酶质量比为1:60;C:天冬氨酸酶与L-天冬氨酸α-脱羧酶的加酶质量比为1:80。
图2双酶偶联反应催化体系示意图。
具体实施方式
富马酸含量的测定:反应液经0.22μm有机滤膜过滤后用HPLC检测,色谱柱为Prevail Organic Acid(OA)有机酸分析柱(5μm,4.6×250mm)。流动相为20%甲醇溶液(磷酸调pH至2.2),流速为0.6mL/min,检测波长为220nm,柱温为40℃,检测时间为15min,进样量为10μL。所测得衍生产物的含量等同于衍生前物质的含量。
L-天冬氨酸及β-丙氨酸含量的测定:反应液用苯基异硫酸酯(PITC)衍生,具体步骤为:取500μL反应液于1.5mL离心管,加入250μL 0.1mol/L PITC乙腈溶液和250μL 1mol/L三乙胺乙腈溶液,充分混匀,避光室温放置0.5h,加入700μL正己烷溶液,涡旋振荡器振荡1min,静置30-60min,吸取下层溶液,经0.22μm有机滤膜过滤,进样量为10μL。衍生产物用HPLC测定:色谱柱为La Chrom C18(5μm,4.6×250mm);流动相A溶液为80%(V/V)已腈水溶液,B溶液为97:3(V/V,pH 6.5)的0.1mol/L乙酸钠-乙腈溶液;采用梯度洗脱:0-20min,B溶液由95%下降到65%;20-30min,B液由65%上升到95%;30-35min,B溶液梯度不变。检测波长为254nm,柱温为40℃。
重组蛋白的纯化及鉴定:将重组菌体溶于结合缓冲溶液(50mmol/L Na2HPO4、50mmol/L NaH2PO4、500mmol/L NaCl、20mmol/L imidazole),超声破碎,离心,上清用0.22μm滤膜过滤。用10倍柱体积的结合缓冲溶液平衡5mL的His Trap HF柱,取20mL的破碎上清上样,用10倍柱体积的结合缓冲溶液洗去非特异性吸附的蛋白,分别用8倍柱体积的150、300和500mmol/L咪唑的缓冲液洗脱蛋白,收集样品并用SDS-PAGE分析鉴定。
实施例1重组大肠杆菌BL21/pET24a-panD的构建
根据GenBank所提供的谷氨酸棒杆菌来源的L-天冬氨酸α-脱羧酶的基因序列(EC4.1.1.11)设计引物,分别在上游引入NdeⅠ酶切位点和保护碱基,下游引入HindⅢ酶切位点和保护碱基,并在C端引入His标签。
提取谷氨酸棒杆菌基因组,将pCR扩增到的panD基因产物用NdeⅠ和HindⅢ双酶切后连接到用同样限制性内切酶酶切的质粒载体pET 24a(+)上,获得重组质粒pET 24a-panD。将重组质粒转化大肠杆菌BL21,筛选获得重组大肠杆菌BL21/pET24a-panD。
实施例2重组大肠杆菌BL21/pET28a-aspA的构建
根据GenBank所提供的大肠肝菌来源的天冬氨酸酶的基因序列(EC4.3.1.1)设计引物,分别在上游引入BamHⅠ酶切位点和保护碱基,下游引入HindⅢ酶切位点和保护碱基,并在C端引入His标签。
提取谷氨酸棒杆菌基因组,将pCR扩增到的panD基因产物用NdeⅠ和HindⅢ双酶切后连接到用同样限制性内切酶酶切的质粒载体pET 28a(+)上,获得重组质粒pET 28a-aspA。将重组质粒转化大肠杆菌BL21,筛选获得重组大肠杆菌BL21/pET28a-aspA。
实施例3天冬氨酸酶的表达
将重组大肠杆菌BL21/pET28a-aspA接种于4mL卡那霉素浓度为100μg/mL的TB培养基,37℃、200r/min振荡过夜培养。将上述过夜培养物按1%的接种量接种于含卡那霉素浓度为100μg/mL的TB培养基,37℃、200r/min振荡培养至菌液OD600为0.6-0.8,加入IPTG至终浓度0.2mmol/L,24℃诱导培养16-20h,收集菌体超声破碎,通过SDS-PAGE分析鉴定天冬氨酸酶重组蛋白表达水平。通过PAGE胶显示,该重组酶在大肠杆菌体内的表达量约为40%,同时通过高效液相色谱测得粗酶液中酶的比酶活为69mmol/g·min。
实施例4 L-天冬氨酸α-脱羧酶酶的表达
将重组大肠杆菌BL21/pET24a-panD接种于4mL卡那霉素浓度为100μg/mL的TB培养基,37℃、200r/min振荡过夜培养。将上述过夜培养物按1%的接种量接种于含卡那霉素浓度为100μg/mL的TB培养基,37℃、200r/min振荡培养至菌液OD600至0.6-0.8,加入IPTG至终浓度0.8mmol/L,37℃诱导培养16-20h,收集菌体超声破碎,通过Tris-tricine SDS-PAGE方法分析鉴定L-天冬氨酸α-脱羧酶重组蛋白表达水平。通过PAGE胶显示,该重组酶在大肠杆菌体内的表达量约为30%,同时通过高效液相色谱测得粗酶液中酶比酶活为13.9mmol/g·h。
实施例5
将两种重组大肠杆菌分别接种于种子培养基中,37℃,200rpm活化6-8h后,以1%的接种量分别转接至1L TB表达陪养基中,待OD600至0.6-0.8时,加入诱导剂IPTG,摇床培养16-18h得到发酵液,4000-6000rpm的转速离心收菌。向收得的菌体中加入100mL缓冲液,超声破碎,离心,用亲和层析柱His Trap HF纯化蛋白,天冬氨酸酶、L-天冬氨酸α-脱羧酶的纯酶比酶活分别为168mmol/g·min和156mmol/g·h。
在含有底物浓度为50mmol/L富马酸和足量氨(调pH至7.0)的10mL反应液中,加入天冬氨酸酶:L-天冬氨酸α-脱羧酶的质量浓度比例为1:80,其中天冬氨酸酶的质量为10μg/mL,反应体系中含有1mmol/L的MgCl2,50mmol/L NaH2PO4/Na2HPO4缓冲液(pH 7.0),37℃、200r/min下进行酶促反应(振荡反应),每隔1-2h取样,终止反应时取适量反应液于100℃煮沸10min,12000r/min离心10min,取上清,用0.22μm微孔有机滤膜过滤,利用HPLC检测反应液中各成分的含量,计算得到β-丙氨酸的浓度为49.5mmol/L,β丙氨酸产率为99%。
在上述双酶偶联催化体系中,固定富马酸浓度为50mmol/L,天冬氨酸酶的添加浓度为10μg/mL,调整L-天冬氨酸α-脱羧酶的添加量,使天冬氨酸酶与L-天冬氨酸α-脱羧酶的加酶质量比分别为1:40、1:60,进行双酶偶联反应。
结果如图1所示,在1:40和1:60(W/W)的反应体系中,反应8h,β-丙氨酸的产率只有82%和93%,且尚有部分中间产物未完全转化,反应至12h,1:40的反应体系中仍有中间产物。而在1:80的反应体系中,反应8h,富马酸可完全转化为β-丙氨酸,β-丙氨酸的产率>95%,中间产物L-天冬氨酸无残余。随着L-天冬氨酸α-脱羧酶浓度的提高,β-丙氨酸的合成速度大大增加,且中间产物L-天冬氨酸的残余量减少。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!