一种集成化药物筛选与染色微流控芯片的制作方法
本实用新型涉及微流控技术和聚合物芯片的设计、加工、制作和应用技术领域,特别提供了一种集成化药物筛选与染色微流控芯片。
背景技术:
现有技术中,微流控芯片是一种在微小通道中操控微小体积流体流动的系统,其中通道的尺度为几十到几百微米,承载流体的量为10-9~10-18L。微流控芯片的各个操作单元通过微通道网络内流体的流动相互联系。微流体控制是微流控芯片实验室的操作核心,所涉及的进样、混合、反应、分离等过程都是在可控流体的运动中完成的。无论是宏观还是微观流体,阀都是流体控制的核心部件。由于其重要性,微型阀的研制早在微流控芯片诞生之前引起人们的广泛关注。理论上讲,凡是能控制微通道闭合和开启状态的部件均可作为微流控芯片中的微阀使用。一个理想的微阀应该具备以下特征:低泄漏、低功耗、响应速度快、线性操作能力和适应面广。微流体和微型阀构成了一套完整的微流控芯片系统。
微流控分析的核心是利用微流控芯片将样品预处理、生物和化学反应、分离检测等基本操作单元集成在具有微米或纳米微通道网络的芯片上,通过操控流体完成复杂的分析过程,具有样品和试剂消耗量少、分析时间短、高通量、容易实现大规模平行测定等优点。利用微流控分析技术可方便的实现分析系统的小型化、集成化和便携化。目 前,该系统被广泛应用在生命科学、疾病诊断与治疗、药物合成与筛选等领域。
细胞水平药物筛选微流控芯片系统旨在通过设计有不同功能的芯片来培养细胞,对细胞施加药物刺激,并配合自动化的检测装置,采集药物与细胞相互作用的信号,收集数据,从而分析药物的作用,进行筛选并得到筛选结果。该系统的优点在于通过对样品全分析过程的微缩化和集成化,实现高灵敏的快速检测,高通量输出以及在线自动化操作等功能,较以往的细胞水平筛选技术表现出极大的优势,非常适合药物成分的筛选。
免疫荧光染色技术是将抗体分子与一些示踪物质结合,利用抗原抗体反应进行组织或细胞内抗原物质定位的技术,是用于观察细胞内蛋白质分布和定位的普遍方法。免疫荧光染色的传统做法需要消耗大量的试剂,人力和时间,特别是某些珍贵抗体的消耗,限制了传统方法的使用。微流控芯片技术以其大大减少样品消耗,节省人工及时间成本,可在厘米见方的空间上实现自动化、高通量的实验等优势,受到了广泛的关注。
人们迫切希望获得一种技术效果优良的集成化药物筛选与染色微流控芯片的制备方法。
技术实现要素:
本发明的目的是提供一种技术效果优良的集成化药物筛选与染色微流控芯片的制备方法。以解决以往细胞药物筛选与染色过程中存在的操作步骤繁琐复杂、消耗大量试剂等局限。
本发明提供了一种集成化药物筛选与染色微流控芯片,所述微流控芯片由上层、下层、底面三层顺序串联贴合布置组成,其中:上层为液路控制层,下层为气路控制层,底面为空白玻璃底板;
所述液路控制层具体设置有下述结构:
——细胞荧光染色进样口:位于在整个液路控制层的最上游;其设置有至少两个以其为入口的通道相互并联并最终汇成一个共用的通道;最终汇成的共用通道还分别连接着下游的细胞培养室和液体流出通道;
——荧光染色进样通道区(P1):布置在细胞荧光染色进样口和细胞进样通道区(P2)之间用于沟通二者;
——细胞进样口:其设置有至少两个,每一个细胞进样口都设置在细胞进样通道区(P2)中的其中一条通道上,且前述细胞进样通道区(P2)中的每一条通道都串接着一个细胞培养室;
——细胞进样通道区(P2):设置在荧光染色进样通道区(P1)和细胞培养室之间;
——细胞培养室:至少有二个,布置在细胞进样通道区(P2)和药物进样通道区(P3)之间;
——药物进样通道区(P3):其为包括覆盖所有细胞培养室和药物进样口之间的通道的区域;
——药物进样口:其数量和细胞培养室相等,各自布置在每一个细胞培养室下游的通道上;
——液体流出通道区(P4):其布置在细胞培养室下游通道的下 游和整个液路最尾端的出液口(13)之间;
——出液口(13):布置在整个液路控制层所有结构的最下游。
所述集成化药物筛选与染色微流控芯片,其特征在于:所述集成化药物筛选与染色微流控芯片还满足下述要求:
细胞培养室设置有四个,与之对应的在细胞进样通道区(P2)上游的细胞进样口和下游药物进样通道区(P3)的药物进样口也都有四个;每一条通道上从上游开始依次串接布置有1个细胞进样口、1个细胞培养室、1个药物进样口。
所述集成化药物筛选与染色微流控芯片,其特征在于:所述集成化药物筛选与染色微流控芯片还满足下述要求之一或其组合:
其一,细胞荧光染色进样口设置有四个,所述集成化药物筛选与染色微流控芯片中设置有四个以细胞荧光染色进样口为入口的通道,其相互并联并最终汇成一个共用的通道;最终汇成的共用通道再次一分为四,变成四条各自设置有一个细胞进样口的四条通道,每个细胞进样口还分别依次连接着下游的细胞培养室、药物进样口和再之后的液体流出通道;
其二,液体流出通道区(P4):其是将细胞培养室下游的至少两条通道合并为最终的共用的一个出液口(13)的通道合并区域;
其三,所述微流控芯片的下层即气路控制层具体由泵阀控制区组成,每个荧光染色液体入口有单独的泵阀单元控制,以使进样液体互 相不影响;气路控制层具体包含有下述结构之一或其组合:设置在各个细胞进样口上游的控制用的阀;设置在各个药物进样口下游的控制用的阀;设置在各个细胞荧光染色进样口下游通道上的控制用的阀;所述微芯片的所有控制用的阀均为常闭阀,使用时打开。
所述集成化药物筛选与染色微流控芯片,其特征在于:所述集成化药物筛选与染色微流控芯片还满足下述要求之一或其组合:
其一,每个细胞培养室由单独的细胞培养液入口、药物入口、荧光染色液入口、进样通道组成;
其二,至少两个并联的细胞培养室(图1中)共同组成液路层;
其三,所述上层芯片和下层芯片的材料均为聚二甲基硅氧烷PDMS聚合物,上层芯片厚1~5mm,下层芯片厚100~500μm;
其四,所述细胞培养室的尺寸为15mm×2mm×100μm的长梭形;
其五,所述芯片的气路和液路通道高度相同,均为80~200μm;
其六,所述芯片的气路和液路通道宽度不同,气路通道宽度为100~300μm,液路通道宽200~600μm。
所述集成化药物筛选与染色微流控芯片,其特征在于:所述集成化药物筛选与染色微流控芯片还满足下述要求:
所述液路层为基于SU-8模板所得的PDMS模块;气路层是在制作成功的气路SU-8模板上甩一层高于模板10~50μm的聚二甲基硅 氧烷PDMS膜,所述液路层的聚二甲基硅氧烷PDMS模板有结构一侧封接到气路层聚二甲基硅氧烷PDMS膜无结构一侧,气路层聚二甲基硅氧烷PDMS膜有阀结构一侧等离子键合到洁净的玻璃片上。
本发明还要求保护一种如上所述集成化药物筛选与染色微流控芯片的制备方法,其特征在于:所述集成化药物筛选与染色微流控芯片的制备方法相关步骤依次要求如下:
(1)采用光刻和腐蚀方法制备出通道部分凸起的光刻胶SU-8模板;
(2)用乳酸乙酯对光刻胶SU-8模板进行显影,165℃~180℃坚膜1~3h;
(3)将芯片下层的光刻胶SU-8模板用硅烷化试剂处理5~10min,使PDMS容易剥离模板底面;
(4)将聚二甲基硅氧烷PDMS与引发剂以体积比(5~20):1混合均匀,分别浇注于芯片上、下层结构光刻胶SU-8模板,80℃烘箱固化20~40min,将聚二甲基硅氧烷PDMS与芯片上层光刻胶SU-8模板剥离,得到带有结构的聚二甲基硅氧烷PDMS芯片;
(5)将芯片上层带有结构的一侧与光刻胶SU-8模板上无结构的芯片下层进行氧等离子体处理1~3min,70~90℃热烘30~60min,进行不可逆封接;
(6)将上述封接好的聚二甲基硅氧烷PDMS芯片与下层结构光刻胶SU-8模板剥离,与干净的空白玻璃片经过氧等离子体处理1~3 min,70~90℃热烘30~60min进行不可逆封接,即得到集成化药物筛选与染色微流控芯片。
所述集成化药物筛选与染色微流控芯片的制备方法,其特征在于:所述集成化药物筛选与染色微流控芯片的制备方法还满足下述要求:所述微流控芯片的细胞培养室中在接种细胞且细胞铺满培养区域底面后,在药物进样区加入药物刺激;细胞培养周期结束,固定细胞,进行荧光染色。
本发明利用微流体与微型阀技术,制备了一种集细胞培养、药物筛选与荧光染色为一体,三种检测指标相继进行的微流控芯片。整个芯片平台结构简单,操作方便,集成度高,分析速度快,效率高,无需任何复杂和昂贵的设备,无需大量细胞与试剂消耗。综上所述,发明一种方便,快捷,集成度高,应用范围广的集成化药物筛选与染色微流控芯片具有十分重要意义的。
本发明解决了以往细胞药物筛选与染色过程中存在的操作步骤繁琐复杂、消耗大量试剂等技术局限。本发明制备过程稳定,操作简单,集成度高。
本发明所述集成化药物筛选与染色微流控芯片的用途说明:该芯片可用于施加不同浓度药物刺激对细胞生物学特性研究,并对该条件下的细胞状态进行荧光染色检测。所述集成化微流控芯片可进行不同种类的细胞培养,可进行不同种类或不同浓度的药物刺激,可进行不 同种类的抗体染色。
本发明的优点在于:1、操作简便、快捷;2、细胞与试剂用量少,实验成本低廉;3、不接触有毒有害试剂,环境友好;4、高度集成化、应用范围广泛。
附图说明
下面结合附图及实施方式对本发明作进一步详细的说明:
图1为集成化药物筛选与染色微流控芯片结构示意简图;
图2为集成化药物筛选与染色微流控芯片上层结构示意图;
图3为集成化药物筛选与染色微流控芯片下层结构示意图。
具体实施方式
附图标记含义如下:
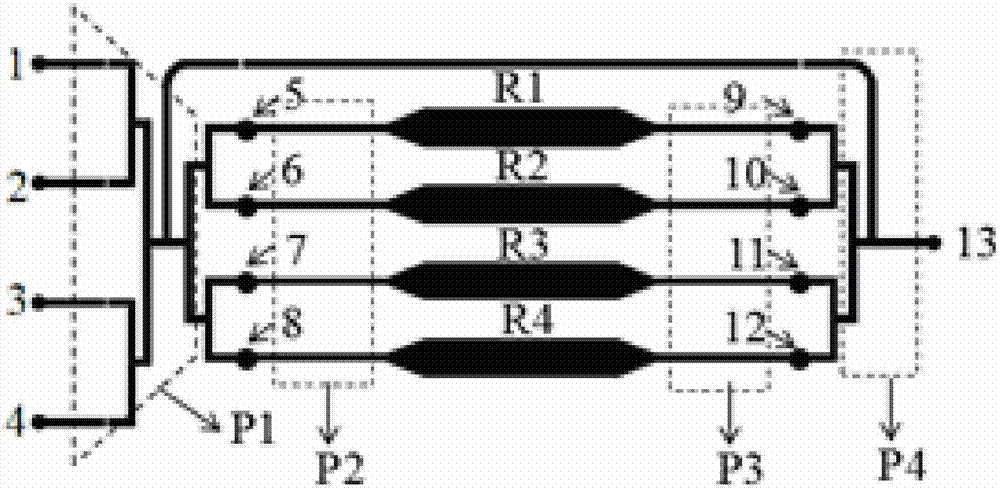
图1中,附图标记1~4均为细胞荧光染色进样口,其具体分别为:一抗入口1、二抗入口2、细胞核染料入口3、PBS缓冲液入口4;荧光染色进样通道P1;5~8分别为细胞进样口一5、细胞进样口二6、细胞进样口三7、细胞进样口四8;细胞进样通道P1;R1~R4分别为:细胞培养室一R1、细胞培养室二R2、细胞培养室三R3、细胞培养室四R4,可同时培养4种不同种类细胞;9~12分别为:药物进样口一9、药物进样口二10、药物进样口三11、药物进样口四12;药物进样通道P3,可同时加入不同种类药物或同种不同浓度药物;液体流出通道P4,出液口13;A~D为分别控制附图标记为1~4的四个细胞 荧光染色进样口的阀,四者分别为:阀一A、阀二B、阀三C、阀四D;另有:控制染料排出的阀五E、控制药物排出的阀六J;附图标记F~I是分别控制附图标记为5~8的各个细胞进样口的阀,分别具体是:阀七F、阀八G、阀九H、阀十I;附图标记K~N为分别控制附图标记9~12这四个药物进样口的阀,其具体是:阀十一K、阀十二L、阀十三M、阀十四N;
图1、图2中,基体材料的边界线省略未画出,图3中基体材料的边界线即外部的矩形框仅为示意;特此说明。
实施例1
一种集成化药物筛选与染色微流控芯片,所述微流控芯片由上层、下层、底面三层顺序串联贴合布置组成,其中:上层为液路控制层,下层为气路控制层,底面为空白玻璃底板;
所述液路控制层具体设置有下述结构:
——细胞荧光染色进样口:位于在整个液路控制层的最上游;其设置有至少两个以其为入口的通道相互并联并最终汇成一个共用的通道;最终汇成的共用通道还分别连接着下游的细胞培养室和液体流出通道;
——荧光染色进样通道区(P1):布置在细胞荧光染色进样口和细胞进样通道区(P2)之间用于沟通二者;
——细胞进样口:其设置有至少两个,每一个细胞进样口都设置在细胞进样通道区(P2)中的其中一条通道上,且前述细胞进样通道区(P2)中的每一条通道都串接着一个细胞培养室;
——细胞进样通道区(P2):设置在荧光染色进样通道区(P1)和细胞培养室之间;
——细胞培养室:至少有二个,布置在细胞进样通道区(P2)和药物进样通道区(P3)之间;
——药物进样通道区(P3):其为包括覆盖所有细胞培养室和药物进样口之间的通道的区域;
——药物进样口:其数量和细胞培养室相等,各自布置在每一个细胞培养室下游的通道上;
——液体流出通道区(P4):其布置在细胞培养室下游通道的下游和整个液路最尾端的出液口(13)之间;
——出液口(13):布置在整个液路控制层所有结构的最下游。
所述集成化药物筛选与染色微流控芯片还满足下述要求:细胞培养室设置有四个,与之对应的在细胞进样通道区(P2)上游的细胞进样口和下游药物进样通道区(P3)的药物进样口也都有四个;每一条通道上从上游开始依次串接布置有1个细胞进样口、1个细胞培养室、1个药物进样口。
所述集成化药物筛选与染色微流控芯片还满足下述要求之一或其组合:
其一,细胞荧光染色进样口设置有四个,所述集成化药物筛选与染色微流控芯片中设置有四个以细胞荧光染色进样口为入口的通道, 其相互并联并最终汇成一个共用的通道;最终汇成的共用通道再次一分为四,变成四条各自设置有一个细胞进样口的四条通道,每个细胞进样口还分别依次连接着下游的细胞培养室、药物进样口和再之后的液体流出通道;
其二,液体流出通道区(P4):其是将细胞培养室下游的至少两条通道合并为最终的共用的一个出液口(13)的通道合并区域;
其三,所述微流控芯片的下层即气路控制层具体由泵阀控制区组成,每个荧光染色液体入口有单独的泵阀单元控制,以使进样液体互相不影响;气路控制层具体包含有下述结构之一或其组合:设置在各个细胞进样口上游的控制用的阀;设置在各个药物进样口下游的控制用的阀;设置在各个细胞荧光染色进样口下游通道上的控制用的阀;所述微芯片的所有控制用的阀均为常闭阀,使用时打开。
所述集成化药物筛选与染色微流控芯片还满足下述要求之一或其组合:
其一,每个细胞培养室由单独的细胞培养液、药物刺激、荧光染色液体入口、进样通道组成;
其二,至少两个并联的细胞培养室(图1中)共同组成液路层;
其三,所述上层芯片和下层芯片的材料均为聚二甲基硅氧烷PDMS聚合物,上层芯片厚1~5mm,下层芯片厚100~500μm;
其四,所述细胞培养室的尺寸为15mm×2mm×100μm的长梭形;
其五,所述芯片的气路和液路通道高度相同,均为80~200μm;
其六,所述芯片的气路和液路通道宽度不同,气路通道宽度为100~300μm,液路通道宽200~600μm。
所述集成化药物筛选与染色微流控芯片还满足下述要求:
所述液路层为基于SU-8模板所得的PDMS模块;气路层是在制作成功的气路SU-8模板上甩一层高于模板10~50μm的聚二甲基硅氧烷PDMS膜,所述液路层的聚二甲基硅氧烷PDMS模板有结构一侧封接到气路层聚二甲基硅氧烷PDMS膜无结构一侧,气路层聚二甲基硅氧烷PDMS膜有阀结构一侧等离子键合到洁净的玻璃片上。
一种如上所述集成化药物筛选与染色微流控芯片的制备方法,其相关步骤依次要求如下:
(1)采用光刻和腐蚀方法制备出通道部分凸起的光刻胶SU-8模板;
(2)用乳酸乙酯对光刻胶SU-8模板进行显影,165℃~180℃坚膜1~3h;
(3)将芯片下层的光刻胶SU-8模板用硅烷化试剂处理5~10min,使PDMS容易剥离模板底面;
(4)将聚二甲基硅氧烷PDMS与引发剂以体积比(5~20):1混合均匀,分别浇注于芯片上、下层结构光刻胶SU-8模板,80℃烘箱固化20~40min,将聚二甲基硅氧烷PDMS与芯片上层光刻胶SU-8 模板剥离,得到带有结构的聚二甲基硅氧烷PDMS芯片;
(5)将芯片上层带有结构的一侧与光刻胶SU-8模板上无结构的芯片下层进行氧等离子体处理1~3min,70~90℃热烘30~60min,进行不可逆封接;
(6)将上述封接好的聚二甲基硅氧烷PDMS芯片与下层结构光刻胶SU-8模板剥离,与干净的空白玻璃片经过氧等离子体处理1~3min,70~90℃热烘30~60min进行不可逆封接,即得到集成化药物筛选与染色微流控芯片。
所述集成化药物筛选与染色微流控芯片的制备方法还满足下述要求:所述微流控芯片的细胞培养室中在接种细胞且细胞铺满培养区域底面后,在药物进样区加入药物刺激;细胞培养周期结束,固定细胞,进行荧光染色。
本实施例利用微流体与微型阀技术,制备了一种集细胞培养、药物筛选与荧光染色为一体,三种检测指标相继进行的微流控芯片。整个芯片平台结构简单,操作方便,集成度高,分析速度快,效率高,无需任何复杂和昂贵的设备,无需大量细胞与试剂消耗。综上所述,发明一种方便,快捷,集成度高,应用范围广的集成化药物筛选与染色微流控芯片具有十分重要意义的。
本实施例解决了以往细胞药物筛选与染色过程中存在的操作步骤繁琐复杂、消耗大量试剂等技术局限。本实施例制备过程稳定,操作简单,集成度高。
本实施例所述集成化药物筛选与染色微流控芯片的用途说明:该芯片可用于施加不同浓度药物刺激对细胞生物学特性研究,并对该条件下的细胞状态进行荧光染色检测。所述集成化微流控芯片可进行不同种类的细胞培养,可进行不同种类或不同浓度的药物刺激,可进行不同种类的抗体染色。
本实施例的优点在于:1、操作简便、快捷;2、细胞与试剂用量少,实验成本低廉;3、不接触有毒有害试剂,环境友好;4、高度集成化、应用范围广泛。
实施例2
集成化药物筛选与染色芯片采用光刻和腐蚀方法制备出通道部分突起的SU-8模板,芯片上下层结构分别由两个SU-8模板反模PDMS组成;两个SU-8模板同时制作,取两块洁净的玻璃片,在甩胶机上甩SU-8胶厚度为100μm,95℃前烘20min,自然降温,将芯片上下层结构的两个掩膜置于SU-8胶平板上面,紫外曝光30s,95℃后烘20min,自然降温;最后,采用乳酸乙酯将上述SU-8胶显影5min,180℃坚膜2h,自然降温,得到芯片模版。
实施例3
将芯片下层结构的SU-8模板用硅烷化试剂处理10min,使PDMS容易剥离模板底面;PDMS与引发剂以体积比10:1混合均匀,分别浇注于芯片上、下层结构SU-8模板,80℃烘箱固化40min,将PDMS 与芯片上层SU-8模板剥离,得到带有结构的PDMS芯片;将芯片上层带有结构的一侧与SU-8模板上无结构的芯片下层进行氧等离子体处理2min,80℃热烘1h,不可逆封接;将上述封接好的PDMS芯片与下层结构SU-8模板剥离,与干净的空白玻璃片经过氧等离子体处理2min,80℃热烘1h进行不可逆封接,即得到集成化药物筛选与染色微流控芯片。
图1中,附图标记1~4均为细胞荧光染色进样口,其具体分别为:一抗入口1、二抗入口2、细胞核染料入口3、PBS缓冲液入口4;荧光染色进样通道P1;5~8分别为细胞进样口一5、细胞进样口二6、细胞进样口三7、细胞进样口四8;细胞进样通道P1;R1~R4分别为:细胞培养室一R1、细胞培养室二R2、细胞培养室三R3、细胞培养室四R4,可同时培养4种不同种类细胞;9~12分别为:药物进样口一9、药物进样口二10、药物进样口三11、药物进样口四12;药物进样通道P3,可同时加入不同种类药物或同种不同浓度药物;液体流出通道P4,出液口13;细胞荧光染色进样通道将细胞荧光染色进样口和细胞进样口连接,细胞进样通道将细胞进样口和细胞培养室连接,药物进样通道将药物进样口和细胞培养室连接,液体流出通道将药物进样口和出液口连接;A~D为分别控制附图标记为1~4的四个细胞荧光染色进样口的阀,四者分别为:阀一A、阀二B、阀三C、阀四D;另有:控制染料排出的阀五E、控制药物排出的阀六J;附图标记F~I是分别控制附图标记为5~8的各个细胞进样口的阀,分别具体是:阀七F、阀八G、阀九H、阀十I;附图标记K~N为分别控制 附图标记9~12这四个药物进样口的阀,其具体是:阀十一K、阀十二L、阀十三M、阀十四N。
所有进样口由单独的阀控制,不同种类的细胞通过附图标记分别为5~8的结构分别进入附图标记分别为R1~R4的四个单独的细胞培养室,待细胞生长稳定,从附图标记分别为9~12的结构处加入不同药物刺激细胞,分别将细胞固定液、细胞封闭液从附图标记分别为5~8的结构处加入,随后通过附图标记分别为1~4的结构处分别加入一抗、二抗、细胞核染料和PBS冲洗后,进行荧光显微镜观察。
- 还没有人留言评论。精彩留言会获得点赞!