利用淀粉样蛋白Aβ25‑35制备人视网膜上皮细胞(ARPE)毒性模型的方法及应用与流程
本发明涉及细胞学领域,具体涉及一种利用淀粉样蛋白Aβ25-35制备人视网膜上皮细胞(ARPE)毒性模型的方法及应用。
背景技术:
年龄相关性黄斑变性(age-related macular degeneration,AMD)是老年人中最常见的导致视力下降甚至丧失的原因之一。随着人口老龄化的增长,发病率呈逐年上升趋势,因AMD致盲的人数占到全球盲人总数的8.7%。严重影响人们的生活质量和生存安全。AMD最主要的形态学特征是玻璃膜疣,即RPE细胞的异常代谢产物的过度沉积。玻璃膜疣的成分非常复杂及丰富,其中含有多种与炎症反应及氧化应激反应相关的脂质及蛋白质类物质、免疫相关蛋白、玻连蛋白、淀粉样蛋白、补体调节分子等。
目前AMD的发病机制仍不清楚。多数学者认为AMD是多因素疾病,除了年龄与之有极强的相关性,代谢、功能、基因和环境等因素也均可影响其发病。近年来很多研究应用免疫组化和分子生物学方法研究AMD的发病,结果均表明炎性过程的局部活化,可以导致活化的补体成分、急性期反应物、免疫调节物和其它炎性因子的聚集把那个参与AMD发生的过程。
流行病学相关报道Aβ和阿尔茨海默病(AD)、AMD都具有一定关联:眼睛和大脑的发育最初均来源于同一个胚胎胚层,并且AD和AMD具有相同形态表型和免疫生成病因,他们有一个共同的Aβ蛋白起作用的过程。Aβ是参与神经损伤及致细胞凋亡的非常重要的因子,它是淀粉样前体蛋白(amyloid precursorprotein,APP)的降解产物。在以往的研究中发现,Aβ1-42具有细胞毒性可导致细胞凋亡,并且对RPE细胞的正常生长有着一定的损伤作用,说明Aβ在视网膜上的积累会对视网膜细胞的活性造成影响,从而影响视网膜的正常功能。但是,在制备Aβ1-42对RPE细胞的毒性模型中,Aβ1-42寡聚体制备过程繁琐,且容易导致制备后无活性,所以寻求更简便、更高效的Aβ诱导的ARPE细胞毒性模型可为深入探索Aβ蛋白对年龄相关性黄斑变性(AMD)的影响、年龄相关性黄斑变性(AMD)发生的诱发因素及其分子调控机理等方面的研究提供可行有效的工具。
技术实现要素:
本发明的目的是提供一种利用淀粉样蛋白Aβ25-35制备人视网膜上皮细胞(ARPE)毒性模型的方法,该发明方法解决了以往Aβ1-42寡聚体制备过程繁琐,且容易导致制备后无活性而无法获得Aβ1-42诱导的ARPE细胞毒性模型的问题。可应用于体外精准靶向研究Aβ蛋白对年龄相关性黄斑变性(AMD)的影响,为分析和揭示年龄相关性黄斑变性(AMD)发生的诱发因素及其分子调控机理提供可行有效的研究工具。
本发明所述方法包括以下步骤:
a、将淀粉样蛋白Aβ25-35用细胞培养基制备成寡聚体;
b、接种ARPE细胞并培养;
c、按照Aβ25-35寡聚体不同浓度处理ARPE细胞;
d、在Aβ25-35寡聚体处理48-60h后,按照常规的MTT方法进行检测,筛选淀粉样蛋白Aβ25-35对ARPE细胞毒性的最优浓度条件。
进一步的,步骤a中包括:
a1:于无菌条件下将Aβ25-35蛋白按照1mg加0.36ml溶剂的比例溶解,配成浓度为1mmol/L-10mmol/L的Aβ25-35储存液;
a2:将Aβ25-35储存液置于二氧化碳培养箱中35℃-39℃孵育,使其老化以获得Aβ寡聚体;每天1次将Aβ25-35储存液颠倒混匀;3-7天后将Aβ25-35储存液从二氧化碳培养箱中取出,保存于4℃或者直接使用。
进一步的,步骤b中包括:
b1:取处于增殖期的APRE细胞,用PRMI1640完全培养基配成单细胞悬液,接种到96孔细胞培养板,调整细胞最终接种密度为10%-20%,每孔体积100μl。
进一步的,步骤c中包括:
c1:待接种细胞完全贴壁后,弃去培养基,加入含有不同浓度Aβ25-35储存液(0μmol/L,0.3μmol/L,1.0μmol/L,5.0μmol/L,20μmol/L,60μmol/L)的PRMI1640完全培养基;每2d换液1次。
进一步的,步骤a1中的溶剂采用PRMI1640培养基或无菌超纯水。
进一步的,步骤a1中Aβ25-35储存液的浓度为2.5mmol/L。
进一步的,步骤a2中孵育温度为37℃,5天后将Aβ25-35储存液从二氧化碳培养箱中取出。
进一步的,步骤b1中,所述细胞最终接种密度为15%。
进一步的,步骤d中,淀粉样蛋白Aβ25-35对ARPE细胞毒性的最优浓度条件为60μmol/L。
上述的方法获得的细胞毒性模型在针对体外研究Aβ蛋白对年龄相关性黄斑变性(AMD)的影响、年龄相关性黄斑变性(AMD)发生的诱发因素及其分子调控机理中的应用。
本发明的有益效果是:
本方法使用常规的技术和试剂,利用现有试剂材料制备Aβ诱导的ARPE细胞的方法,实现了制备这一研究工具的技术改进。本方法制备的Aβ25-35寡聚体诱导的ARPE细胞毒性模型,可应用于体外精准靶向研究Aβ蛋白对年龄相关性黄斑变性(AMD)的影响,为分析和揭示年龄相关性黄斑变性(AMD)发生的诱发因素及其分子调控机理提供可行有效的研究工具。较之以前的研究,本方法的技术操作简便、易于掌握、无额外的毒性潜在危险等优点。
附图说明
图1为实施例1不同浓度Aβ25-35寡聚体诱导ARPE细胞制备毒性模型的细胞活性效应检测图。不同的Aβ25-35寡聚体浓度(0μmol/L,0.3μmol/L,1.0μmol/L,5.0μmol/L,20μmol/L,60μmol/L)处理48h后,MTT检测细胞数目。Means±SD,n=8。
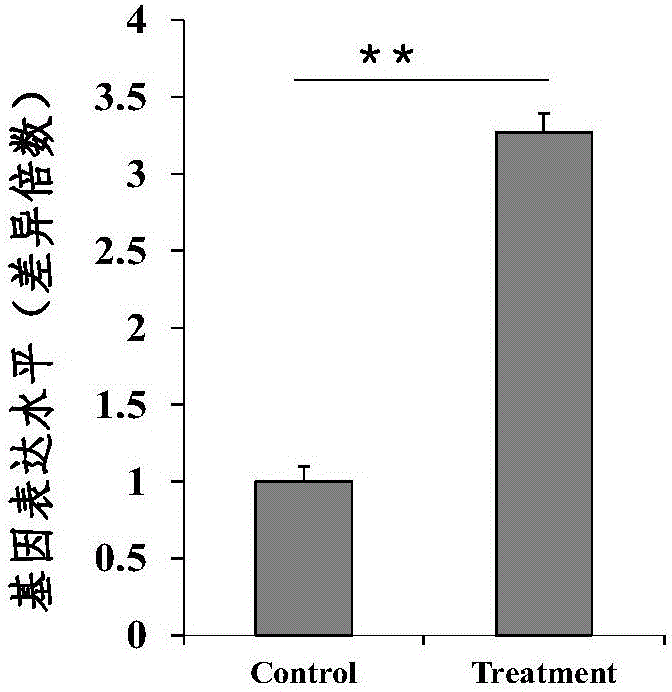
图2为实施例2制备的Aβ25-35寡聚体诱导的ARPE细胞毒性模型的细胞周期关键基因CCNE表达检测图。60μmol/LAβ25-35寡聚体处理ARPE细胞48h后,收集对照组和模型组细胞进行Q-PCR检测。发现模型组细胞中调控G1/S期转化的关键基因CCNE mRNA表达水平显著上调(P<0.01)。Means±SD,n=3。
图3为实施例3制备的Aβ25-35寡聚体诱导的ARPE细胞毒性模型的细胞凋亡关键蛋白CASP3活性检测图。60μmol/LAβ25-35寡聚体处理ARPE细胞48h后,收集对照组和模型组细胞进行western blotting检测。发现模型组细胞中调控细胞凋亡的关键蛋白CASP3的活性明显上调。
具体实施方式
本发明所述方法包括五个大步骤a、将淀粉样蛋白Aβ25-35用细胞培养基制备成寡聚体;b、接种ARPE细胞并培养;c、按照Aβ25-35寡聚体不同浓度处理ARPE细胞;d、在Aβ25-35寡聚体处理48-60h后,按照常规的MTT方法进行检测,筛选淀粉样蛋白Aβ25-35对ARPE细胞毒性的最优浓度条件。
下面对上述五个大步骤分步做详细的说明:
a1:于超净工作台中无菌条件下将Aβ25-35蛋白(Sigma,货号A4559,1mg规格)按照1mg加0.36ml PRMI1640培养基或无菌超纯水的比例溶解,配成浓度为2.5mmol/L的Aβ25-35储存液。溶解Aβ25-35蛋白的溶剂选用PRMI1640培养基或无菌超纯水,优选的选用PRMI1640培养基。后面步骤中ARPE细胞培养时使用PRMI1640培养基,因此选用该培养基较之无菌超纯水更能消除对细胞的负面影响。Aβ25-35储存液的溶解浓度为2.5mmol。Aβ25-35储存液的溶解浓度范围为1-10mmol,选用2.5mmol可以更好地避免添加时添加体积过大影响细胞培养基变化过大,有可减少浓度过大引起取液浪费。
a2:将配制的Aβ25-35储存液置于二氧化碳培养箱中37℃孵育,使其老化以获得Aβ寡聚体;每天1次颠倒混匀;5天后将Aβ25-35储存液从二氧化碳培养箱中取出,保存于4℃或者直接使用。Aβ25-35储存液需要无菌条件下孵育,故直接置于二氧化碳培养箱中;孵育温度范围为35℃-39℃,优选温度37℃,此时Aβ25-35的寡聚体老化效果更佳。使Aβ25-35储存液老化以获得Aβ寡聚体。每天1次颠倒混匀Aβ25-35储存液。孵育时间过短容易寡聚体过少,而孵育过长则容易寡聚体过度老化,造成降解,孵育时间3-7天,本实施例中优选5天后将Aβ25-35储存液储存液从二氧化碳培养箱中取出,保存于4℃或者直接使用。
b1:使用0.25%胰蛋白酶-EDTA消化液消化处于增殖期的ARPE细胞,用PRMI1640完全培养基(组成为:89%DMEM/F12培养基+10%FBS+1%双抗)配成单细胞悬液并接种到96孔细胞培养板,调整细胞最终接种密度为15%,每孔体积100μl。接种细胞前需要将细胞重悬为单细胞,该细胞生长习性具有聚团特性,聚团的非单细胞形式可导致Aβ对细胞毒性效应无差别。细胞最终接种密度可以为10%-20%,由于该细胞生长习性具有聚团特性,密度过大引起短时间聚团,也可导致Aβ对细胞毒性效应无差别,因此,优选最终接种密度为15%。
c1:待接种细胞完全贴壁后,弃去培养基,加入含有不同浓度Aβ25-35寡聚体(0μmol/L,0.3μmol/L,1.0μmol/L,5.0μmol/L,20μmol/L,60μmol/L)的PRMI1640完全培养基(组成为:89%PRMI1640培养基+10%FBS+1%双抗);每2d换液1次。细胞接种贴壁时间本实施例中为12h,贴壁时间范围在8-24h均可,贴壁过短容易造成细胞贴壁不牢固;贴壁过长容易导致细胞处理前增殖过度,后期细胞处理毒性表型不显著,因此,优选12h。Aβ25-35寡聚体处理细胞选择0μmol/L,0.3μmol/L,1.0μmol/L,5.0μmol/L,20μmol/L,60μmol/L等浓度,浓度跨度较大,可以更大范围进行筛选,避免遗漏。
d、毒性模型中Aβ25-35浓度优化筛选:在Aβ25-35处理细胞时间48h后,按照常规的MTT方法进行检测,筛选Aβ25-35对ARPE细胞毒性的最优浓度条件。Aβ25-35寡聚体处理细胞时间范围为48h-60h,为了可以更好地应用于分子水平的检测,Aβ25-35寡聚体处理细胞时间优选为48h。处理细胞的Aβ25-35寡聚体浓度为60μmol/L,Aβ25-35寡聚体浓度可以在0.3-60μmol/L的范围,为了应用检测和分析中表型更明显,选定最优浓度条件为60μmol/L。
本发明还提供了上述方法在针对Aβ25-35诱导的ARPE细胞毒性影响细胞活性、增殖、细胞凋亡等方面及其分子机理研究等方面的应用。本方法建立的毒性可应用于体外精准靶向研究Aβ蛋白对年龄相关性黄斑变性(AMD)的影响,为分析和揭示年龄相关性黄斑变性(AMD)发生的诱发因素及其分子调控机理提供可行有效的研究工具。
实施例1:Aβ25-35寡聚体诱导ARPE细胞毒性模型的制备与检测
使用0.25%胰蛋白酶-EDTA消化液消化处于增殖期的APRE细胞,10cm细胞培养皿加入1ml消化液,消化2-5分钟至细胞呈流沙状,加入1-2mlPRMI1640完全培养基(组成为:89%DMEM/F12培养基+10%FBS+1%双抗)轻柔吹打至单细胞。1000rpm离心5分钟后去上清,重新加入PRMI1640完全培养基配成单细胞悬液,并接种到96孔细胞培养板,调整细胞最终接种密度为15%,每孔体积100μl。
待接种细胞12h完全贴壁后,弃去培养基,加入含有不同浓度Aβ25-35寡聚体(0μmol/L,0.3μmol/L,1.0μmol/L,5.0μmol/L,20μmol/L,60μmol/L)的PRMI1640完全培养基处理ARPE细胞;以后每2d换液1次。处理48h后采用MTT法检测细胞活性,每个处理均为8孔细胞重复。MTT染色4h后,DMSO洗脱,洗脱液于酶标仪490波长测定OD值。最终筛选Aβ25-35对ARPE细胞毒性的最优浓度条件。采用SASV8统计软件中的ANOVA程序,采用T-test检验数据差异,结果用平均值±标准误表示,以P<0.05为差异显著性标准。
检测发现:相比于无添加的对照组细胞,不同浓度Aβ25-35寡聚体处理APRE细胞48h后均出现活性细胞数目减少效应;其中1.0μmol/L和5.0μmol/L添加组细胞增殖被显著抑制(P<0.05,P<0.05),20μmol/L和60μmol/L添加组细胞增殖被极显著抑制(P<0.01,P<0.01)(如图1所示)。结果表明:本实验中制备Aβ25-35寡聚体有效,Aβ25-35寡聚体对APRE细胞增殖具有抑制作用;在后继地实验中优选地使用60μmol/L浓度添加Aβ25-35寡聚体制备ARPE细胞毒性模型。
实施例2:Aβ25-35寡聚体诱导的ARPE细胞毒性模型的细胞周期相关基因检测
分别将ARPE细胞接种于6cm细胞培养皿,按照实施例1中处理细胞接种和最优浓度条件(60μmol/L)添加Aβ25-35寡聚体诱导ARPE细胞毒性模型,以无添加Aβ25-35寡聚体的细胞为对照。
在Aβ25-35寡聚体处理ARPE细胞48h后,两种细胞均被收集并提取细胞总RNA(每个组3孔细胞重复),反转录后使用Q-PCR技术分析细胞中相关细胞周期的特异性基因CCNE mRNA的表达,特异性引物信息见表1。采用SASV8统计软件中的ANOVA程序,采用T-test检验数据差异,结果用平均值±标准误表示,以P<0.05为差异显著性标准。
表1目的基因的特异性引物信息
检测发现:相比于无添加的对照组细胞,Aβ25-35寡聚体浓度(60μmol/L)处理48h后,控制G1/S期的关键调控基因CCNE mRNA表达水平显著上调(P<0.01)(如图2所示)。结果表明,Aβ25-35寡聚体影响ARPE 细胞的增殖,Aβ25-35寡聚体诱导的ARPE细胞毒性模型会促进细胞周期的G1/S期转化。
实施例3:Aβ25-35寡聚体诱导的ARPE细胞毒性模型的细胞凋亡相关关键蛋白的活性检测
分别将ARPE细胞接种于6cm细胞培养皿,按照实施例1中处理细胞接种和最优浓度条件(60μmol/L)添加Aβ25-35寡聚体诱导ARPE细胞毒性模型,以无添加Aβ25-35寡聚体的细胞为对照。
在Aβ25-35寡聚体处理ARPE细胞48h后,两种细胞均被收集并提取细胞总蛋白(每个组3孔细胞重复),使用Westernblotting技术和特异性的CASP3抗体,分析了本方法制备的Aβ25-35寡聚体诱导的ARPE细胞毒性模型的细胞凋亡的关键控制蛋白CASP3的活性变化。
检测发现:相比于无添加的对照组细胞,Aβ25-35寡聚体浓度(60μmol/L)处理48h后,CASP3的活性明显增加(如图3所示)。结果表明:Aβ25-35寡聚体促进ARPE细胞的凋亡。
本发明所述PRMI1640完全培养基组分中双抗是指青霉素和链霉素,为本领域通用术语,可购自试剂公司。
本发明所述含89%PRMI1640培养基,10%FBS和1%双抗为本领域通用术语,百分比数指试剂的体积分数,均可购自试剂公司。
上述实施例及实验方法,如无特殊说明,均为常规方法,所用的试验材料和试剂,如无特殊说明,均为常规生化试剂,购自试剂公司。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!