一种特异靶向猪IRS1基因的sgRNA导向序列及其应用的制作方法
本发明涉及一种sgrna导向序列及应用。
背景技术:
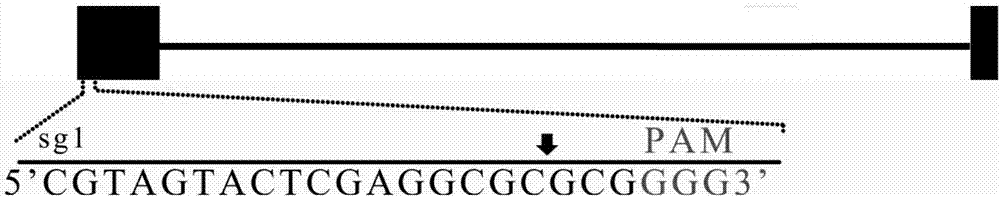
:irs-1为主要的胰岛素受体底物,通过自身磷酸化作用将胰岛素信号向下各级传递、发散,从而诱导个体系统的生长以及影响葡糖代谢。irs-1分布于全身各组织细胞中,主要在骨骼肌中表达。目前研究认为irs-1的表达可能与具有ⅱ型糖尿病家族史的患者密切相关,irs-1表达不足或者磷酸化异常可导致胰岛素抵抗。katsutaromorino等人的研究表明,在这类糖尿病患者中,irs-1的ser312、ser136磷酸化水平提高了50%,akt的磷酸化水平下降60%,导致的结果是患者骨骼肌细胞葡萄糖摄取量比对照组低60%,线粒体密度低36%,脂类密度却高60%,呈明显的胰岛素对抗状态。基因水平研究认为:编码irs-1的基因p512a(p513a,rs1801276)和g971r(g972r,rs1801278)变异导致了irs-1的磷酸化水平异常,而这种变异是否为具有ⅱ型糖尿病家族史的患者所特有,携带这种突变基因的病人的糖尿病发病风险是否会显著增高还存在争议。eleftheriazeggini的统计实验认为这两处基因突变和糖尿病发生没有显著联系。目前的动物实验也说明他的结论是正确的,不仅是突变,甚至是敲除irs-1基因的小鼠也仅仅表现出对胰岛素的抵抗,而不会表现出高血糖的症状,但如果胰岛β细胞不能分泌足够的胰岛素(细胞损伤),小鼠就会表现出糖尿病症状。irs-1基因是胰岛素受体与胰岛素样生长因子1(insulin-likegrowthfactors1,igf1)受体的重要底物,为了验证体内irs-1基因的生理作用,基因打靶产生了irs-1-/-基因型小鼠,irs-1-/-小鼠能够以正常比例出生,但是它们的胚胎发育以及出生后发育明显迟缓,即使表现出一定的胰岛素抵抗现象,但是总体的血糖水平能够正常维持。将irs-1敲除之后,下游的pi3k的活力并没有下降,有其它的物质能够与p85亚基结合,这证明了irs-1虽然是胰岛素信号通路中重要的受体底物,但是不依赖irs-1的信号通路在2型糖尿病发病中起到重要作用。crispr技术被证明是进行哺乳动物基因组操作的有效的方法。在这个系统中,一个短rna可以介导cas9核酸酶准确的切割降解所匹配的dna位点。与以往的基因打靶载体不同,crispr/cas9系统只需20个碱基的sgrna序列即可准确介导基因的敲除。这大大简化了基因打靶载体的构建过程。同时,因为短片段比较容易合成制备,通过这个技术已经制备多位点突变的细胞系和基因敲除鼠。对于功能基因的研究,敲除或干扰单个基因往往是看不出表型上的改变的,经常是需要对多个基因同时进行突变。2013年,张峰实验室利用crispr/cas9系统实现了对小鼠胚胎干细胞tet1、2、3、sry、uty-8五个基因的同时突变,并通过合子注射cas9及sgrna的mrna实现了tet1、tet2双基因突变,获得成活的个体;li-enjao也在斑马鱼上实现了五个色素基因的同时双等位基因突变,获得成活的个体,并呈现出色素缺陷的表型;周琪课题组也利用同样的方法实现了大鼠的tet家族三个基因的单基因及多基因的敲除,并且产生的突变可以通过生殖细胞传递给下一代;2014年yuyuniu,通过短尾猴合子期注射cas9及sgrna的mrna实现了ppar-γ以及rag1的双基因突变。此外,人们不仅能够针对编码蛋白基因进行突变,还可以针对非编码区进行特定区域的基因突变,用于研究非编码区的功能。目前,利用crispr/cas9系统已经实现了在不同的物种中进行单基因、多基因突变,大大加快了基因功能研究进程。技术实现要素:本发明目的在于提供一种特异靶向猪irs1基因的sgrna导向序列及其应用,该sgrna导向序列可以用于敲除猪irs1基因,为制备转基因猪奠定基础。本发明特异靶向猪irs1基因的sgrna导向序列为irs1-sgrna1,其核苷酸序列为:5’-cgtagtactcgaggcgcgcg-3’,如seqidno:1所示,位于基因irs1的外显子1。上述特异靶向猪irs1基因的sgrna导向序列在敲除猪irs1基因中的应用,具体方法如下:一、在猪irs1基因的sgrna导向序列的5’端加上cacc得到正向寡核苷酸;同时根据导向序列获得得其对应的dna互补链,并且再起5’端加上aaac得到反向寡核苷酸;分别合成上述正向寡核苷酸和反向寡核苷酸,将合成的正向寡核苷酸和反向寡核苷酸变性,退火,形成双链;二、将步骤一制得的双链dna与crispr/cas9载体连接,得到重组敲除表达载体;三、将步骤二制得的重组敲除表达载体转染细胞,筛选稳定转染细胞,得到成功敲除igfbp3基因的细胞。进一步的,步骤二中所述的crispr/cas9载体为px330载体。进一步的,步骤三中所述转染细胞的方法为脂质体转染法。进一步的,步骤三中所述筛选所用药物为嘌呤霉素。进一步的,步骤三中所述的细胞为猪成纤维细胞。上述特异靶向猪irs1基因的sgrna导向序列在特异识别和靶向修饰猪irs1基因中的应用。上述特异靶向猪irs1基因的sgrna导向序列在构建猪irs1基因突变库中的应用。特异靶向猪irs1基因的sgrna导向序列,能产生基因插入突变、基因序列置换、基因序列缺失等多种类型irs1基因突变体,可以在构建猪irs1基因突变库中的应用。本发明相对于现有技术具有如下的优点及效果:本发明根据sgrna导向序列设计合成两条单链核苷酸序列,退火形成双链,然后与cas9载体连接,利用cas9载体将sgrna及crispr系统引入目标细胞中,cas9蛋白会在sgrna的引导下找到与其匹配的基因组dna序列,进行剪切,实现猪基因irs1的敲除。(1)本发明利用质粒载体px330将sgrna以及crispr系统引入细胞中,cas9蛋白会在sgrna的引导下找到与其匹配的dna序列,进行剪切。质粒载体安全性高,不会引起细胞的免疫反应。(2)本发明的载体中含有嘌呤霉素抗性基因,利用嘌呤霉素对细胞进行筛选,未转入px330载体的细胞将在筛选过程中被淘汰。(3)本发明提供的特异靶向猪irs1基因的sgrna导向序列,可通过crispr/cas9系统敲除或编辑irs1基因,进而消除irs1的表达,为制备irs1转基因猪奠定基础。附图说明图1是特异靶向猪irs1基因的sgrna导向序列及其位置示意图。图2是pcr扩增猪irs1基因外显子片段电泳图。具体实施方式下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。以下实施例中所使用的细胞为原代培养猪成纤维细胞,px330载体购自addgene公司,内切酶bbsi,bsmbi购自neb公司,嘌呤霉素和细胞培养基购自sigma公司。实施例1:(1)sgrna设计根据猪irs1基因的基因组序列(geneid:nm001244489),设计1个靶向猪irs1基因的sgrna。20nt的寡核苷酸sgrna导向序列为:irs1-sgrna1:5’-cgtagtactcgaggcgcgcg-3’,位于基因irs1外显子编码区中;在其5’端加上cacc得到正向寡核苷酸序列;根据导向序列获得其对应的dna互补链,并且在其5’端加上aaac得到反向寡核苷酸。分别合成上述正向寡核苷酸和反向寡核苷酸,将合成的正向和反向sgrna寡核苷酸序列:95℃变性5min,72℃退火10min;退火后可以形成带有粘性末端的双链dna,具体寡核苷酸序列见表1。表1sgrna导向序列的寡核苷酸序列核苷酸序列(5’至3’)sg1-fcacccgtagtactcgaggcgcgcgsg1-raaaccgcgcgcctcgagtactacg(2)构建表达sgrna的载体质粒载体px330载体有bbsi酶切位点,用bbsi酶切,其中,酶切体系为10μl体系:bbsi1μl;10×nebuffer1μl;质粒2μl;ddh2o6μl;酶切条件为:37℃酶切过夜;将酶切后载体px330与步骤(1)制得的退火双链利用t4连接酶进行连接,连接体系为10μl体系:px330载体2μl,退火双链sgrna6μl,10nebt4dnaligasebuffer1μl,t4ligase1μl;连接条件为16℃连接过夜;将连接产物转化感受态细菌dh5α,具体转化方法为:-80℃取出感受态细菌dh5α,在冰浴溶解;然后100μl感受态细菌中加入10μl的上述连接产物,混匀后冰浴30min;42℃水浴100s热激活,冰浴2min;然后加入900μlsoc培养基,37℃摇床60min;涂amp+(100μg/ml)固体soc培养基平板,37℃培养过夜,挑取阳性克隆,在soc液体培养基中37℃摇床过夜,之后用tiangen质粒抽提试剂盒提取质粒并测序验证,得到表达sgrna的px330-irs1-sg1质粒载体。实施例2:(1)猪成纤维细胞的培养与冻存将猪胎儿置于国产大皿中加生理盐水清洗5-6遍,清洗完毕后,去掉胎儿四肢、尾巴、头和内脏。将处理完的胎儿放于进口小皿中,用剪刀剪碎,剪至最大的组织块为1mm3即可终止。加2ml0.25%的edta-trypsin于小皿中,并将小皿放于37度培养箱中消化25min后用4ml培养液dmem/f12(10%fbs)终止消化,并用巴斯德吸管吹打并吸出液体放于15ml离心管中,1000rpm,离心3min。离心完后,弃掉上清,加3ml培养液重悬,平均分在三个进口大皿中,进口大皿加8ml培养液dmem/f12(10%fbs)。第二天观察细胞状态,如细胞量达到90%则按照1:3的比例传代。如细胞量较少,则进行换液即可。一般猪胎儿成纤维细胞传至1代长满后即可冻存,冻存提前配好冻存液放于度中,再进行完常规的消化后用冻存液重悬,500ul分与冻存管中,并迅速将冻存管放在冻盒中,最后将冻存盒放于-80冰箱中过夜第二天,将冻存盒中的细胞导入进口液氮罐中即可。(2)质粒转染和阳性细胞筛选将重组质粒px330-irs1-sg1通过脂质体转染的方法转染猪胎儿成纤维细胞,得到重组细胞。转染的具体步骤参见脂质体3000(invitrogen,货号:11668019)操作说明书方法进行转染。将转染后细胞利用2μg/ml的嘌呤霉素对转染后的细胞进行筛选,筛选持续48h后进行细胞恢复培养,对筛选后的细胞进行培养并冷冻保存。(3)基因敲除效果鉴定根据所设计的sgrna序列设计鉴定引物,用于对敲除后目的片段进行鉴定,所设计的引物如表2所示:表2扩增irs1片段的引物序列序列(5’至3’)irs1-fttggcacggttgtgcagctgcaggairs1-rttctcggacgtgcgcaaggtgggct利用takara公司takaraminibestuniversalgenomicdnaextractionkitver.5.0,codeno.9765.对稳定转染的细胞进行基因组抽提,利用鉴定引物进行pcr鉴定。其pcr反应体系为50μl体系:基因组dna1μl,2×pcrmix25μl,上下游引物各1μl,ddh2o22μl。pcr反应条件为:94℃预变性5min,94℃变性30s,59℃退火30s,72℃延伸30s,共33个循环,之后72℃延伸10min。获得的dna片段命名为irs1。pcr反应产物琼脂糖凝胶电泳后,利用gelextractionkit(takara)进行胶回收,对胶回收产物进行测序分析,测序结果如图2所示。测序结果表明细胞基因组在基因编辑处发生了突变,对照组与野生型基因组进行了对比没有发生变化。本发明成功建立了敲除irs1基因的猪成纤维细胞。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 采用寡核苷酸介导的基因修复提高靶向基因修饰的效率的方法和组合物与流程
- CRISPR/Cas9靶向敲除人ezrin基因增强子关键区的方法及其特异性gRNA与流程
- CRISPR/Cas9 靶向敲除人PD‑1基因及其特异性gRNA的制作方法与工艺
- 靶向人TSPAN8基因的siRNA及其应用的制作方法与工艺
- 靶向人TSPAN8基因的siRNA及其应用的制作方法与工艺
- CRISPR/Cas9靶向敲除人乙肝病毒P基因及其特异性gRNA的制作方法与工艺
- 一种特异靶向人ABCG2基因的sgRNA导向序列及其应用的制作方法与工艺
- 一种利用CRISPR‑Cas9靶向敲除MSTN基因的方法与流程
- CRISPR/Cas9靶向敲除人CNE10基因及其特异性gRNA的制作方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程