一种拮抗黄芪根腐病的芽孢杆菌菌株及其发酵培养基的制作方法
本发明涉及微生物领域,具体属于一株能够拮抗黄芪根腐病菌(fusariumacuminatum、fusariumsolani)和具有促进植株生长能力的芽孢杆菌(bacillusatrophaeus)sxkf16-1及其发酵培养基,以及它们在制备黄芪根腐病生防制剂中的应用。
背景技术:
黄芪是我国中药方剂中的大宗药材,性温,味甘,具补气固表,托疮生肌等功效,被广泛用于临床各科,素有“十药八芪”之称。由于黄芪极高的药用价值,以及其药理作用研究的不断深入、药用范围的不断拓宽,国内外市场对黄芪的需求量日益增大。
黄芪主产于甘肃、内蒙、山西等地。近年来,随着种植面积的扩大,轮作周期缩短,重茬和迎茬面积增加,致使黄芪根腐病在上述主产区均已普遍发生,且危害逐年加重,成为制约黄芪产业可持续发展的重要因素。根腐病是一类极具毁灭性的土传病害,素有“植物癌症”之称。在黄芪上,更是因其多年生特性,积重难返、难以防控。黄芪根腐病由多种病原菌混合侵染引起,主要包括腐皮镰孢菌(fusariumsolani)、锐顶镰刀菌(fusariumacuminatum)、尖镰孢菌(fusariumoxysporum)、立枯丝核菌(rhizoctoniasolani)、链铬孢属真菌等(alternariaspp.)等,镰刀菌为最主要的致病菌属。
目前,化学防治作为黄芪根腐病最主要的防治方法,虽然见效快、作用强,但化学农药高毒性、高残留、高污染的特点,极易导致病菌抗药性增加、生态系统破坏。同时,还可导致有效成分含量的降低,严重影响临床用药安全和国际市场竞争力。为了避免中药材病害防治中的农药污染,保证绿色生产,国家制定了一系列的无公害生产条例,并在《中药材gap栽培技术》中明确规定了禁止使用的剧毒农药和部分高毒农药。
与化学农药相比,生物防治因具有对非靶标生物安全,毒副作用小,环境兼容性好,生产原料来源广泛等优点而越来越受到重视。因此,黄芪根腐病的防控应首先立足于生物防治,特别是生物农药的推广和使用,而获得高效拮抗菌是生物农药开发的基础。芽孢杆菌作为土壤和植物微生态区系的优势生物种群,具有很强的抗菌防病及抗逆能力,特别是由于其在定殖力、繁殖力、稳定性、以及与化学农药的相容性等方面,明显优于非芽孢杆菌和真菌,因而在土传病害的生物防治中更是显示出了极高的应用价值。
目前,国内外利用芽孢杆菌防治大田作物根部病害的报道有很多,且不少制剂已商业化。已报道的生防芽孢杆菌有:枯草芽孢杆菌(b.subtilis)、多粘芽孢杆菌(b.polymyxa)、蜡状芽孢杆菌(b.cereus)、蜡状芽孢杆菌蕈状菌变种(b.cereusvar.mycoides)、巨大芽孢杆菌(b.megaterium)和短小芽孢杆菌(b.pumilus)等。已投放市场并用于大田作物和蔬菜土传病害防治的芽孢杆菌制剂主要包括:美国的枯草芽孢杆菌制剂gb03、mbi600、qst713和解淀粉枯草芽孢杆菌变种(b.subtilisvar.amyloliquefaciensfzb24)制剂等;国内的枯草芽孢杆菌制剂则有“百抗”、“麦丰宁”、“纹曲宁”等,但针对中药材土传病害仅有一种芽孢杆菌制剂(登记证号ls2001821)可用于三七根腐病防治。
因此,根据黄芪产业发展和根腐病防治的实际需要,筛选获得对黄芪根腐病具显著抑制作用,且兼具促生功能的芽孢杆菌,对开发黄芪根腐病专用芽孢杆菌生防制剂,实现中药材土传病害的生物防治,具有十分重要的意义。
技术实现要素:
本发明目的之一是针对黄芪根腐病的两种优势致病镰刀菌(fusariumsolani和fusariumacuminatum),提供一株抑菌效果良好,且兼具促进植物生长能力的多功能芽孢杆菌菌株。该菌株可用于黄芪根腐病生防制剂的开发,缓解黄芪根腐病的发生蔓延和化学农药施用带来的不良影响。
本发明目的之二是提供多功能拮抗促生芽孢杆菌菌株的发酵培养基配方,用于黄芪根腐病生防制剂的制备和生产。
为实现上述目的,本发明提供如下技术方案:
本发明所提供的多功能拮抗促生细菌为菌株sxkf16-1,该菌株经鉴定,其分类命名为萎缩芽孢杆菌(bacillusatrophaeus),其微生物保藏号是:cgmccno.14083;保藏时间:2017年4月27号;保藏地址:北京市朝阳区北辰西路,中国科学院微生物研究所;保藏单位:中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc)。
本发明所述的萎缩芽孢杆菌(bacillusatrophaeus)sxkf16-1对黄芪根腐病的优势病原菌(fusariumsolani、fusariumacuminatum)具有很强的拮抗作用,其无菌发酵液在离体防病试验中,在不同的处理组下(保护性、治疗性和拮抗性),均具有显著的防病效果。
本发明所述的萎缩芽孢杆菌(bacillusatrophaeus)sxkf16-1主要通过其发酵液中的抗菌物质显著抑制fusariumsolani与fusariumacuminatum的菌丝生长和孢子萌发,从而起到抑菌防病作用。
本发明所述的萎缩芽孢杆菌(bacillusatrophaeus)sxkf16-1具有多种促生性能,分别为:溶磷、解淀粉酶活性、产iaa能力。
本发明提供的萎缩芽孢杆菌(bacillusatrophaeus)sxkf16-1的发酵培养基配方为:葡萄糖15.0~25.0g/l、牛肉膏15.0~20.0g/l、花生饼粉15.0~30.0g/l,caco32.0~2.2g/l、nacl0.7~0.8%。发酵培养基的最优配比为:葡萄糖21.16g/l、牛肉膏17.31g/l、花生饼粉20.64g/l,caco32.0g/l,nacl0.7%。
本发明所述的多功能拮抗菌——萎缩芽孢杆菌(bacillusatrophaeus)sxkf16-1有以下几个优点:
本说明所述的多功能拮抗菌sxkf16-1分离自山西黄芪主产区(浑源)健康黄芪植株根际土壤,并非源自其他生境,根际定殖效果较好,安全可靠,对黄芪无致病侵染能力。
本发明所述的多功能拮抗菌sxkf16-1是通过活体拮抗、发酵液抑菌、离体防病试验等大量筛选工作获得的,对黄芪根腐病的2种优势病原菌(fusariumsolani和fusariumacuminatum)均具有显著的抑制作用,且在离体防病试验中,对黄芪根腐病显示出了保护、治疗和拮抗等多种防病效果。
本说明所述的多功能拮抗菌sxkf16-1兼具溶磷、产解淀粉酶和iaa促生性能。
本说明所述的多功能拮抗菌sxkf16-1的发酵液对高温、紫外线和强酸/强碱等不良环境具有很高的耐受性,能够满足在黄芪适生地土壤和气候条件下保持良好防病效果的要求。
附图说明
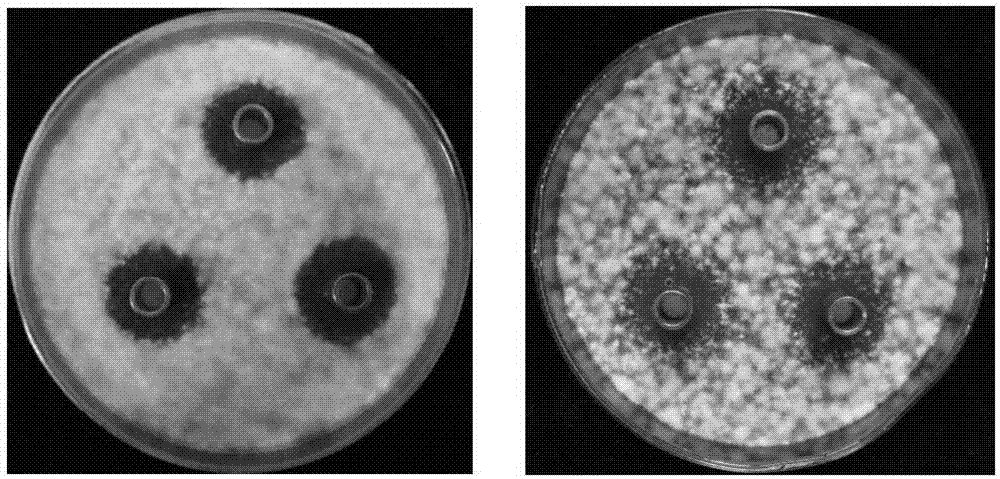
图1为萎缩芽孢杆菌sxkf16-1无菌发酵液的抑菌效果图,图中:左图靶标菌为fusariumsolani;右图靶标菌为fusariumacuminatum。
图2为萎缩芽孢杆菌sxkf16-1无菌发酵滤液对菌丝生长的抑制作用,图中:左图靶标菌为fusariumsolani;右图靶标菌为fusariumacuminatum;不同小写英文字母表示5%水平差异显著性。
图3为萎缩芽孢杆菌sxkf16-1的促生长性能测定结果
图4为萎缩芽孢杆菌sxkf16-1菌落形态图
图5为萎缩芽孢杆菌sxkf16-1革兰氏染色图
图6为萎缩芽孢杆菌sxkf16-1芽孢染色图
图7为萎缩芽孢杆菌sxkf16-1的系统进化树
图8为萎缩芽孢杆菌sxkf16-1发酵培养基优化前后抑菌效果
具体实施方式
以下结合具体实施例对本发明的技术方案进行详细描述。以下实施例仅用于说明和解释本发明,而不构成对本发明技术方案的限制。
实施例1:芽孢杆菌的来源和分离
在2014年7月,从山西(浑源)黄芪主产区,采集健康黄芪植株根际土壤用于芽孢杆菌的分离。分离方法:取10g黄芪根际土壤,60℃预处理10min后,溶于90ml无菌水中,充分震荡摇匀,梯度稀释得10-3稀释液,吸取100μl均匀涂布于pda平板,37℃恒温培养48h后,挑选清晰可辨且生长均匀的单菌落,转接至pda斜面,37℃继续培养48h后,4℃保存备用。获得的菌株经多次划线法纯化后,得最终纯化的菌株用于后续拮抗菌筛选。
实施例2:多功能拮抗促生萎缩芽孢杆菌sxkf16-1的抑菌防病效果
对峙—异步培养法测定活体抑菌效果。菌株sxkf16-1的培养:保存于4℃的菌株转接至pda斜面上,28℃活化48h;靶标菌培养:靶标病原菌接入pda平板,25℃培养5d后,打取直径5mm菌块。活体抑菌:挑取活化后的sxkf16-1菌株在pda平板中央划长约9cm的细线,28℃温箱培养24h后,于距划线两侧2cm处对称接种病原菌菌块,25℃继续培养72h后测量抑菌带宽度及病原菌菌落的长短半径,并计算抑菌率。结果表明:以fusariumsolani和fusariumacuminatum为靶标时,72h时抑菌带宽度和抑菌率分别为6.83±0.68mm、46.51±2.91%和4.83±1.25mm、39.08±6.97%。
牛津杯法测定发酵液的抑菌活性。菌株sxkf16-1无菌发酵液的制备:菌株活化后,用无菌水制备种子液,血球计数板计数并使其终浓度为1.5×107-2.0×108cfu/ml。种子液按体积比4%(v/v)接种至(50ml/250ml三角瓶)发酵基础培养基中(培养基:马铃薯20%,葡萄糖1.5%,kh2po40.1%、nacl0.2%;自然ph),28-30℃,180r/min摇床振荡培养48h,8000r/min离心20min,取上清液,用细菌过滤器(φ=0.22μm)过滤,得无菌发酵滤液,置4℃冰箱备用。靶标菌菌块及孢子悬液的制备:如上所述制备菌块。将5个菌块接入pd培养液(50ml/250ml三角瓶),摇床振荡培养(25℃、180r/min)72h,无菌纱布过滤去除菌丝,孢子稀释至20-30个/视野(10×15倍)。抑菌活性测定:将靶标菌孢子悬液(f.acuminatum与f.solani与pda培养基的比例分别为400μl/300ml和240μl/300ml)加入到熔融状态的培养基中,制备混菌平板(20ml/皿,9cm平皿),待平板凝固后,放入3个无菌牛津杯,各加入200μl无菌发酵液,25℃培养72h,十字交叉法测量抑菌圈直径。试验设3次重复。结果表明:以fusariumsolani和fusariumacuminatum为靶标时,无菌发酵液的抑菌圈直径分别为:21.08±1.56mm和19.92±1.88mm(图1)。
离体水培法测定防病效果。黄芪预处理:将生长5个月的黄芪幼苗清水洗净根部泥土,75%酒精涮根2-3次后,再用无菌水冲洗3-4次,待根部不再滴水时用无菌针轻刺根部表皮,每株5点。病原菌孢子悬液制备:如上所述培养靶标病原菌,并制备孢子悬液,使其终浓度为1.5×106-2.5×107cfu/ml。离体防病试验:选取长势一致的健康黄芪分成6组,分别作如下处理:a、黄芪直接浸入已装有含2.5%pd培养液的无菌水中;b、将黄芪在病菌孢子悬浮液中浸泡30min,取出晾至无水滴滴下,再浸入无菌水中,6h后重复1次;c、将黄芪直接浸入已装有含2.5%拮抗菌发酵液的无菌水中;d、先将黄芪在含2.5%拮抗菌发酵液的无菌水中培养3d后,再同b进行病原菌接种;e、先同b进行病原菌接种后,再放入含2.5%拮抗菌发酵液的无菌水中培养3d;f、将黄芪浸入同时含有拮抗菌发酵液和病原菌孢子悬液的无菌水中,浓度同上述处理。以上试验溶液总体积均为60ml,处理后试管保鲜膜封口,于人工气候箱培养。分别在7d和15d记录各处理的发病情况,并计算病情指数。结果见表1。
表1菌株sxkf16-1无菌发酵液对黄芪根腐病的离体防病效果
注:不同小写英文字母表示5%水平差异显著性。
实施例3:多功能拮抗促生萎缩芽孢杆菌sxkf16-1的抑菌特性
无菌发酵液对靶标菌菌丝生长的抑制作用:无菌发酵滤液制备和靶标菌孢子悬液制备均同前所述。含药平板法测定拮抗菌株发酵液对菌丝生长的抑制效果:将无菌发酵液按比例均匀加入熔融态的pda培养基中,使其稀释10、20、40、80和160倍,并制备平板(20ml/皿),然后将靶标菌菌块接入平板中央,培养72、120和168h时测量菌落直径并计算抑制率。抑制率=(对照菌落净生长直径-处理菌落净生长直径))/对照菌落净生长直径×100%。结果见图2。
无菌发酵液对靶标菌孢子萌发的抑制作用:同前所述制备孢子悬液及拮抗菌无菌发酵滤液。用无菌水将无菌滤液稀释至20、40、80倍,然后将无菌滤液和孢子悬液在平皿中等量混合(2ml+2ml);混匀后,置25-28℃下培养,24h后镜检观察孢子萌发和畸变情况,并计算孢子萌发率和致畸率。萌发率/%=(萌发的孢子数/总孢子数)×100%;孢子萌发抑制率/%=[(对照萌发率-处理萌发率)/对照萌发率]×100%。(注:畸形但萌发的孢子计入萌发数);致畸率/%=(畸形孢子数/总孢子数)×100%。结果见表2。
表2菌株sxkf16-1对黄芪根腐病菌孢子萌发的抑制作用
实施例4:多功能拮抗促生萎缩芽孢杆菌sxkf16-1的促生性能
溶磷性能测试:菌株点接于pikovaskaia's培养基中,每皿接种4点,每个菌株3皿,30℃培养120h,观察接种菌株周围有无溶磷圈形成;淀粉酶活性测定:菌株接种于含有0.2%可溶性淀粉的nb牛肉膏蛋白胨固体平板上,30℃静置培养72h,形成明显菌落后,在平板上滴加碘液,观察菌落周围变色情况并测量酶解圈大小;分泌iaa能力的测定:菌株接种于含有l-色氨酸(100mg/l)的lb液体培养基中,30℃、180r/min摇床培养24h后,取50μl菌悬液滴于白色陶瓷板上,同时加入等体积salkowski比色液(50ml35%hclo4+1ml0.5mol/lfecl3),将白色陶瓷板于室温避光放置30min后观察,颜色变红者表示能够分泌iaa。以加入50μl未接菌的lb液体培养基与等体积比色液的混合溶液为对照。结果见图3。
实施例5:多功能拮抗促生萎缩芽孢杆菌sxkf16-1的鉴定
菌株形态、生理生化特征鉴定:参照《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》,观察并测定拮抗菌的生长情况、菌落形态与颜色、革兰氏染色和芽孢染色等形态与生理生化特征。结果表明:本发明所述菌株sxkf16-1的主要生物学特征为:在pda平板表面生长的菌落为圆形,淡黄色,表面中间褶皱,边缘规则,有光泽,不透明(图4);菌体杆状,大小为(0.6-0.9)μm×(3.5-4.5)μm,革兰氏染色阴性(图5),芽孢染色阳性(图6),芽孢一般在菌体中间。生理生化特性具体见表3。根据文献资料,可初步确定该菌株为萎缩芽孢杆菌(bacillusatrophaeus)。
表3菌株sxkf16-1的生理生化特性
16srdna分子鉴定:pcr扩增16srdna,采用通用引物27f和1495r扩增,序列如下:27f:5′-agagtttgatcctggctcag-3′;1495r:5′-ctacggctaccttgttacga-3′。pcr反应体系25μl:10×pcrbuffer2.5μl,引物(25pmol/l)各1μl,dntpmixture2.5μl,taqdnapolymerase(5u/μl)0.5μl,ddh2o15.5μl,dna模板2μl。反应条件:95℃预变性4min,95℃变性lmin,55℃退火40s,72℃延伸2min,共30个循环;然后72℃保持7min。扩增产物用0.8%琼脂糖凝胶电泳检测后,委托上海sangon生物股份有限公司测序。将测序结果(见序列表sqdidno:1)提交到genbank中进行同源性比较,并选取与其同源性高的菌株序列,用mega5.0软件构建系统发育树,并用bootstrap进行自举检验,1000次重复。结果表明:菌株sxkf16-1与萎缩芽孢杆菌形成一个族群(图7),同源性达99%。
实施例6:多功能拮抗促生萎缩芽孢杆菌sxkf16-1发酵液对不良环境的耐受性
热稳定性:取菌株sxkf16-1的无菌发酵滤液,分装于4支无菌小管(3ml/管),分别在30、50、70、90、100℃下加热处理30min后,迅速冷却至室温,然后测定其抑菌活性。结果表明:以fusariumsolani和fusariumacuminatum为靶标时,发酵液在100℃下处理30min后,与对照相比,抑菌活性保持率分别达80.58%、77.34%(表4)。
表4不同温度下处理30min对发酵液抑菌稳定性的影响
酸碱稳定性:取菌株sxkf16-1的无菌发酵滤液,分装于6支无菌小管(3ml/管),分别用1mol/lhcl和1mol/l的naoh调节,使最终ph为4、5、6、7、8、9,然后测定发酵液抑菌活性。结果表明:以fusariumsolani和fusariumacuminatum为靶标时,在ph为4.0和9.0时,抑菌活性保持率分别为74.22、82.70%和72.12、75.25%(表5)。
表5不同ph处理对发酵液抑菌稳定性的影响
光稳定性:将20ml无菌滤液加入到无菌平皿中(直径9mm),在20w紫外灯(距光源40cm)下照射1、2、4、8h,然后补加无菌蒸馏水到原体积量,测定发酵液抑菌活性。结果表明:以fusariumsolani和fusariumacuminatum为靶标时,紫外照射8h后,抑菌活性保持率分别达82.70%、77.34%(表6)。
表6紫外照射不同时间对发酵液抑菌稳定性的影响
以上试验均以f.acuminatum和f.solani作为指示菌,如前所述用牛津杯法测定发酵液抑菌活性,以发酵液原液为对照。每个处理重复3次。
实施例7:多功能拮抗促生萎缩芽孢杆菌sxkf16-1发酵培养基的优化
基础培养基选择:根据萎缩芽孢杆菌sxkf16-1的特点选出6种不同基础培养基配方,比较发酵液的抑菌活性后,选择配方蛋白胨14.29g/l、淀粉14.07g/l、豆饼粉6.49g/l、caco32.0g/l、mgso41.0g/l为优化前的基础培养基。后续抑菌测定均以f.solani为靶标。
发酵培养基碳源优化:将原始培养基中的淀粉分别等量用蔗糖、麦芽糖、乳糖、葡萄糖、甘露糖、玉米粉、糊精代替,配制成8种培养基,制备无菌发酵滤液,进行抑菌能力测定,并以基础培养基为对照,确定最佳碳源为葡萄糖。
发酵培养基最优碳源浓度的优化:在最优碳源的基础上,分别配置浓度为5g/l、10g/l、15g/l、20g/l、25g/l、30g/l的发酵培养基,制备无菌发酵滤液,抑菌能力测定结果表明,葡萄糖为碳源,浓度在15~25g/l,时,发酵液抑菌效果最好。
发酵培养基氮源优化。氮源1选择:将原始培养基中的氮源1(蛋白胨)分别用等量有机氮源(胰蛋白胨、牛肉膏、酵母浸粉、尿素、硫酸铵)和无机氮源(kno3、氯化铵)代替,配制成8种培养基,制备无菌发酵滤液,以基础培养基为对照,抑菌能力测定结果表明,最佳氮源1为牛肉膏。氮源2选择:将原始培养基中的氮源2(豆饼粉)分别用等量氮源(玉米粉、黄米面、高粱面、花生饼粉、麸皮)代替,配制成6种培养基,制备无菌发酵滤液,以基础培养基为对照,抑菌能力测定结果表明,最佳氮源2为花生饼粉。
发酵培养基最优氮源浓度的优化:在最优氮源的基础上,分别配置氮源1和氮源2的浓度为5g/l、10g/l、15g/l、20g/l、25g/l和30g/l的发酵培养基,制备无菌发酵液,抑菌能力测定表明,氮源1为牛肉膏且浓度15~20g/l、氮源2为花生饼粉且浓度15~30g/l时,发酵液抑菌效果最好。
发酵培养基无机盐优化:以碳源和氮源优化后的培养基为基础,根据微生物对大量元素与微量元素的利用情况不同,将无机盐1caco3用等量cacl2、mgso4、kh2po4和mnso4·h2o替换;将无机盐2mgso4分别按0.7%的氯化钠(nacl)和磷酸氢二钾(k2hpo4)替换、按0.0005%的量用mnso4·h2o和硫酸亚铁(feso4)替换,制备成含不同无机盐的培养基。同碳氮源优化的方法,最终确定最佳无机盐1仍为caco3,无机盐2为nacl。
发酵培养基最优无机盐浓度的优化:在最优无机盐的基础上,配置含1.6g/l、1.8g/l、2.0g/l、2.2g/l和2.4g/l无机盐1caco3的发酵培养基;浓度分别为0.5%、0.6%、0.7%、0.8%和0.9%的无机盐2nacl的发酵培养基,并制备无菌发酵液;抑菌能力测定表明,无机盐1caco3浓度为2.0~2.2g/l、无机盐2nacl浓度0.7~0.8%时,发酵液抑菌效果最好。考虑到经济成本的因素,选择caco3的最优浓度为2.0g/l,nacl的最优浓度为0.7%。
由上述试验得出,多功能拮抗促生萎缩芽孢杆菌sxkf16-1发酵培养基的配方为:葡萄糖15.0~25.0g/l、牛肉膏15.0~20.0g/l、花生饼粉15.0~30.0g/l,caco32.0~2.2g/l、nacl0.7~0.8%。
发酵培养基中碳氮源浓度的正交优化:在单因素优化的基础上,对拮抗芽孢杆菌sxkf16-1进行l934的正交试验,在浓度为20g/l的葡萄糖左右选取三个值,分别为17g/l,20g/l,23g/l;浓度为20g/l的牛肉膏左右选取三个值,分别为16g/l,19g/l,22g/l;浓度为20g/l的花生饼粉左右选取三个值,分别为16g/l,18g/l,20g/l。试验结果分别进行极差分析与方差分析,确定碳源和氮源1、氮源2对发酵液抑菌活性影响的大小及其各自的浓度范围。极差分析表明:对抑菌活性影响最大的是牛肉膏,其次是花生饼粉,最后是葡萄糖,最优组合为葡萄糖20g/l,牛肉膏16g/l,花生饼粉20g/l。方差分析与极差分析结果一致,因此最终确定培养基中碳氮源组合为:葡萄糖20g/l,牛肉膏16g/l,花生饼粉20g/l。
响应面法优化发酵培养基:在以上试验基础上,采用designexpert8.0.5box-behnken中心组合设计原理,选择发酵培养基中对抑菌活性影响较大的3个因素a(辅助碳源)、b(辅助氮源)、c(辅助氮源),进行三因素三水平中心试验。采用多元二次回归方程拟合因素与响应值之间的函数关系,通过回归方程优化培养基成分,预测响应值,并对影响实验过程的因子及其交互作用进行评价,确定最佳培养基配方。
响应面法结果分析:对试验结果进行回归分析,得到的二次多元回归方程如下:
y=26.75+0.94a+0.24b+0.39c+0.73ab+0.08ac+0.21bc-1.24a2-0.56b2-0.89c2
该回归方程由designexpert8.0.5软件得出,并计算得到最佳响应变量y。发酵培养基中对f.solani的抑菌能力进行方差分析,结果可以看出,p<0.0001,表明二次多元回归模型的效果极显著,失拟项p=0.1384>0.05即不显著。相关系数r2=99.96%,r2adj=0.9992,说明模型与实验拟合度较好,实验失拟小,因此可以用此模型来进行发酵培养基中抑菌能力分析和预测。三个因素的交互作用对f.solani的抑菌效果影响显著,随着数值的变化响应值也在变化,响应面在中心有一个最大值(抑菌圈直径最大)。对响应面和回归方程进行分析后,得到抑菌效果最优的发酵培养基,即在发酵培养基中添加21.16g/l葡萄糖、17.31g/l牛肉膏、20.64g/l花生饼粉时,菌株sxkf16-1的发酵液抑菌效果最好。
发酵培养基优化前后效价比较:对优化前后的培养基进行抑菌效果对比,结果显示,原始培养基发酵液的抑菌圈直径为(20.86±0.76)mm,而优化后可达(26.67±2.10mm)mm,抑菌活性提高了21.8%,且抑菌圈边缘清晰,抑菌效果彻底(图8),表明优化后的发酵培养基更利于sxkf16-1菌株发挥抑菌效果。试验设3次重复。
因此,菌株sxkf16-1的最优发酵培养基配方为:葡萄糖21.16g/l、牛肉膏17.31g/l、花生饼粉20.64g/l,caco32.0g/l、nacl0.7%,此配方可作为生防制剂生产的基础培养基。
sequencelisting
<110>山西大学
<120>一种抗黄芪根腐病的芽孢杆菌菌株及其发酵培养基
<130>.
<160>1
<170>patentinversion3.5
<210>1
<211>1455
<212>dna
<213>bacillusatrophaeus
<400>1
gcaagtggcgggagctatacatgcaagtcgagcggacagatgggagcttgctccctgatg60
ttagcggcggacgggtgagtaacacgtgggtaacctgcctgtaagactgggataactccg120
ggaaaccggggctaataccggatgcttgtttgaaccgcatggttcaaacataaaaggtgg180
cttcggctaccacttacagatggacccgcggcgcattagctagttggtgaggtaatggct240
caccaaggcaacgatgcgtagccgacctgagagggtgatcggccacactgggactgagac300
acggcccagactcctacgggaggcagcagtagggaatcttccgcaatggacgaaagtctg360
acggagcaacgccgcgtgagtgatgaaggttttcggatcgtaaagctctgttgttaggga420
agaacaagtgccgttcaaatagggcggcaccttgacggtacctaaccagaaagccacggc480
taactacgtgccagcagccgcggtaatacgtaggtggcaagcgttgtccggaattattgg540
gcgtaaagggctcgcaggcggtttcttaagtctgatgtgaaagcccccggctcaaccggg600
gagggtcattggaaactggggaacttgagtgcagaagaggagagtggaattccacgtgta660
gcggtgaaatgcgtagagatgtggaggaacaccagtggcgaaggcgactctctggtctgt720
aactgacgctgaggagcgaaagcgtggggagcgaacaggattagataccctggtagtcca780
cgccgtaaacgatgagtgctaagtgttagggggtttccgccccttagtgctgcagctaac840
gcattaagcactccgcctggggagtacggtcgcaagactgaaactcaaaggaattgacgg900
gggcccgcacaagcggtggagcatgtggtttaattcgaagcaacgcgaagaaccttacca960
ggtcttgacatcctctgacacccctagagatagggcttccccttcgggggcagagtgaca1020
ggtggtgcatggttgtcgtcagctcgtgtcgtgagatgttgggttaagtcccgcaacgag1080
cgcaacccttgatcttagttgccagcattcagttgggcactctaaggtgactgccggtga1140
caaaccggaggaaggtggggatgacgtcaaatcatcatgccccttatgacctgggctaca1200
cacgtgctacaatggacagaacaaagggcagcgagaccgcgaggttaagccaatcccaca1260
aatctgttctcagttcggatcgcagtctgcaactcgactgcgtgaagctggaatcgctag1320
taatcgcggatcagcatgccgcggtgaatacgttcccgggccttgtacacaccgcccgtc1380
acaccacgagagtttgtaacacccgaagtcggtgaggtaacctttatggagccagccgcc1440
gaagtgacagaactg1455
- 还没有人留言评论。精彩留言会获得点赞!