一种高效表达的猪圆环病毒2型Cap‑穿膜肽融合蛋白基因及其应用的制作方法
本发明属于生物免疫技术领域,具体涉及一种高效表达的猪圆环病毒2型cap-穿膜肽融合蛋白基因及其应用。
背景技术:
猪圆环病毒2型(porcinecircovirustype2,pcv2)是危害世界养猪业的重要病原。pcv2orf2基因编码的衣壳cap蛋白具有重要免疫保护作用,是目前研发的pcv2重组亚单位疫苗的重要抗原基因。pcv2重组杆状亚单位疫苗已经实现商品化,但疫苗生产成本较高。很多分子佐剂,比如一些细胞因子,il-18,gmsf等都与免疫原共同刺激机体产生良好的免疫应答,从而提高疫苗的免疫效果。
蜜蜂蜂毒素分泌信号肽(honeybeemelittinsecretionpeptide,hbm)具有帮助靶基因分泌表达的作用,使重组蛋白具有完整的生物学功能。穿膜肽(cellpenetratingpeptide,cpp)可以投递治疗物质进入细胞,人免疫缺陷病毒tat蛋白中含有的tat肽是最先被发现的穿膜肽,可以有效地穿越细胞膜。已有研究证明,药物、多肽或者蛋白、寡核苷酸/dna/rna、纳米粒、脂质体、细菌噬菌体、荧光染料、量子点等物质可以被有效地投递到细胞内。由于cpps投递靶物质范围广泛,并且可以将抗原投递给抗原递呈细胞(apc),提高机体免疫应答,所以,它在疾病治疗和疫苗领域有着巨大潜力。
技术实现要素:
本发明的目的在于提供一种猪圆环病毒2型cap-穿膜肽融合蛋白基因。
本发明的另一目的在于提供一种猪圆环病毒2型cap-穿膜肽融合蛋白。
本发明的另一目的在于提供上述猪圆环病毒2型cap-穿膜肽融合蛋白的应用。
本发明的目的可以通过以下技术方案实现:
一种猪圆环病毒2型cap-穿膜肽融合蛋白基因,该基因为(1)~(3)中的任意一种:
(1)融合穿膜肽tat基因序列的cap基因;
(2)融合穿膜肽pptg20基因序列的cap基因;
(3)融合蜜蜂信号肽hbm基因序列的cap基因。
上述的猪圆环病毒2型cap-穿膜肽融合蛋白基因,其在于:
所述融合穿膜肽tat基因序列的cap基因的核苷酸序列如seqidno.1所示;
所述融合穿膜肽pptg20基因序列的cap基因的核苷酸序列如seqidno.3所示;
所述融合蜜蜂信号肽hbm基因序列的cap基因的核苷酸序列如seqidno.5所示。
上述的猪圆环病毒2型cap-穿膜肽融合蛋白基因,其在于:
所述融合穿膜肽tat基因序列的cap基因的制备过程为:根据穿膜肽tat基因序列tatggcaggaagaagcggagacagcgacgaaga和pvax-cap中cap基因序列,设计引物tat-cap-f,5’-cgctcgagatgtatggcaggaagaagcggagacagcgacgaagaatgacctaccccc-3’,cap-r,5’-cgggtacctcaatggtgatggtgatgatgcttggggttcaggg-3’,以重组质粒pvax-cap为模板,扩增得到tat-cap基因;
所述融合穿膜肽pptg20基因序列的cap基因的制备过程为:根据穿膜肽pptg20基因序列ggtctgttccgagcactgctgcgactgctgcgatctctgtggcgactgctgctgcgagca和pvax-cap中cap基因序列,设计引物pptg20-cap-f1,5’-cgctcgagatgggtctgttccgagcactgctgcgactgctgcgatctctgtggcgact-3’xhol,pptg20-cap-f2,5’-ctgctgcgatctctgtggcgactgctgctgcgagcaatgacctacccccgccgccg-3’,cap-r,5’-cgggtacctcaatggtgatggtgatgatgcttggggttcaggg-3’,以重组质粒pvax-cap为模板,两次pcr扩增得到pptg20-cap基因;
所述融合蜜蜂信号肽hbm基因序列的cap基因的制备过程为:根据蜜蜂信号肽hbm基因序列atgaaattcttagtcaacgttgcccttgtttttatggtcgtatacatttcttacatctatgcggatcga和pvax-cap中cap基因序列,设计引物hbm-cap-f1,5’-cgctcgagatgaaattcttagtcaacgttgcccttgtttttatggtcgtatac-3’xhol,hbm-cap-f2,5’-tttatggtcgtatacatttcttacatctatgcggatcgaatgacctacccccgccgccg-3’,cap-r,5’-cgggtacctcaatggtgatggtgatgatgcttggggttcaggg-3’,以重组质粒pvax-cap为模板,两次pcr扩增得到hbm-cap基因。
包含有上述猪圆环病毒2型cap-穿膜肽融合蛋白基因的表达盒、重组表达载体、重组杆状病毒、转基因细胞系或转基因重组菌。
一种重组杆状病毒,采用以下过程制备:将上述的猪圆环病毒2型cap-穿膜肽融合蛋白基因克隆至杆状病毒载体pfast-bac-dual后,将阳性重组载体质粒转化dh10bac感受态,同源重组,获得重组bacmid,将重组bacmid转染sf9细胞进行培养获得重组杆状病毒。
由上述的基因编码的猪圆环病毒2型cap-穿膜肽融合蛋白。优选为a~c中的任意一种:a、如seqidno.2所示的氨基酸序列;b、如seqidno.4所示的氨基酸序列;c、如seqidno.6所示的氨基酸序列。
上述融合蛋白的制备过程为:将上述的猪圆环病毒2型cap-穿膜肽融合蛋白基因克隆至杆状病毒载体pfast-bac-dual后,将阳性重组载体质粒转化dh10bac感受态,同源重组,获得重组bacmid,将重组bacmid转染sf9细胞进行培养获得重组杆状病毒,由重组杆状病毒进行表达得到融合蛋白。
上述的猪圆环病毒2型cap-穿膜肽融合蛋白在制备pvc2亚单位疫苗中的应用。
一种pvc2亚单位疫苗,包含上述的猪圆环病毒2型cap-穿膜肽融合蛋白。该疫苗中还包含有cp974s水性佐剂。
本发明的有益效果:
本课题组先前研究发现,穿膜肽与pvax-cap质粒混合制备的dna疫苗能提高其在小鼠体内的免疫应答水平。本研究将tat、pptg20,hbm与pcv2cap蛋白n端融合,成功构建重组杆状病毒,实现了cap蛋白有效表达,为pcv2基因工程疫苗研究奠定了基础。
附图说明
图1tat、pptg20、hbm与cap融合基因重组杆状病毒构建的技术路线
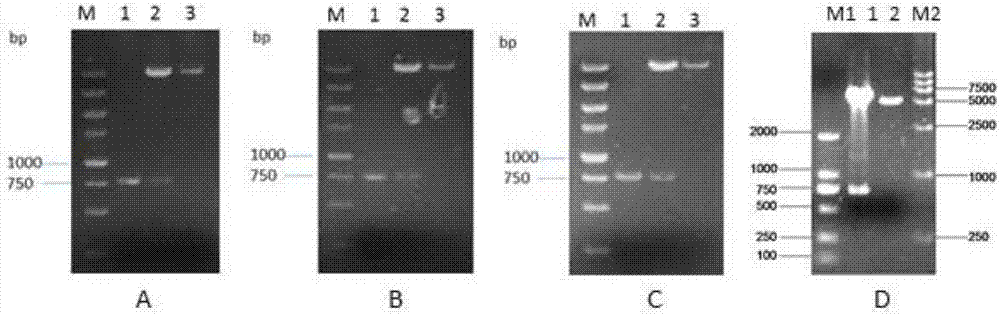
图2重组质粒的酶切鉴定
其中,a.pfast-bac-pptg20-cap;b.pfast-bac-tat-cap;c.pfast-bac-hbm-cap;d.pfast-bac-cap
a:m.dl5000dnamarker;1.pptg20-cap;2.digestionproductofpfast-bac-pptg20-cap;3.plasmiddigestioncontrol;
b:m.dl5000dnamarker;1.tat-cap;2.digestionproductofpfast-bac-tat-cap;3.plasmiddigestioncontrol;
c:m.dl5000dnamarker;1.hbm-cap;2.digestionproductofpfast-bac-hbm-cap;3.plasmiddigestioncontrol;
d:m2.dl5000dnamarker;1.digestionproductofpfast-bac-cap;2.plasmiddigestioncontrol
图3重组质粒的pcr鉴定
m.dl5000dnamarker;1-2.pcrproductofrbac-pptg20-capusingm13f+pptg-f,2489bp;3-4.pcrproductofrbac-hbm-capusingm13f+hbm-f,2496bp;5.pcrproductofrbac-tat-capusingm13f+tat-f,2459bp;6.pcrproductofrbac-capusingm13f+cap-f,2393bp
图4sf9细胞感染重组杆状病毒后出现的细胞病变
图5重组杆状病毒westernblotting鉴定
图6重组杆状病毒ifa鉴定(200×)
图7病毒样颗粒电镜观察
图8不同重组蛋白免疫小鼠pcv2elisa抗体测定结果
图9免疫小鼠pcv2中和抗体检测
图10免疫小鼠淋巴细胞增殖反应的检测结果
图11仔猪免疫后elisa抗体水平检测结果
图12仔猪免疫后中和抗体水平检测结果
图13攻毒后各组猪相对日增重测定
图14攻毒后各组猪病毒血症检测
图15淋巴组织中病毒含量的检测
图16淋巴结组织中pcv2抗原ihc检测结果(he染色,400×)
具体实施方式
实施例一、猪圆环病毒2型重组杆状病毒的构建与鉴定
本实施例采用pcr方法将猪圆环病毒2型(pcv2)orf2优化密码子基因与穿膜肽pptg20、tat和蜜蜂信号肽(hbm)基因融合,克隆至杆状病毒载体pfast-bac-dual,经酶切和基因测序鉴定正确后,分别转化dh10bac感受态,经蓝白两轮斑筛选正确转座到bacmid的克隆,提取基因组并用脂质体将bacmids转染进sf9昆虫细胞,待细胞病变出现后收集细胞裂解产物,获得重组杆状病毒rbac-cap、rbac-pptg20-cap、rbac-tat-cap和rbac-hbm-cap,采用westernblot和免疫荧光技术鉴定,结果显示,四种重组病毒均能表达cap蛋白,两种穿膜肽融合cap基因在杆状病毒表达系统中表达量明显高于蜜蜂信号肽-cap融合基因重组病毒,tat-cap和pptg20-cap重组蛋白抗原性明显优于hbm-cap和cap,tat-cap、pptg20-cap和hbm-cap均可形成病毒样颗粒,为pcv2基因工程疫苗研究奠定了基础。
1材料与方法
1.1主要材料
昆虫杆状病毒表达系统(baculovirusexpressionsystem,bevs)购于invitrogen公司,包括pfastbachtb、pfastbacdual质粒、dh10bac菌株、sf9昆虫细胞。大肠杆菌dh5α由本实验室保存,本实验中所用的限制性内切酶、t4dna连接酶、taq酶均购自takara公司。dna回收试剂盒和质粒提取试剂盒购自鼎国公司。培养昆虫细胞的grace培养基、expressfive无血清培养基和fbs为gibco公司产品。转染试剂lipofectamine2000购于invitrogen公司。hrp标记的羊抗小鼠igg和fitc标记的spa购自博士德公司。
pcv2cap蛋白的单克隆抗体3e5由本实验室制备和保存。该单克隆抗体由保藏号为cgmccno.8169的杂交瘤细胞株分泌。制备过程如下:取6~8周龄健康雌性balb/c小鼠,腹腔注射灭菌液体石蜡0.5ml/只;7天后,每只小鼠腹腔接种1~2×106个杂交瘤细胞。接种前,杂交瘤细胞弃掉培养液,用无血清的rpmi1640培养液洗涤细胞两次,尽量洗去血清蛋白,吹散细胞并配成浓度为4~5×106个/ml的细胞悬液。无菌条件下,注射0.5ml细胞悬液入小鼠腹腔。杂交瘤细胞以腹水瘤的形式在小鼠腹腔内大量繁殖,7~10天后,小鼠腹部明显胀大,触之有波动感,且表现为精神萎靡、被毛凌乱的状态,此时即可收集腹水。采集腹水时,左手抓住小鼠颈背部皮肤、左后腿和尾巴,腹部朝向实验者,并使头部呈45度倾斜向下。用12号针头自腹股沟插入腹腔后,迅速使小鼠头部朝上和腹部向下,腹水自然流出而收集。过两、三天后,腹部胀大,可再次收集,一般可收集2~3次。将腹水收集至离心管,4000rpm离心10min,取中间无色透明层液体,即为单克隆抗体3e5腹水,20℃冻存备用。
1.2pcv2cap目的基因分子设计
设计以下4种pcv2cap基因分子,采用pcr方法扩增,用于构建重组杆状病毒。
1.2.1密码子序列优化的pcv2cap基因及重组质粒pvax-cap的构建
根据真核细胞嗜好密码子基因序列设计pcv2cap基因(如下),由invitrogen公司合成,并克隆至pvax质粒,获得重组质粒pvax-cap,目的基因两端含bamhi和xhoi。具体构建方法为:将回收纯化的cap基因及pvax1用bamhi和xhoi限制性内切酶进行双酶切处理,酶切反应条件为37℃水浴4h,使用dna胶回收试剂盒回收纯化cap基因与pvax1酶切产物。采用t4连接酶,16℃过夜连接,将连接产物转化dh5α感受态细胞,挑取单个菌落培养,提取疑似重组质粒,经pcr及双酶切鉴定后,将含有阳性质粒的菌液送由invitrogen公司进行测序鉴定,获得阳性重组质粒pvax-cap。
人工合成的密码子优化的cap基因序列如seqidno.7所示。
1.2.2融合穿膜肽的基因序列tat的cap基因(tat-cap)
根据穿膜肽tat基因序列tatggcaggaagaagcggagacagcgacgaaga(seqidno.8)和pvax-cap中cap基因序列,设计引物tat-cap-f,5’-cgctcgagatgtatggcaggaagaagcggagacagcgacgaagaatgacctaccccc-3’(seqidno.11),cap-r,5’-cgggtacctcaatggtgatggtgatgatgcttggggttcaggg-3’(seqidno.16),扩增得到tat-cap基因。
1.2.3融合穿膜肽的基因序列pptg20的cap基因(pptg20-cap)
根据穿膜肽pptg20基因序列ggtctgttccgagcactgctgcgactgctgcgatctctgtggcgactgctgctgcgagca(seqidno.9)和pvax-cap中cap基因序列,设计引物pptg20-cap-f1,5’-cgctcgagatgggtctgttccgagcactgctgcgactgctgcgatctctgtggcgact-3’xhol(seqidno.12),pptg20-cap-f2,5’-ctgctgcgatctctgtggcgactgctgctgcgagcaatgacctacccccgccgccg-3’(seqidno.13),cap-r,5’-cgggtacctcaatggtgatggtgatgatgcttggggttcaggg-3’(seqidno.16),两次pcr扩增得到pptg20-cap基因。
1.2.4融合hbm基因序列的cap基因(hbm-cap)
根据hbm基因序列atgaaattcttagtcaacgttgcccttgtttttatggtcgtatacatttcttacatctatgcggatcga(seqidno.10)和pvax-cap中cap基因序列,设计引物hbm-cap-f1,5’-cgctcgagatgaaattcttagtcaacgttgcccttgtttttatggtcgtatac-3’xhol(seqidno.14),hbm-cap-f2,5’-tttatggtcgtatacatttcttacatctatgcggatcgaatgacctacccccgccgccg-3’(seqidno.15),cap-r,5’-cgggtacctcaatggtgatggtgatgatgcttggggttcaggg-3’(seqidno.16),两次pcr扩增得到hbm-cap基因。
按图1技术路线,构建重组杆状病毒。
表1用于扩增不同基因片段的引物及其序列
1.3重组杆状病毒表达质粒的构建
1.3.1目的基因扩增
以质粒pvax-cap为模板,利用前文所述的各对引物,通过pcr分别扩增各个对应的cap基因片段。利用二次pcr方法将穿膜肽基因带入到cap基因的n端,比如用hbm-f2上游引物与cap-r以pvac-cap质粒为模板,扩增出的目的基因条带切胶后胶回收纯化,再利用hbm-f1上游与cap-r进行二次pcr以回收产物为模板,扩增目的条带并回收。pptg20-cap扩增方法同hbm-cap;tat-cap由于片段相对较短只需要一次pcr即可获得。primestarmix保真聚合酶预混液进行pcr,25μl反应体系含primestarmix10.5μl、引物各1μl、模板dna1μl和ddh2o11.5μl。反应程序如下:95℃5min,98℃10sec,58℃5sec,72℃45s进行35个循环,最后72℃延伸10min。pcr产物经1%凝胶电泳鉴定。
1.3.2目的基因克隆鉴定
pcr产物经凝胶回收试剂盒进行纯化。提取纯化目的基因和载体pfast-bac-dual分别酶切。酶切体系如下:目的基因/载体20/14μl、酶1.5μl、10×buffer3μl和ddh2o4/10μl。37℃酶切4h并凝胶回收后进行连接。10μl连接体系如下:目的基因7μl、载体1μl、t4连接酶1μl、t4buffer1μl。连接反应:16℃连接仪连接过夜。制备大肠杆菌dh5α感受态细胞。取10μl的连接产物加入到100μl的dh5α感受态细胞,轻弹混匀,冰浴30min。42℃热激90s,迅速放置于冰水中,冰浴1min;加入800μl的lb液体培养基,37℃220rpm振摇培养45min,载体与目的基因连接转化产物涂布于50μg/ml氨苄lb平板,37℃温箱培养过夜,选取阳性克隆提取质粒。对重组质粒进行双酶切鉴定,鉴定正确后送金斯瑞测序。重组质粒命名为:pfast-bac-hbm-cap、pfast-bac-pptg20-cap、pfast-bac-tat-cap和pfast-bac-cap。
1.4重组杆状病毒的构建
1.4.1重组bacmid构建与鉴定
取冻存的dh10bac菌液接种于含50μg/ml卡那霉素的3mllb培养基中,制备感受态细胞。将阳性质粒转化感受态细胞dh10bac,涂布含10μg/ml四环素、50μg/ml卡那霉素、7μg/ml庆大霉素、100μg/mlx-gal和40μg/mliptg的lb平板。37℃温箱避光培养48h,至出现显著蓝白菌落。挑取单个白色单菌落接种于含10ug/ml的四环素、50ug/ml的卡那霉素和7ug/ml的庆大霉素的液体lb培养基中,37℃250rpm振荡培养12h以上,按bac-to-bac杆状病毒表达系统说明书中改良的碱裂解法提取重组载体骨架bacmid。由南京金斯瑞生物技术公司测定目的基因序列,鉴定正确的重组bacmid用于后续转染实验。
1.4.2重组杆状病毒的获得与传代
采用lipofectamine2000转染试剂将重组bacmid转染sf9细胞,27℃培养箱孵育6h后,吸去转染混合液,直接加入2ml含10%fbs的grace’s完全培养基,27℃继续培养至sf9细胞出现明显病变,收获细胞和培养上清。500g离心5min收集上清,4℃避光保存,即为f1代重组病毒。细胞用于鉴定蛋白表达。将第一代重组病毒按1:10的体积比感染新的sf9细胞,27℃培养3天至细胞出现明显病变时,500g离心5min,去除细胞和大的细胞碎片,收集上清4℃避光保存,即为第二代病毒,用同样的方法获得第三代病毒。
1.5westernblot鉴定重组cap
将重组杆状病毒按1:10体积比感染对数生长期的sf9细胞,同时设立正常sf21细胞对照,感染后72h无菌收取细胞培养物。收集上清留作种毒,4℃保存;用适量0.01mph7.2的pbs轻轻吹下细胞,500g离心5min,用适量pbs重悬细胞沉淀,加入适量loadingbuffer煮沸后用于sds-page电泳,并转印至硝酸纤维素膜(nc膜),去离子水漂洗,用含10%脱脂乳的pbst封闭液封闭,室温轻摇2h。加入pcv2cap单克隆抗体(1:2000稀释),室温轻摇1.5h。用pbst洗涤nc膜,加入羊抗小鼠igg-hrp(用pbst1:10000稀释),室温轻摇45min。用pbst洗涤nc膜。用化学发光试剂盒显色,在暗室进行x光片显影,观察特异性蛋白条带。
1.6间接免疫荧光鉴定(ifa)
将重组毒接种于96孔板中的单层sf9细胞,同时设正常sf9细胞作为阴性对照。27℃培养2天,细胞出现明显病变前,弃培养上清液,pbs洗涤细胞后用预冷的80%丙酮固定,4℃作用10min。pbs洗涤2次,每次5min,加入1:500稀释的pcv2单克隆抗体,37℃孵育1h。pbs洗3次,每次5min,再加入1:200稀释的羊抗鼠igg-fitc,37℃孵育45min,pbs洗3次,于荧光显微镜下观察,记录结果。
1.7双抗体夹心elisa的测定
收集重组杆状病毒感染的sf9细胞裂解物溶液,采用双抗体夹心elisa方法测定pcv2抗原性。夹心elisa具体步骤如下:①包被:pcv2单克隆抗体3e5用抗原包被液稀释500倍后用于包被,100ul每孔,先在37℃放置0.5h,再于4℃放置过夜。②用pbst洗涤3次,每次3min,用pbst配置5%的脱脂乳,每孔200ul,37℃放置1h。③用pbst洗涤3次,加入待检的抗原,100ul每孔,37℃放置1h。④洗涤后加入处理过的兔抗pcv2血清(1:3000稀释),100ul每孔,37℃放置1h。⑤用pbst洗涤4次,加入用pbst稀释10000倍的羊抗兔igg-hrp,100ul每孔,37℃放置1h。⑥洗涤后加入tmb,37℃显色10min。⑦每孔加入50ul2mh2so4终止反应,并用酶标仪读取od450数值。
1.8病毒样颗粒(vlp)观察
将获得的重组杆状病毒bac-tat-cap接种于sf9细胞,大量表达重组蛋白。接种后于27℃温箱培养96h,当细胞出现显著病变时,500g离心5min收集细胞。加适量pbs重悬细胞沉淀,于冰上超声裂解10min,4℃12000rpm离心15min收获上清。亲和层析法纯化上清中的cap蛋白。具体步骤如下:①400μl蛋白样品中加入2μlpcv2单克隆抗体3e5,混合均匀后于冰浴中晃动2h;②吸取50μlproteina树脂于1.5ml离心管中,用pbs洗涤3次;③将蛋白样品加到含有树脂的离心管中,冰浴中搅拌2h,使树脂处于悬浮状态;④低速离心后吸取上清,再用pbs洗涤树脂3次;⑥加50μl洗脱液到树脂中,冰浴30min;⑤低速离心收集上清,冻存于-20℃备用。收获的蛋白经磷钨酸负染后透射电镜观察,检测是否有病毒样颗粒的形成。
2结果
2.1重组质粒构建与鉴定
将pcr产物进行琼脂糖核酸电泳,pcr在预期大小位置上出现特异带,hbm-cap大小为774bp;pptg20-cap大小为768bp;tat-cap大小为741bp。
将pcr扩增的目的基因克分别隆入pfast-bac-dual中,转化e.colidh5α感受态细胞,挑单菌落提取质粒。取阳性质粒进行双酶切分析,结果均切出与目的基因大小一致的片段(图2),基因测序结果全部正确,命名重组质粒为pfast-bac-hbm-cap、pfast-bac-pptg20-cap、pfast-bac-tat-cap和pfast-bac-cap。
2.2重组bacmids和重组杆状病毒的获得
将重组载体质粒转化感受态dh10bac,经两轮蓝白斑筛选,每种质粒挑取2个白色菌落振荡过夜,用碱裂解法提取质粒,分别用通用引物m13的下游引物或者上游以及目的基因上游或者下游引物进行pcr鉴定含有目的基因(图3),即为重组bacmids。
将bacmids转染细胞,培养7-10天后细胞出现明显病变,表现为细胞变大、变圆,边缘透亮(图4),收获病毒,命名为rbac-hbm-cap、rbac-pptg20-cap、rbac-tat-cap和rbac-cap,4℃保存。
2.3重组杆状病毒鉴定
westernblot鉴定cap蛋白:将3种重组病毒和rbac-cap分别接种sf9细胞,培养4-5天后细胞出现明显病变。收集上清病毒液,并用灭菌pbs将细胞吹下并冻融三次然后进行westernblotting,结果见图5。cap、pptg20-cap、hbm-cap、tat-cap重组蛋白大小约29kd左右,其中pptg20-cap和tat-cap表达量明显高于cap和hbm-cap组。
ifa鉴定cap蛋白:将3种重组病毒和rbac-cap分别接种sf9细胞,培养3天固定细胞进行ifa鉴定,结果见图6,rbac-tat-cap表达产物的荧光量最多。
2.4重组蛋白抗原性比较
将3种重组病毒和rbac-cap分别接种sf9细胞,培养5天后细胞出现明显病变。收集细胞,冻融三次后进行夹心elisa,结果见表2。tat-cap和pptg20-cap抗原性明显高于hbm-cap,其中tat-cap抗原性最高,800倍稀释后与50倍稀释的勃林格的pcv2亚单位疫苗的抗原性相似。
表3夹心elisa方法检测重组蛋白抗原性
2.5电镜观察
将重组病毒接种sf9细胞扩大培养,裂解细胞获得tat-cap、pptg20-cap和hbm-cap蛋白,采用蔗糖密度梯度离心纯化蛋白颗粒,进行透射电镜观察,可以见到三种重组蛋白均可形成vlp,大小约20nm(图7)。
3讨论
本研究利用不同基因融合cap蛋白,探究这些因子对cap蛋白在杆状病毒表达系统中的作用。研究结果显示,穿膜肽可以提高cap在杆状病毒中的表达量,hbm信号肽不具有使cap蛋白分泌表达的作用,这可能与cap蛋白的核定位序列有关,还需要进一步研究。穿膜肽融合cap基因的杆状病毒蛋白表达水平较高,可能是由于穿膜肽能引导杆状病毒更容易地进入细胞,促进病毒在细胞中的增殖,从而提高cap蛋白的表达量,且可以增强cap蛋白向细胞表面提呈。根据电镜观察结果,这些多肽融合在capn端不影响cap形成病毒样颗粒,为pcv2重组亚单位疫苗研究奠定了重要基础。
4小结
本研究采用pcr方法将猪圆环病毒2型(pcv2)orf2优化密码子基因与穿膜肽pptg20、tat和蜜蜂信号肽(hbm)基因融合,成功构建获得4种重组杆状病毒经过westernblot和免疫荧光技术鉴定,结果证明,rbac-tat-cap和rbac-pptg20-cap表达量最高,抗原性最好,重组蛋白可以有效形成病毒样颗粒,可以作为pcv2重组亚单位疫苗候选种毒。
实施例二、杆状病毒表达的四种pcv2cap重组蛋白小鼠免疫特性比较
本研究采用重组杆状病毒rbac-tat-cap、rbac-pptg20-cap、rbac-hbm-cap和rbac-cap表达的4种cap蛋白,利用cp974s水性佐剂,制备pcv2亚单位疫苗tat-cap、pptg20-cap、hbm-cap和cap,进行小鼠免疫试验,结果显示,4种疫苗均可诱导产生pcv2抗体,但pptg20-cap和tat-cap重组病毒亚单位疫苗诱导的中和抗体和细胞免疫水平明显高于cap亚单位疫苗,具有重要应用前景。
1材料与方法
1.1主要材料与实验动物
表达cap蛋白的重组杆状病毒rbac-tat-cap、rbac-pptg20-cap、rbac-hbm-cap和rbac-cap均由本实验室构建并保存。highfive细胞(美国atcc)由本实验室保存;pcv2单克隆抗体3e5由本实验室制备并保存。
cp974s水佐剂:由本实验室设计配方,配制方法为:取卡波姆50~60g,加至9800ml蒸馏水中,待充分溶胀后,混匀,115℃高压灭菌30分钟,呈胶冻状,室温放置。使用前缓慢加入灭菌的5%~6%氢氧化钠溶液(5~6g/100ml),使其转化为水溶性状,加入20~30μg/ml副猪嗜血杆菌荚膜多糖、30~40μg/ml细菌蛋白omp、20~30μg/ml细菌dna和0.01%~0.03%的生育酚水溶液(10~30mg/100ml)(用0.45μm滤膜过滤除菌),加灭菌蒸馏水至10000ml,充分搅拌混匀,2~8℃保存,应不超过12个月。
5周龄清洁级icr小鼠,经间接elisa检测pcv2抗体阴性。
1.2疫苗制备
将相同滴度的重组杆状病毒(105.0tcid50/ml)接种sf9昆虫细胞,在感染后96小时收取发生病变的细胞。首先吸弃细胞培养上清,每瓶细胞(75cm2)加入1ml0.01mol/lph7.2pbs溶液,吹下细胞,再对细胞悬液进行超声波裂解,得到含有pcv2cap蛋白的细胞裂解液。用夹心elisa方法测定其cap蛋白含量,调整目的蛋白浓度为30μg/ml。将目的蛋白抗原和cp974s佐剂按4:1比例混合,以300r/min搅拌,充分混合10分钟,配置4种疫苗tat-cap、pptg20-cap、hbm-cap和cap,保存于4℃备用。
1.3小鼠免疫试验
将50只清洁级小鼠随机分为5组,第1-4组为tat-cap、pptg20-cap、hbm-cap和cap疫苗接种组,第5组为pbs对照组。小鼠适应2天后进行首免,免疫方法为背部皮下多点注射,疫苗免疫剂量是200μl。首免后14d进行加强免疫,加强免疫的剂量和方法与之前相同。首免后第28、42d,每组随机取5只小鼠眼球采血,分离血清,分别测定elisa抗体和中和抗体滴度;无菌摘取小鼠脾脏,加灭菌pbs研磨后分离淋巴细胞,测定淋巴细胞增殖反应。
1.4elisa抗体检测
包被抗原为本实验室制备纯化保存的capc,此蛋白由大肠杆菌表达。用ph9.6碳酸盐缓冲液稀释至终浓度为5ug/ml,包被酶标板,100μl/孔,37℃作用2h后4℃包被过夜;洗涤3次,每次3-5min;每孔加200μl的0.15%bsa封闭液封闭板子,37℃作用2h;洗涤;将待检血清用pbs倍比稀释,每个样品一行,每孔加100μl,37℃作用1h;洗涤;然后加入酶标羊抗鼠igg(1:5000倍稀释),100μl/孔,37℃作用1h;洗涤;加底物液tmb显色,最后用2mm的h2so4终止反应。结果判定:待检血清od450值/阴性血清od450值≥2.1为阳性。
1.5中和抗体检测
待检血清于56℃水浴30min进行灭活,12000rpm离心10min除菌后,吸出上清到灭菌的ep管中。再将处理好的血清用维持液进行倍比稀释,依次是1∶4、1∶8、1∶16、1∶32,……与此同时,将增殖的pcv2用维持液稀释到200tcid50/0.1ml,然后与不同稀释度的血清等体积混合,37℃水浴作用1h。弃掉长有pk15细胞的96孔板中的营养液,用纯dmem洗涤细胞一遍,再将水浴作用后的血清病毒混合物加到孔中,每个血清稀释度设置3个重复,100μl每孔,37℃培养72h。同时设置阴性血清对照、阴性血清病毒对照和空白对照。72h后用间接免疫荧光法(ifa)测定血清中和抗体效价,以能够抑制50%pcv2感染的血清最大稀释度作为待检血清的中和抗体效价。
1.6淋巴细胞增殖试验
将小鼠眼球采血,用颈椎脱臼法处死小鼠。无菌条件下,取出脾脏,并用剪子剪去与其相连的结缔组织和脂肪组织。将分离获得的脾脏放入200目的虑网膜中,加入3mlpbs后无菌研磨,将脾细胞悬液转移到含有淋巴细胞分离液的离心管中,2000rpm离心15min。用吸管吸取中间层的灰白细胞,放入另一只试管中,加红细胞裂解液5ml,混匀脾细胞,静置5min,待红细胞完全破碎,2000rpm离心10min,弃上清去除红细胞。加入5ml纯1640再次洗涤细胞沉淀,2000rpm离心10min,弃掉上清,用10%的1640稀释到5×106个/ml,加入96孔板,100μl每孔。将pcv2作为刺激抗原,cona作为对照,终浓度10μg/ml,37℃下培养72h,每孔加入20μlmtt(5mg/ml),每组3个重复,37℃下继续培养6h。弃掉96孔中的培养液,加入dmso,100μl每孔,振荡融解紫色结晶,测定波长570nm的od值,计算刺激指数(si=刺激孔的od值/未刺激孔的od值)。
1.7数据统计分析
应用spss软件对实验数据进行统计分析,并比较各组数值的差异,其中p<0.05表示差异显著,p<0.01表示差异极显著。
2结果
2.1elisa抗体
结果见图8。tat-cap、pptg20-cap、hbm-cap和cap疫苗首次免疫14天即可诱导产生pcv2抗体,首免后28天和42天,四种疫苗免疫组均产生较高水平的elisa抗体,而阴性对照组则未检测到pcv2特异性抗体。
2.2中和抗体
结果如图9。首免后28和42天,tat-cap和pptg20-cap疫苗免疫组pcv2中和抗体水平明显高于hbm-cap和cap疫苗免疫组(p<0.05)。同时,阴性对照组则未检测到pcv2中和抗体。
2.3细胞免疫应答
结果如图10。首免后28-42天,tat-cap和pptg20-cap疫苗免疫组pcv2特异性si明显高于hbm-cap和cap疫苗免疫组(p<0.05)。
3结论
本研究制备了重组杆状病毒rbac-tat-cap、rbac-pptg20-cap、rbac-hbm-cap和rbac-cap表达的重组cap蛋白亚单位疫苗。四种疫苗均可诱导小鼠产生pcv2elisa抗体和中和抗体,但tat-cap和pptg20-cap疫苗中和抗体和细胞免疫水平明显高于hbm-cap和cap疫苗,tat-cap和pptg20-cap重组蛋白疫苗体液免疫和细胞免疫水平相似,具有重要应用前景。
实施例三pcv2cap蛋白重组杆状病毒疫苗猪体免疫保护效力研究
本研究以重组杆状病毒rbac-tat-cap和rbac-pptg20-cap表达的重组蛋白制备疫苗,进行猪体免疫保护试验,并与进口商品化pcv2亚单位疫苗进行比较,结果为:免疫后2周可检测到elisa抗体,免疫后4周,tat-cap组、pptg20-cap和商品疫苗组中和抗体水平分别为1:90、1:85和1:72。免疫后4周进行攻毒试验,tat-cap和pptg20-cap疫苗都能为攻毒仔猪提供免疫保护,免疫猪病毒血症、淋巴结和肺脏组织病理变化和淋巴结组织病毒载量均显著低于非免疫对照组,免疫效果稍优于商品化pcv2亚单位疫苗,具有重要应用前景。
1材料与方法
1.1主要材料与试剂
猪圆环病毒2型sh株(pcv2sh,为常规分离的病毒毒株)由本实验室分离鉴定保存;pk15细胞和sf9细胞(美国atcc)由本实验室保存;表达cap蛋白的重组杆状病毒rbac-tat-cap和rbac-pptg20-cap由本实验室构建并保存;弗氏完全佐剂、不完全佐剂、匙孔血蓝蛋白和巯基乙酸培养基购自sigma公司,cp940s水佐剂由本实验室配置;pcv2单克隆抗体3e5由本实验室制备并保存;羊抗小鼠igg-hrp、spa-hrp、羊抗小鼠igg-fitc和dab显色试剂盒购自武汉博士德生物工程公司;病毒dna提取试剂盒购自omega公司;人外周血淋巴细胞分离液购自天津灏阳生物制品有限公司。其他常规试剂均为分析纯。
1.2实验动物
5周龄清洁级icr小鼠,经间接elisa检测pcv2抗体阴性;30日龄断奶仔猪,经检测pcv2和prrsv的抗原抗体均为阴性,隔离饲养。
1.3疫苗的制备
取重组杆状病毒rbac-tat-cap和rbac-pptg20-cap(107.5tcid50/ml)接种sf9昆虫细胞(106.0个细胞/ml),培养96小时,低速离心,弃上清,加入原等体积pbs溶液(0.01mol/l,ph7.2),超声波裂解,获得两种pcv2cap蛋白液,分别与cp974s水溶性佐剂,按4:1体积比混合制成两种疫苗tat-cap和pptg20-cap,于4℃保存备用。
1.4仔猪免疫保护试验
筛选25头30日龄断奶仔猪,经检测pcv2和prrsv抗原抗体均为阴性,随机分为5组,每组5只,各组隔离饲养。第一组接种pcv2tat-cap亚单位疫苗,肌肉注射1ml,第二组接种pcv2pptg20-cap亚单位疫苗,第三组接种ciroflex进口商品化亚单位疫苗(勃林格公司),第四组不接种作为攻毒对照组(cc),第五组不接种作为空白对照组(nc)。免疫后14、21和28天采血,分离血清用于elisa抗体和中和抗体检测。免疫后28天对免疫组和攻毒组仔猪进行攻毒,用pcv2sh株(含106.0tcid50/ml)滴鼻1ml、肌肉注射2ml,隔离饲养。攻毒后第4、7日,分别在每头猪的两侧腋下及两侧臀部共4个点对所有猪接种用弗氏不完全佐剂乳化的钥匙孔血蓝蛋白(klh/icfa,0.5mg/ml),每个点接种1ml(4ml/头),同时腹腔接种巯基乙酸培养基,10ml/头;攻毒后第11日和19日再次分别腹腔接种巯基乙酸培养基,10ml/头。攻毒后每天上午测量所有仔猪的体温,并观察仔猪的临床表现。攻毒后7、19、28天采血,分离血清用于病毒血症检测。攻毒后0和28天分别称量每头猪体重,计算相对日增重(rdwg)。攻毒后28天剖杀所有仔猪,观察每头猪肺脏和淋巴结等脏器病变情况,取淋巴结、肺脏于4%多聚甲醛中固定,用于组织切片制作和免疫组化试验。
1.5elisa抗体检测
包被抗原为本实验室制备纯化保存的capc,此蛋白由大肠杆菌表达。用ph9.6碳酸盐缓冲液稀释至终浓度为5ug/ml,包被酶标板,100μl/孔,37℃作用2h后4℃包被过夜;洗涤3次,每次3-5min;每孔加200μl的0.15%bsa封闭液封闭板子,37℃作用2h;洗涤;将待检血清用pbs倍比稀释,每个样品一行,每孔加100μl,37℃作用1h;洗涤;然后加入酶标的spa(1:10000倍稀释),100μl/孔,37℃作用1h;洗涤;加底物液tmb显色,最后用2mm的h2so4终止反应。结果判定:待检血清od450值/阴性血清od450值≥2.1为阳性。以判定阳性的血清最大稀释度作为该样品的抗体滴度。
1.6中和抗体检测
待检血清于56℃水浴30min进行灭活,12000rpm离心10min除菌后,吸出上清到灭菌的ep管中。再将处理好的血清用维持液进行倍比稀释,依次是1∶4、1∶8、1∶16、1∶32,……与此同时,将增殖的pcv2用维持液稀释到200tcid50/0.1ml,然后与不同稀释度的血清等体积混合,37℃水浴作用1h。弃掉长有pk15细胞的96孔板中的营养液,用纯dmem洗涤细胞一遍,再将水浴作用后的血清病毒混合物加到孔中,每个血清稀释度设置3个重复,100μl每孔,37℃培养72h。同时设置阴性血清对照、阴性血清病毒对照和空白对照。72h后用间接免疫荧光法(ifa)测定血清中和抗体效价,以能够抑制50%pcv2感染的血清最大稀释度作为待检血清的中和抗体效价。
1.7real-timepcr定量检测pcv2
样品dna提取:取200μl血清或淋巴结组织悬液,加入400μlpbs,终浓度1%的sds和终浓度50μg/ml的蛋白酶k,56℃水浴30min,加入等体积的酚,振荡混匀,12000rpm离心10min;小心吸取上清至新的ep管,加入等体积的酚/氯仿,振荡混匀,12000rpm离心10min;小心吸取上清至新的ep管,加入等体积的氯仿,振荡混匀,12000rpm离心10min;小心吸取上清至新的ep管,加入1/10体积的3m乙酸钠(ph5.2)和2.5倍体积的预冷的无水乙醇,-20℃过夜沉淀dna;12000rpm离心15min,弃上清,沉淀用75%乙醇洗涤一次,室温干燥;最后加入20μl无菌双蒸水溶解dna,-20℃保存备用。
real-timepcr:反应体系为:dna2μl,2×powersybrgreenpcrmastermix(toyobo公司)10μl,引物f/r各1μl(终浓度400nm,f:5’-ccaggagggcgttctgact-3’;r:5’-cgttaccgctggagaaggaa-3’),无菌双蒸水补足体积至20μl。置abi7300realtimepcr仪上进行,反应程序为:预变性95℃2min,95℃15s,60℃1min,进行40个循环。同时设定阴性对照并用阳性质粒模板pt-sh10倍倍比稀释作为模板,按同样方法操作,绘制标准曲线,根据样品ct值和标准曲线计算出相应的拷贝数。
1.8病理学观察
按常规方法进行病理解剖,观察脏器病理变化,并采集肺脏、脾脏、淋巴结等脏器10%多聚甲醛固定后,制备石蜡切片,he染色,显微镜观察组织病变。将制作好的切片保存于切片盒中,待二甲苯挥发完全后,在显微镜下观察组织切片的病理变化。
1.9免疫组化
按常规方法处理载玻片,制备支气管淋巴结和腹股沟淋巴结石蜡切片,用免疫组化方法检测pcv2抗原:(1)石蜡切片常规脱蜡入水。(2)3%h2o2去离子水孵育5~10min,蒸馏水洗3次。(3)抗原热修复:将切片浸入0.01m枸橼酸盐缓冲液(ph6.0),微波炉加热至沸腾后低火20min。冷却后用pbs(0.01m,ph7.2~7.6)洗涤1~2次。(4)滴加5%羊血清封闭液,37℃温箱孵育30min,甩去多余液体。(5)滴加小鼠抗pcv2单克隆抗体(1:100),37℃孵育4h,用pbs洗2min×3次。(6)滴加hrp标记的羊抗小鼠igg,37℃孵育1h,用pbs洗2min×3次。(7)dab显色:使用dab显色试剂盒,在1ml试剂2(dab底物液)中加入约50ul试剂1,混合均匀加至切片,室温显色,镜下控制反应时间5~20min之间,至有细胞呈棕色着染为止,蒸馏水洗涤。(8)苏木素轻度复染,封片。(9)显微镜观察,淋巴滤泡中棕色着染细胞数≥10%判定pcv2抗原阳性。
1.10数据统计分析
应用spss软件对实验数据进行统计分析,并比较各组数值的差异,其中p<0.05表示差异显著,p<0.01表示差异极显著。
2结果
2.1体液免疫应答
间接elisa抗体检测,结果以血清稀释100倍时的s/p值表示,具体结果见图11。免疫2周后,三个免疫组都有不同程度的pcv2抗体产生,免疫4周后,两个免疫组的抗体水平继续升高。
中和抗体结果如图12,tat-cap组、pptg20-cap和商品疫苗组中和抗体水平分别为1:90、1:85和1:72,各组之间没有显著性差异(p>0.05)。
2.2攻毒后仔猪临床症状
免疫后4周,进行pcv2攻毒,每天测量体温,连续三周,结果显示,三个免疫组和空白对照组均没有持续出现发热的现象(大于40℃),没有明显的临床症状。非免疫攻毒组有两头猪出现3-4天体温升高,消瘦、被毛粗乱和精神沉郁等轻微临床症状。攻毒后0天和28天称量每一头猪的体重,计算相对日增重,结果见图13,三个疫苗免疫组的相对日增重明显高于攻毒对照组(p<0.05),说明tat-cap和pptg20-cap疫苗组都对仔猪产生了免疫保护作用,促进了仔猪的生长。
2.4攻毒后仔猪病毒血症检测
攻毒后7、19、28天采血,分离血清用于病毒血症检测,结果如图14。所有猪都有病毒血症发生,但tat-cap和pptg20-cap疫苗组明显低于攻毒对照组(p<0.05),与商品疫苗组相似(p>0.05)。
2.5淋巴结组织中病毒测定
攻毒28天后,剖杀所有猪并提取腹股沟淋巴结的dna,用于real-timepcr,进而测定其中的pcv2含量,结果见图15。所有猪的淋巴结中都能检测到病毒的存在,但是三个免疫组之间相似(p>0.05),但均明显低于攻毒对照组(p<0.05),表明tat-cap和pptg20-cap疫苗组均有效降低了pcv2的感染。
2.6病理变化和免疫组化检测结果
淋巴结和肺脏组织学病理变化观察结果显示,空白对照组和三个疫苗免疫组淋巴结和肺脏组织无明显病变,攻毒对照组淋巴结的淋巴滤泡边界模糊,淋巴细胞缺失,肺脏出现间质增宽、肺泡缩小、出血和实变的现象。淋巴结组织免疫组化检测结果显示,攻毒组淋巴组织中存在较多的棕黄色细胞,而tat-cap、pptg20-cap和商品疫苗免疫组则没有特异性的着色细胞(图16)。
3结论
综上所述,本研究制备的两种pcv2cap蛋白亚单位疫苗可以诱导机体产生pcv2特异性的elisa抗体和中和抗体,对pcv2攻毒产生保护作用,为pcv2新型疫苗研制奠定了基础。
序列表
<110>南京农业大学
<120>一种高效表达的猪圆环病毒2型cap-穿膜肽融合蛋白基因及其应用
<160>16
<170>siposequencelisting1.0
<210>1
<211>741
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgtatggcaggaagaagcggagacagcgacgaagaatgacctacccacgccggcgcttt60
cggcgccgccggcatcgccctcgctcccatctgggccaaatcctccggcggcggccttgg120
ctcgtgcatccccggcaccggtatcgctggcgccggaagaacggcatcttcaatacccgc180
ctgtcccgcaccatcggctacaccgtgaagaagaccaccgtgcggacaccaagctggaat240
gtggacatgatgcgcttcaacattaacgacttcctccctcccggaggcgggagcaacccc300
ctgaccgtgccattcgagtactatcgcatccggaaagtgaaggtggagttctggccatgc360
tcccccattacacagggcgaccggggagtcggcagcaccgccgtgatcctggacgacaac420
ttcgtgaccaaagccaacgctctgacatacgacccctacgtcaattactccagccggcac480
accatcacccagcccttcagctaccacagccgctacttcacccccaagcccgtgctggac540
cggaccatcgactacttccaacccaacaacaagcgcaaccagctgtggctgcgcctgcaa600
accacaggcaacgtggaccacgtcggcctggggaccgcttttgagaacagcatctacgac660
caggactacaacatccgcatcaccatgtacgtgcagttccgcgaattcaacctgaaggac720
ccccctctcaatcccaagtga741
<210>2
<211>248
<212>prt
<213>人工序列(artificialsequence)
<400>2
alathrmettyrglyarglyslysargargglnargargargmetthr
151015
tyrproargargargpheargargargarghisargproargserhis
202530
leuglyglnileleuargargargprotrpleuvalhisproarghis
354045
argtyrargtrpargarglysasnglyilepheasnthrargleuser
505560
argthrileglytyrthrvallyslysthrthrvalargthrproser
65707580
trpasnvalaspmetmetargpheasnileasnasppheleupropro
859095
glyglyglyserasnproleuthrvalpropheglutyrtyrargile
100105110
arglysvallysvalgluphetrpprocysserproilethrglngly
115120125
aspargglyvalglyserthralavalileleuaspaspasnpheval
130135140
thrlysalaasnalaleuthrtyraspprotyrvalasntyrserser
145150155160
arghisthrilethrglnprophesertyrhisserargtyrphethr
165170175
prolysprovalleuaspargthrileasptyrpheglnproasnasn
180185190
lysargasnglnleutrpleuargleuglnthrthrglyasnvalasp
195200205
hisvalglyleuglythralaphegluasnseriletyraspglnasp
210215220
tyrasnileargilethrmettyrvalglnpheargglupheasnleu
225230235240
lysaspproproleuasnprolys
245
<210>3
<211>768
<212>dna
<213>人工序列(artificialsequence)
<400>3
atgggtctgttccgagcactgctgcgactgctgcgatctctgtggcgactgctgctgcga60
gcaatgacctacccacgccggcgctttcggcgccgccggcatcgccctcgctcccatctg120
ggccaaatcctccggcggcggccttggctcgtgcatccccggcaccggtatcgctggcgc180
cggaagaacggcatcttcaatacccgcctgtcccgcaccatcggctacaccgtgaagaag240
accaccgtgcggacaccaagctggaatgtggacatgatgcgcttcaacattaacgacttc300
ctccctcccggaggcgggagcaaccccctgaccgtgccattcgagtactatcgcatccgg360
aaagtgaaggtggagttctggccatgctcccccattacacagggcgaccggggagtcggc420
agcaccgccgtgatcctggacgacaacttcgtgaccaaagccaacgctctgacatacgac480
ccctacgtcaattactccagccggcacaccatcacccagcccttcagctaccacagccgc540
tacttcacccccaagcccgtgctggaccggaccatcgactacttccaacccaacaacaag600
cgcaaccagctgtggctgcgcctgcaaaccacaggcaacgtggaccacgtcggcctgggg660
accgcttttgagaacagcatctacgaccaggactacaacatccgcatcaccatgtacgtg720
cagttccgcgaattcaacctgaaggacccccctctcaatcccaagtga768
<210>4
<211>257
<212>prt
<213>人工序列(artificialsequence)
<400>4
alathrmetglyleupheargalaleuleuargleuleuargserleu
151015
trpargleuleuleuargalametthrtyrproargargargphearg
202530
argargarghisargproargserhisleuglyglnileleuargarg
354045
argprotrpleuvalhisproarghisargtyrargtrpargarglys
505560
asnglyilepheasnthrargleuserargthrileglytyrthrval
65707580
lyslysthrthrvalargthrprosertrpasnvalaspmetmetarg
859095
pheasnileasnasppheleuproproglyglyglyserasnproleu
100105110
thrvalpropheglutyrtyrargilearglysvallysvalgluphe
115120125
trpprocysserproilethrglnglyaspargglyvalglyserthr
130135140
alavalileleuaspaspasnphevalthrlysalaasnalaleuthr
145150155160
tyraspprotyrvalasntyrserserarghisthrilethrglnpro
165170175
phesertyrhisserargtyrphethrprolysprovalleuasparg
180185190
thrileasptyrpheglnproasnasnlysargasnglnleutrpleu
195200205
argleuglnthrthrglyasnvalasphisvalglyleuglythrala
210215220
phegluasnseriletyraspglnasptyrasnileargilethrmet
225230235240
tyrvalglnpheargglupheasnleulysaspproproleuasnpro
245250255
lys
<210>5
<211>774
<212>dna
<213>人工序列(artificialsequence)
<400>5
atgaaattcttagtcaacgttgcccttgtttttatggtcgtatacatttcttacatctat60
gcggatcgaatgacctacccacgccggcgctttcggcgccgccggcatcgccctcgctcc120
catctgggccaaatcctccggcggcggccttggctcgtgcatccccggcaccggtatcgc180
tggcgccggaagaacggcatcttcaatacccgcctgtcccgcaccatcggctacaccgtg240
aagaagaccaccgtgcggacaccaagctggaatgtggacatgatgcgcttcaacattaac300
gacttcctccctcccggaggcgggagcaaccccctgaccgtgccattcgagtactatcgc360
atccggaaagtgaaggtggagttctggccatgctcccccattacacagggcgaccgggga420
gtcggcagcaccgccgtgatcctggacgacaacttcgtgaccaaagccaacgctctgaca480
tacgacccctacgtcaattactccagccggcacaccatcacccagcccttcagctaccac540
agccgctacttcacccccaagcccgtgctggaccggaccatcgactacttccaacccaac600
aacaagcgcaaccagctgtggctgcgcctgcaaaccacaggcaacgtggaccacgtcggc660
ctggggaccgcttttgagaacagcatctacgaccaggactacaacatccgcatcaccatg720
tacgtgcagttccgcgaattcaacctgaaggacccccctctcaatcccaagtga774
<210>6
<211>259
<212>prt
<213>人工序列(artificialsequence)
<400>6
alathrmetlyspheleuvalasnvalalaleuvalphemetvalval
151015
tyrilesertyriletyralaaspargmetthrtyrproargargarg
202530
pheargargargarghisargproargserhisleuglyglnileleu
354045
argargargprotrpleuvalhisproarghisargtyrargtrparg
505560
arglysasnglyilepheasnthrargleuserargthrileglytyr
65707580
thrvallyslysthrthrvalargthrprosertrpasnvalaspmet
859095
metargpheasnileasnasppheleuproproglyglyglyserasn
100105110
proleuthrvalpropheglutyrtyrargilearglysvallysval
115120125
gluphetrpprocysserproilethrglnglyaspargglyvalgly
130135140
serthralavalileleuaspaspasnphevalthrlysalaasnala
145150155160
leuthrtyraspprotyrvalasntyrserserarghisthrilethr
165170175
glnprophesertyrhisserargtyrphethrprolysprovalleu
180185190
aspargthrileasptyrpheglnproasnasnlysargasnglnleu
195200205
trpleuargleuglnthrthrglyasnvalasphisvalglyleugly
210215220
thralaphegluasnseriletyraspglnasptyrasnileargile
225230235240
thrmettyrvalglnpheargglupheasnleulysaspproproleu
245250255
asnprolys
<210>7
<211>705
<212>dna
<213>人工序列(artificialsequence)
<400>7
atgacctacccacgccggcgctttcggcgccgccggcatcgccctcgctcccatctgggc60
caaatcctccggcggcggccttggctcgtgcatccccggcaccggtatcgctggcgccgg120
aagaacggcatcttcaatacccgcctgtcccgcaccatcggctacaccgtgaagaagacc180
accgtgcggacaccaagctggaatgtggacatgatgcgcttcaacattaacgacttcctc240
cctcccggaggcgggagcaaccccctgaccgtgccattcgagtactatcgcatccggaaa300
gtgaaggtggagttctggccatgctcccccattacacagggcgaccggggagtcggcagc360
accgccgtgatcctggacgacaacttcgtgaccaaagccaacgctctgacatacgacccc420
tacgtcaattactccagccggcacaccatcacccagcccttcagctaccacagccgctac480
ttcacccccaagcccgtgctggaccggaccatcgactacttccaacccaacaacaagcgc540
aaccagctgtggctgcgcctgcaaaccacaggcaacgtggaccacgtcggcctggggacc600
gcttttgagaacagcatctacgaccaggactacaacatccgcatcaccatgtacgtgcag660
ttccgcgaattcaacctgaaggacccccctctcaatcccaagtga705
<210>8
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>8
tatggcaggaagaagcggagacagcgacgaaga33
<210>9
<211>60
<212>dna
<213>人工序列(artificialsequence)
<400>9
ggtctgttccgagcactgctgcgactgctgcgatctctgtggcgactgctgctgcgagca60
<210>10
<211>69
<212>dna
<213>人工序列(artificialsequence)
<400>10
atgaaattcttagtcaacgttgcccttgtttttatggtcgtatacatttcttacatctat60
gcggatcga69
<210>11
<211>57
<212>dna
<213>人工序列(artificialsequence)
<400>11
cgctcgagatgtatggcaggaagaagcggagacagcgacgaagaatgacctaccccc57
<210>12
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>12
cgctcgagatgggtctgttccgagcactgctgcgactgctgcgatctctgtggcgact58
<210>13
<211>56
<212>dna
<213>人工序列(artificialsequence)
<400>13
ctgctgcgatctctgtggcgactgctgctgcgagcaatgacctacccccgccgccg56
<210>14
<211>53
<212>dna
<213>人工序列(artificialsequence)
<400>14
cgctcgagatgaaattcttagtcaacgttgcccttgtttttatggtcgtatac53
<210>15
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>15
tttatggtcgtatacatttcttacatctatgcggatcgaatgacctacccccgccgccg59
<210>16
<211>43
<212>dna
<213>人工序列(artificialsequence)
<400>16
cgggtacctcaatggtgatggtgatgatgcttggggttcaggg43
- 还没有人留言评论。精彩留言会获得点赞!