一种枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关基因蛋白的研究样本的制备方法与流程
本发明涉及微生物技术领域,更具体地,涉及一种枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关基因蛋白的研究样本的制备方法。
背景技术:
邻苯二甲酸酯(phthalateesters,paes)又称酞酸酯,是一类常用的增塑剂,一般为油状,微溶于水,易溶于有机溶剂,可提高塑料制品的可塑性和强度,作为添加剂广泛地应用在各类工业产品、生活产品中和生产原料中。
paes已经在大气、水体、污水淤泥、河流沉积物、灰尘、土壤以及动植物体中检出,表明paes已在环境中广泛存在。有研究表明paes在环境介质中存留时间长并且是一类具有生物蓄积性和致畸、致癌、致突变的环境激素类污染物,因此paes对人体和生态环境都会造成较大风险。美国国家环保署已将邻苯二甲酸二甲酯(dmp)、邻苯二甲酸二乙酯(dep)、邻苯二甲酸正二丁酯(dbp)、邻苯二甲酸丁基苄基酯(bbp)、邻苯二甲酸二(2-乙基己基)酯(dehp)和邻苯二甲酸正二辛脂(dnop)这6种paes化合物列为优先控制的污染物,而我国也把其中3种paes单体(dep、dbp、dnop)列为了优先控制的环境污染物。
目前,国内对paes的研究主要包括:paes的含量测定、paes的污染状况、paes的检测方法、毒性和毒理学试验、paes的微生物降解等,较少涉及到降解paes的基因分析。
技术实现要素:
本发明的目的是为了克服现有技术的不足,提供一种从牛血清中分离高纯度牛血清白蛋白的方法。
本发明的第一个目的是提供一种微生物培养用无机盐的组合物。
本发明的第二个目的是提供所述组合物作为或制备培养基中的应用。
本发明的第三个目的是提供一种微生物的培养基。
本发明的第四个目的是提供一种检测微生物降解/利用某种目标含碳化合物的能力的方法。
本发明的第五个目的是提供一种检测枯草芽孢杆菌降解/利用苯二甲酸酯能力的方法。
本发明的第六个目的是提供一种枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关蛋白或基因的研究样本的制备方法。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
一种微生物培养用无机盐的组合物,包括nacl、k2hpo4·3h2o、nh4cl和mgso4·7h2o,其质量比为0.91~1.09:0.91~1.09:0.491~0.509:0.391~0.409。
优选地,包括nacl、k2hpo4·3h2o、nh4cl和mgso4·7h2o的质量比为1:1:0.5:0.4。
所述组合物作为或制备微生物培养基中的应用。
优选地,微生物为枯草芽孢杆菌。
一种微生物的培养基,含有所述组合物。
优选地,每升培养基中含有所述无机盐组合物0.91~1.09g。
优选地,每升培养基中含有所述无机盐组合物2.9g。
优选地,还含有碳源。
优选地,所述碳源为葡萄糖。
优选地,所述培养基中含有所述组合物和0.3871~0.3889g/l葡萄糖,ph7.2~7.4。
优选地,所述培养基中含有所述组合物和0.388g/l葡萄糖,ph7.2~7.4。
最优选地,所述培养基中含1g/lnacl+1g/lk2hpo4·0.5g/l3h2o+nh4cl+0.4g/l+mgso4·7h2o+0.388g/l葡萄糖,ph7.2~7.4。
优选地,所述碳源为邻苯二甲酸酯。
优选地,所述碳源为dbp(邻苯二甲酸正二丁酯)和/或dehp(邻苯二甲酸二(2-乙基己基)酯)。
优选地,所述培养基中含有所述组合物和99.91~100.09g/ldbp+99.91~100.09g/ldehp,ph7.2~7.4。
更优选地,所述培养基中含有所述组合物和0.1g/ldbp+0.1g/ldehp,ph7.2~7.4。
最优选的,所述培养基中含有1g/lnacl+1g/lk2hpo4·0.5g/l3h2o+nh4cl+0.4g/l+0.1g/ldbp+0.1g/ldehp,ph7.2~7.4。
一种检测微生物降解/利用目标含碳化合物的能力的方法,其特征在于,利用所述培养基培养待测微生物,根据待测微生物的生长情况判断其对目标含碳化合物的降解/利用能力,其中所述培养基中的碳源包括目标含碳化合物。
优选地,所述微生物为枯草芽孢杆菌,目标含碳化合物为邻苯二甲酸酯。
一种检测枯草芽孢杆菌降解/利用苯二甲酸酯能力的方法,利用所述含有邻苯二甲酸酯培养基培养枯草芽孢杆菌,根据枯草芽孢杆菌的生长情况判断其对苯二甲酸酯的降解/利用能力。
优选地,包括以下步骤:
s11.预培养枯草芽孢杆菌;
s12.利用所述培养基培养枯草芽孢杆菌;
s13.检测培养的枯草芽孢杆菌的生长情况。
一种枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关蛋白或基因的研究样本的制备方法,包括以下步骤:
s21.预培养枯草芽孢杆菌;
s22.利用所述含有邻苯二甲酸酯培养基培养枯草芽孢杆菌,取对数生长期的菌液,离心后-80℃保存。
优选地,邻苯二甲酸酯的用量为0.1g/ldbp+0.1g/ldehp。
优选地,利用测定生长曲线检测枯草芽孢杆菌的生长情况,判断对数生长期限。
优选地,利用紫外分光光度法绘制生长曲线检测。
优选地,利用紫外分光光度法测定波长为600nm的吸光度绘制生长曲线。
优选地,预培养枯草芽孢杆菌的方法为:将保存的枯草芽孢杆菌接种至lb固体培养基上,在29~31℃恒温箱下培养10~24h进行活化;挑取活化后的枯草芽孢杆菌至lb液体培养基中,在145~160r/min,30℃的摇床下培养10~12h。
优选地,测定生长曲线的方法为:将预培养的枯草芽孢杆菌与45~55体积的所述培养基混合,进行培养,分别在不同的时间点,采用波长为600nm的紫外分光光度计测定其光度值,即od600,以od600为纵坐标,培养时间为横坐标,绘制其生长曲线,确定其对数生长期。
优选地。所述不同时间点为0、2、6、10、13、14、28、30、36h中的一个或几个。
最优选地,包括以下步骤:
s21.预培养枯草芽孢杆菌,将保存的枯草芽孢杆菌接种至lb固体培养基上,在30℃恒温箱下培养24h进行活化;挑取活化后的枯草芽孢杆菌至lb液体培养基中,在160r/min,30℃的摇床下培养12h;
s22.将预培养的枯草芽孢杆菌与50倍体积的所述含有邻苯二甲酸酯培养基混合,160r/min、30℃震荡进行培养,分别在0、2、6、10、13、14、28、30、36h时,采用波长为600nm的紫外分光光度计测定其光度值,即od600,以od600为纵坐标,培养时间为横坐标,绘制其生长曲线,确定其对数生长期,取对数生长期的菌液,10000r/min,4℃的条件下离心2min,去除上清液后在-80℃进行液氮速冻保存。
与现有技术相比,本发明具有如下有益效果:
(1)本发明提供了一种无机盐培养基,无机盐培养基为无色透明液体,克服了无机盐配方不溶解而影响后期光度值测定的问题,为筛选各种碳源能否被微生物利用,及能利用不同碳源的微生物提供了基础。
(2)本发明提供的枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关蛋白或基因的研究样本的制备方法,准确有效,制备得到的样品中参与paes代谢表达量变化明显,有利于进行下一步的研究。
附图说明
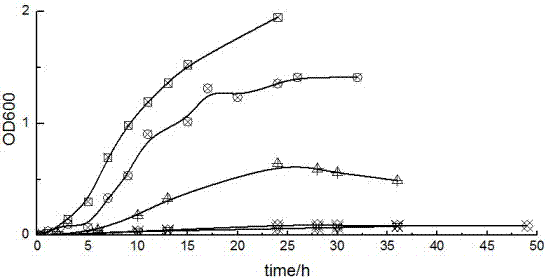
图1为菌株的生长曲线;□代表菌株在含100ppmdbp和100ppmdehp的无机盐培养基中的生长曲线;○代表菌株在含与100ppmdbp和100ppmdehp等碳量的葡萄糖无机盐培养基中的生长曲线;δ代表菌株在lb液体培养基中的生长曲线;◇代表菌株在含丙酮的无机盐培养基中的生长曲线;
图2为bacillussubtilis基因组圈图。
图3为cog功能注释分布图。
图4为go数据库注释菌株生物学功能途径分布。
图5为kegg数据库注释菌株生物代谢途径分布。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1一种微生物的培养基
一、配方
nacl1g、k2hpo4·3h2o1g、nh4cl0.5g、mgso4·7h2o0.4g、溶解于蒸馏水1l,ph7.2~7.4。
二、配制方法
上述无机盐溶解度较低,溶解时应在一种物质完全溶解后再添加下一种物质进行溶解。
实施例2一种微生物的培养基
一、配方
nacl0.91g、k2hpo4·3h2o1.09g、nh4cl0.509g、mgso4·7h2o0.391g、溶解于蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例3一种微生物的培养基
一、配方
nacl1.09g、k2hpo4·3h2o0.91g、nh4cl0.491g、mgso4·7h2o0.409g、溶解于蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例4一种微生物的培养基
一、配方
nacl1g、k2hpo4·3h2o1g、nh4cl0.5g、mgso4·7h2o0.4g、葡萄糖0.388g、蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例5一种微生物的培养基
一、配方
nacl0.91g、k2hpo4·3h2o1.09g、nh4cl0.491g、mgso4·7h2o0.409g、葡萄糖0.3871g、蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例6一种微生物的培养基
一、配方
nacl1.09g、k2hpo4·3h2o0.91g、nh4cl0.509g、mgso4·7h2o0.391g、葡萄糖0.3889g、蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例7一种微生物的培养基
一、配方
nacl1g、k2hpo4·3h2o1g、nh4cl0.5g、mgso4·7h2o0.4g、dbp0.1g、dehp0.1g、蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例8一种微生物的培养基
一、配方
nacl1.09g、k2hpo4·3h2o0.91g、nh4cl0.509g、mgso4·7h2o0.391g、dbp0.1009g、dehp0.9991g、蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例9一种微生物的培养基
一、配方
nacl0.91g、k2hpo4·3h2o1.09g、nh4cl0.491g、mgso4·7h2o0.391~0.409g、dbp0.9991g、dehp0.1009g、蒸馏水1l,ph7.2~7.4。
二、配制方法
同实施例1。
实施例10枯草芽孢杆菌的预培养
一种枯草芽孢杆菌的预培养方法,包括以下步骤:
s1.lb固体培养基平板的制备
lb固体培养基的配方为:胰蛋白胨10g、酵母提取物5g、nacl10g、琼脂18g、蒸馏水1l,ph7.2~7.4,经高压蒸汽灭菌锅在121℃下灭菌21min。
玻璃培养皿在160℃的干热灭菌箱上灭菌2h。灭菌后将玻璃培养皿和lb固体培养基转移至超净工作台,待玻璃培养皿冷却至室温和lb固体培养基冷却至50℃时,在酒精灯附近倒约20mllb固体培养基至玻璃培养皿中。
s2.第一次接种
用锡纸包裹从冰箱拿出装有枯草芽孢杆菌的离心管,待温度上升至室温后,转移至超净工作台。在酒精灯旁用烧灼冷却后的接种环蘸取少量菌液在s1配制的平板中划线,后倒置存放于30℃的恒温箱培养24h进行活化。
s3.lb液体培养基的配制
lb液体培养基的配方为:胰蛋白胨10g、酵母提取物5g、nacl10g、蒸馏水1l,ph7.2~7.4,量100ml上述培养基进250ml锥形瓶,封上锡纸,经高压蒸汽灭菌锅在121℃下灭菌21min。
灭菌后转移至超净工作台,待其冷却至室温。
s4.第二次接种
在酒精灯旁用烧灼冷却后的接种环挑取活化后的枯草芽孢杆菌至lb液体培养基中,封上封口膜,在160r/min,30℃的摇床下培养12h,制备得到枯草芽孢杆菌悬浊液,完成预培养。
实施例11枯草芽孢杆菌对降解邻苯二甲酸酯及下生长曲线的测定
一、实验操作
s1.paes母液配制
用丙酮将dbp和dehp稀释至10000ppm,dbp和dehp的浓度分别为5000ppm。
s2.培养基的配制
配制含有无机盐组合物的培养基12瓶,每瓶100ml,置于250ml锥形瓶中,分别标签a1、a2、a3、b1、b2、b3、c1、c2、c3、d1、d2、d3。
其中a1、a2、a3为利用上一步的paes母液配制的实施例7所述培养基;
b1、b2、b3为实施例4所述培养基+2ml丙酮/瓶;
c1、c2、c3为实施例1所述培养基+2ml丙酮/瓶;
d1、d2、d3为实施例4所述培养基;
e1、e2、e3为lb液体培养基。
配制好的培养基,封上锡纸,经高压蒸汽灭菌锅在121℃下灭菌21min,后转移至超净工作台,待其冷却至室温。
s3.测定生长曲线
在超净工作台中用灭菌后的移液枪吸取1ml实施例10制备的枯草芽孢杆菌悬浊液至上述培养基,封上封口膜后在160r/min、30℃的摇床上分别培养0、2、6、10、13、14、28、30、36h,采用波长为600nm的紫外分光光度计测定其光度值,即od600,,以od600为纵坐标,培养时间为横坐标,利用origin软件绘制其生长曲线,确定其对数生长期。
二、实验结果
枯草芽孢杆菌在含100ppmdbp和100ppmdehp同等碳量的葡萄糖、2ml丙酮和无机盐培养基下生长曲线的测定是为了对比枯草芽孢杆菌在邻苯二甲酸酯胁迫下生长时基因表达的异同;枯草芽孢杆菌在含2ml丙酮和无机盐的培养基下生长曲线的测定是为了判断该菌是否能以丙酮为碳源和能源;枯草芽孢杆菌在无机盐培养基下生长曲线的测定是为了判断该菌能否在只含有无机盐培养基中生长繁殖。
如图1所示:枯草芽孢杆菌不能以丙酮为碳源和能源,枯草芽孢杆菌在只含有无机盐的培养基无法生长繁殖;枯草芽孢杆菌在100ppmdbp和100ppmdehp胁迫下生长的对数生长期为:5-10h;在同等碳量的葡萄糖下生长的对数生长期为:5-10h;枯草芽孢杆菌lb液体培养基中对数生长期5-15h。
因此,选择枯草芽孢杆菌在含100ppmdbp、100ppmdehp和无机盐培养基生长作为实验组来研究基因表达的异同,在含有葡萄糖和无机盐培养基生长作为对照组。
同时,利用本发明提供的培养基可以验证枯草芽孢杆菌对于苯二甲酸酯的降解作用。
实施例12一种枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关蛋白或基因的研究样本的制备方法
一、实验操作
s1.paes母液配制
同实施例8。
s2.培养基的配制
配制实施例7所述培养基,分装到3个250ml锥形瓶中,每个锥形瓶100ml,分别标签为:a1、a2、a3;
配制实施例4所述培养基,分装到3个250ml锥形瓶中,每个锥形瓶100ml,分别标签为:b1、b2、b3;
配制lb液体培养基,分装到3个250ml锥形瓶中,每个锥形瓶100ml,分别标签为:e1、e2、e3。
配制好的培养基封上锡纸,经高压蒸汽灭菌锅在121℃下灭菌21min,后转移至超净工作台,待其冷却至室温。
s3.枯草芽孢杆菌的培养在超净工作台中用灭菌后的移液枪吸取实施例10制备的2ml枯草芽孢杆菌悬浊液至上述培养基,封上封口膜后在160r/min、30℃的摇床上培养,a培7h,b培养7h,e培养10h,至其对数生长期,后分别将200ml上述悬浊液分四份于100ml离心管中,在10000r/min,4℃的条件下离心2min,去除上清液后在-80℃进行液氮速冻保存。
s4.将a、b样本送去公司进行转录组测序,e样本送去公司进行全基因组测序。
二、实验结果
1、全基因组测序结果与分析
(1)bacillussubtilis基因组组装结果分析
经过测序,共获得4149636bp大小的数据,对基因组进行大约100×的深度测序。利用soapdenovo软件对所测数据进行简单组装,得到一个scaffolds。构建枯草芽孢杆菌的不同文库,进行illuminahiseq测序,构建的illuminape文库,共完成测序反应9824852次,获得序列1473727800bp;构建的pacbio文库(20kb),共完成测序反应167580次,获得序列1556901687bp,平均插入片段长度9290bp。将通过两种不同手段的到的结果进行过滤、整合分析后如下表1所示。结合二者拼装结果,最后得到一条大小为4149636bp的序列,gc含量为43.70%。
表1基因组拼装数据统计:
(2)bacillussubtilis基因组的基本特征
此细菌的基因组长度为4149636bp,蛋白编码序列(codingsequence,cds)共有4344个,gc百分含量为43.70%,基因的平均长度为852bp,编码基因的序列占整个基因组序列的89.20%。dna上无遗传效应的片段即基因间区的长度为447642bp,对于枯草芽孢杆菌基因预测统计结果如下表2所示。
表2基因信息统计表:
(3)bacillussubtilis全基因组圈图
如图2所示,圈图的最外面一圈为基因组大小的标识,每一个刻度为0.5mp;第二圈和第三圈为正链、负链上的cds,不同的颜色表示cds不同的cog的功能分类;第四圈为rrna和trna;第五圈为gc含量,向外的红色部分表示该区域gc含量高于全基因组平均gc含量,峰值越高表示与平均gc含量差值越大,向内的蓝色部分表示该区域gc含量低于全基因组平均gc含量,峰值越高表示与平均gc含量差值越大;最内一圈为gcskew值,具体算法为g-c/g+c,在生物意义上该值为正值时正链越更倾向于转录cds,为负值时负链更倾向于转录cds。
2、.生物信息学分析
(1)基因的功能注释
将根据测序结果得到的预测基因的蛋白序列分别与nr、genes、eggnog和go数据库进行blastp比对(blast2.2.28+),因此得到这些预测基因的注释信息。总注释结果统计如表3所示。对注释结果分析,菌株中寻找到4344个orfs。其中4308个orfs使用blastp比对nr数据库得到了注释,3920个orfs在swiss-prot数据库比对中得到基因注释。在cog数据库中注释到了2844个同源蛋白簇,但有617个无人工校正的同源蛋白簇。在kegg基因数据库中有1975个基因没有得到相应基因参与的具体生物学通路,在go数据库中比对,共有1419个基因未得到注释结果。
表3注释结果统计:
(2)cog分析
如图2所示:通过预测可知枯草芽孢杆菌全基因组中共包含了3461个具有功能的蛋白质,占编码蛋白总数的79.67%。将该菌编码的所有蛋白与co蛋白数据库进行blastp比对,结果共有25个分类。如图3所示:其中有717个unigene归为未知功能(functionunknown),占据了最高的比例,为20.72%。其次是321个注释为仅一般功能预测(generalfunctionpredictiononly)比例为9.27%。再次是295个是氨基酸的转运与代谢(aminoacidtransportandmetabolism)所占比例为8.52%。碳水化合物转运和新陈代谢(carbohydratetransportandmetabolism)所占比例为7.86%,一共有272个unigene。同时,还发现一些所占比例比较小的unigene。
(3)go分析
图4为该菌的go注释结果,一共注释了2915个序列,其中与细胞组件相关的go注释结果有5290个,约占总体的32.67%;与生物进程相关的go注释结果有7335个,约占总体的45.30%;与分子功能相关的go注释结果有3566个,约占总体的22.02%。从图4上分析生物过程注释结果,可鉴定到的基因分为13类,细胞过程(cellularprocess)所占比例最高,为61.68%,其次是代谢过程(metabolicprocess),所占比例为57.27%。另外单细胞过程(single-organismprocess)、定位(localization)、生物过程的调节(regulationofbiologicalprocess),所占比例分别为50.87%、15.86%、14.77%。还有低比例的生物粘附和生殖过程的基因也被鉴定到。根据分子组件注释结果,可鉴定到的基因分为18类,这些基因参与最多的就是细胞(cell),所占比例为48.10%,其次是细胞的组件(cellpart),占的比例是47.76%。另外有关细胞构造的膜(membrane)、膜组件(membranepart)所占的比例为36.03%、32.10%。还有少数是关于细胞膜的组成成分。分析到的关于分子功能注释结果是鉴定到的基因分为13类,它们主要的是催化活性(catalyticactivity)(54.39%)和结合功能(binding)(44.38%);其次分别是转运活性(transporteractivity)(10.22%)、核酸结合转录因子活性(nucleicacidbindingtranscriptionfactoractivity)(4.89%)、结构分子活性(structuralmoleculeactivity)(2.12%)和分子传感活性(signaltransduceractivity)(1.50%);此外,还有基因表现出d-丙氨酰载体活性和营养储藏活性等。
(4)kegg代谢通路分析
将unigene比对到kegg数据库之后我们得到了kegg注释信息和pathway代谢途径注释,在所有的基因序列中共有2279成功的得到了kegg注释,并且对比到了185个pathway路径中。如图5所示,在这185个通路中,分布比例最高的分别是代谢途径(metabolicpathways)、次级代谢产物的生物合成(biosynthesisofsecondarymetabolites)、不同环境中的微生物代谢(microbialmetabolismindiverseenvironments),所占据的比例分别是25.67%、12.46%和7.46%。
3、邻苯二甲酸酯讲解基因的预测
根据样本中蛋白的表达变化,本研究发现参与paes代谢的关键酶包含酯酶、双加氧酶还原酶、脱氢酶、脱羧酶、通透酶、d-半乳糖酸转运蛋白等。并筛选出了可能的双加氧酶、酯酶等相关降解酶,在表4中包含了这些蛋白id、序列长度、相似度、基因片段代码等。根据生物信息分析结果推测pcac是原儿茶酸代谢途径相关的基因簇。
表4邻苯二甲酸酯降解相关酶的预测:
结果说明本发明提供的枯草芽孢杆菌中降解/利用邻苯二甲酸酯的相关蛋白或基因的研究样本的制备方法,准确有效,制备得到的样品中参与paes代谢表达量变化明显,有利于进行下一步的研究。
- 还没有人留言评论。精彩留言会获得点赞!