一种突变型KRAS特异性抗体及其制备方法与流程
本发明涉及分子生物学领域,具体涉及一种突变型kras特异性抗体及其制备方法。
背景技术:
ras基因广泛存在于各种真核生物中,具有重要的生理功能,其最早是在鼠肉瘤病毒的子代基因中发现的。哺乳动物的ras基因家族中有hras,kras和nras三个成员,与肿瘤的发生密切相关,其中kras的影响最大。kras基因定位在12号染色体上,编码相对分子质量约为2.1kd的蛋白质。kras蛋白又称为p21,具有gtp水解酶活性,是人类表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)信号传导通路中的重要信号分子。kras基因突变后编码的异常蛋白不受上游egfr信号调控,持续激活传导通路的级联反应,刺激细胞的异常增殖与分化,从而导致肿瘤的发生。
kras突变发生在多种恶性肿瘤中。大约90%的胰腺癌、30%-60%的结直肠癌、约50%的甲状腺癌、约30%的肺癌、约15%的卵巢癌中存在kras突变,且常发生在肿瘤早期阶段;另外,膀胱癌、乳腺癌、肝癌、肾癌及部分类型的血液系统肿瘤等肿瘤中均有较高的kras基因突变水平。kras热点突变位点为第12和13位密码子,包括7种主要的突变类型:g12d、g12a、g12v、g12s、g12r、g12c以及g13d。其中g12d为最常发生的突变类型之一,其第12位的甘氨酸(glycine,g)突变替换成天冬氨酸(asparticacid,d),相应蛋白质编码区的第35个碱基由g突变为a。
egfr为ras-raf-mapk信号通路的上游调控分子,以egfr为靶点的药物可阻断下游信号传导,抑制肿瘤新生血管的形成,从而抑制肿瘤的生长、侵袭和转移。由于突变型kras蛋白并不受上游egfr信号的调控,因而肿瘤患者kras基因是否存在突变会显著影响抗egfr靶向药物的治疗效果。目前,kras基因突变检测已被美国国家癌症综合网络(nationalcomprehensivecancernetwork,nccn)列入结直肠癌临床治疗用药的必检项目,在决定是否予以抗egfr靶向药物治疗之前,患者首先应进行kras基因突变检测。若患者存在kras突变,则不建议予抗egfr靶向治疗药物。因此,检测组织或外周血中kras基因是否存在突变对指导癌症患者的临床用药具有重要作用。
由于g12d为kras最常见的突变类型之一,因此我们针对该突变类型制备了相应的单克隆抗体,对kras基因突变检测和指导患者临床用药均具有重要价值。
目前对kras突变的检测方法主要有直接测序法(dnasequencing),实时荧光定量pcr(real-timequantitativepcr),等位基因特异性寡核酸杂交(allelespecificoligoneucliotides,aso),限制性片段长度多态性(restrictionfragmentlengthpolymorphism,rflp)分析,变性高效液相色谱法(denaturinghigh-performanceliquidchromatograph,dhplc),高分辨溶解曲线分析(high-resolutionmeltingcurveanalysis,hrma)等方法。直接测序法是检测基因突变的金标准,费用较低,但是操作繁琐耗时,且灵敏度不高,样本突变率需达20-30%时才能被检出,不适合临床大样本检测。pcr-rflp联合了pcr技术、pflp分析及电泳方法,虽具有较高的灵敏度(0.1%),但操作复杂且需要测序验证,应用受限。dhplc的灵敏度在5%左右,但检测过程易污染,且最终仍需测序确认。hrma基于核酸的物理性质,灵敏度在5%左右,但对于阳性结果并不能确认其具体突变位点,需要测序进行验证。这些检测方法多基于pcr技术,从核酸层面进行检测。而市面上暂无针对突变型kras的单克隆抗体,因而无法从蛋白层面进行直接检测,包括通过免疫组化、免疫荧光、流式细胞术、蛋白免疫印迹等方法。
技术实现要素:
因此,本发明提供了一种突变型kras特异性抗体及其制备方法,也就是一种特异性识别krasg12d突变型蛋白的单克隆抗体及其制备方法。利用本发明的制备方法制备出的单克隆抗体能够特异性识别krasg12d突变型蛋白,从而可以在蛋白层面为kras突变的检测提供技术支持。
为实现本发明的目的,本发明提供了如下技术方案:
一种单克隆抗体,其特征在于,其特异性识别如seqidno:4所示氨基酸序列的krasg12d突变型蛋白,或者特异性识别含有seqidno:4所示氨基酸序列的多肽。
该单克隆抗体特异性优先结合krasg12d突变型蛋白或多肽,与krasg12d突变型蛋白结合效率达100%,而与野生型kras蛋白的结合效率<50%。
该单克隆抗体特异性识别的kras突变型蛋白为:第12位的甘氨酸(glycine,g)被替换为天冬氨酸(asparticacid,d),相应蛋白质编码区的第35个碱基由g突变为a。
进一步地,该单克隆抗体为一种分泌性糖蛋白,由一个或多个y形的特异性结构组成;每一个y形的特异性结构由2条完全相同的多肽重链和2条完全相同的多肽轻链通过二硫键连接而成。
该单克隆抗体,包括抗原结合部位,是一种鼠源性抗体。在一些方案中,该单克隆抗体是igg1或igg2a。
一种单克隆抗体的制备方法,包括如下步骤:
(1)获得kras35g>a蛋白质编码区的基因序列,如seqidno:2所示;
(2)制备免疫原;如seqidno:4所示氨基酸序列的krasg12d突变型蛋白;
(3)免疫动物,进行细胞融合获得杂交瘤细胞;
(4)初步筛选,获得分泌特异性识别krasg12d突变型蛋白的单克隆抗体的杂交瘤细胞株;
(5)二次筛选,进一步获得分泌特异性识别krasg12d突变型蛋白的单克隆抗体的杂交瘤细胞株;
(6)培养杂交瘤细胞,获得单克隆抗体。
进一步地,还包括如下步骤:
(7)小鼠腹腔内接种杂交瘤细胞,实现单克隆抗体的定量生产。
进一步地,还包括如下步骤:
(8)单克隆抗体的纯化与活性测定。
进一步地,步骤(1)中,由seqidno:1所示基因序列通过定点突变,获得kras35g>a蛋白质编码区的基因序列。
进一步地,步骤(2)中,免疫动物选择6-8周龄雌性balb/c小鼠。
进一步地,步骤(4)中,通过竞争抑制elisa检测杂交瘤细胞的培养上清进行初次筛选;步骤(5)中,通过westernblot检测培养上清进行二次筛选。
进一步地,步骤(4)中,由氨基酸序列为seqidno:3的kras野生型重组融合蛋白进行阻断,筛选出未被明显阻断的单克隆抗体的杂交瘤细胞株。
一种上述的单克隆抗体作为恶性肿瘤检测试剂的应用。
本发明的有益效果在于:
本发明提供了一种特异性识别krasg12d突变型蛋白的单克隆抗体、分泌该单克隆抗体的杂交瘤细胞株及其制备方法。利用本发明的方法制备出的单克隆抗体能够特异性结合krasg12d突变型蛋白,而不结合野生型kras蛋白(在某种程度上),因而能够区分g12d突变型和其他突变类型及野生型人kras蛋白,可作为一种krasg12d突变的检测试剂。
由于抗体是一种分泌性的糖蛋白,是能与相应抗原以高亲和力结合的有用试剂。通过对抗体进行不同的标记和修饰,可使其应用于多种检测方法,更方便得定位与分析抗原,是一种理想的简便、快速又价廉的检测方法。
因此相对于现有的各种基于pcr技术检测kras突变的方法,本发明所述的单克隆抗体在蛋白层面为kras突变的检测提供了有力的技术支持。该检测特性可通过各种常见的检测方法来实现,包括elisa,westernblot,流式细胞术,免疫组织化学,免疫荧光及免疫共沉淀等,应用广泛且便捷,具有极大的临床和科研价值。
附图说明
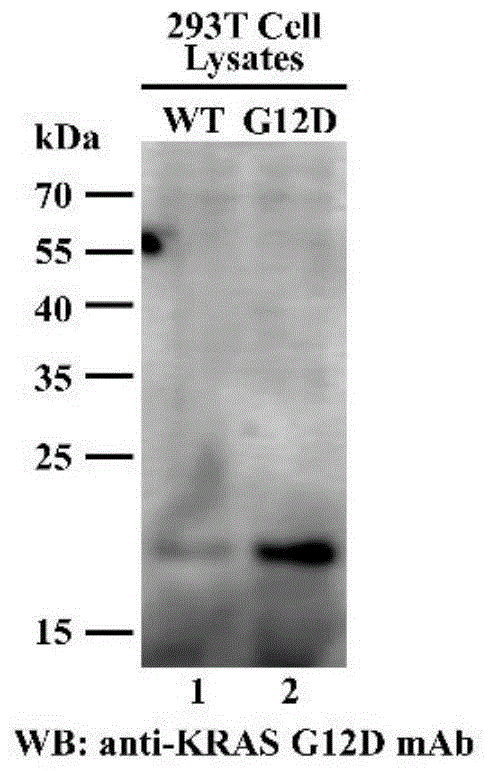
图1是westernblot检测krasg12d突变型单克隆抗体的特异性结果图。泳道1为表达野生型kras蛋白的293t细胞的裂解液,泳道2为过表达g12d突变型kras蛋白的293t细胞的裂解液。图中的“wb∶anti-krasg12dmab”的中文含义即为:westernblot检测krasg12d突变型单克隆抗体的特异性。wb即为westernblot的简称;“293tcelllysates”的中文含义即为293t细胞的裂解液。
图2是直接elisa法测定krasg12d突变型单克隆抗体滴度的结果图。
图3是直接elisa法测定hrp标记的krasg12d突变型单克隆抗体滴度的结果图。
具体实施方式
下面对本发明做进一步详细的阐述。
本发明的目的是提供一种特异性识别krasg12d突变型蛋白的单克隆抗体及其制备方法。利用本发明方法制备出的单克隆抗体能够特异性识别krasg12d突变型蛋白(结合效率达100%,而与野生型kras蛋白的结合效率<50%)。
在本发明中,
(1)根据krasg12d的突变情况(蛋白质编码区的第35个碱基由g突变为a),可以设计特异性定点突变引物,通过定点突变技术,将已有的野生型kras序列(seqidno:1)突变为kras35g>a序列(seqidno:2)。
(2)根据seqidno:2所示序列,可以设计一对特异性pcr引物,构建重组表达载体pet28a-krasg12d,转化大肠杆菌rosetta感受态细胞,通过iptg诱导原核蛋白表达并进行纯化,从而得到krasg12d突变型抗原。
(3)以上述krasg12d突变型抗原为免疫原,免疫balb/c小鼠,采用经典细胞融合技术制备krasg12d突变型单克隆抗体。
(4)采用竞争抑制酶联免疫吸附试验(elisa),利用kras野生型重组融合蛋白进行阻断反应,筛选出未被阻断的单克隆,从而获得分泌特异性识别krasg12d突变型蛋白的单克隆抗体的杂交瘤细胞株;
(5)通过蛋白免疫印迹(westernblot)进行二次筛选,以真核细胞表达的kras野生型蛋白和krasg12d突变型蛋白作为筛选抗原,筛选获得特异性优先结合krasg12d突变型蛋白的单克隆抗体及其相应的杂交瘤细胞株。
(6)于balb/c小鼠腹腔内接种筛选获得的杂交瘤细胞,诱导腹水的生成,从而实现单克隆抗体的定量生产。
(7)收集腹水单抗,进行沉淀及纯化,直接elisa法测定纯化抗体的滴度。
本发明提供的杂交瘤细胞株haml0430(2f8-6-9)(保藏于浙江大学医学院附属第二医院消化实验室)产生的单克隆抗体,包括重链可变区和轻链可变区,该重链可变区和轻链可变区共同决定了该单克隆抗体的特异性。
本发明的单克隆抗体为一种鼠源性抗体。在某些操作实例中,这种单克隆抗体是igg1或igg2a。
本发明提供的一种生产特异性优先结合krasg12d突变型蛋白的单克隆抗体的方法,其步骤可以包括:在适当条件下培养本发明中提到的杂交瘤细胞株,通过体外或者体内途径,获得相应的单克隆抗体并进行纯化。
本发明提供该单克隆抗体作为恶性肿瘤检测试剂的应用。利用该单克隆抗体作为恶性肿瘤检测试剂进行抗原检测。在一些应用实例中,本发明提供了一种癌症检测方法(例如胰腺癌、结直肠癌、肺癌、甲状腺癌、胆管癌、肝癌、肾癌、膀胱癌等),其主要步骤包括:利用本发明提供的单克隆抗体接触来自待检测患者的生物学样本;检测抗体与样本是否结合;若抗体与样本存在结合则指示癌症、发展成癌症的风险或者相对较差的预后。
在另外的应用实例中,本发明为恶性肿瘤患者(例如胰腺癌、结直肠癌、肺癌等)治疗方案的选择提供了指导作用。
下面详细解释本发明的一些术语:
一、kras:
本专利所描述的kras基因是来自哺乳动物ras基因家族(包括kras,nras和hras),其编码的蛋白质为小gtp酶超家族的成员,具有gtp水解酶活性,又称为p21。
野生型kras基因的蛋白质编码区序列见seqidno:1。
野生型kras蛋白的氨基酸序列见seqidno:3。
kras蛋白为egfr信号传导通路中的重要下游分子,参与细胞生长的调节。kras基因突变后导致持续的细胞增殖,是肿瘤发生的关键要素。其中kras有7种主要的突变类型:g12d、g12a、g12v、g12s、g12r、g12c以及g13d。
kras蛋白的突变形式包括一个或多个氨基酸的插入、删除或替换等。本专利中描述的rkasg12d突变是指第12位的甘氨酸(glycine,g)被替换为天冬氨酸(asparticacid,d)。
krasg12d突变型基因的蛋白质编码区序列见seqidno:2。
krasg12d突变型蛋白质的氨基酸序列见seqidno:4。
二、抗体与抗原结合部位:
本发明包括特异性优先结合krasg12d突变型蛋白的单克隆抗体。该单克隆抗体是一种分泌性糖蛋白,由一个或多个y形的特异性结构组成。每一个y形的特异性结构由4条多肽链,即2条完全相同的多肽重链(h链,大约50-70kda)和2条完全相同的多肽轻链(l链,大约25kda)通过二硫键连接而成。其中轻链有λ和κ两种类型,而重链可分为μ、δ、γ、α、ε五种类型,不同的重链和轻链共同决定了抗体的类型(igm、igd、igg、iga或者ige)。
每条重链(h)大约由440个氨基酸组成,可分为可变区(vh)和恒定区(ch),其中ch由ch1、ch2和ch3组成。每条轻链(l)大约由220个氨基酸组成,同样分为可变区(vl)和恒定区(cl),轻链恒定区只有一个结构域cl。一条重链和一条轻链的可变区结合形成一个抗原结合部位,可变区的不均一性是存在多种抗原结合部位的结构基础。其中,在可变区中存在一些由5-10个氨基酸组成的高变区,也称为互补决定区(complementaritydeterminingregions,cdrs),是与抗原真正结合的部位。
三、krasg12d突变型单克隆抗体的结合特异性:
本发明的单克隆抗体能够特异性优先结合krasg12d突变型蛋白,与其结合效率达100%,而与kras野生型蛋白的结合效率<50%。因此该抗体能够区分g12d突变型和其他突变类型及野生型人kras蛋白。该结合特异性可通过相应的检测手段进行确认,比如酶联免疫吸附试验(elisa)、免疫印迹实验(westernblot)、免疫组织化学染色、免疫荧光、流式细胞分选等方法。
四、修饰与标签抗体:
本发明还包括上述抗krasg12d突变型单克隆抗体被至少一种额外分子或基团修饰而成的抗体。该修饰可用于纯化或者增加抗体功能。抗体可与某些检测试剂或标签结合,例如放射性同位素,荧光复合物,酶及生物素等。在一些操作实例中,本发明抗体偶联辣根过氧化物酶,可应用于双抗体夹心elisa检测方法。在另外的操作实例中,本发明抗体可通过亲和素和生物素标记,进一步提高其检测灵敏度。
五、特异性识别krasg12d突变型抗原的单克隆抗体的检测用途:
本发明单克隆抗体可作为一种恶性肿瘤检测试剂,主要适用于胰腺癌、结直肠癌、肺癌、甲状腺癌及卵巢癌等。
该检测用途包括检测肿瘤的进展程度、判断肿瘤分型以及评估可能的预后情况。检测步骤包括:用本发明抗体接触来自待检测患者的生物学样本;检测抗体与样本是否结合;若抗体与样本存在结合则指示癌症、发展成癌症的风险或者相对较差的预后。被检测样本可以是血清、血浆和组织等。
本发明抗体的检测用途可通过常见的检测技术来实现,包括elisa,westernblot,流式细胞术,免疫细胞化学,免疫组织化学,免疫荧光或者免疫共沉淀等。若抗体未被标记,则可使用一种能够结合kras抗体并且能被检测到的二抗或者其他分子。抗体的相互结合需要特定的种类和亚型,由于本发明抗体是一种小鼠igg,因此二抗必须是一种标记的抗小鼠igg的抗体。另外本发明抗体也能用一种可检测的标记物直接标记,例如酶,辅基,荧光材料,发光材料及放射性材料等(见上文描述)。在一些操作实例中,本发明的抗体或者修饰后抗体可提供在具有检测用途的试剂盒中。
本发明抗体还可以为癌症患者的临床用药提供指导。在选择治疗方案之前,检测患者是否存在kras突变对治疗选择具有重要意义。
下面通过一个详细的实施例进一步阐述本发明。但本发明的保护范围并不局限于此。
krasg12d突变型单克隆抗体的获得(即制备方法),包括如下步骤:
1.抗原准备
(1)获得目的基因序列:
根据krasg12d的突变情况(第35个碱基由g突变为a),设计特异性定点突变引物(seqidno:5和seqidno:6)。通过定点突变技术,将已有的野生型kras序列突变为kras(35g>a)序列。测序验证引物序列是否正确。
根据kras蛋白质编码区的序列,设计一对特异性pcr引物(seqidno:7和seqidno:8)。以kras(35g>a)突变型基因序列为模板,pcr扩增突变型kras基因。
(2)构建重组表达载体
将步骤(1)中获得的pcr产物和pet28a表达载体分别进行双酶切(bamhi与hindiii),利用t4dna连接酶进行连接,转化大肠杆菌dh5α感受态细胞,用含有卡那霉素的固体培养基筛选,挑取单个菌落,小量抽提质粒,通过双酶切及琼脂糖凝胶电泳进行初步鉴定。测序验证目的基因的序列及阅读框是否正确。从而构建得到重组表达载体pet28a-krasg12d。
(3)获得含重组表达质粒的表达菌种
将步骤(2)中获得的重组表达质粒分别转化大肠杆菌bl21和rosetta感受态细胞,分别用含有卡那霉素或者卡那霉素与氯霉素的固体培养基筛选,挑取菌落至7ml含有相应抗生素的lb培养基中,37℃震荡培养,待菌液扩增至一定浓度(od值达0.8)后,加入1ml甘油,分装并保存菌种于-80℃。
(4)诱导表达与蛋白纯化
取100ul上述保存的菌种至7ml含有相应抗生素的lb培养基中,37℃震荡培养4-5h后,分别加入不同浓度的iptg(0、0.25、0.5、0.75和1mm)进行诱导表达,于16℃诱导过夜或者37℃诱导4-5h。收取菌液,裂解菌体,分别收集上清和沉淀。
sds-page电泳及考马斯亮蓝染色分析不同诱导条件下的目标蛋白表达浓度,选择最优诱导条件(rosetta感受态细胞,0.5mmiptg,16℃诱导过夜)。
取100ul上述保存的rosetta菌种至7ml含有卡那霉素和氯霉素的lb培养基中,37℃震荡培养4-5h,转接至200ml的大瓶中继续震荡培养4-5h。待菌液扩增至一定浓度后,加入0.5mmiptg,16℃诱导表达过夜。收集菌液,进行包涵体复性,收集并纯化krasg12d突变型蛋白。
2.单抗的制备
(1)免疫动物
选用6-8周龄近交系雌性balb/c小鼠,按预先制定的免疫方法进行四次免疫注射。
首次免疫。将纯化的100ugkrasg12d突变型抗原与等量的弗氏完全佐剂乳化,乳化完成后,通过背部皮下多点注射途径对balb/c小鼠进行基础免疫;
二次免疫。2周后,将纯化的100ugkrasg12d突变型抗原与等量的弗氏不完全佐剂乳化,通过背部皮下多点注射途径对balb/c小鼠进行追加免疫;
三次免疫。2周后,以同样的方式追加免疫1次。
三次免疫后7-10天采血,elisa检测效价,选择效价最高者进行后续细胞融合。
(融合前三天)加强免疫。将纯化的50ugkrasg12d突变型抗原通过腹腔注射至小鼠体内。3天后,取脾脏进行融合。
(2)细胞融合
处死小鼠,于无菌条件下取出脾脏,收获免疫脾细胞,制备脾细胞悬液。收获同系骨髓瘤细胞,将骨髓瘤细胞与小鼠脾细胞按1:5比例混合,加入预热的促融合剂聚乙二醇。在融合剂的作用下,各种淋巴细胞可与骨髓瘤细胞发生融合,形成杂交瘤细胞。采用含hat的选择培养基,筛选培养融合细胞。
(3)杂交瘤细胞的筛选
1)通过竞争抑制elisa检测杂交瘤细胞的培养上清进行初次筛选。
a.纯化的krasg12d突变型抗原(1mg/ml)按1:200比例包被酶标板,每孔100ul,4℃包被过夜。甩掉包被液,以1×tbst缓冲液洗板(洗5次),用10%胎牛血清于37℃封闭1h。取50ul培养上清,加入50ul的krasg12d突变型抗原进行阻断,37℃反应1h;同时取50ul培养上清,加入50ul的10%胎牛血清,37℃反应1h,作为对照。封闭结束后甩掉封闭液,将上述反应后的培养上清加入酶标板中,于37℃孵育1h。甩掉培养上清,洗板,加入酶标抗体,每孔100ul,于37℃孵育1h。甩掉酶标抗体,洗板,加入底物显色液100ul(a液50ul,b液50ul),室温反应5分钟,然后加入100ul终止液。用酶标仪检测450nm波长处的od值,挑选od值与对照孔之间无明显差异的细胞株,即为初次筛选得到的分泌特异性识别krasg12d突变型蛋白的单克隆抗体的杂交瘤细胞株。
b.将筛选得到的阳性杂交瘤细胞株克隆化培养(有限稀释法),获得能产生高效价单克隆抗体的杂交瘤细胞克隆。将杂交瘤细胞株扩大培养,并冻存保种。初次筛选得到15株杂交瘤细胞株,其编号分别为3h7-8-8,5b7-6-9,3b10-4-7,3h7-16-1,5b7-2-4,4h1-1-12,5b7-1-8,2f8-6-9,5b7-6-15,2f8-8-2,5b1-7-1,2f8-2-2,2g2-2-16,2g2-2-9及5b7-4-1。
2)通过westernblot检测培养上清进行二次筛选。
a.利用引物3和引物4,分别以kras(35g>a)和野生型kras为模板进行pcr扩增,将得到的pcr产物和pcdna3.1(-)表达载体分别进行双酶切(bamhi与hindiii),利用t4dna连接酶进行连接,转化大肠杆菌dh5α感受态细胞。用含有氨苄的固体培养基筛选,挑取单个菌落,小量抽提质粒,通过双酶切及琼脂糖凝胶电泳进行初步鉴定。测序验证目的基因的序列及阅读框是否正确。从而构建得到重组表达载体pcdna3.1(-)-krasg12d和pcdna3.1(-)-kraswt。大量抽提质粒,用于后续的细胞转染
b.培养293t细胞,待细胞生长至适宜密度(60%-70%)后,以lipo3000分别转染pcdna3.1(-)-krasg12d和pcdna3.1(-)-kraswt质粒。继续培养48h,收取细胞,裂解得到蛋白样本,进行蛋白定量。
c.在蛋白样本中按2:1比例加入上样缓冲液,沸水浴加热3-5min。配制15%的sds-page凝胶,将变性的蛋白样本直接加至sds-page胶的加样孔中,同时加入蛋白marker以判断蛋白的分子量大小。以60v电压开始电泳,待蛋白样本均进入分离胶后,调节电压为120v,直至电泳结束。裁剪合适大小的pvdf膜,按照滤纸-凝胶-pvdf膜-滤纸的顺序放置凝胶与膜,安装好转膜槽,置于冰水浴中进行转膜,调节转膜电流为280ma,转膜时间为90min。转膜结束后,将膜取出,于tbst溶液中漂洗1-2min,然后放入5%脱脂奶粉中,于摇床上缓慢摇动,室温封闭1h。将膜取出放入杂交瘤细胞培养上清中,4℃孵育过夜。洗去培养上清(加入tbst溶液,于摇床上缓慢摇动洗涤5min,更换洗涤液,共洗涤5次),加入用5%脱脂奶粉稀释的辣根过氧化物酶(hrp)标记的二抗(抗小鼠igg),室温摇动孵育1h。洗去二抗,利用ecl化学发光检测试剂进行检测分析。筛选出特异性优先结合krasg12d突变型蛋白的单克隆抗体。最后筛选得到一株分泌性能最佳的杂交瘤细胞株,其编号为2f8-6-9。
(4)单克隆抗体的大量制备与纯化
选取6-8周的雌性balb/c小鼠,腹腔注射0.5ml的无菌液体石蜡。2周后,复苏杂交瘤细胞(2f8-6-9),待细胞处于对数生长期时,收集细胞,按1×106/ml的细胞密度,0.5ml/只,进行小鼠腹腔注射。注射后1周起,每日观察小鼠腹腔隆起程度和小鼠生命状态,及时收集腹水。将腹水吸取至1.5ml离心管中,3500rpm,离心10min,分离下层血细胞和上层油脂,收集中间的淡黄色液体,即为含有单克隆抗体的腹水。
配制饱和硫酸铵溶液和10mmph7.4的pbs溶液,于4℃预冷。用pbs溶液稀释腹水,在磁力搅拌下,向稀释后的腹水中缓慢滴加等体积的预冷饱和硫酸铵溶液,滴加完后继续磁力搅拌1min,然后溶液置于4℃,静置15min。重复于磁力搅拌下滴加饱和硫酸铵溶液,滴加完后磁力搅拌1min,将溶液置于4℃,静置15min。9000rpm,4℃,离心10min,去除上清,用2mlpbs溶解沉淀。将抗体溶液转移至透析袋中,4℃,用10mmph7.4的pbs溶液透析。每3h更换1次透析液,共更换6次。
透析结束后,收集单抗溶液,以最大转速(14800rpm),4℃,离心3min,收集上清。按1:200比例加入10%nan3溶液,保存于4℃。
(5)直接elisa法测定krasg12d突变型单克隆抗体的滴度
1)纯化的krasg12d突变型蛋白(1mg/ml)按1:200比例包被酶标板,每孔100ul,4℃过夜。甩掉包被液,洗板,以10%胎牛血清于37℃封闭1h。封闭结束后甩掉封闭液,将纯化的抗体按1:2000、1:4000、1:8000、1:16000、1:32000、1:64000、1:128000、1:256000、1:512000、1:1024000、1:2048000和1:4096000比例进行稀释,分别加入酶标板中,每孔100ul,37℃孵育1h。甩掉上述抗体溶液,洗板,加入酶标抗体,每孔100ul,37℃孵育1h。甩掉酶标抗体,洗板,加入底物显色液100ul(a液50ul,b液50ul),室温反应5分钟,加入100ul终止液。用酶标仪检测450nm波长处的od值。elisa检测结果见图2。
2)用辣根过氧化物酶(hrp)标记krasg12d突变型单克隆抗体:
将纯化后的单抗进行蛋白浓度定量。取50mg的抗体,于4℃,0.01mph9.6cbs溶液中透析过夜。
配制5mg/ml的hrp溶液和0.1mnaio4溶液,在电磁搅拌下,按1:5比例向hrp溶液中滴加0.1mnaio4溶液,可见褐色的hrp溶液逐渐变为墨绿色。避光于室温下继续搅拌20min,将溶液转至透析袋中,于1mmph4.4naac溶液中,4℃透析过夜。
将透析后的抗体与透析后的hrp溶液按1:1.2比例混合,室温下避光搅拌2h。向混合溶液中加入新配制的nabh4溶液(4mg/ml),混匀,于4℃避光搅拌2h。用饱和硫酸铵溶液进行沉淀,pbs溶液透析,收集纯化后的抗体。
直接elisa法测定hrp修饰后krasg12d突变型单克隆抗体滴度。纯化的krasg12d突变型蛋白(1mg/ml)按1:200比例包被酶标板,每孔100ul,4℃过夜。甩掉包被液,洗板,以10%胎牛血清于37℃封闭1h。封闭结束后甩掉封闭液,将纯化的hrp修饰抗体按1:50、1:100、1:200、1:400、1:800、1:1600、1:3200和1:6400比例进行稀释,加入酶标板中,每孔100ul,37℃孵育1h。甩掉上述抗体,洗板,加入底物显色液100ul(a液50ul,b液50ul),室温反应5分钟,加入100ul终止液。用酶标仪检测450nm波长处的od值。elisa检测结果见图3。
综上,本发明提供了一种特异性识别krasg12d突变型蛋白的单克隆抗体、分泌该单克隆抗体的杂交瘤细胞株及其制备方法。利用本发明的方法制备出的单克隆抗体能够特异性结合krasg12d突变型蛋白,而不结合野生型kras蛋白(在某种程度上),因而能够区分g12d突变型和其他突变类型及野生型人kras蛋白,可作为一种krasg12d突变的检测试剂。
由于抗体是一种分泌性的糖蛋白,是能与相应抗原以高亲和力结合的有用试剂。通过对抗体进行不同的标记和修饰,可使其应用于多种检测方法,更方便得定位与分析抗原,是一种理想的简便、快速又价廉的检测方法。
因此相对于现有的各种基于pcr技术检测kras突变的方法,本发明所述的单克隆抗体在蛋白层面为kras突变的检测提供了有力的技术支持。该检测特性可通过各种常见的检测方法来实现,包括elisa,westernblot,流式细胞术,免疫组织化学,免疫荧光及免疫共沉淀等,应用广泛且便捷,具有极大的临床和科研价值。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施例的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施例或变更均应包含在本发明的保护范围之内。
序列表
<110>浙江大学
<120>一种突变型kras特异性抗体及其制备方法
<160>8
<170>siposequencelisting1.0
<210>1
<211>567
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgactgaatataaacttgtggtagttggagctggtggcgtaggcaagagtgccttgacg60
atacagctaattcagaatcattttgtggacgaatatgatccaacaatagaggattcctac120
aggaagcaagtagtaattgatggagaaacctgtctcttggatattctcgacacagcaggt180
caagaggagtacagtgcaatgagggaccagtacatgaggactggggagggctttctttgt240
gtatttgccataaataatactaaatcatttgaagatattcaccattatagagaacaaatt300
aaaagagttaaggactctgaagatgtacctatggtcctagtaggaaataaatgtgatttg360
ccttctagaacagtagacacaaaacaggctcaggacttagcaagaagttatggaattcct420
tttattgaaacatcagcaaagacaagacagggtgttgatgatgccttctatacattagtt480
cgagaaattcgaaaacataaagaaaagatgagcaaagatggtaaaaagaagaaaaagaag540
tcaaagacaaagtgtgtaattatgtaa567
<210>2
<211>567
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgactgaatataaacttgtggtagttggagctgatggcgtaggcaagagtgccttgacg60
atacagctaattcagaatcattttgtggacgaatatgatccaacaatagaggattcctac120
aggaagcaagtagtaattgatggagaaacctgtctcttggatattctcgacacagcaggt180
caagaggagtacagtgcaatgagggaccagtacatgaggactggggagggctttctttgt240
gtatttgccataaataatactaaatcatttgaagatattcaccattatagagaacaaatt300
aaaagagttaaggactctgaagatgtacctatggtcctagtaggaaataaatgtgatttg360
ccttctagaacagtagacacaaaacaggctcaggacttagcaagaagttatggaattcct420
tttattgaaacatcagcaaagacaagacagggtgttgatgatgccttctatacattagtt480
cgagaaattcgaaaacataaagaaaagatgagcaaagatggtaaaaagaagaaaaagaag540
tcaaagacaaagtgtgtaattatgtaa567
<210>3
<211>188
<212>prt
<213>人工序列(artificialsequence)
<400>3
metthrglutyrlysleuvalvalvalglyalaglyglyvalglylys
151015
seralaleuthrileglnleuileglnasnhisphevalaspglutyr
202530
aspprothrilegluaspsertyrarglysglnvalvalileaspgly
354045
gluthrcysleuleuaspileleuaspthralaglyglngluglutyr
505560
seralametargaspglntyrmetargthrglygluglypheleucys
65707580
valphealaileasnasnthrlysserphegluaspilehishistyr
859095
arggluglnilelysargvallysaspsergluaspvalprometval
100105110
leuvalglyasnlyscysaspleuproserargthrvalaspthrlys
115120125
glnalaglnaspleualaargsertyrglyilepropheilegluthr
130135140
seralalysthrargglnglyvalaspaspalaphetyrthrleuval
145150155160
arggluilearglyshislysglulysmetserlysaspglylyslys
165170175
lyslyslyslysserlysthrlyscysvalilemet
180185
<210>4
<211>188
<212>prt
<213>人工序列(artificialsequence)
<400>4
metthrglutyrlysleuvalvalvalglyalaaspglyvalglylys
151015
seralaleuthrileglnleuileglnasnhisphevalaspglutyr
202530
aspprothrilegluaspsertyrarglysglnvalvalileaspgly
354045
gluthrcysleuleuaspileleuaspthralaglyglngluglutyr
505560
seralametargaspglntyrmetargthrglygluglypheleucys
65707580
valphealaileasnasnthrlysserphegluaspilehishistyr
859095
arggluglnilelysargvallysaspsergluaspvalprometval
100105110
leuvalglyasnlyscysaspleuproserargthrvalaspthrlys
115120125
glnalaglnaspleualaargsertyrglyilepropheilegluthr
130135140
seralalysthrargglnglyvalaspaspalaphetyrthrleuval
145150155160
arggluilearglyshislysglulysmetserlysaspglylyslys
165170175
lyslyslyslysserlysthrlyscysvalilemet
180185
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
ttggagctgatggcgtaggcaa22
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctaccacaagtttatattca20
<210>7
<211>33
<212>dna
<213>人工序列(artificialsequence)
<400>7
ccagctgggatccatgactgaatataaacttgt33
<210>8
<211>54
<212>dna
<213>人工序列(artificialsequence)
<400>8
ggacgcaagcttttagtggtggtggtggtggtgattggagttttacataattac54
- 还没有人留言评论。精彩留言会获得点赞!