一种高纯度低密度脂蛋白的制备方法与流程
本发明属于物质提取技术领域,具体涉及一种高纯度低密度脂蛋白的制备方法。
背景技术:
血脂是血清中胆固醇、甘油三酯和类脂等的总称,血脂不溶于水,必须与载脂蛋白结合形成脂蛋白才能溶于血液,被运输至组织进行代谢。低密度脂蛋白胆固醇(low-densitylipoproteincholesterol,ldl-c)是血液中胆固醇含量(约50%)最多的脂蛋白,故ldl-c浓度基本能反应血液低密度脂蛋白(ldl)总量。另外,ldl能够被氧化为氧化型ldl(oxidizedlow-densitylipoprotein,ox-ldl)。
用于脂蛋白分析的三种常见超速离心法是:分析性超速离心、区带超速离心、制备性超速离心,在超速离心过程中各类脂蛋白因其密度不同而上浮速度各异,各类脂蛋白可通过依次增加血浆密度而分离。目前市场上用于科研的ldl主要分为冻干粉及液体两种保存形式。如实验需要高浓度ldl进行干预,冻干粉往往不能够被溶剂完全溶解,且冻干粉本身就容易造成ldl生物活性减低,而液体ldl的浓缩主要采用风干的方法,也容易影响其生物活性。ldl提取过程中加入大量溴化钾(kbr)调密度,需要透析后才能用于后续实验,但是ldl透析的时间各不相同,尚无统一标准。这与透析时ldl的体积与磷酸缓冲盐溶液(pbs)的体积比,换液时间间隔及次数,透析袋宽度等多个因素有关。并且很多实验室透析袋都是经过洗净、灭菌等步骤后回收利用的,这样对透析袋反复多次处理,会明显影响透析的效率。血浆ldl的常规提取量一般较少,如实验需大量ldl时,单个体单次采血量难以满足要求。但单个体多次采血、多个体单次采血或者多个体多次采血均不能保证ldl活性的批间差异,更无法保证实验结果的稳定性及可重复性。
技术实现要素:
为了克服上述现有技术的不足之处,本发明提供一种高纯度低密度脂蛋白的制备方法。
本发明是通过如下技术方案实现的:一种高纯度低密度脂蛋白的制备方法,采用超速离心机固定角式转头密度梯度离心法,通过溴化钾调整血浆密度,实现各类脂蛋白的逐层分离,利用琼脂糖凝胶电泳鉴定血浆低密度脂蛋白纯度,全自动生化分析仪测定低密度脂蛋白及k+浓度,渗透压仪检测透析前后低密度脂蛋白的渗透压,具体包括以下步骤:
根据密度不同离心去除血浆中的乳糜微粒、极低密度脂蛋白,提取剩余的血浆加入溴化钾调密度为1.045g/ml,再进行离心得到位于最上层的常规低密度脂蛋白,使用磷酸缓冲盐溶液透析降低k+浓度,低密度脂蛋白透析前后k+浓度的全自动生化分析仪所测结果与渗透压仪检测结果相比较,如透析至与磷酸缓冲盐溶液渗透压无明显差异,则认为溴化钾被完全透析,进而获取高纯度低密度脂蛋白。
进一步地,将上述步骤中离心得到位于最上层的常规低密度脂蛋白吸取后,提取第二层并加入溴化钾调密度为1.045g/ml,再次离心得到高浓度低密度脂蛋白。
进一步地,将上述步骤中离心得到位于最上层的常规低密度脂蛋白吸取后,提取第二层和第三层,并混合后加入超纯水调密度为1.045g/ml,再次离心获得纯度较高的低密度脂蛋白。
本发明采用固定角式转头密度梯度离心法,加入kbr调整血浆的密度,实现各类脂蛋白的逐层分离。再利用渗透压仪、全自动生化分析仪、琼脂糖凝胶电泳纯化及鉴定血浆ldl。提取的ldl透析至与pbs缓冲液渗透压无明显差异时,可以认为kbr已被完全去除;将第一次离心去除ldl的第二层调密度后,再次离心得高浓度ldl;混合第二、三两层或仅第二层调密度后,仍可离心得到高纯度ldl,提高了回收率。
具体的操作方法如下:
1、制备高纯度ldl的方法
取血浆(含1mmol/l乙二胺四乙酸)离心,4℃,20000rpm×2h除去cm,将其余部分混合后加入kbr调密度为1.025g/ml离心,4℃,50000rpm×12h除去vldl,收集剩下的血浆加入kbr调密度为1.045g/ml离心,4℃,50000rpm×12h得最上层的常规ldl。由于ldl提取过程中加入大量kbr,致使透析前k+浓度较正常高出数十倍,通过pbs缓冲液的反复多次透析后,k+浓度明显降低,对于如心肌细胞收缩功能测定、膜片钳钾通道的测定等无明显影响。将ldl透析前后k+浓度的全自动生化分析仪所测结果,与对应渗透压相比较发现,如透析至与pbs缓冲液渗透压无明显差异,则可以认为kbr被完全透析。
2、制备高浓度ldl的方法
取血浆(含1mmol/l乙二胺四乙酸)离心,4℃,20000rpm×2h除去cm,将其余部分混合后加入kbr调密度为1.025g/ml离心,4℃,50000rpm×12h除去vldl,收集剩下的血浆加入kbr调密度为1.045g/ml离心,4℃,50000rpm×12h得最上层的常规ldl,将其中的第二层吸出混合加入kbr调密度为1.045g/ml离心,4℃,50000rpm×12h,吸出淡黄色的上层液体,即为高浓度的ldl。对于部分需要高浓度ldl的实验,基本上无需浓缩即可使用。
3、提高ldl回收率的方法
取血浆(含1mmol/l乙二胺四乙酸)离心,4℃,20000rpm×2h除去cm,将其余部分混合后加入kbr调密度为1.025g/ml离心,4℃,50000rpm×12h除去vldl,收集剩下的血浆加入kbr调密度为1.045g/ml离心,4℃,50000rpm×12h得最上层的常规ldl。实验中除第一次加入kbr调密度为1.045g/ml所得常规ldl外,无论混合第二、三两层加入超纯水或仅第二层加入kbr调密度为1.045g/ml,亦可再次获得纯度较高的ldl,只是浓度有所差别。反复多次从血浆中提取ldl,可以明显提高其回收率。
本发明的方法在五个方面做了优化与改良:
一、目前市场上用于科研的ldl主要分为冻干粉及液体两种保存形式。如实验需要高浓度ldl进行干预,冻干粉往往不能够被溶剂完全溶解,且冻干粉本身就容易造成ldl生物活性减低,而液体ldl的浓缩主要采用风干的方法,也容易影响其生物活性。本发明首先离心去除cm与vldl,收集剩下的血浆调密度为1.045g/ml,离心得最上层的ldl,将其中的第二层吸出混合调密度为1.045g/ml,离心后吸出淡黄色的上层液体,即为高浓度的ldl。对于部分需要高浓度ldl的实验,基本上无需浓缩即可使用。
二、本发明采用全自动生化分析仪检测ldl的含量标定提取ldl的浓度。现今国际上通常采用bca试剂盒或lowry法测定ldl的蛋白含量,以蛋白量的大小来反应ldl中相应脂质量的大小。ldl主要是载脂蛋白apob和胆固醇酯组成的,而脂蛋白中胆固醇酯含量较为稳定,细胞吞噬大量脂质才会泡沫化,因此虽然测脂质不如测蛋白方便,但是测定ldl中胆固醇的方法作为脂蛋白的定量依据更为科学、严谨。
三、本发明将提取出的ldl溶液置入再生纤维素透析袋内,然后浸入pbs缓冲液中,通过pbs缓冲液的反复多次透析后,样品溶液中的大分子量的生物大分子被截留在袋内,而盐和小分子物质不断扩散透析到袋外,通过不断更换缓冲液,即可将样品中要除掉的小分子稀释到足够低的浓度。对于影响透析的多个因素本发明没有具体限定,而是就其透析完全的指标加以分析。最终通过全自动生化分析仪与渗透压仪确定透析的程度,以及是否达到后续实验的要求。正常血浆中k+浓度为3.5-5.5mmol/l,由于ldl提取过程中加入大量kbr,致使透析前k+浓度较正常高出数十倍。正常情况下细胞内的k+比细胞外高几十倍,当ldl中的大量kbr没有被完全透析而作为干预因素作用于细胞时,导致细胞内外k+浓度差变小,对心肌、骨骼肌、酸碱平衡等都会产生影响,如引起心肌兴奋性先升高后降低,传导性降低,自律性降低,收缩性减弱等。通过pbs缓冲液的反复多次透析后,k+浓度明显降低,对于如心肌细胞收缩功能测定、膜片钳钾通道的测定等才能不产生明显影响。
四、本发明将ldl透析前后k+浓度的全自动生化分析仪所测结果,与渗透压仪检测结果相比较发现,如透析至与pbs缓冲液渗透压无明显差异,则可以认为kbr被完全透析,ldl可以作为一种干预因素用于后续实验。与渗透压仪相比,全自动生化分析仪的检测成本高,耗时长,需要的样本量大。以pbs缓冲液渗透压为参照,采用渗透压仪测定ldl透析液的渗透压值就能便捷的反映ldl纯度。
五、本发明中除第一次加入kbr调密度为1.045g/ml所得ldl外,混合第二、三两层加入超纯水或仅第二层再次加入kbr调密度为1.045g/ml离心后,亦可再次获得纯度较高的ldl。序贯漂浮超速离心法虽然能够处理较大的血浆样本量,但是耗时很长。常规的密度梯度超速离心法主要优点就是大大缩短离心时间,但是它所能处理的血浆样本量较序贯漂浮超速离心法少得多,无法一次性制备大量脂蛋白样本,故脂蛋白的回收率较低。本发明采用超速离心机固定角式转头密度梯度离心法,反复多次从血浆中提取ldl,可以明显提高其回收率,为分离制备大量实验所用的脂蛋白样本成功地探索出一条新的途径。
本发明的有益效果是:1、ldl纯度高:通过pbs缓冲液的反复多次透析后,以pbs缓冲液渗透压为参照,采用渗透压仪测定ldl透析液的渗透压值可以便捷的反映ldl纯度。
2、ldl浓度高:将常规超速离心第一次所得ldl吸出后,第二层再次加入kbr调整密度后提取的ldl浓度显著高于之前第一次提取的ldl。
3、ldl回收率高:除常规超速离心第一次所得ldl,混合第二、三两层再次加入超纯水调密度后仍能离心得到高纯度的ldl。反复多次从血浆中提取ldl,可以明显提高ldl回收率。
附图说明
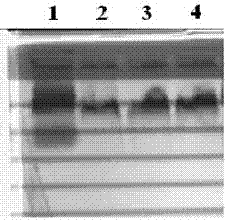
图1ldl苏丹黑b染色琼脂糖电泳图[1为正常血浆,2、3、4分别为c组、a组、b组提取的ldl]
图2ldl及ox-ldl苏丹黑b染色琼脂糖电泳图[1为正常血浆,2为b组提取的ldl,3、4、5分别为a组、b组、c组提取ldl氧化后的ox-ldl]
具体实施方式
下面根据附图和实施例对本发明进一步说明。
1、血浆分离:
在血浆中加入乙二胺四乙酸(edta),终浓度为1mmol/l,3000rpm×20min,沉淀为血细胞,上清血浆待用。
2、cm分离:
离心机:beckmanavantij-e高速冷冻离心机;
转头,离心管:ja-20:20000rpm,18400×g,8×50ml;
离心参数:4℃,20000rpm×2h;
离心结果:cm呈白色上浮于液体的表面,或紧贴于离心管壁,小心吸出。
3、血浆脂蛋白的分离:
离心机:hitachicp-80wx超速离心机;
转头,离心管:p70at:70000rpm,505000×g,8×40ml,40pa管。
3.1、vldl分离:
血浆处理:将去除cm后的血浆混合,加入超纯水或kbr,调密度至1.025g/ml;
离心参数:4℃,50000rpm×12h;
离心结果:vldl浮于离心管的上层呈奶油状,约占上面无色透明层的1/2,用巴氏吸管仔细吸出。若血浆含有大量甘油三脂(>1000mg/ml),vldl则在管顶部形成淡黄色透明的胶状层。
3.2、ldl分离:
血浆处理:将去除vldl后的血浆混合,加入kbr,使最终密度为1.045g/ml;
离心参数:4℃,50000rpm×12h;
离心结果:大致可以分为三层:ldl形成一层淡黄色带浮于顶部为最上层(a组),用巴氏吸管仔细吸出。第二层与第三层之间存在一条白色颗粒漂浮带。将上步离心吸出ldl后的剩余液体,分为两种不同方法处理:
(1)将第二层的液体吸出混合后,加入kbr,调密度至1.045g/ml。
离心参数:4℃,50000rpm×12h;
离心结果:大致分为两层:ldl浮于最上层为淡黄色(b组),用巴氏吸管仔细吸出。第二层液体的黄色较ldl层稍深。
(2)将第二、三层的液体混合后,加超纯水,调密度至1.045g/ml。
离心参数:4℃,50000rpm×12h;
离心结果:大致可以分为三层:ldl浮于最上层为无色透明(c组),用巴氏吸管仔细吸出。第二层与第三层之间仍存在一条白色颗粒漂浮带。
4、将上述所得ldl移入再生纤维素透析袋,两端用透析袋夹夹紧,放入0.01mol/l的pbs缓冲液(nacl138mm,kcl2.7mm,na2hpo410.14mm,kh2po41.76mm,ph=7.4)中4℃透析5-8h,以除去离心过程中所加的抗氧化剂和大量的kbr。
5、经过上述处理后,根据是否进行后续氧化,可以对ldl做以下两种不同处理:
5.1、如不需氧化,将ldl以0.22μm滤膜过滤除菌后,保存于tris缓冲液(tris-hcl50mm,nacl0.15m,edta2mm,ph=7.4),4℃备用。
5.2、如需氧化,用pbs缓冲液将ldl稀释至蛋白浓度0.5mg/ml,加入终浓度为5μmol/l的新鲜配制的cuso4溶液,37℃孵育24小时后,放入0.01mol/l的pbs中4℃透析5-8h,以终止氧化反应。氧化前的ldl为淡黄色,氧化后一般黄色消失甚至出现乳白色,这是肉眼判断氧化成功的标准。将制备好的ox-ldl以0.22μm滤膜过滤除菌后,保存于tris缓冲液,4℃备用。
6、实验中测定ldl浓度(全自动生化分析仪)、渗透压(渗透压仪wescor5520,美国)及ox-ldl氧化修饰程度(琼脂糖凝胶电泳以及mda试剂盒,南京建成生物公司)。
7、统计学方法:
采用spss23.0统计分析软件进行统计学分析,定量资料以均数±标准差(mean±sd)表示,三组样本均数间比较采用单因素方差分析。p<0.05为差异有统计学意义。
8、结果:
8.1、琼脂糖凝胶电泳结果:
三组不同方法提取的ldl经苏丹黑b染色后,均呈单条色带,证明三组不同方法提取的ldl纯度均较高(图1)。琼脂糖电泳时,apob中的赖氨酸残基与醛反应使ox-ldl相对带负电荷,其向阳极迁移,根据ox-ldl电泳距离和非氧化ldl的电泳距离之比的变化即相对电泳迁移率,判断其氧化修饰的程度。三组不同方法提取的ldl经氧化后,ox-ldl的相对电泳迁移率均加快,但是三组之间无明显差异(图2)。
8.2、硫代巴比妥酸反应物(tbars)测定:
脂质过氧化物(lpo)的分解产物丙二醛(mda),在酸性环境下能与硫代巴比妥酸(tba)形成红色物质,可在532nm比色测定。测mda的含量与ox-ldl浓度之间没有关系,它主要说明ldl已经氧化以及氧化的程度,它的值不能代表ox-ldl的含量。我们实验中ox-ldl是ldltbars值的5-8倍,结合ox-ldl相对电泳迁移率的增加,说明ldl已经被氧化。
8.3、提取ldl浓度的全自动生化分析仪检测(表1):
第一次调密度为1.045g/ml,离心后大致分为三层,通过琼脂糖凝胶电泳的结果,发现第一层为较纯的ldl,第二层以ldl为主及少量hdl,第三层以hdl为主及少量ldl,根据此线索又对上述样品进行了全自动生化分析仪的检测,结论与前面一致。按照方案中三种不同提取方法得到的ldl,分别进行全自动生化分析仪检测,结果发现三组之间ldl浓度有显著差异(p<0.05),b组>a组>c组(p<0.05)。
表1ldl检测结果(mean±sd,n=6)
8.4、提取ldl透析前后渗透压的改变(表2):
ldl透析后渗透压较透析前明显降低(p<0.05),但是和pbs缓冲液相比无明显差异。与透析前及pbs缓冲液相比较,ldl透析后的k+浓度均明显减少(p<0.05)。将ldl中含k+浓度的全自动生化分析仪所测结果,与对应渗透压相比较发现,如透析至与pbs缓冲液渗透压无明显差异,则可以认为kbr被完全透析,ldl可以作为一种干预因素用于后续实验。
表2ldl透析前后渗透压与k+浓度的改变(mean±sd,n=6)
- 还没有人留言评论。精彩留言会获得点赞!