使用α9整联蛋白拮抗剂和CXCR4拮抗剂的HSC的迁移和释放的制作方法
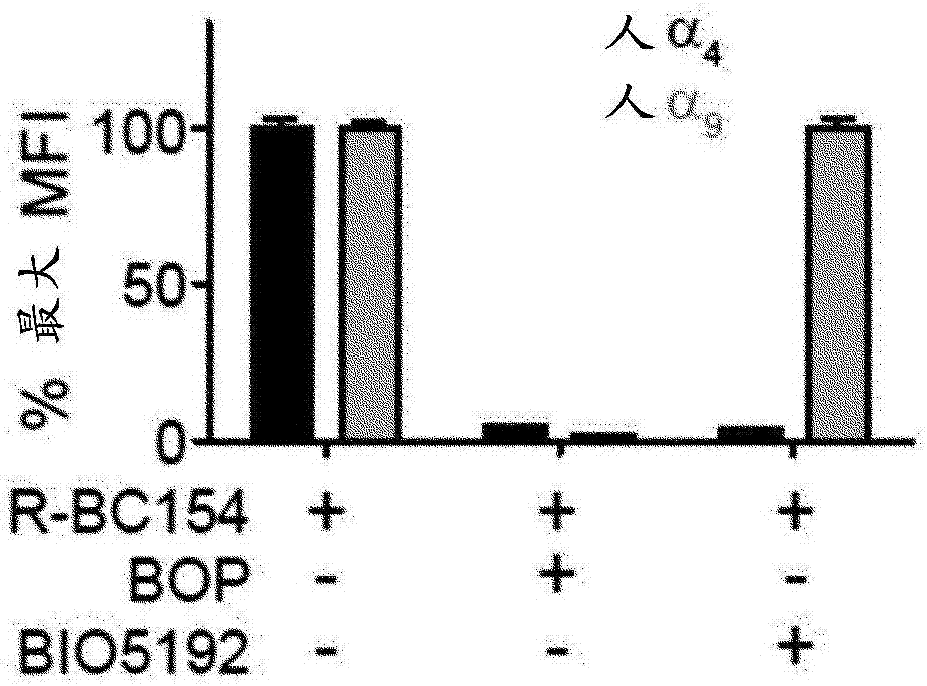
本发明涉及增强造血干细胞(hsc)及其前体和祖细胞从骨髓(bm)干细胞龛的迁移和释放,以及用于增强hsc及它们的前体及其祖细胞从bm和干细胞龛的迁移和释放的方法。本发明还涉及用于增强hsc及它们的前体及其祖细胞的迁移和释放的组合物。本发明包括已经通过所述方法和组合物迁移和释放的hsc及它们的前体和祖细胞的细胞群以及所述细胞群用于治疗血液病和hsc及其前体和祖细胞的移植的用途。发明背景bm干细胞龛内的hsc调节和保留是通过hsc表面受体与周围细胞如成骨细胞和窦状内皮细胞所表达的其相应配体之间的相互作用来介导的。使用功能测定及体内和离体成像进行的bm内的hsc的空间分布分析表明它们优先集中于骨内膜龛内的最靠近于骨/bm界面之处。值得注意的是,与经典的lin-sca-1+ckit+cd150+cd48-表型相同、但与骨内膜bm分离的hsc相对于从中央髓腔分离的hsc具有更大的归龛潜力和增强的长期、多谱系造血重构。因此,用于动员的骨内膜hsc的治疗靶向应提供更好的移植结果。bm血生成位置涉及原始造血细胞与基质细胞介导的bm干细胞龛的造血微环境之间的发育调节的粘着相互作用。在稳态条件下,hsc通过与基质元件(如vcam-1和骨桥蛋白(opn))的粘着相互作用保留在bm龛中,导致原始造血祖细胞在bm中的生理保留。粘合剂相互作用的干扰可导致保留在bm中的hsc的释放,并引起干细胞/祖细胞从骨髓龛的释放,并最终通过动员进入循环。白细胞从骨髓最终至外周血的生理性流出或转移,以及少量干细胞/祖细胞从正常骨髓环境至循环的逃逸,是一个对其知之甚少的现象。细胞从骨髓的血管外空间至循环的移动可能需要可逆的粘附与迁移步骤的协调序列。在该过程中,由干细胞/祖细胞或骨髓中的基质细胞表达的粘着分子的所有组成成分是至关重要的。由不同刺激触发的祖细胞的粘附和/或迁移的改变可能导致它们在骨髓和外周血之间的移动或再分配。释放和动员hsc的特定群体可以允许在各种情况下使用,包括移植、基因治疗、疾病、包括癌症如白血病、包括乳腺癌的肿瘤性癌症的治疗、或组织和皮肤的修复。然而,为了动员hsc,需要可以一开始从bm移出hsc的快速和选择性的动员方案。hsc的特异性细胞群从bm干细胞龛的迁移和释放可以提供更长期的多谱系的造血重构。将动员的外周血(pb)造血干细胞(hsc)移植到接受血液病治疗的患者中已经基本上取代了传统的骨髓(bm)移植。通过5天时间的重组粒细胞集落刺激因子(g-csf)实现hsc动员的一些临床实践,据信这可以刺激切割cxcr4/sdf-1相互作用的蛋白酶的生成。然而,g-csf在大量患者中无效,并且与几种副作用相关,如骨痛、脾脏肿大、罕见情况下的脾破裂、心肌梗死和脑缺血。g-csf的这些固有缺点推动了鉴别基于小分子的替代的动员策略的各种努力。例如,fda批准的cxcr4拮抗剂amd3100(plerixafor;mozobiltm)已被证明能够快速动员hsc,而只具有受限的毒性问题。然而,amd3100的临床动员仅与g-csf组合才有效,并且寻找快速、选择性的和不依赖g-csf的动员方案仍然是具有临床兴趣的课题。虽然临床上g-csf是最广泛使用的动员剂,但其缺点还包括潜在的毒副作用、相对较长的治疗过程(连续注射5-7天)和患者的不同响应性。然而,为了实现动员,hsc必须从其对bm干细胞龛的附着中释放出来。对于龛功能和hsc在龛环境保持而言重要的分子包括vcam-1、opn和tenasin-c。整联蛋白如α4β1涉及hsc的动员。具体来说,由hsc表达的α4β1(vla-4)和α9β1整联蛋白通过与骨内膜区域内的vcam-1和opn结合而参与干细胞静止和龛停留。虽然α9β1整联蛋白在hsc动员中的作用未知,但使用非甾体抗炎药(nsaid)的opn的下调以及整联蛋白α4或g-csf的选择性抑制已经验证了与整联蛋白结合的opn/vcam-1是hsc动员的有效标靶。然而,各种特征、诸如与小分子如整联蛋白的结合表明它们是截然不同的分子。在pepinsky等人(2002)中,α4β1和α9β1整联蛋白的结合特征有明显差异。pepinsky表明,与egta治疗相比,结合小分子n-苯-磺酰基-(l)-脯氨酰基-(l)-o-(1-吡咯烷基羰基)酪氨酸(bop)的差异是明显的。该治疗抑制单克隆抗体9eg7与α4β1的结合,而刺激9eg7与α9β1的结合。最显著的是,与α9β1(表观kd>10μm)相比,结合α4β1(表观kd为10nm)的vcam-1的整联蛋白的亲和力估计>1000倍。α9β1和α4β1与opn的结合也有差异。因此,本发明的目的是提供促进hsc的迁移和释放的化合物,从而改善这些细胞类型的动员和与不依赖g-csf的治疗方案。通过提供靶向特定hsc群体的这些化合物,可以改重构和移植结果。发明概述在本发明的一个方面,提供了一种用于增强在体内或离体hsc及其前体和祖细胞从bm干细胞结合配体迁移的方法,所述方法包括在存在或不存在g-csf的情况下,在体内或离体将有效量的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分施用于bm干细胞龛。优选地,hsc的迁移导致hsc从bm干细胞结合配体的释放,其使hsc能够从bm向pb移动,从而增强hsc的动员。通过使用进一步加强hsc至pb的动员的动员剂能协助动员的进一步刺激。优选地,hsc是骨内膜祖细胞,其选自cd34+细胞、cd38+细胞、cd90+细胞、cd133+细胞、cd34+cd38-细胞、谱系–定型cd34-细胞或cd34+cd38+细胞。优选α9整联蛋白的拮抗剂或其活性部分是α9β1整联蛋白或其活性部分。在另一个实施方案中,所述方法还包括施用α4整联蛋白或其活性部分的拮抗剂。优选地,α4整联蛋白是α4β1的拮抗剂或其活性部分。在另一个实施方案中,拮抗剂与α9和α4交叉反应,并且任选地与α9β1和α4β1交叉反应。任选地,拮抗剂是α9β1/α4β1或其活性部分的拮抗剂。优选地,拮抗剂是式(i)的化合物或其药学上可接受的盐,其具有下式:其中x选自键和–so2–;r1选自h、烷基、任选地被取代的芳基和任选地被取代的杂芳基;r2选自h和取代基;r3选自h和c1-c4烷基;r4选自h和–or6;r5选自h和–or7;条件是当r4是h时,则r5是–or7,且当r4是–or6时,则r5是h;r6选自h、c1-c4烷基、–(ch2)n-r8、–c(o)r9和–c(o)nr10r11;r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r8选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r9选自任选地被取代的环烷基、任选地被取代的杂环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r10和r11与它们所连接的氮一起形成任选地被取代的杂环烷基环;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。优选地,式(i)的化合物具有以下的式(ia)或其可药用盐。在一个实施方案中,式(i)的化合物具有以下的式(ib)或其可药用盐。优选地,式(i)的化合物具有以下的式(ic)或其可药用盐。在另一个实施方案中,式(i)的化合物具有以下的式(id)或其可药用盐。优选地,上式的化合物具有以下的式(ie)或其可药用盐。在另一个实施方案中,提供了用于增强来自bm干细胞结合配体的hsc的迁移、释放或动员的组合物,所述组合物包含如本文所述的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分。在本发明的又一个方面,提供了从受试者收获hsc的方法,所述方法包括:在存在或不存在g-csf的情况下,向受试者施用有效量的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分,其中所述有效量增强hsc及其前体和祖细胞从bm干细胞龛中的bm干细胞结合配体的迁移;动员迁移的hsc到pb;并从pb收获hsc。在本发明的另外方面,提供了用于治疗受试者血液学障碍的方法,所述方法包括在存在或不存在g-csf的情况下,向受试者施用治疗有效量的本文描述的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分或包含从受试者收获的hsc的细胞组合物,所述受试者施用了如本文所述的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分以增强hsc从bm至pb的迁移、释放或动员。在另一个优选的实施方案中,所述血液病是造血性肿瘤性疾病,并且所述方法涉及化学增敏hsc以改变hsc的易感性,使得已经变得无效的化学治疗剂变得更有效。另一个方面,提供了将hsc移植到患者内的方法,所述方法包括向受试者施用α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分,以从bm干细胞结合配体迁移hsc;将hsc从bm释放和动员至pb;从受试者的pb收获hsc;和将hsc移植到患者身上。在本发明的具体实施方案的以下描述中本发明的其它方面将对本领域技术人员而言变得显而易见。附图为了进一步理解本发明的方面和优点,应结合附图参考下文的详细描述。图1显示(a)在二价金属阳离子(ca2+/mg2+)(黑色实线)的存在下,r-bc154(ixb)特异性结合由cho细胞表达的鼠α4和α9。在edta存在下(点虚线),r-bc154(ixb)结合被消除。(b)使用r-bc154(ixb)、bop和bio5192来证明在1mmca2+/mg2+存在下,与α4(黑色)相比与在人和(c)鼠中的α9(灰色)结合的特异性检测。n=3,代表至少2次独立实验。图2显示(a)与人cbmnc结合的r-bc154(ixb)的剂量响应。n=3,代表2次独立实验。(b)cbhsc(cd34+cd38-)、祖细胞(cd34+cd38+)和定型细胞(cd34-cd38+)的代表性群体。(c)在1mmca2+/mg2+的单独存在下(实线黑线)或与bop的组合(实心灰线)或与bio5192的组合(黑色点虚线)存在下,与cbmnc定型细胞、祖细胞和hsc结合的r-bc154(ixb)。数据代表3个单独样本。通过α9β1的α9-特异性结合,通过α4β1的α4-特异性结合。(d)与cb定型细胞、祖细胞和hsc上的α9β1结合的r-bc154(ixb)的特异性结合。n=3ud-不可检测。(e)与人bm(hubm)结合的r-bc154(ixb)。数据代表3个单独样本。(f)r-bc154(ixb)与hubmα9β1的特异性结合。n=3单因素方差分析p<0.01。(g)在hubm祖细胞和hsc上的α9β1表达(黑色实线,短划虚线igg1同种型对照)。数据代表3个个体样本。(h)从cb单核细胞(mnc)产生人源化nodscidil2rγ-/-(hunsg)小鼠和bm白细胞(wbc)cd34+cd38+祖细胞、cd34+cd38-hsc和cd34-cd38+定型细胞的流式细胞术分析。(i)与人源化nsg(hunsg)bm结合的r-bc154(ixb)。数据代表3个单独样本。(j)r-bc154(ixb)与hunsgbmα9β1的特异性结合。n=3单因素方差分析p<0.01。(k)α9β1在hunsgbm祖细胞和hsc上的表达(黑色实线,短划虚线igg1同种型对照)。数据代表3个个体样本。(l)α4(实线)在hunsgbm定型细胞、祖细胞和hsc上的表达。同型=短划虚线。(m)图2i的量化数据描述了在ca2+/mg2+存在下与hunsgbm定型细胞、祖细胞和hsc结合的r-bc154(ixb)。n=3。单因素方差分析p<0.005。图3显示(a)鼠bmlin-sca+c-kit+(lsk;祖细胞)和lskcd150+cd48-(lskslam;hsc)的代表性流式细胞术图。(b)在1mmca2+/mg2+(黑色条)或10mmedta存在下与鼠祖细胞和hsc结合的r-bc154(ixb)。(c)描绘骨内膜(ebm)和中心(cbm)bm的股骨的示意图和在不存在外源性加入的阳离子的情况下与中心(cbm)和骨内膜(ebm)祖细胞和hsc的结合的体外r-bc154(ixb)。(d)在1mmca2+/mg2+存在下,与来自中心和骨内膜bm的淋巴(b220+和cd3+)和骨髓(gr1mac1+)、lsk和lskslam细胞结合的比较r-bc154(ixb)。数据代表2个单独的实验。单因素方差分析p<0.0001。(e)与来自wt(黑色条)和α4-/-/α9-/-条件性ko小鼠(白色条)的中心和骨内膜lsk和lskslam细胞结合的r-bc154(ixb)。t检验p<0.01。图4显示了在10mmedta(灰线)和1mmca2+/mg2+(黑线)的存在下,来自用r-bc154(ixb)(10nm)处理的骨内膜和中心wbm的门控淋巴(b220+和cd3+)、骨髓(gr1mac1+)和谱系-群。数据表示n=3。图5显示α9β1/α4β1整联蛋白拮抗剂bop快速动员鼠长期再生hsc。(a)具有bop的鼠祖细胞(lsk,白色方形)和hsc(lskslam,灰色方块))的剂量依赖性动员。从两个生物重复汇总数据;每组n>3。单因素方差分析p<0.05。(b)用10mg/kgbop进行祖细胞和hsc动员的时程。从两个生物重复汇总数据。每个时间点n=5个动物,不重复分析。时间0是介质对照。单因素方差分析p<0.05。图6显示(a)单剂量bop后长达18小时的pb中的总祖细胞(lsk)、(b)hsc(lskslam)和(c)淋巴细胞含量的延长时程分析。n=5。单因素方差分析p<0.05。(d)历经30分钟用盐水或r-bc154(ixb)处理的小鼠pb中lsk和lskslam含量的分析。数据从两个独立实验汇总。n>6。(e)单独施用bop或bop与amd3100组合施用后,与骨内膜相比中心祖细胞(lsk)和hsc(lskslam)结合的体内bop的分析。数据呈现为与骨内膜结合的bop相对于其中心对应物(点虚线)的倍数增加。n=3。p值表示使用每个治疗组中中心和骨内膜群体之间的配对t检验的统计学显著性结果。p<0.05图7显示了表示在外源性ca2+/mg2+(黑色实线)存在下和r-bc154(ixb)的体内施用时的r-bc154(ixb)的体外染色与在外源ca2+/mg2++bop(点虚线)的存在下的r-bc154(ixb)进行对比的图。数据表示n=3。图8显示了使用了bop与amd3100的组合的增强的hsc动员。(a)代表性流式细胞术图,和(b)lsk含量的测定,(c)lpp-cfc含量,和(d)用盐水(n=3)、bop(n=4)、amd3100(n=4)以及bop与amd3100的组合(n=4)处理的小鼠的外周血中的hpp-cfc含量。数据是平均值±sem。(e)用盐水、bop(10mg/kg)和amd3100(3mg/kg)单独以及与bop组合的(1、5和10mg/kg)处理的小鼠的外周血中的wbc含量的分析。数据是平均值±sem。单因素方差分析p<0.05。(f)通过bop、amd3100以及bop和amd3100的组合(每组5个接受者)动员的rfp血液的有限稀释移植分析。阳性多系移植物植入被认为>0.5%cd3+、b220+和gr1mac1+。(g)移植了30μlrfp动员的pb的接受者的存活。(h)在bop、amd3100或bop+amd3100之后动员的pb中长期hsc频率。所有数据均为±sem单因素方差分析*p<0.05,**p<0.01,***p<0.005,****p<0.001。图9显示(a)单剂量介质(n=5)、bio5192单独(n=5)或与amd3100(n=5)组合或bop与amd3100组合(n=3)后1小时的pb白细胞(wbc)含量。(b)单剂量介质(n=5)、bio5192单独(n=5)或与amd3100组合(n=5)或bop与amd3100组合(n=3)后1小时的总pb祖细胞(lsk)和hsc(lskslam)含量。所有数据为均值±sem。单因素方差分析*p<0.05,**p<0.01,***p<0.005,****p<0.001图10显示(a)单剂量bop+amd3100或4天g-csf后的pb祖细胞(lsk)和hsc(lskslam)含量的分析。从两个生物重复汇总数据。n>8。(b)连续竞争移植测定的示意图。(c)1°接受者中pbrfp+白细胞(wbc)的比例。每个数据点是来自两个移植之一的个体接受者。1st=十字标,2nd=圆。短划虚线是数学上预期的移植物植入水平。(d)1°接受者中pbrfp+和gfp+淋巴样(b220+和cd3+)和骨髓(gr1+/mac1+)植入物的分析。n=8;从第一和第二个实验汇总。(e)1°接受者的bm中的供体植入和(f)谱系分布(淋巴样、b220+和cd3+和骨髓,gr1+/mac1+)的分析。(g)2°接受者pb分析。每个数据点是单个接受者。短划虚线是数学上预期的移植物植入水平。(h)移植后20周,2°接受者的pbrfp+和gfp+淋巴样(b220+和cd3+)和骨髓(gr1+/mac1+)移植物的分析。数据基于5个单独的2°接受者进行分组。n=4,每个供体2°接受者。ud=无法检测。(i)在移植后20周的2°接受者的bm中的供体移植物和(j)谱系分布(淋巴样,b220+和cd3+和骨髓,gr1+/mac1+)的分析。所有符号均为个体动物,所有数据均为平均值±sem。*p<0.05,**p<0.01,***p<0.005,****p<0.001。图11显示bop和amd3100的组合在人源化nsg(hunsg)小鼠中有效动员人cd34+干细胞和祖细胞。plot显示动员后hunsgpb中hucd45+cd34+细胞含量的分析。数据表示为相对于盐水对照的cd34+细胞/mlpb的倍数增加,每个数据点代表个体动物。黑色条=平均值。**p<0.01,****p<0.001。图12显示了具有相似结构但是苯磺酰基已经被3-吡啶磺酰基代替的bop的替代小分子。数据显示没有化合物、单独的py-bop、单独的amd3100和py-bop和amd3100用于(a)祖细胞(lsk)和(b)hsc(lskslam)。数据是平均值±sem。*p<0.05,**p<0.01。图13显示(a)以倍数增加表示的动员至pb的all细胞。(b)将amd3100添加到bop中增加了bop占据的α4β1/α9β1的%。数据是平均值±sem。t检验*p<0.05。发明详述造血干细胞动员是一种将造血干细胞从骨髓空间(例如髋骨和胸骨)刺激到血液中的过程,因此它们可用于将来的再灌注的收集,或者它们自然地从骨髓排出移动至身体各处进入器官(诸如脾脏)中以提供血细胞。鉴于能够人工激发hsc进入血液中的活性剂的发现(在此可以将它们收集起来并用于移植等目的),可以将这种经常伴随着各种血液病的有趣的自然现象改变为治疗法的有用组成部分。化合物如g-csf和fda批准的cxcr-4拮抗剂amd3100已经显示出可动员hsc。然而,这种治疗可能导致毒性问题和各种副作用。在hsc可以动员之前,它们必须从它们所位于并且通过粘着相互作用而保留其中的bm干细胞龛被迁移和释放。因此,在本发明的一个方面,提供了一种用于在体内或离体增强hsc及其前体和祖细胞从bm干细胞结合配体迁移的方法,所述方法包括在体内或离体将有效量的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性衍生物施用于bm干细胞龛。在稳态条件下,hsc位于称为bm干细胞龛的bm中的专门位置。在这里,它们作为静止的干细胞存在,随后在它们被释放,准备进入pb并且进入组织中开始分化。hsc通过粘着分子或结合配体(例如但不限于vcam-1、opn和tenacin-c)保留在bm干细胞龛中。hsc/bm干细胞龛相互作用的管理有助于hsc迁移和释放至bm干细胞龛并最终到pb。因此,本发明提供了通过破坏hsc和bm干细胞龛环境之间的粘着相互作用和结合配体来从bm干细胞龛中的相互作用中迁移和释放hsc的方法。然后,细胞变得可用于动员至pb,或者它们可留在bm中。bm干细胞龛包括骨内膜龛和中央髓腔。骨内膜干细胞龛位于骨髓的骨内膜,在这里成骨细胞是hsc功能如增殖和静止的主要调节因子。此外,相当一部分hsc与内皮龛中的窦状内皮细胞密切相关,在那里它们准备进入外周血并开始分化。中央髓腔是骨的中央腔,负责形成红细胞和白细胞,也称为骨髓。申请人已经发现,在cxcr4拮抗剂或其活性部分的存在下,至少通过用小分子拮抗剂抑制α9整联蛋白,hsc及其前体和祖细胞可以从bm干细胞龛优选迁移至骨内膜龛中,或者动员进入具有长期多谱系植入潜力的pb中。令人惊讶地发现,α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性衍生物的使用显著增加了cd34+干细胞和祖细胞向血液中的迁移和释放。申请人已经开发了一种基于一系列n-苯基磺酰基脯氨酸二肽的荧光小分子整联蛋白拮抗剂r-bc154(ixb)(1)(图1a),其结合活化的人和鼠α9β1和α4β1整联蛋白以及bmhsc和祖细胞(图1a)。申请人假定,该家族化合物将靶向强效的骨内膜hsc用于动员,其基于α9β1/α4β1和骨内膜bm内的opn之间的限制性相互作用。现已发现,r-bc154(ixb)(1)及其非标记衍生物bop(2)通过在体内内在活化的α9β1/α4β1整联蛋白优先结合并动员小鼠和人类hsc和祖细胞。此外,当bop与cxcr4拮抗剂amd3100一起使用时,相对于4天的g-csf方案,在1小时内实现了更长时间的再生hsc的动员。还发现bop和amd3100的组合在人源化nodscidil2rγ-/-小鼠模型中动员人cd34+细胞。因此,单独使用α9β1/α4β1整联蛋白抑制剂或与amd3100组合使用的骨内膜hsc的治疗靶向为用于干细胞移植应用的当前动员策略提供了有希望的替代方案。整联蛋白是非共价连接的αβ异二聚体跨膜蛋白,其主要功能为细胞粘着和细胞信号传导过程的介质。它们由α链和β链组成,每个链起到不同的作用,并具有对其活化和活性重要的不同金属结合位点。在哺乳动物中,已经鉴定了18个α链和8个β链,迄今描述了24种不同和独特的αβ组合。α4β1整联蛋白(很晚期抗原-4;vla-4)主要在白细胞上表达,已知是血管细胞粘着分子-1(vcam-1)、纤连蛋白和opn的受体。α4β1整联蛋白是白细胞募集、迁移和活化的关键调节因子,在炎症和自身免疫性疾病中起重要作用。因此,重点致力于开发用于治疗哮喘、多发性硬化和克罗恩病的α4β1整联蛋白功能的小分子抑制剂,其中几名候选物进行了到i期和ii期临床试验。pepinsky等人(2002)最近还研究了由itga9基因编码的整联蛋白α9,一种结构相似的整联蛋白。α9亚单位与β1亚单位形成异二聚体复合物,形成α9β1整联蛋白。虽然这种相关的整联蛋白α9β1与α4β1共享许多结构和功能特性,但整联蛋白α4β1和α9β1之间存在使得它们不同的差异。与主要表达在白细胞上的表达受限的α4β1不同的是,α9β1的细胞表达普遍存在。此外,虽然结合到几个相同的配体(包括vcam-1和opn),但是其他小分子与α9β1和α4β1整联蛋白的结合已被证明是不同的。如本文实施例所示,最大的差异在于解离率动力学。与α4β1相比,α9β1拮抗剂(r-bc154(ixb))以及bop显示出明显降低的对于α9β1的解离率。r-bc154(ixb)的详述在本文的实施例2中举例说明(图5c),bop的详述在pepinsky等(2002)中列举。之前,已经表明α4β1和α9β1整联蛋白均被造血干细胞(hsc)表达。整联蛋白α4β1和α9β1主要参与hsc与骨髓的螯合和募集以及hsc静止的维持,这是长期再生干细胞的关键特征。通过α4β1和α9β1整联蛋白的hsc调节通过与vcam-1和opn的相互作用介导,vcam-1和opn由骨衬成骨细胞、内皮细胞和骨髓环境的其它细胞表达和/或分泌。然而,如pepinsky等人(2002)所述,α4β1和α9β1之间对vcam-1和opn的结合亲和力的差异显著不同。α4β1的小分子抑制剂已被认为是有效的hsc动员剂。然而,尽管α4β1和α9β1之间的结构和功能具有相似性,但结合特征是不同的,因此α9β1整联蛋白在这方面的作用尚未开发。在本发明的一个优选实施方案中,α9整联蛋白的拮抗剂是α9β1整联蛋白的拮抗剂。因此,优选α9整联蛋白的拮抗剂是α9β1整联蛋白或其活性部分的拮抗剂。如本文所用,α9β1整联蛋白的活性部分或α4β1整联蛋白的活性部分是保留整联蛋白活性的α9β1蛋白或α4β1蛋白的一部分。也就是说,该部分是α9β1蛋白或α4β1蛋白的一部分,其小于完整的蛋白质,但仍然可以以与完整α9β1或α4β1蛋白相同或相似的方式起作用。在本文中使用术语“α9整联蛋白”或“α4整联蛋白”或“α9β1整联蛋白”或“α4β1整联蛋白”的情况下,其还包括所提及的其任何活性部分。类似地,如本文所用,cxcr4拮抗剂的活性衍生物是与cxcr4拮抗剂相似的保留cxcr4拮抗剂活性的化合物。在本文中使用术语“cxcr4拮抗剂”的情况下,其还包括所提及的其活性衍生物。在本发明的另一个实施方案中,α9整联蛋白、优选α9β1整联蛋白的拮抗剂也是α4整联蛋白、优选α4β1整联蛋白的拮抗剂。希望本发明的α9整联蛋白拮抗剂可以抑制α9β1整联蛋白和α4β1整联蛋白的活性。因此,优选拮抗剂是α9β1/α4β1整联蛋白拮抗剂。换句话说,优选拮抗剂与α4β1以及α9β1反应,即与两个整联蛋白交叉反应。α9整联蛋白、优选α9β1整联蛋白的拮抗剂可以与α4整联蛋白、优选α4β1整联蛋白的拮抗剂相同或不同。如果拮抗剂相同,可以使用单一拮抗剂来抑制α9整联蛋白和α4整联蛋白二者的活性。可以同时或依次使用分离的拮抗剂来抑制α9整联蛋白、优选α9β1整联蛋白和α4整联蛋白、优选α4β1整联蛋白。在本发明的另一个实施方案中,以下是优选的:α9整联蛋白、优选α9β1整联蛋白和α4整联蛋白、优选α4β1整联蛋白在与整联蛋白拮抗剂相互作用之前被活化。拮抗剂优选与内在活化的整联蛋白相互作用。因此,期望α9整联蛋白是内在活化的。优选地,α9β1整联蛋白是内在活化的。如上所述,期望α9β1整联蛋白/α4β1整联蛋白同时或相继地被活化,使得整联蛋白拮抗剂通过骨内膜龛中内在活化的α9/α4整联蛋白靶向hsc和祖细胞。整联蛋白活化是细胞调节整联蛋白功能的重要机制,通过在空间和时间上操控整联蛋白的配体亲和力。整联蛋白可以通过调节的蛋白质结合从内部活化,或可以通过多价配体结合从外部活化。与外部结构域结合的配体引起构象变化,其增加配体亲和力,修饰细胞质结构域中的蛋白质相互作用位点以及所得到的信号。因此,可以内在地或通过使用二价阳离子实现整联蛋白的活化。在本发明的另一个实施方案中,α9整联蛋白的拮抗剂,优选α9β1整联蛋白的拮抗剂,更优选α9β1/α4β1整联蛋白的拮抗剂包含具有下式的式(i)的化合物或其药学上可接受的盐:其中x选自键和–so2–;r1选自h、烷基、任选地被取代的芳基和任选地被取代的杂芳基;r2选自h和取代基;r3选自h和c1-c4烷基;r4选自h和–or6;r5选自h和–or7;条件是当r4是h时,则r5是–or7,且当r4是–or6时,则r5是h;r6选自h、c1-c4烷基、–(ch2)n-r8、–c(o)r9和–c(o)nr10r11;r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r8选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r9选自任选地被取代的环烷基、任选地被取代的杂环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r10和r11与它们所连接的氮一起形成任选地被取代的杂环烷基环;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在式(i)化合物的一组实施方案中:r4是h;r5是–or7;且x、r1、r2、r3和r7如在式(i)中所定义。在该类实施方案中,式(i)的化合物可具有式(ii)的结构:其中:x选自键和–so2–;r1选自h、烷基、任选地被取代的芳基和任选地被取代的杂芳基;r2选自h和取代基;r3选自h和c1-c4烷基;r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在式(i)或式(ii)的化合物的一组实施方案中:r7选自c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r12选自–cn、–o(c1-c4烷基)和任选地被取代的杂芳基;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n是1或2。在式(i)或式(ii)的化合物的一些实施方案中,r7选自c1-c4烷基。如本文所述的用于式(i)或式(ii)的基团的示例性的c1-c4烷基可以是直链或支链的。在一些实施方案中,c1-c4烷基可选自甲基、乙基、正丙基、异丙基、正丁基、仲丁基、异丁基和叔丁基。在一些实施方案中,r7可以是甲基或叔丁基,使得–or7是–och3或–oc(ch3)3。在式(i)或式(ii)的化合物的一些实施方案中,r7是–(ch2)n-r12。在该类实施方案中,r12可选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn,且n是1至3范围内的整数。在式(i)或式(ii)的化合物的一些实施方案中,r7是–(ch2)n-r12,其中r12可选自–cn、–o(c1-c4烷基)和任选地被取代的杂芳基,且n是1或2。在式(i)或式(ii)的化合物的一些实施方案中,r7是–(ch2)n-r12,其中:r12是–och3,且n是2,或r12是任选地被取代的四唑基(优选5-四唑基),且n是1。在式(i)或式(ii)的化合物的一些实施方案中,r7是–c(o)r13。在该类实施方案中,r13可选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基。在一组实施方案中,r13可以是任选地被取代的5-或6-元的环烷基环。示例性的环烷基环可以是环戊基或环己基。在一组实施方案中,r13可以是任选地被取代的芳基环。示例性的芳基环是苯基。在一组实施方案中,r13可以是任选地被取代的杂芳基环。示例性的杂芳基环是吡咯基。在式(i)或式(ii)的化合物的一些实施方案中,r7是–c(o)nr14r15。在式(i)或式(ii)的化合物的一些实施方案中,其中r7是–c(o)nr14r15,r14和r15可各自独立地选自c1-c4烷基和任选地被取代的芳基。在式(i)或式(ii)的化合物的一些特定的实施方案中,其中r7是–c(o)nr14r15,r14和r15各自是乙基或异丙基。在式(i)或式(ii)的化合物的一个特定的实施方案中,其中r7是–c(o)nr14r15,r14和r15之一是甲基,且r14和r15的另一个是苯基。在式(i)或式(ii)的化合物的一些实施方案中,其中r7是–c(o)nr14r15,r14和r15与它们所连接的氮一起可形成任选地被取代的杂环烷基环。在一种形式中,任选地被取代的杂环烷基环可以是任选地被取代的5-至7-元的杂环烷基环。特别的杂环烷基环可选自吡咯烷基、哌啶基、哌嗪基和吗啉基环。在式(i)或式(ii)的化合物的特定的实施方案中,r7是–c(o)nr14r15,其中r14和r15与它们所连接的氮一起形成任选地被取代的吡咯烷基环。在式(i)或式(ii)的化合物的一些特定的实施方案中:r7选自c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r12选自c1-c4烷基、–cn、–o(c1-c4烷基)和5-四唑基;r13是2-吡咯基;r14和r15各自独立地是c1-c4烷基,或r14和r15与它们所连接的氮一起形成任选地被取代的吡咯烷基或吗啉基环;且n是1或2。在式(i)的化合物的一组实施方案中,x是–so2-。在该类实施方案中,式(i)的化合物可具有式(iii)的结构:其中:r1选自h、烷基、任选地被取代的芳基和任选地被取代的杂芳基;r2选自h和取代基;r3选自h和c1-c4烷基;r4选自h和–or6;r5选自h和–or7;条件是当r4是h时,则r5是–or7,且当r4是–or6时,则r5是h;r6选自h、c1-c4烷基、–(ch2)n-r8、–c(o)r9和–c(o)nr10r11;r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r8选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r9选自任选地被取代的环烷基、任选地被取代的杂环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r10和r11与它们所连接的氮一起形成任选地被取代的杂环烷基环;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在式(iii)的化合物的一些实施方案中,r4是h,且r5是or7,提供式(iiia)的化合物:其中r1、r2和r3如式(iii)中所定义;r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在式(iiia)的一些实施方案中,r7选自c1-c4烷基(优选甲基或叔丁基)、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;其中r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n是整数,其选自1、2和3。在式(iiia)的特定的实施方案中,r7是–c(o)nr14r15,其中r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环。在一种形式中,任选地被取代的杂环烷基环可以是任选地被取代的5-至7-元的杂环烷基环。特别的杂环烷基环可选自吡咯烷基、哌啶基、哌嗪基和吗啉基环。在式(i)的一个特定的实施方案中,x是–so2-,r4是h,且r5是-or7,其中r7是–c(o)nr14r15,且r14和r15与它们所连接的氮一起形成吡咯烷基环。在该类实施方案中,式(i)的化合物可具有式(iiib)的结构:其中r1、r2和r3如本文所定义。在如本文所述的式(i)、(ii)、(iii)、(iiia)或(iiib)的化合物的一组实施方案中,r1是任选地被取代的芳基。在另一个实施方案中,r1是任选地被取代的杂芳基。在一些实施方案中,r1是任选地被取代的苯基。在另一个实施方案中,r1是任选地被取代的吡啶基。在一组实施方案中,r1是被至少一个卤素基团取代的苯基。卤素取代基可选自氯、氟、溴或碘、优选氯。在一些实施方案中,r1是被多个卤素基团取代的苯基。所述卤素取代基可位于苯基环的3-和5-位。在另一组实施方案中,r1是吡啶基。在该实施方案中,分子的剩余部分可位于吡啶基氮原子的间位。在一个实施方案中,式(i)的化合物可具有式(iva)、(ivb)或(ivc)的结构:其中在(iva)、(ivb)和(ivc)中的每一个中,r2、r3和r7如在式(i)中所定义。在式(iva)、(ivb)或(ivc)的化合物的一组实施方案中:r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在如本文所述的式(i)、(ii)、(iii)、(iiia)、(iiib)、(iva)、(ivb)或(ivc)的化合物的一些实施方案中,r3是h。在其中r3是h的实施方案中,式(i)的化合物可具有式(v)的结构:其中:x选自键和–so2–;r1选自h、烷基、任选地被取代的芳基和任选地被取代的杂芳基;r2选自h和取代基;r4选自h和–or6;r5选自h和–or7;条件是当r4是h时,则r5是–or7,且当r4是–or6时,则r5是h;r6选自h、c1-c4烷基、–(ch2)n-r8、–c(o)r9和–c(o)nr10r11;r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r8选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r9选自任选地被取代的环烷基、任选地被取代的杂环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r10和r11与它们所连接的氮一起形成任选地被取代的杂环烷基环;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在式(v)的化合物的一些实施方案中,r4是h,且r5是or7,提供式(va)的化合物:其中x、r1、r2和r7如式(v)中所定义。在式(va)的化合物的一些实施方案中,r7选自c1-c4烷基(优选甲基或叔丁基)、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;其中r12、r13、r14、r15和n如本文对式(v)所定义。在式(va)的化合物的特定的实施方案中,r7是–c(o)nr14r15,其中r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环。在一种形式中,任选地被取代的杂环烷基环可以是任选地被取代的5-至7-元的杂环烷基环。特别的杂环烷基环可选自吡咯烷基、哌啶基、哌嗪基和吗啉基环。在式(v)或(va)的化合物的一些实施方案中,x是–so2-。在式(va)的化合物的一个特定的实施方案中,x是–so2-,r3和r4各自是h,且r5是–or7,其中r7是–c(o)nr14r15,且r14和r15与它们所连接的氮一起形成吡咯烷基环。在该类实施方案中,式(v)的化合物可具有式(vb)的结构:在式(v)或(va)的化合物的一组实施方案中,r1是任选地被取代的芳基、优选任选地被取代的苯基。任选的取代基优选是至少一个选自氯、氟、溴或碘的卤素基团,优选氯。在一组实施方案中,r1是被至少一个卤素基团取代的苯基。在一些实施方案中,r1是被多个卤素基团取代的苯基。卤素取代基优选位于苯基环的3-和5-位。在一个实施方案中,式(v)的化合物可具有式(via)、(vib)或(vic)的结构:其中在(via)和(vib)中的每一个中,r2和r7如在式(v)中所定义。在式(via)、(vib)或(vic)的化合物的一组实施方案中:r7选自h、c1-c4烷基、–(ch2)n-r12、–c(o)r13和–c(o)nr14r15;r12选自任选地被取代的烷基、任选地被取代的芳基、任选地被取代的杂芳基、–o(c1-c4烷基)、–c(o)-(c1-c4烷基)、–c(o)o-(c1-c4烷基)和–cn;r13选自任选地被取代的环烷基、任选地被取代的芳基和任选地被取代的杂芳基;r14和r15各自独立地选自c1-c4烷基和任选地被取代的芳基,或r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环;且n每次出现时为1至3范围内的整数。在式(via)、(vib)或(vic)的化合物中的另一组实施方案中,r7选自甲基、叔丁基、–(ch2)n-r12,其中r12选自–cn、–ch3、-c(ch3)3和任选地被取代的杂芳基(优选5-四唑基),且n是1或2。在式(via)、(vib)或(vic)的化合物中的另一组实施方案中,r7是–c(o)r13,其中r13选自任选地被取代的环烷基(优选环戊基或环己基)、任选地被取代的芳基(优选苯基)和任选地被取代的杂芳基(优选吡咯基)。在式(via)、(vib)或(vic)中的另一个实施方案中,r7是–c(o)nr14r15,其中r14和r15与它们所连接的氮一起形成任选地被取代的杂环烷基环。在一种形式中,任选地被取代的杂环烷基环可以是任选地被取代的5-至7-元的杂环烷基环。特别的杂环烷基环可选自吡咯烷基、哌啶基、哌嗪基和吗啉基环。在一个特定的实施方案中,式(i)的化合物具有式(viia)的结构:其中r2和r3如在式(i)中所定义。在式(i)的化合物的一组实施方案中,r3是h,提供以下式(viiia)的化合物:其中r2选自h和取代基。在式(i)的化合物的一种形式中,r2是h,提供以下式(ixa)的化合物或其可药用盐:在一个优选的特定实施方案中,式(i)的化合物是以下式(ic)的化合物或其可药用盐:在另一个特定的实施方案中,式(i)的化合物具有式(viib)的结构:其中r2和r3如在式(i)中所定义。在式(i)的化合物的一组实施方案中,r3是h,提供以下式(viiib)的化合物:其中r2选自h和取代基。在式(i)的化合物的一种形式中,r2是h,提供以下式(id)的化合物或其可药用盐:在一个优选的特定实施方案中,式(i)的化合物是以下式(ie)的化合物或其可药用盐:如本文所述,在式(i)、(ii)、(iii)、(iiia)、(iiib)、(iva)、(ivb)、(ivc)、(v)、(va)、(vb)、(via)、(vib)、(vic)、(viia)、(viib)、(viiia)或(viiib)的化合物中,r2在一些实施方案中可以是取代基。在一组实施方案中,r2是取代基,其选自任选地被取代的杂芳基、任选地被取代的杂环烷基、任选地被取代的环烷基、羟基、氨基和叠氮基,或r2是具有式(a)的结构的取代基:其中y是任选地被取代的杂芳基或任选地被取代的杂芳基-c(o)nh-;连接基选自–(ch2)p–和–(ch2ch2o)p–或其任意组合;p每次出现时为1至4的范围内的整数;且z是荧光团(优选罗丹明基团)。在式(i)、(ii)、(iii)、(iiia)、(iiib)、(iva)、(ivb)、(ivc)、(v)、(va)、(vb)、(via)、(vib)、(vic)、(viia)、(viib)、(viiia)或(viiib)的化合物的一些实施方案中,r2是任选地被取代的杂芳基。适合的任选地被取代的杂芳基可包含5至10个环原子和至少一个选自o、n和s的杂原子。任选地被取代的杂芳基可以是单环或二环。在一些实施方案中,r2可以是杂芳基,其选自吡唑、咪唑、1,2,3-三唑、1,2,4-三唑、四唑、吲唑、4,5,6,7-四氢吲唑和苯并咪唑、在式(i)、(ii)、(iii)、(iiia)、(iiib)、(iva)、(ivb)、(v)、(va)、(vb)、(via)、(vib)、(vii)或(viii)的化合物的一些实施方案中,r2是任选地被取代的杂环烷基。适合的任选地被取代的杂环烷基可包含3至10个环原子、优选4至8个环原子和至少一个选自o、n和s的杂原子。任选地被取代的杂环烷基可以是单环或二环。在一些实施方案中,r2可以是任选地被取代的杂环烷基,其选自任选地被取代的氮杂环丁烷、吡咯烷、哌啶、氮杂环庚烷、吗啉和硫吗啉。在一些实施方案中,r2可以是任选地被取代的哌啶。在一些实施方案中,哌啶可以被至少一个c1-c4烷基取代基取代。在一些实施方案中,c1-c4烷基取代基可以是甲基。在一些实施方案中,r2可选自2-甲基哌啶、3-甲基哌啶、4-甲基哌啶、3,5-二甲基哌啶和3,3-二甲基哌啶。当r2是任选地被取代的杂芳基或任选地被取代的杂环烷基时,r2可以通过杂芳基或杂环烷基环上的杂原子连接于式(i)、(ii)、(iii)、(iiia)、(iiib)、(iva)、(ivb)、(v)、(va)、(vb)、(via)、(vib)、(vii)或(viii)的化合物的吡咯烷环。例如,当r2是选自吡唑、咪唑、1,2,3-三唑、1,2,4-三唑、四唑、吲唑、4,5,6,7-四氢吲唑和苯并咪唑的杂芳基时,或当r2是选自任选地被取代的氮杂环丁烷、吡咯烷、哌啶、氮杂环庚烷、吗啉和硫吗啉的任选地被取代的杂环烷基时,则r2通过杂芳基或杂环烷基的氮(n)杂原子以共价方式连接于化合物的剩余部分。在式(i)、(ii)、(iii)、(iiia)、(iiib)、(iva)、(ivb)、(v)、(va)、(vb)、(via)、(vib)、(vii)或(viii)的化合物的一些实施方案中,r2是具有式(a)的结构的取代基:其中y是任选地被取代的杂芳基;或任选地被取代的杂芳基-c(o)nh-;连接基选自–(ch2)p–和–(ch2ch2o)p–或其任意组合;p每次出现时为1至4的范围内的整数;且z是荧光团(优选罗丹明基团)。在一些实施方案中,y可选自三唑或三唑-c(o)nh-。在一些实施方案中,y可以是三唑或三唑-c(o)nh-,使得式(a)的结构为式(a1)或(a2):在一些实施方案中,连接基可选自–(ch2)p–和–(ch2ch2o)p–或其任意组合,其中p每次出现时为1至4的范围内的整数。在一些实施方案中,连接基可以为式(a3)或(a4):其中p每次出现时为1至4的范围内的整数。在式(a)、(a1)、(a2)、(a3)或(a4)的一些实施方案中,z是罗丹明荧光团,其选自以下基团:在一个特定的实施方案中,式(i)的化合物具有以下的式(ixa):在另一个特定的实施方案中,式(i)的化合物具有以下的式(ixb):不希望受理论所束缚,据信本文所述式的化合物中的吡咯烷氨基甲酸酯部分对于确保对α9整联蛋白、更特别α9β1整联蛋白或其活性部分的高结合亲和力是重要的。还认为羧酸官能度对于拮抗剂活性是必需的。在上面的描述中,使用了许多术语,这些术语是技术人员熟知的。然而,为了清楚起见,许多术语定义如下。如本文所用,术语“未取代的”是指不存在取代基或仅有的取代基是氢。在整个说明书中使用的术语“任选地取代的”表示该基团可以或可以不被一个或多个非氢取代基进一步取代或稠合(以形成稠合的多环体系)。在某些实施方案中,取代基是一个或多个独立地选自以下的基团:卤素、=o、=s、-cn、-no2、-cf3、-ocf3、烷基、烯基、炔基、卤代烷基、卤代烯基、卤代炔基、杂烷基、环烷基、环烯基、杂环烷基、杂环烯基、芳基、杂芳基、环烷基烷基、杂环烷基烷基、杂芳基烷基、芳基烷基、环烷基烯基、杂环烷基烯基、芳基烯基、杂芳基烯基、环烷基杂烷基、杂环烷基杂烷基、芳基杂烷基、杂芳基杂烷基、羟基、羟基烷基、烷基氧基、烷基氧基烷基、烷基氧基环烷基、烷基氧基杂环烷基、烷基氧基芳基、烷基氧基杂芳基、烷基氧基羰基、烷基氨基羰基、烯基氧基、炔基氧基、环烷基氧基、环烯基氧基、杂环烷基氧基、杂环烯基氧基、芳基氧基、苯氧基、苄氧基、杂芳基氧基、芳基烷基氧基、氨基、烷基氨基、酰氨基、氨基烷基、芳基氨基、磺酰氨基、亚磺酰基氨基、磺酰基、烷基磺酰基、芳基磺酰基、氨基磺酰基、亚磺酰基、烷基亚磺酰基、芳基亚磺酰基、氨基亚磺酰基氨基烷基、c(=o)oh、-c(=o)re、c(=o)ore、c(=o)nrerf、c(=noh)re、c(=nre)nrfrg、nrerf、nrec(=o)rf、nrec(=o)orf、nrec(=o)nrfrg、nrec(=nrf)nrgrh、nreso2rf、-sre、so2nrerf、-ore、oc(=o)nrerf、oc(=o)re和酰基,其中re和rf、rg和rh各自独立地选自h、c1-c4烷基、c1–c12卤代烷基、c2-c12烯基、c2-c12炔基、c1-c10杂烷基、c3-c6环烷基、c3-c12环烯基、c5-c6杂环烷基、c1–c12杂环烯基、c6芳基和c1-c5杂芳基,或者当re和rf与它们所连接的原子一起时形成具有3至12个环原子的环状或杂环环系统。在某些实施方案中,任选的取代基可以选自卤素、烷基、环烷基、杂环烷基、芳基、杂芳基、芳基烷基、-c(o)re、-c(o)ore、-c(o)nrerf、-ore、-oc(o)nrerf、oc(o)re和酰基,其中re和rf各自独立地选自h、c1-c4烷基、c3-c6环烷基、c5-c6杂环烷基、c6芳基和c1-c5杂芳基,或当re和rf与它们所连接的原子一起时形成具有3至12个环原子的环状或杂环环系统。除非另有说明,作为基团或部分基团的“烷基”是指直链或支链的脂族烃基,优选c1–c12烷基,更优选c1-c10烷基,最优选c1-c4。适当的直链和支链的c1-c4烷基取代基的实例包括甲基、乙基、正丙基、2-丙基、正丁基、仲丁基和叔丁基。所述基团可以是端基或桥连基。作为基团或基团的一部分的“芳基”是指(i)优选每个环具有5至12个原子的任选地被取代的单环或稠合多环芳族碳环(具有环原子全部为碳原子的环结构)。芳基的实例包括苯基、萘基等;(ii)任选地被取代的部分饱和的双环芳族碳环部分,其中苯基和c5-7环烷基或c5-7环烯基稠合在一起形成环状结构,如四氢萘基、茚基或茚满基。该基团可以是端基或桥连基。通常,芳基是c6-c18芳基。“键”是化合物或分子中的原子之间的连接。在本文所述的式(i)化合物的一组实施方案中,所述键是单键。除非另有说明,“环烷基”是指饱和的单环或稠合或螺环多环,碳环优选每个环含有3至9个碳,如环丙基、环丁基、环戊基、环己基等。它包括单环系统(如环己基)、双环体系如萘烷以及多环体系如金刚烷。环烷基通常为c3-c12烷基。该基团可以是端基或桥连基。“卤素”表示氯、氟、溴或碘。“杂芳基”单独或作为基团一部分是指包含在芳环中具有一个或多个作为环原子的杂原子、其余环原子为碳原子的芳环(优选为5或6元芳环)的基团。合适的杂原子可以选自氮、氧和硫。所述基团可以是单环或双环杂芳基。杂芳基的实例包括噻吩、苯并噻吩、苯并呋喃、苯并咪唑、苯并噁唑、苯并噻唑、苯并异噻唑、萘并[2,3-b]噻吩、呋喃、异中氮茚(isoindolizine)、氧杂蒽酮(xantholene)、phenoxatine、吡咯、咪唑、吡唑、吡啶、吡嗪、嘧啶、哒嗪、四唑、吲哚、异吲哚、1h-吲唑、嘌呤、喹啉、异喹啉、2,3-二氮杂萘、萘啶、喹喔啉、噌啉、咔唑、菲啶、吖啶、吩嗪、噻唑、异噻唑、吩噻嗪、噁唑、异噁唑、呋咱、吩噁嗪、2-、3-或4-吡啶基、2-、3-、4-、5-或8-喹啉基、1-、3-、4-或5-异喹啉基、1-、2-或3-吲哚基、和2-或3-噻吩基。杂芳基通常是c1-c18杂芳基。该基团可以是端基或桥连基。“杂环烷基”是指在至少一个环中含有至少一个选自氮、硫、氧的杂原子、优选1-3个杂原子的饱和单环、双环或多环。每个环优选为3-至10-元,更优选为4-至7-元。合适的杂环烷基的实例包括吡咯烷基、四氢呋喃基、四氢噻吩基、哌啶基、哌嗪基、四氢吡喃基和吗啉代。该基团可以是端基或桥连基。应理解,式(i)化合物家族为异构体形式,其包括非对映异构体、对映异构体和互变异构体、以及“e”或“z”构型的几何异构体或e和z异构体的混合物。还应当理解,一些异构形式如非对映异构体、对映异构体和几何异构体可以通过物理和/或化学方法和由本领域技术人员分离。对于存在几何异构可能性的那些化合物而言,虽然将认识到其它异构体可能为正确结构归属,但是申请人已经画出了化合物所认为的异构体。公开的实施方案的一些化合物可作为单一立体异构体、外消旋物和/或对映异构体和/或非对映异构体的混合物存在。所有此类单立体异构体、外消旋物及其混合物旨在为描述和要求保护的主题范围内。此外,式(i)在适用的情况下旨在涵盖化合物的溶剂化和非溶剂化形式。因此,每个式包括具有指定结构的化合物,包括水合物和非水合形式。式(i)还旨在包括化合物的药学上可接受的盐。术语“药学上可接受的盐”指保持以上鉴定的化合物的所需生物活性的盐,并且包括药学上可接受的酸加成盐和碱加成盐。式(i)的化合物的适合药学上可接受的酸加成盐可由无机酸或有机酸制备。此类无机酸的实例为盐酸、硫酸和磷酸。适当有机酸可选自脂肪族、环脂族、芳族、杂环、羧酸和磺酸类有机酸,其实例为甲酸、乙酸、丙酸、琥珀酸、乙醇酸、葡糖酸、乳酸、苹果酸、酒石酸、柠檬酸、延胡索酸、马来酸、烷基磺酸和芳基磺酸。类似地,碱加成盐可以通过本领域熟知的方法使用有机或无机碱来制备。合适的有机碱的实例包括单胺如甲胺、乙胺、三乙胺等。合适的无机碱的实例包括naoh、koh等。在remington'spharmaceuticalsciences,第19版,mackpublishingco.,easton,pa1995中可找到另外关于药学上可接受的盐的信息。在试剂为固体的情况下,本领域的技术人员应理解发明化合物、试剂和盐可呈不同结晶或多晶型物形式存在,其全部旨在为本发明和指定式的范围内。在本发明的另一个优选实施方案中,提供了一种用于在体内或离体增强hsc及其前体和其祖细胞从bm干细胞结合配体的释放的方法,所述方法包括在体内或离体向bm干细胞龛施用有效量的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分。一旦hsc从bm干细胞结合配体迁移,它们不再锚定到bm上,并且可以从bm中释放并进入细胞周期进行增殖和分化。或者,它们可以保留在bm中并进入bm中的细胞周期。在另一个优选的实施方案中,本发明提供了一种在在体内或离体增强hsc及其前体和其祖细胞从bm干细胞龛的动员的方法,所述方法包括在在体内或离体向bm干细胞龛施用有效量的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分。由于hsc被迁移和释放,hsc可以被动员到pb。移动和释放对于实现动员至关重要。加强的hsc的释放将使更多的细胞被动员。在本发明的另一个优选实施方案中,所述方法在存在或不存在g-csf的情况下进行。优选地,所述方法在不存在g-csf的情况下进行。虽然临床上g-csf是对于hsc最广泛使用的动员剂,但其缺点包括潜在的毒副作用、相对长的治疗过程(连续注射5-7天)和患者的可变响应性。因此,本发明的优点是可以在不存在g-csf的情况下进行有效的动员,基本上可以避免毒副作用。作为7跨膜蛋白的cxc趋化因子受体4(cxcr4)与鸟嘌呤核苷酸结合蛋白偶联。cxcr4在造血起源细胞中广泛表达,是人类免疫缺陷病毒1(hiv-1)的cd4+的主要共同受体。在正常生理条件下,cxcr4主要在造血和免疫系统中表达。cxcr4对于趋化因子配体12(cxcl12)是特异性的,cxcl12也称为基质衍生因子-1(sdf-1)。作为稳态趋化因子,sdf-1是8kda趋化因子肽。像其他趋化因子一样,sdf-1与其受体结合以促进细胞定向迁移到主要位于骨髓基质细胞中的具有67个氨基酸残基的特定位置(趋化性)。已开发cxcr4拮抗剂以阻断sdf-1/cxcr4相互作用。cxcr4拮抗剂plerixafor于2008年被fda批准用于动员造血干细胞。与bop一起使用的合适的cxcr4拮抗剂包括但不限于bicyclam衍生物(例如amd3100)、四氢喹啉衍生物(例如amd070、amd11070和gsk812397),环肽(例如t140、tc14012、tn14003、fc131和fc122)、基于对亚二甲苯二胺的衍生物(例如amd36465、wz811和msx122),异硫脲衍生物和其它cxcr4拮抗剂如pol6326、pol5551、ccte-9908和tg-0054。优选地,cr+xcr4拮抗剂是amd3100。amd3100(l,r-[l,4-亚苯基双(亚甲基)]双[1,4,8,11-四氮杂环十四烷]八氢溴酸盐脱水物;也称为plerixafor)是已知的cxcr4拮抗剂,已经被美国食品和药物管理局批准用于动员造血干细胞。虽然已经确定amd3100在体外是cxcr4的拮抗剂,但它似乎比单纯的体内cxcr4拮抗作用具有更多的活性。本发明中使用的“造血干细胞”是指能够最终分化为所有血细胞(包括红细胞、白细胞、巨核细胞和血小板)的多能干细胞。这可能涉及分化成祖细胞或胚细胞的中间阶段。因此,术语“造血干细胞”、“hsc”、“造血祖细胞”、“hpc”、“祖细胞”或“胚细胞”在本发明中可互换使用,并描述具有降低的分化潜能但仍然能够成熟成不同的特定谱系的细胞(例如骨髓或淋巴谱系)的hsc。“造血祖细胞”包括红细胞系爆发形成单位、粒细胞、红细胞、巨噬细胞、巨核细胞集落形成单位、粒细胞、红细胞、巨噬细胞和粒细胞巨噬细胞集落形成单位。本发明涉及增强hsc及其前体和其祖细胞从bm干细胞结合配体的迁移。一旦迁移,细胞可以从bm干细胞龛被释放,在那里它们可以保留或优选被释放并被动员到pb中。这些细胞具有造血重构能力。本发明提供了一种通过从bm干细胞龛(优选最靠近骨内膜龛内的骨/bm界面)或从中央髓腔迁移hsc来增强hsc动员的方法。更优选地,从骨内膜龛内的骨/bm界面动员hsc,因为这些细胞已被证明相对于从中央髓腔分离的hsc给予更长的、多谱系造血重构。迁移、释放或动员的细胞类型还可以在鼠群体中找到,其选自富集lin-sca-1+ckit+(本文称为lsk)细胞的bm衍生祖细胞或富集lskcd150+cd48-细胞(这里称为lskslam)的干细胞。这些等同的鼠群体提供了可以通过使用α9整联蛋白或其活性部分的拮抗剂从bm干细胞龛迁移、释放或动员的细胞类型的指示。优选地,所述细胞类型等同于在富集lskcd150+cd48-细胞(lskslam)的干细胞中发现的那些细胞类型。优选地,被迁移、释放或动员的细胞是骨内膜祖细胞,并且选自cd34+、cd38+、cd90+、cd133+、cd34+cd38-细胞、谱系-定型cd34-细胞或cd34+cd38+细胞。最优选的是人细胞。本发明可以在在体内或离体进行。即α9拮抗剂,优选α9β1的拮抗剂,更优选α9β1/α4β1的拮抗剂可以与cxcr4拮抗剂或其活性部分一起在体内施用于有需要的受试者或施用于离体样品以从bm动员hsc。本文所用的“受试者”包括所有动物,包括哺乳动物和其他动物,包括但不限于伴侣动物、农场动物和动物园动物。术语“动物”可以包括任何存活的多细胞脊椎动物生物、包括例如哺乳动物、鸟、猿猴、狗、猫、马、牛、啮齿动物等的类别。同样,术语“哺乳动物”包括人类和非人类的哺乳动物。本发明涉及增强hsc迁移、释放或动员。如本文使用的“增强”是指细胞或生物体的性能的改善或特定参数的其他生理上有益的增加。有时,可以将现象的增强量化为特定参数的测量值的减小。例如,干细胞的迁移可以被测量为在循环系统中循环的干细胞的数量的减少,但是这仍然可以表示这些细胞迁移到它们可以执行或促进有益的生理结果的身体区域的增强,所述有益的生理结果包括但不限于分化为替代或矫正损失或损坏的功能的细胞。同时,由于hsc从bm迁移到pb,增强可被测量为外周血中任何一种细胞类型的增加。增强可指循环干细胞数量减少15%、20%、25%、30%、35%、40%、45%或50%以上,或者可表示循环干细胞数量增加15%、20%、25%、30%、35%、40%、45%或大于50%。干细胞迁移的增强可导致或被测量为非造血系的细胞群减少例如15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、70%、75%或细胞群更大的减少或细胞群的响应。换言之,增强的参数可以被认为是干细胞的转运。在一个实施方案中,增强的参数是干细胞从诸如bm的组织源释放。在一个实施方案中,增强的参数是干细胞的迁移。在另一个实施方案中,参数是干细胞的分化。在一个实施方案中,静脉内、皮内、皮下、肌内、透皮或粘膜施用α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分;任选地,静脉内或皮下施用所述拮抗剂。在另一个实施方案中,将α9整联蛋白拮抗剂和cxcr4拮抗剂分别或组合施用,使得α9整联蛋白拮抗剂和cxcr4拮抗剂的施用可以共同作用以提供hsc从bm向pb的动员的协同结果。α9整联蛋白拮抗剂和cxcr4拮抗剂可以组合、同时或依次施用。在本发明的另一个方面提供了一种组合物,其用于增强来自bm干细胞龛中bm干细胞结合配体的hsc的迁移,所述组合物包含本文所述的α9整联蛋白的拮抗剂和cxcr4拮抗剂或其活性部分。更优选地,拮抗剂是如本文所述的α9整联蛋白拮抗剂。最优选地,拮抗剂是如本文所述的α4β1/α9β1整联蛋白拮抗剂。优选地,cxcr4拮抗剂是amd3100或其活性部分。在一个优选的实施方案中,组合物增强hsc从bm干细胞龛中的bm干细胞结合配体的释放。更优选地,该组合物增强hsc从bm干细胞龛至pb的迁移或动员。所述组合物可以是药物组合物,其还包含药学上可接受的载体。在组合物中如本文所述的α9整联蛋白的拮抗剂可以单独提供或与α9整联蛋白、α4整联蛋白、α9β1整联蛋白、α4β1整联蛋白的另外的拮抗剂组合提供,或者其可以是α9β1/α4β1整联蛋白的组合拮抗剂。拮抗剂可以相同或不同,但都将起至少α9整联蛋白的拮抗剂的作用。在本发明的另一个方面提供了如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分在制备药物中的用途,所述药物用于增强hsc及其前体和其祖细胞从患者bm干细胞结合配体的迁移。本文描述的方法包括组合物和药物组合物的制备和使用,其包含作为用于增强hsc及其前体和其祖细胞从bm干细胞结合配体的迁移的活性成分的本文所述的α9整联蛋白的拮抗剂和cxcr4拮抗剂或其活性部分。优选地,增强了hsc的释放。更优选地,增强hsc动员。药物组合物通常包含药学上可接受的载体。如本文所用的措辞“药学上可接受的载体”包括本领域技术人员已知的可与药物施用配伍的盐水、溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。补充的活性化合物也可以掺入到组合物中,例如生长因子例如g-csf。可以使用更具体的载体,包括环糊精,优选丙基环糊精,更优选羟丙基环糊精。这可以以0-20%的范围、优选以5、6、7、8、9、10、11、12、13、14或15%、更优选以10%存在。药物组合物通常被配制成可与预期施用途径相容。施用途径的实例包括肠胃外,例如静脉内,皮内,皮下,透皮(局部),透粘膜,腹膜内和直肠施用。优选地,将如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分皮下或静脉内施用。这些化合物可以组合、同时或依次施用。在一些实施方案中,将药物组合物配制成将本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分靶向递送至骨髓、优选至bm干细胞龛、更优选至bm干细胞龛的骨内膜龛。例如,在一些实施方案中,可将与cxcr4拮抗剂或其活性部分组合的如本文所述的α9整联蛋白的拮抗剂配制在脂质体纳米混悬剂和包合配合物(例如与环糊精)中,其可以更有针对性地递送至bm同时减少副作用。药物组合物可以与施用说明书一起包含在容器、包装或分配器中。在本发明的另一个方面,提供了从受试者收获hsc的方法,所述方法包括:将有效量的如本文所述的α9整联蛋白或其活性部分的拮抗剂和cxcr4拮抗剂或其活性部分施用于受试者,其中所述有效量增强hsc及其前体和祖细胞从bm干细胞龛中的bm干细胞结合配体的迁移;将迁移的hsc动员至pb;和从pb收获hsc。优选地,在没有g-csf的情况下施用α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分。如本文所述的化合物如α9β1整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分的增强hsc及其前体和其祖细胞从bm干细胞龛中的bm干细胞结合配体的迁移用途,能使得细胞最终动员至pb用于进一步收集。细胞可以自然地从bm中动员和排出,或者这些细胞可以通过使用其它hsc动员剂(例如但不限于白细胞介素-17、环磷酰胺(cy)、多西他赛和粒细胞集落刺激因子(g-csf))被激发而动员。在一个实施方案中,认为细胞一旦被收获,就可以返回到身体以补充或补足患者的造血祖细胞群(同源或自体移植),或者被移植到另一个患者以补充其造血祖细胞群(异源的或同种异体移植)。在个体经过化疗期之后的情况中,这可能是有利的。此外,还有一些遗传病症,如地中海贫血、镰状细胞性贫血、先天性角化不良、舒-戴二氏综合征和diamond-blackfan贫血,其中hsc和hpc数量降低。因此,本发明的方法在增强hsc漂移、释放或动员中可能是有用的和适用的。骨髓移植的接受者可能具有有限的骨髓储备,例如老年受试者或者以前暴露于免疫降低治疗如化学疗法的受试者。与对照血细胞水平相比,受试者可能具有降低的血细胞水平或具有发展为降低的血液细胞水平的风险。如本文所用,术语“对照血细胞水平”是指在改变受试者中的血细胞水平的事件之前的或实质上不存在所述事件的受试者的血细胞平均水平。改变受试者血细胞水平的事件包括例如贫血、创伤、化疗、骨髓移植和放射治疗。例如,受试者由于例如创伤而导致贫血或失血。通常,向供体施用有效量的α9整联蛋白拮抗剂如α9β1整联蛋白拮抗剂、更优选α9β1/α4β1整联蛋白拮抗剂和cxcr4拮抗剂,以诱导hsc从bm的迁移、释放或优选动员,以及至pb的释放和动员。一旦将hsc动员至pb,血液的收集和hsc的分离可以使用通常可用于供血的方法进行,例如但不限于血库中使用的那些技术。在一些实施方案中,一旦从已经使用如本文所述的α9整联蛋白拮抗剂治疗的受试者获得了pb或bm,则可以使用标准方法如血液成分部分清除或白细胞分离术从其中分离hsc。优选地,用于人的整联蛋白拮抗剂的有效量在25-1000μg/kg体重、更优选50-500μg/kg体重、最优选50-250μg/kg体重的范围内。有效量可以选自50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240或250μg/kg体重。优选地,用于人的cxcr4拮抗剂的有效量在10-1000ug/kg体重、更优选10-500ug/kg体重、最优选10-250ug/kg体重的范围内。有效量可以选自10、20、30、40、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240或250μg/kg体重。取决于α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分的所用量,迁移、释放或优选动员可立即发生。然而,可以在施用后约1小时内收获hsc。α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分的实际时间和量可以根据多种因素而变化,包括但不限于受试者的生理状况(包括年龄、性别、疾病类型和阶段、一般身体状况、对给定剂量的响应性、期望的临床效果)和施用途径。临床和药理学领域的技术人员将能够通过常规实验和使用对照曲线来确定有效量。本发明认为的术语“对照曲线”被认为是指通过在相同条件下测量不同浓度的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分的hsc迁移、释放或动员特征而产生的统计学和数学上相关的曲线,并且其中细胞可以以规则的时间间隔收获和计数。本发明考虑的这些“对照曲线”可以用作在随后的情况下评价不同施用浓度的一种方法。本发明认为的术语“收获造血干细胞”、“收获造血祖细胞”、“收获hsc”或“收获hpc”被认为是指从pb中分离细胞并被认为是本领域技术人员会明白的技术。任选地收集、分离细胞,并任选地进一步扩增,产生甚至更大的hsc群体和分化的后代。在本发明的另一个方面,提供了包含由本文所述的方法获得的hsc的细胞组合物,所述方法包括施用有效量的本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分以增强hsc从bm到pb的迁移、释放或动员。由于hsc的迁移增加,假定更多的hsc可以被释放到bm干细胞龛,以便随后动员到pb。因此,从已经向bm干细胞龛施用有效量的α9整联蛋白或其活性部分的拮抗剂的受试者收获的细胞组合物将富含hsc。优选地,细胞组合物将富含骨内膜龛的细胞,并且是选自cd34+、cd38+、cd90+、cd133+、cd34+cd38-细胞、谱系-定型cd34-细胞或cd34+cd38+细胞的骨内膜祖细胞。在本发明的另一个方面,提供了一种用于治疗血液病的方法,所述方法包括施用包含由本文所述方法获得的hsc的细胞组合物,所述方法包括施用有效量的如本文所述的α9整联蛋白拮抗剂以及cxcr4拮抗剂或其活性部分,以增强hsc从bm向pb的迁移、释放或动员。在本发明的另一个方面,提供了一种治疗受试者血液病的方法,所述方法包括将治疗有效量的本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分施用于受试者以加强hsc从bm到pb的迁移、释放或动员。在另一个优选的实施方案中,所述血液病是造血性肿瘤性疾病,并且所述方法涉及化学敏化hsc以改变hsc的易感性,使得已经变得无效的化学治疗剂变得更有效。白血病治疗中长期存在的问题是以下概念:处于休眠状态的恶性细胞可能逃避细胞毒性剂的作用,使其能够驱动复发。虽然对控制癌细胞休眠已经做了很多努力,但很少有人专注于微环境的作用,特别是骨髓干细胞龛。最近,已经有数据证明已知在骨髓中锚定正常造血干细胞的细胞外基质分子osp,也在支持白血病细胞、特别是急性淋巴细胞性白血病(all)的休眠中起作用(通过将它们锚定在骨髓微环境的关键区域中)。此外,额外的数据显示复发的all具有显著升高的整联蛋白α4β1的水平。本文提供的数据表明,与α9β1及其细胞外基质配体相互作用竞争的药物将诱导这些细胞进入细胞周期,使其易受细胞毒性化疗的侵袭。因此,bop或α9拮抗剂、优选α9β1拮抗剂、更优选α9β1/α4β1拮抗剂可以与任何cxcr4拮抗剂组合使用,以增强hsc迁移、释放和动员进入外周血,或增加白血病细胞对化疗的敏感性。在一些实施方案中,本文描述的方法包括治疗需要增加干细胞数量的血液病患者的方法。在一些另外的实施方案中,受试者被预定为或计划捐献干细胞如hsc,例如用于异源或自体移植。通常,所述方法包括将治疗有效量的本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分施用于需要或已经确定需要所述治疗的受试者。施用用于治疗这些受试者的治疗有效量的本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分将导致pb或bm中hsc的数量和/或频率增加。本文所用的“治疗”是指治疗性治疗和预防性或防范性措施,其中目的是预防或减缓(减轻)靶向的病症、疾病或障碍(统称为“疾病”),即使治疗最终不成功。那些需要治疗的人可能包括那些已经患有疾病的人、以及那些容易患有疾病或要预防疾病的人。“有效量”是足以实现pb或bm中hsc的数量和/或频率的显著增加或减少的量。有效量可以以一种或多种施用、应用或剂量施用。本文所用的“治疗有效量”是指足以在被治疗的受试者中达到期望的效果的特定组合物或组合物中活性剂的量。例如,这可以是对增强补充、修复或恢复组织的hsc的迁移有效的量。在另一个实施方案中,“治疗有效量”是有效增强hsc转运的量,例如增加hsc的释放,正如血流中循环干细胞水平升高所证明的那样。在另一个实施方案中,“治疗有效量”是有效地增强hsc从循环系统到各种组织或器官的归龛和迁移的量,如血液中循环hsc和/或与归龛和迁移相关的表面标记的表达的水平的降低可以证明。治疗有效量可以根据多种因素而变化,包括但不限于受试者的生理状况(包括年龄,性别,疾病类型和阶段,一般身体状况,对给定剂量的响应性,期望的临床效果)和施用途径。临床和药理领域的技术人员将能通过常规实验来确定治疗有效量。组合物可以每天一次或多次至每周一次或多次施用;包括每隔一天一次施用。技术人员将理解,某些因素可能影响有效治疗受试者所需的剂量和时间,包括但不限于先前的治疗、受试者的一般健康和/或年龄以及存在的其他疾病。此外,用有效量的本文所述的组合物治疗受试者可包括单次治疗或一系列治疗。在一些实施方案中,所述施用将导致pb中hsc的数量增加约10-200倍。在一些实施方案中,所述施用将导致pb中cd34+细胞增加约2-6倍。化合物的剂量、毒性和治疗功效可以通过标准药物程序来确定,例如在细胞培养物或实验动物中,例如用于测定ld50(对群体50%致死的剂量)和ed50(在50%群体中治疗有效的剂量)的标准药物程序。毒性和治疗效果之间的剂量比是治疗指数,可以表示为ld50/ed50的比例。优选表现出高治疗指数的化合物。虽然可以使用显示出毒性副作用的化合物,但应注意设计将这些化合物靶向至受侵袭组织的部位的递送系统,以最小化对未受侵袭细胞的潜在损伤,从而减少副作用。从细胞培养测定和动物研究获得的数据可以用于配制用于人的一系列剂量。这些化合物的剂量优选在包括具有很少或没有毒性的ed50的循环浓度的范围内。剂量可以在该范围内变化,这取决于所用的剂型和使用的施用途径。对于本发明方法中使用的任何化合物,治疗有效剂量最初可以从细胞培养测定来判断。可以在动物模型中配制剂量以实现循环血浆浓度范围,其包括在细胞培养物中测定的ic50(即,如本文所述的α9整联蛋白的拮抗剂浓度达到症状的半最大抑制的浓度)。这些信息可用于更精确地确定人体中的有用剂量。可以例如通过高效液相色谱法测量血浆中的水平。在一些实施方案中,本文所述的治疗方法包括施用另一种hsc动员剂,例如选自但不限于白细胞介素-17、环磷酰胺(cy)、多西他赛和粒细胞集落刺激因子(g-csf)的动员剂。在一些实施方案中,一旦从已经使用如本文所述的α9整联蛋白拮抗剂治疗过的受试者获得了pb或bm,则可以例如使用标准方法例如血液成分部分清除或白细胞分离术来从那里分离hsc。在一些实施方案中,所述方法包括向受试者施用分离的干细胞,如将细胞重新引入同一受试者,或者将细胞移植到第二受试者,例如hla型匹配的第二受试者,同种异体移植。本发明包括将α9整联蛋白拮抗剂直接施用于患者以动员他们自己的hsc或使用来自α9整联蛋白拮抗剂治疗的已经从其中收获hsc的另一供体的hsc。在一些实施方案中,施用如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分的受试者是健康的。在其他实施方案中,受试者患有疾病或生理状况,如免疫抑制、慢性疾病、创伤性损伤、退行性疾病、感染或其组合。在某些实施方案中,受试者可能患有皮肤、消化系统、神经系统、淋巴系统、心血管系统、内分泌系统的疾病或病症或其组合。在特定的实施方案中,受试者患有骨质疏松症、阿尔茨海默病、心肌梗死、帕金森病、创伤性脑损伤、多发性硬化、肝硬化或其组合。施用治疗有效量的本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分可以预防、治疗和/或减轻关于任何上述病症的严重性或以其他方式提供有益的临床益处,但本文所述的α9整联蛋白拮抗剂的方法和用途的应用不限于这些用途。在多个实施方案中,新的组合物和方法在如骨、软骨、腱和韧带等骨骼组织以及退行性疾病如帕金森病和糖尿病的治疗中发现治疗效用。增强干细胞从血液到组织的释放、循环、归龛和/或迁移可导致更有效地将hsc递送到缺陷部位以提高修复效率。在一些实施方案中,可以使用hsc、pb或bm有效治疗的受试者包括通常可以用骨髓或干细胞移植治疗的任何受试者,例如患有癌症、例如成神经细胞瘤(未成熟神经细胞引起并主要影响婴儿和儿童的癌症)、骨髓发育不良、骨髓纤维化、乳腺癌、肾细胞癌或多发性骨髓瘤的受试者。例如,可以将所述细胞移植到对放射治疗或化疗治疗有抗性的患有癌症的受试者中,例如,以恢复被用于治疗癌症的高剂量化学疗法和/或放射治疗所破坏的干细胞,或者移植至g-csf治疗的非应答者以动员hsc。在一些实施方案中,受试者具有造血肿瘤性疾病。如本文所用,术语“造血肿瘤疾病”包括涉及造血起源的增生/赘生性细胞的疾病,例如由骨髓、淋巴或红细胞谱系或其前体细胞引起的疾病。在一些实施方案中,疾病由分化不良的急性白血病,例如成红细胞白血病和急性巨核细胞白血病引起。另外的示例性骨髓疾病包括但不限于急性早幼粒细胞白血病(apml)、慢性髓性白血病(cml);淋巴恶性肿瘤包括但不限于包括b谱系all和t谱系all的急性淋巴细胞白血病(all)、慢性淋巴细胞性白血病(cll)、前淋巴细胞性白血病(pll)、多毛细胞白血病(hll)和瓦尔登斯特伦巨球蛋白血症(wm)。恶性淋巴瘤的其他形式包括但不限于霍奇金病和中等/高级别(侵略性)非霍奇金淋巴瘤及其变体,外周t细胞淋巴瘤、成人t细胞白血病/淋巴瘤(atl)、皮肤t细胞淋巴瘤(ctcl)、巨粒淋巴细胞白血病(lgf),霍奇金病和里德-斯特伯格病。通常,所述方法将包括施用细胞组合物,或迁移、释放或动员干细胞以恢复被高剂量化学疗法和/或放射治疗(例如用于治疗疾病的治疗)破坏的干细胞。或者,hsc从bm干细胞龛迁移、释放或动员,并在进入bm或pb中的细胞周期时化学敏化。优选地,造血肿瘤疾病是all。在一些实施方案中,bm、pb或hsc用于治疗患有自身免疫性疾病、例如多发性硬化(ms)、重症肌无力、自身免疫性神经病、硬皮病、再生障碍性贫血和系统性红斑狼疮的受试者。在一些实施方案中,被治疗的受试者具有非恶性疾病,如再生障碍性贫血、包括镰状细胞性贫血的血红蛋白病或免疫缺陷病症。本发明还提供给药方案。在一个实施方案中,给药方案取决于待治疗的疾病状态的严重性和应答性,治疗过程从单次施用持续到经过数天和/或数周的重复施用。在另一个实施方案中,给药方案取决于受试者的外周血流中循环的cd34+hsc的数量。在另一个实施方案中,给药方案取决于受试者的外周血流中循环的骨髓来源的干细胞的数量。例如,hsc从bm的移动程度可能取决于已经在pb中循环的hsc的数量。本发明还提供了增强受试者hsc转运的方法,所述方法包括向受试者施用治疗有效量的如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分。在一个实施方案中,hsc的转运水平与受试者的外周血中循环的cd34+hsc的数量有关。在另一个实施方案中,hsc的转运水平与受试者的外周血中循环的骨髓来源的hsc的数量有关。本发明还提供了在向受试者施用如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分后,诱导循环hsc(如骨内膜祖细胞,且选自cd34+、cd38+、cd90+、cd133+、cd34+cd38-细胞、谱系-定型cd34-细胞或cd34+cd38+细胞)群的瞬时增加的方法。在一个实施方案中,将如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分提供给受试者将增强该受试者的hsc在施用后一定时间段内的释放,例如少于12天、少于6天、少于3天、少于2天、或少于1天、少于12小时、少于6小时、少于约4小时、少于约2小时、或少于约1小时。在一个实施方案中,施用如本文所述的α9整联蛋白拮抗剂和cxcr4拮抗剂或其活性部分导致hsc在施用后约30分钟至约90分钟进入循环。优选地,hsc的释放将在施用后约60分钟。在另一个实施方案中,释放的hsc进入循环系统并增加受试者体内循环hsc的数量。在另一个实施方案中,循环hsc数量与正常基线相比增加百分数可以是约25%、30%、40%、50%、60%、70%、80%、90%或约100%或与对照相比增加超过约100%。在一个实施例中,对照是来自同一受试者的基线值。在另一个实施方案中,对照是未治疗的受试者或用安慰剂或药理学载体治疗的受试者中的循环干细胞或hsc的数量。在本发明的另一个方面,提供了将hsc移植至患者的方法,所述方法包括向受试者施用α9整联蛋白拮抗剂和cxcr4拮抗剂以从bm干细胞结合配体迁移hsc;从bm到pb释放和动员hsc;从受试者的pb收获hsc;和将hsc移植至患者。在一个实施方案中,认为收获后的细胞提供可以返回到身体以补充或补足受试者的造血祖细胞群的细胞组合物,或者移植到另一个受试者以补充其造血祖细胞群。在个体经过化疗期之后的情况中,这可能是有利的。在一个实施方案中,所述方法具体涉及移植hsc的亚型。这些细胞具有造血重构能力并且存在于干细胞龛中的bm中。本发明提供了一种从干细胞龛(优选最靠近骨内膜龛内的骨/bm界面)或从中央髓腔移植hsc的方法。更优选地,从骨内膜龛内的骨/bm界面移植hsc,因为这些细胞已被证明相对于从中央髓腔分离的hsc给予更长的、多谱系的造血重构。优选地,移植的细胞在干细胞龛,更优选中心或骨内膜龛中找到。可移植的细胞的等同类型也可以在鼠群体中找到,其选自包含富集lin-sca-1+ckit+(本文称为lsk)细胞的bm衍生的祖细胞或富集lskcd150+cd48-细胞(这里称为lskslam)的干细胞。优选地,移植的细胞是骨内膜祖细胞,且选自cd34+、cd38+、cd90+、cd133+、cd34+cd38-细胞、谱系-定型cd34-细胞或cd34+cd38+细胞。总之,申请人证明α4β1和α9β1整联蛋白的小分子抑制剂bop可有效和快速地动员具有长期多系移植潜能的hsc。当与cxcr4抑制剂如amd3100组合使用时,相对于g-csf观察到长期再生hsc的动员的显著增强。使用bop/amd3100组合的hsc动员的功效通过人源化nodscidil2rγ-/-模型中的cd34+细胞的动员得到证实。使用相关的荧光标记的整联蛋白拮抗剂r-bc154(ixb),申请人证明这类化合物通过骨内膜龛内活化的α4β1和α9β1整联蛋白结合鼠和人hsc和祖细胞。因此,单独或与amd3100组合使用小分子α4β1和α9β1整联蛋白拮抗剂治疗靶向骨内膜龛提供了一种有效和方便的策略,解决了临床hsc动员中与g-csf相关的许多缺点。本说明书中包含的文献、作品、材料、装置、物品等的讨论仅用于提供本发明的背景的目的。不建议或表示任何或所有这些事项构成现有技术基础的一部分,或者是在本申请的每个权利要求的优先权日之前存在的与本发明相关的领域中的普通知识。当本说明书(包括权利要求书)中使用术语“包括”时,它们将被解释为说明所述特征、整数、步骤或组分的存在、但不排除一个或多个其他特征、整数、步骤或组分或其组的存在。现在将参考以下非限制性实施例更充分地描述本发明。实施例方法(i)流式细胞术使用如j.grassinger等人blood,2009,114,49-59中所述的lsrii(bdbiosciences)进行流式细胞术分析。在582nm、585nm或610nm检测r-bc154(ixb),并用黄绿激光器(561nm)激发。对于bm和pb分析,以10-20k个细胞事件/秒的速率分析了高达5×106个细胞。对于pblskslam分析,节省了1×106个事件。细胞分选在cytopeiainflux(bd)进行,如j.grassinger等人之前所述。(ii)细胞系如前jgrassinger等人blood,2009,114,49-59所述,使用pmscv-hitga4-ires-hitgb1和pmscv-hitga9-ires-hitgb1载体,通过逆转录病毒转导,产生过表达整联蛋白α4β1(ln18α4β1)或α9β1(ln18α9β1)的稳定的ln18细胞(atcc号:crl-2610),并将其保持在补充有在10%fbs中的2mml-谷氨酸的dmem中。通过使用2.5μg/ml的pe-cy5缀合的小鼠抗人α4抗体(bdbioscience)或20μg/ml小鼠抗人α9β1抗体(millipore)在pbs-2%fbs中,通过两轮facs来选择转导的细胞,然后加入0.5μg/ml的pe-缀合的山羊抗小鼠igg(bdbio-science)。如上所述,使用psm2c-shitga4(openbiosystems)进行在ln18和ln18α9β1细胞中的α4表达的沉默。使用facs对α4沉默的ln18细胞(对照细胞系;ln18sia4)和ln18α9β1(ln18α9β1sia4)进行就α4表达而言的阴性选择。(ⅲ)免疫组织化学(a)抗体染色。将ln18sia4(对照细胞系)、ln18α4β1和ln18α9β1细胞用2.5μg/ml的小鼠抗人α4抗体(bdbioscience)、4μg/ml的小鼠抗人α9β1抗体(millipore)或4μg/ml的小鼠同种型对照(bdbioscience)在pbs-2%fbs中染色1小时,然后用5μg/ml的alexafluor594缀合的山羊抗小鼠igg1染色1小时,然后用pbs-2%fbs洗涤三次。(b)抗体混合物。为了分析与鼠祖细胞(lsk;lineage-sca-1+c-kit+)和hsc(lskslam;lskcd150+cd48-)结合的r-bc154(ixb),将bm和pb细胞用谱系混合物(抗ter119,抗b220,抗cd3,抗gr-1,抗mac-1)、抗sca-1、抗c-kit、抗cd48和抗cd150进行免疫标记。对于谱系分析,分别将细胞进行染色,对于t细胞使用抗cd3,对于b细胞使用抗-b220,对于巨噬细胞使用抗-mac-1,对于粒细胞使用抗gr-1。或者,还使用含有抗cd3/b220(缀合pb)和抗b220/gr1/mac-1(缀合af647)的混合物进行谱系分析,由此将b220+细胞鉴定为+/+细胞,cd3+细胞是+/-,gr1/mac-1+细胞是-/+群。为了从脐带血mncs或来自人源化nsg小鼠的bm和pb分析人wbc,将细胞用含有抗hucd3/cd14/cd15(全部缀合af488)、抗cd14/cd15/cd19/cd20(全部缀合af647)、抗hucd45-pb、抗mucd45-bv510、抗hucd34-pecy7、抗hucd34和抗hucd38抗体的谱系混合物进行免疫标记。所用缀合抗体的完整列表详见表1和表2。表1.抗小鼠抗体表2.抗人抗体抗体缀合物克隆同种型供应商cd3af647okt3小鼠igg2abiolegendcd14af488m5e2小鼠igg2abiolegendcd14af488m5e2小鼠igg2abdbiosciencescd15af488h198小鼠igmbiolegendcd19af488hib19小鼠igg1biolegendcd19af647hib19小鼠igg1biolegendcd20af4882h7小鼠igg2bbiolegendcd20af6472h7小鼠igg2bbiolegendcd34fitc8g12小鼠igg1bdbiosciencescd34pecy78g12小鼠igg1bdbiosciencescd38pecy7hb7小鼠igg1bdbiosciencescd45pbhi30小鼠igg1biolegendcd45bv650hi30小鼠igg1bdbiosciencescd45pej.33小鼠igg1immunotech(c)r-bc154(ixb)染色。在含有1mmcacl2-mgcl2或1mmmncl2的tbs-2%fbs(50mmtrishcl,150mmnacl,2mm葡萄糖,10mmhepes,ph7.4))中,用r-bc154(ixb)(50nm)处理培养的ln18sia4(对照细胞系)、ln18α4β1和ln18α9β1细胞,并在37℃下孵育20分钟,然后用tbs-2%fbs洗涤三次。将染色的细胞用pbs中的4%多聚甲醛固定5分钟,用水洗涤三次,然后用2.5μg/ml的dapi染色。将细胞装载至vectorshield中,用水洗涤,盖玻片,并且在4℃下储存过夜,然后用荧光显微镜(olympusbx51)拍摄图像。(iv)饱和结合实验将培养的α4β1、α9β1和对照ln18细胞(0.5×106个细胞)用100μl在tbs-2%fbs(不含阳离子,或含1mmcacl2-mgcl2或1mmmncl2)中的0、1、3、10、30和100nm的化合物(r-bc154)处理。将细胞在37℃下孵育60分钟,用tbs-2%fbs洗涤一次,干燥沉淀并重悬于相关结合缓冲液中,用于流式细胞术分析。将平均通道荧光相对于浓度作图,并使用graphpadprism6拟合于一点饱和配体结合曲线。从该曲线确定解离常数kd。(v)离解速率(off-rate)动力学测定将含有α4β1或α9β1ln18细胞(0.5×106个细胞)的eppendorf小瓶用50nmr-bc154(ixb)(100μl,含有1mmcacl2-mgcl2或1mmmncl2的tbs-2%fbs)在37℃处理30分钟,用相关的结合缓冲液洗涤一次并干燥沉淀。在37℃下用500nm的未标记的竞争性抑制剂(100μl,含有1mmcacl2-mgcl2或1mmmncl2的tbs-2%fbs)处理细胞,持续所指明的时间(0、2.5、5、15、30、45、60分钟)。用冷tbs-2%fbs(含有相关阳离子)稀释细胞,通过离心沉淀,洗涤一次,重新混悬(约200μl)于结合缓冲液中,用于流式细胞术分析。将平均通道荧光对时间作图,使用graphpadprism6将数据拟合为单相或两相指数衰减函数。离解速率koff从曲线外推。(vi)结合速率(on-rate)动力学测量将含有在含有1mmcacl2-mgcl2或1mmmncl2的50μltbs-2%fbs中的α4β1或α9β1ln18细胞(0.5×106细胞)的eppendorf小瓶,在37℃下在加热块中预活化20分钟。向每个管中加入在相关tbs-2%fbs(具有相关阳离子)中的100nmr-bc154(ixb)(50μl-终浓度=50nm),在37℃下孵育0、0.5、1、2、3、5、10、15和20分钟后,通过加入3mltbs-2%fbs(具有相关阳离子)来淬灭管。用tbs-2%fbs(具有相关阳离子)洗涤一次细胞,离心沉淀,并重新混悬于相关结合缓冲液中(200μl),用于流式细胞分析。将平均通道荧光相对时间作图,使用graphpadprism6将数据拟合为单相或两相关联函数。观察的结合速率kobs从曲线外推,kon使用以下计算而得:(kobs-koff)/[r-bc154(ixb)=50nm]。(vii)小鼠c57bl/6小鼠是monashanimalservices(monashuniversity,clayton,澳大利亚)培育的。小鼠6-8周龄,性别匹配实验。c57bl/6(c57)、rfp、gfp和α4flox/flox/α9flox/flovvav-cre小鼠是在monashanimalservices培育的。红色荧光蛋白(rfp)小鼠由澳大利亚悉尼的儿童医学研究所(children’smedicalresearchinstitute)提供。条件性α4flox/flox/α9flox/flox小鼠最初是通过将α4flox/flox小鼠(华盛顿大学医学系/血液学系的赠品)与α9flox/flox小鼠(加利福尼亚大学医学系)和vav-cre老鼠(wehiinstitute,墨尔本)杂交繁育产生的。nodsil2rγ-/-(nsg)小鼠是内部获得(australianregenerativemedicineinstitute)。通过尾静脉注射新鲜分选的脐带血cd34+细胞(>150k)与2×106个辐照的单核支持细胞,产生人源化nsg小鼠。移植后4-5周,使nsg小鼠眼出血,并评估hucd45和mucd45以及cd34植入。对于移植物,就c57bl/6小鼠而言,以分开的剂量(每次5.25gy)、6小时的间隔、在移植前24小时,给予辐照,就nsg小鼠而言,以单次剂量(2.75gy)、在移植前5小时给予辐照,分别给予每个接受者作为支持细胞的总计2×105辐照的(15gy)c57bl/6bm细胞或2×106辐照的(15gy)脐带血(cb)单核细胞(mnc)。(viii)体内骨髓结合测定将pbs(10mgkg-1)中的r-bc154(ixb)静脉内注射到c57小鼠中。5分钟后,分离骨髓细胞,如先前在d.n.haylock等人的stemcells,2007,25,106-1069和j.grassinger等人,cytokine,2012,58,218-225中所述。简而言之,切除一股股骨、胫骨和髂嵴并清除肌肉。去除骨骺的和干骺端的区域后,用pbs-2%fbs冲洗骨,得到全骨髓,用pbs-2%fbs洗涤,然后免疫标记,用于流式细胞术。为了分析r-bc154(ixb)结合,选择以下抗体组合,以使发射光谱重叠最小化。为了染色祖细胞(lsk;lineage-sca-1+c-kit+)和hsc(lskslam;lskcd150+cd48-),将细胞用谱系混合物(cd3、ter-119、gr-1、mac-1、b220;所有抗体缀合apc-cy7)、抗sca-1-pb、抗c-kit-af647、抗cd48-fitc和抗cd150-bv650标记。(ix)造血细胞分离。如先前在j.grassinger等人,cytokine,2012,58,218-225和d.n.haylock等人,stemcells,2007,25,1062-1069中所述分离骨内膜和中枢鼠骨髓细胞的群体。简而言之,切除一股骨、胫骨和髂骨,并清除肌肉。去除骨骺的和干骺端的区域后,用pbs-2%fbs冲洗骨,得到骨髓细胞。使用研钵和研杵将冲洗好的长骨以及骨骺和干骺碎片合并并粉碎。使用胶原酶i(3mg/ml)和分散酶ii(4mg/ml)在37℃下在轨道振荡器中以750rpm消化骨碎片。5分钟后,将骨碎片用pbs洗涤一次,用pbs2%fbs洗涤一次,以收集骨内膜骨髓细胞。通过眼后穿刺收集外周血,并在室温下使用nh4cl裂解缓冲液裂解红细胞5分钟。用pbs2%fbs洗涤分离的细胞群,然后如以上在抗体混合物中所述染色,用于流式细胞术。(x)人cd34+细胞的分离如先前在nilsson,s.k等人blood106,1232-1239(2005)和grassinger,j等人blood114,49-59,(2009)所述,从脐带血分离单核细胞(mnc)。将mnc与含有小鼠抗人cd3、cd11b、cd14、cd16、cd20、cd24和cd235a(bd)的谱系抗体混合物孵育,然后用dynal绵羊抗小鼠igg珠(invitrogen,carlsbad,ca)以每个细胞2个珠子的比例处理5分钟,进行两轮,然后在4℃下恒定旋转10分钟。富集的mnc用通过facs纯化的cd34-异硫氰酸荧光素(fitc)cd34+细胞染色。(xi)体外和体内r-bc154(ixb)结合。对于体外标记实验,将来自c57小鼠、条件性α4-/-/α9-/-小鼠和人源化nodscidil2rγ-/-小鼠和人脐带血mnc的5×106bm细胞,用r-bc154(ixb)(最多300nm)在含有1mmcacl2/mgcl2(活化)或10mmedta(去活化)的pbs(0.5%bsa)或tbs(0.5%bsa)中,以40×106个细胞/ml在4℃下处理20分钟。将细胞用冷pbs(2%fbs)洗涤,然后在流式细胞术分析之前如“抗体混合物”中所述免疫标记。对于体内实验,c57bl/6小鼠、α4-/-/α9-/-vav-cre小鼠和人源化nodscidil2rγ-/-小鼠,以100ul/10gm鼠体重,接受静脉内或皮下注射的r-bc154(ixb)(5-10mg/kg),并以如上所述进行分析。通过荧光显微镜检查,在分选的祖细胞群(lsk细胞),进行了r-bc154(ixb)结合分析,其中从未处理的和r-bc154(ixb)注射的小鼠收获的bm细胞为去除b220、gr-1、mac-1和ter-119的谱系,用抗sca-1-pb和抗c-kit-fitc染色,并在sca1+c-kit+上进行分选。使用olympusbx51显微镜对分选的细胞进行成像。(xii)竞争性抑制试验。在37℃用50nmr-bc154(ixb)(80μl,在含有1mmcacl2/mgcl2的pbs-2%fbs中)处理α4β1和α9β1ln18细胞(1-2×105个细胞)10分钟,用pbs洗涤,通过离心沉淀,然后用0、0.01、0.1、0.3、1、10、100和300nm的bop(80μl,含有1mmcacl2/mgcl2的pbs-2%fbs)处理。将细胞在37℃下孵育90分钟,用pbs洗涤,通过离心沉淀,并重悬于pbs(200μl)中,用于流式细胞术分析。将%最大平均荧光强度(mfi)相对于bop的对数浓度作图,将数据拟合到配体结合s形剂量-响应曲线,并从图形获得ic50值。对于结合至lsk和lskslam细胞的r-bc154(ixb)的竞争性替代,在37℃下,用在pbs(含有0.5%bsa和1mmcacl2/mgcl2)中的500nmbop处理从注射了r-bc154(ixb)的小鼠分离的wbm细胞,进行45分钟,然后进行流式细胞术分析。(xiii)动员方案对于动员实验,所有小鼠以100μl/10gm体重进行皮下注射,并且使用edta涂覆的注射器通过喉部出血收获pb。(a)r-bc154(ixb)和bop。小鼠接受单次注射所指定剂量的新鲜制备的r-bc154(ixb)和bop在盐水中的溶液,然后在所指定时间通过喉部出血收获pb。(b)g-csf。小鼠以250μg/kg每天两次(500ug/kg/天)接受g-csf,间隔6-8小时连续4天。接受g-csf和bop的组接受如上所述的标准g-csf方案,然后在收获前1小时单次注射bop。对照小鼠接受等体积的盐水。(xiv)动员人源化nodsil2rγ(nsg)小鼠通过尾静脉注射新鲜分选的脐带血cd34+细胞(>150k)与2×106个辐照的单核支持细胞,产生人源化nsg小鼠。移植后4-5周,使nsg小鼠眼出血并评价hucd45和mucd45。在这些条件下,如通过流式细胞术分析基于相对于总%cd45的%hucd45所确定,实现了>90%的人源化。给予人源化nsg小鼠至少1周时间来在实验前进行恢复。在“动员方案”中指定的相关条件下动员小鼠,随后如“抗体混合物”中所述通过喉出血、裂解和免疫标记收集pb。(a)hsc动员。小鼠接受皮下注射,以100μl/10gm体重单次注射bop(最多15mg/kg)以各种时间范围进行,以1mg/kg单次注射bio5192持续1小时,以3mg/kg单次注射amd3100/kg持续1小时(在收获前1小时,对还接受bop或bio5192的小鼠注射单个剂量的bop或bio5192)或g-csf以250μg/kg一日二次(500μg/kg/天),间隔6至8小时连续4天(收获前1小时,对还接受bop和/或amd3100的小鼠注射单个剂量的bop和/或amd3100)。当适当时,对照小鼠接受等量体积的盐水或10%hpβcd/盐水。(xv)低和高增殖潜力的集落形成细胞测定如先前在j.grassinger等人cytokine,2012,58,218-225和bartelmez,s.h.等人experimentalhematology,17,240-245(1989)中所述,分析了低和高增殖潜力的集落形成细胞(分别为lpp-cfc和hpp-cfc)。简言之,将动员的pb裂解,并将4000wbc置于35mm培养皿中的含有重组小鼠干细胞因子以及重组人集落刺激因子-1、白细胞介素-1α(il-1α)和il-3的双层营养琼脂培养系统中。培养物在37℃下在5%o2,10%co2,85%n2的湿润培养箱中孵育。特别例举了lpp-cfc和hpp-cfc的14天的孵育,如j.grassinger等人(2012)中先前所述。(xvi)长期移植测定(a)限制性稀释分析。将rfp小鼠用bop(n=15)、amd3100(n=5)或者bop和amd3100(n=5)的组合进行处理,1小时后收获pb。将每个处理组的每一供体小鼠的pb合并,裂解并以原始血容量的1/3溶于pbs中。将辐照的wbm填充细胞(2×105/小鼠)以指定的移植体积加入裂解的pb的等分试样中,然后用pbs充满以允许200μl注射/小鼠。通过尾静脉注射施用于辐照的c57bl/6小鼠,并在移植后6、12和20周评价多系谱rfp植入。(b)竞争性初始和次级移植测定。如“动员方案”所述,分别用bop/amd3100(1小时)和g-csf(每天两次,共4天)处理rfp(n=5)和gfp(n=5)小鼠。然后收集pb,并将rfp和gfp组中的血液合并,裂解,洗涤并重新混悬于pbs中至原始血容量的1/3。将等体积的rfp和gfp血液混合,以允许每只小鼠移植500μl的rfp和gfp血液。加入辐照的wbm填充细胞(2×105/小鼠),并用pbs填充混合物以允许200μl注射/小鼠。通过尾静脉注射向辐照的c57bl/6接受体(n=5)施用,并在移植后6、12和20周评价rfp和gfp植入。取出20周时,将来自每个初始接受体(n=5)的wbm细胞(股骨的第1/10)移植到辐照的c57次级接受体(n=4/初始接受体)中,并在移植后6、12和20周评价多系谱植入。(xvii)α4和α9β1整联蛋白在人hsc上的表达。通过用纯化的小鼠抗人α9β1、山羊抗小鼠af647、然后小鼠抗hucd49d-pecy7、抗hucd34-fitc和抗hucd38-bv421的混合物,依次标记细胞,评价在来自cd34+富集的人bm细胞的人hsc、来自hunsg小鼠的bm和cbmnccd34+细胞上的人α4(cd49d)和α9β1的表达。将匹配的小鼠igg1同种型用作对照。(xviii)统计分析当适用于数据集时,将数据使用学生氏t检验、单向或双向anova进行分析。为了确定干细胞再生频率,使用l-calc软件(stemcelltechnologies)进行poisson分析。对log-rank(mantel-cox)检验用于比较存活曲线。p<0.05被认为是显著的。实施例1:α9β1整联蛋白拮抗剂的制备(a)拮抗剂化合物的合成可以使用如下所述的反应途径和合成流程来制备各种实施方案的试剂。在以下实施例中详细描述了实施方案的具体化合物的制备,但是技术人员将认识到所描述的化学反应可以容易地适应于制备各种实施方案的许多其它试剂。例如,非示例性化合物的合成可以通过本领域技术人员显而易见的修饰来成功地进行,例如,通过适当地保护干扰基团,通过改变为本领域已知的其它合适的试剂,或通过对反应条件进行常规变化。有机合成中合适的保护基列表可见于t.w.greene'sprotectivegroupsinorganicsynthesis,第3版,johnwiley&sons,1991。或者,本文公开的或本领域已知的其它反应将被认为可用于制备各种实施方案的其它化合物。可以根据本领域已知的技术获得或制备用于合成化合物的试剂。方法、流程和实施例中的符号、缩写和惯例与当代科学文献中使用的符号、缩写和惯例一致。具体而言,可以在实施例和整个说明书中使用以下缩写,但并不意味着要进行限制。除非另有说明,否则所有温度均以℃(摄氏度)表示。除非另有说明,否则所有反应均在室温下进行。除非另有说明,否则所有起始原料、试剂和溶剂都是从商业来源获得的,不经进一步纯化地使用。从genscript获得n-(苄氧基羰基)-l-脯氨酰基-l-o-(叔丁基醚)酪氨酸甲酯26。所有无水反应在干燥氮气氛下进行。通过在j.c.meyer制造的solventdispensingsystem上通过两个连续的活化的中性氧化铝柱来干燥乙醚、二氯甲烷、四氢呋喃和甲苯,并基于grubbs及其同事的原始设计。石油精油是指在40-60℃沸腾的馏分。在merck预涂覆的0.25mm二氧化硅铝背板上进行薄层色谱(tlc),并通过以下显影:用uv光,和/或在茚三酮溶液或磷钼酸溶液中浸渍,然后加热。反应产物的纯化通过快速色谱法使用mercksilicagel60(230-400目)或反相c18硅胶进行。在reichert-jungthermovar热台显微镜熔点仪上记录熔点。在perkinelmermodel341旋光仪上记录光旋转。使用thermonicolet6700光谱仪使用配有钻石窗的smartatr(衰减全反射)附件获得ftir光谱。在brukerav400光谱仪上分别在400和100mhz下记录质子(1h)和碳(13c)nmr光谱。1hnmr以ppm为单位,使用溶剂作为内标(cdcl3,7.26ppm)。使用溶剂作为内标(cdcl3,77.16ppm),质子去偶13cnmr(100mhz)以ppm报告。采用电喷雾离子化技术在watersqtofii(cmse,clayton,vic3168)或finnigan混合ltq-ft质谱仪(thermoelectroncorp.,bio21institute,universityofmelbourne,parkville,vic3010)上获得高分辨率质谱(esi)。实施例1a:n-(苯磺酰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸(bop)的制备bop的合成从二肽26开始,如下面的流程1所示:流程1在0℃下使用三氟乙酸对叔丁基保护基26进行脱保护,得到酚27,水处理后,将其未经进一步纯化用于下一个步骤。苯酚27与1-吡咯烷羰基氯的反应在碳酸钾的存在下顺利进行,历经两步骤以良好的收率(74%)得到氨基甲酸酯28。3小时内完成cbz保护基的氢解,经快速色谱后得到收率极佳的胺(85%)。然后将胺29与苯磺酰氯在碱存在下反应,经快速色谱后得到收率极佳的磺酰胺30(96%)。最后,使用氢氧化钠皂化甲酯部分30,然后在amberlyst树脂上进行离子交换,经快速色谱后得到bop,收率81%。作为举例,本文提供了从二肽26开始形成bop的实际反应条件。步骤1:n-(苄氧基羰基)-l-脯氨酰基-l-o-酪氨酸甲酯(27)在0℃将三氟乙酸(tfa)(1.27ml,16.6mmol)滴加至n-(苄氧基羰基)-l-脯氨酰基-l-o-(叔丁基醚)酪氨酸甲酯26(0.80g,1.66mmol;定制肽合成,来自genscript)在干燥ch2cl2(10ml)中的混悬液中。将该混合物缓慢温热至室温,并搅拌3小时,此时tlc(70:30etoac/石油精油)表明原料完全消耗。将该混合物用etoac稀释,并用h2o、盐水洗涤,干燥(mgso4),并减压浓缩。将残余物用甲苯(×3)浓缩,得到粗品n-(苄氧基羰基)-l-脯氨酰基-l-o-酪氨酸甲酯27(700mg),为无色油状物,其不经进一步纯化用于下一步骤。步骤2:n-(苄氧基羰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸甲酯(28)将1-吡咯烷羰基氯(147μl,1.38mmol)加入到粗苯酚27(393mg,0.922mmol)和k2co3(256mg,1.84mmol)在n,n-二甲基甲酰胺(dmf)(5ml)中的混合物中。将该混合物在50℃搅拌过夜,用etoac/h2o稀释,分离有机相。将有机层用5%hcl、饱和的nahco3水溶液、盐水洗涤,干燥(mgso4),并减压浓缩。将残余物经快速色谱法(70%etoac/石油精油)纯化,得到无色泡沫状的氨基甲酸酯28(355mg,74%),将其未经进一步纯化用于下一步骤。步骤3:l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸甲酯(29)将cbz保护的二肽28(356mg,0.681mmol)和10%pd/c(50%h2o,150mg)在meoh(30ml)中的混合物用h2吹扫三次。将该混合物在h2气氛下搅拌3小时,这时tlc(10%meoh/ch2cl2)表明原料完全消耗,将该混合物通过一层celite过滤,并将滤液减压浓缩。将残余物经快速色谱(5%至10%meoh/ch2cl2)纯化,得到胺29(224mg,85%),为无色油状物。δh(400mhz,cdcl3)1.64-1.78(2h,m),1.82-1.92(5h,m),2.16-2.25(1h,m),2.97-3.15(4h,m),3.39(2h,t,j=6.5hz),3.49(2h,t,j=6.5hz),3.65(3h,s),4.03(1h,dd,j=5.7,8.3hz)4.72(1h,dd,j=7.8,13.3hz),5.69(1h,brs),6.99(2h,d,j=8.3hz),7.13(2h,d,j=8.3hz),8.41(1h,d,j=7.9hz)。步骤4:n-(苯磺酰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸甲酯(30)将二异丙基乙胺(dipea)(95μl,0.546mmol)加入到胺d(71mg,0.182mmol)、phso2cl(35μl,0.273mmol)和4-二甲基氨基吡啶(dmap)(2.2mg,0.018mmol)在ch2cl2(3ml)中的搅拌的溶液中。将该混合物在室温下搅拌4小时,减压浓缩,将残余物经快速色谱(2.5%meoh/ch2cl2)纯化,得到无色泡沫状的产物e(93mg,96%)。δh(400mhz,cdcl3)1.42-1.56(3h,m),1.90-2.05(5h,m),3.03(1h,dd,j=7.6,14.0hz),3.10-3.16(1h,m),3.26(1h,dd,j=5.6,14.0hz),3.35-3.40(1h,m),3.45(2h,t,j=6.5hz),3.54(2h,t,j=6.5hz),3.77(3h,s),4.08(1h,dd,j=2.0,8.0hz),4.82(1h,dt,j=5.7,11.6hz),7.06(2h,d,j=8.7hz),7.13(2h,d,j=8.7hz),7.25(1h,d,j=7.5hz;被溶剂峰遮蔽),7.52-7.57(2h,m),7.61-7.65(1h,m),7.83-7.85(2h,m)。步骤5:n-(苯磺酰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸(bop,ic)将0.1mnaoh(3.2ml,0.162mmol)加入到酯30(86mg,0.162mmol)在meoh(10ml)中的溶液中,将该混合物在室温下搅拌过夜。将该反应用amberlyst树脂(h+形式)终止,过滤,并将滤液减压浓缩。将粗制的产物经快速色谱(10%meoh/ch2cl2)纯化,得到产物bop,ic(68mg,81%),为无色玻璃状物。δh(400mhz,d4-meoh)1.47-1.55(1h,m),1.59-1.72(2h,m),1.77-1.85(1h,m),1.93-2.00(4h,m),3.11(1h,dd,j=7.8,13.7hz),3.18-3.24(1h,m),3.27(1h,dd,j=5.0,13.7hz),3.35-3.44(3h,m),3.56(2h,d,j=6.5hz),4.14(1h,dd,j=4.0,8.5hz),4.69(1h,m),7.04(2h,d,j=8.5hz),7.27(2h,d,j=8.5hz),7.60(2h,t,j=7.6hz),7.69(1h,t,j=7.4hz),7.86(2h,d,j=7.4hz)。对于体外和体内实验,通过用0.98当量naoh(0.01mnaoh)处理bop(ic)的游离酸在meoh中的溶液将bop(ic)转化为钠盐。将该溶液通过0.45μm注射器过滤器单元过滤,将产物冻干,得到钠盐,为松散无色粉末。δh(400mhz,d2o)1.47-1.59(2h,m),1.68-1.83(2h,m),1.87-1.92(4h,m),3.01(1h,dd,j=7.7,13.8hz),3.18-3.26(2h,m),3.34-3.40(3h,m),3.48-3.51(2h,m),4.06(1h,dd,j=4.4,8.7hz),4.43(1h,dd,j=5.0,7.7hz),7.04(2h,d,j=8.5hz),7.27(2h,d,j=8.5hz),7.61(2h,t,j=8.1hz),7.73(1h,t,j=7.5hz),7.78(2h,d,j=7.5hz)。实施例1b:r-bc154(ixb)的制备还合成了缺乏peg-间隔基的化合物ixb(r-bc154),如以下流程2所示:流程2因此,用naoh水解甲酸酯18,得到去保护的叠氮化物抑制剂23,随后在cuso4、抗坏血酸钠和tbta的存在下与n-丙炔基硫代罗丹明b24反应,得到荧光标记的式ixb的化合物(r-bc154),通过hplc纯化后产率为43%。作为举例,本文提供了从甲酯18开始形成荧光标记的bop衍生物ixb的实际反应条件。步骤1:(s)-2-((2s,4r)-4-叠氮基-1-(苯基磺酰基)吡咯烷-2-甲酰氨基)-3-(4-((吡咯烷-1-羰基)氧基)苯基)丙酸(23)用0.2mnaoh(4.05ml,0.811mmol)处理在etoh(10ml)中的甲酯18(420mg,0.737mmol),并在室温下搅拌1小时。将该混合物减压浓缩以除去etoh,将水相用10%hcl酸化。将水相用chcl3(4×10ml)萃取,将合并的有机相用盐水洗涤,干燥(mgso4),并减压浓缩。经快速色谱(10%meoh/ch2cl2,带有0.5%acoh的)纯化粗物质,得到浅黄色泡沫状的酸23(384mg,94%)。[α]d-0.7(c1.00在chcl3中);δh(400mhz,cdcl3)1.67-1.73(1h,m),1.89-1.96(5h,m),3.10(1h,dd,j=8.0,13.8hz),3.21(1h,dd,j=4.0,11.5hz),3.38(1h,dd,j=5.3,14.0hz),3.44-3.55(5h,m),3.81(1h,m),4.11(1h,t,j=6.5hz),4.89(1h,m),7.05,7.22(4h,2×d,j=8.0hz),7.41(1h,d,j=6.8hz),7.53-7.64(3h,m),7.85(2h,d,j=7.5hz);δc(100mhz,cdcl3)25.0,25.8,36.1,36.8,46.5,46.6,53.2,53.9,58.9,61.2,122.0(2c),128.0(2c),129.4(2c),130.5(2c),133.6,133.7,136.0,150.5,153.6,170.9,173.7;ν/cm-13329,2977,2881,2105,1706,1672;hrms(esi+)m/z557.1817(c25h29n7o6s[m+h]+理论值557.1813)。步骤2:r-bc154(ixb)用cuso4(86μl,0.86μmol,0.01m,在h2o中)、抗坏血酸钠(430μl,4.3μmol,0.01m,在h2o中)和三[(1-苄基-1h-1,2,3-三唑-4-基)甲基]胺(tbta)(108μl,1.08μmol,0.01m,在dmf中)处理在dmf(2ml)中的叠氮化物23(12mg,22μmol)和n-丙炔基硫代罗丹明b24(14mg,24μmol)。将该混合物在60℃下搅拌2小时,此时tlc表明形成新的荧光产物。将该混合物减压浓缩,并将残余物经快速色谱(40:10:1chcl3/meoh/h2o,带有0.5%acoh)部分纯化。将该物质通过hplc(15分钟内,50%-98%mecn/h2o(0.1%tfa)梯度洗脱;rt=14.9分钟)进一步纯化,得到纯的ixb(10.6mg,43%),为紫色玻璃状物,δh(400mhz,d4-甲醇)1.27-1.31(12h,dt,j=7.0,3.5hz),1.91-1.98(4h,m),2.29-2.35(1h,m),2.71-2.78(1h,m),3.08(1h,dd,j=7.5,13.8hz),3.22(1h,dd,j=5.3,13.8hz),3.41(2h,t,j=6.5hz),3.54(2h,t,j=6.5hz),3.63-3.70(8h,m),3.85(1h,dd,j=3.5,12.0hz),3.97(1h,dd,j=5.6,11.6hz),4.21(2h,d,j=1.4hz),4.41(1h,t,j=7.3hz),4.72(1h,dd,j=5.4,7.5hz),5.08(1h,m),6.91(2h,t,j=2.2hz),6.98-7.04(4h,m),7.11(2h,t,j=9.0hz),7.30(2h,d,j=8.6hz),7.40(1h,d,j=8.0hz),7.44(2h,t,j=7.5hz),7.58-7.68(4h,m),8.00(1h,dd,j=1.9,8.0hz),8.37(1h,d,j=1.8hz);δc(100mhz,d4-甲醇)12.9(4c),25.9,26.7,37.1,37.6,39.0,46.8(4c),47.5,47.6,54.8,55.7,60.3,62.1,97.0(2c),115.0(2c),115.26,115.29,122.9(2c),123.9,127.5,128.6(2c),129.3,130.5(2c),131.6(2c),132.3,133.8,133.9,134.4,135.26,135.34,138.3,144.1,144.8,146.9,151.7,155.2,157.16,157.17,157.2,157.8,159.4,173.1,173.8;ν/cm-13088-3418,2977,2876,1711,1649,1588;hrms(esi+)m/z1174.3447(c55h61n9nao13s3[m+na]+理论值1174.3443)。对于体外和体内测试,ixb的游离酸(11.7mg,9.97μmol)溶于0.01mnaoh(997μl,9.97μmol)中,将深紫色溶液通过0.45μm注射器过滤器单元过滤。将产物冻干,得到ixb的钠盐(11.6mg,99%),为松散的紫色粉末。实施例2:分析使用r-bc154(ixb)和bio5192对于hsc上人和鼠α9β1的特异性结合。为了评估小分子拮抗剂对hsc的α9β1的特异性靶向,开发了使用选择性的和有效的(kd<10pm)α4β1拮抗剂bio5192(leone,d.r.等人(2003))(双重α9β1/α4β1拮抗剂bop)及其荧光类似物r-bc154(ixb)的体外测定。这些以二价金属阳离子依赖方式有效地结合与人和鼠(图1a)α9β1和α4β1整联蛋白。这与bio5192相反,bio5192在二价金属阳离子存在和不存在时均与α4β1结合。人和鼠α9β1/α4β1与r-bc154(ixb)和过量的bio5192的共标记允许特异性检测与α9β1的结合(图1b,c)。相比之下,与过量bop组合的r-bc154(ixb)标记完全抑制与人和鼠α9β1/α4β1整联蛋白均结合的r-bc154(ixb)(图1b,c)。鉴于所有造血细胞中α4β1表达的普遍存在,r-bc154与bio5192的组合提供了一种测量与造血干细胞和祖细胞上的α9β1特异性结合的便捷方法。为了评估α9β1对r-bc154(ixb)结合的贡献,在不存在竞争性拮抗剂的情况下或在存在过量的选择性α4β1拮抗剂bio5192(1μm)或双重α4β1/α9β1拮抗剂bop(1μm)的情况下,用r-bc154(100nm)在含有0.5%bsa和1mmcacl2/mgcl2的pbs中在0℃将人和鼠细胞染色30分钟。洗涤细胞,如上所述免疫标记,并通过流式细胞术分析。通过测量r-bc154(ixb)+bio5192和+bop之间的mfi差异,计算α9β1结合的贡献,并表示为单独r-bc154(ixb)的%。使用在相同条件下培养的转导的ln18细胞和cho细胞作为对照,证实bio5192抑制>95%的与α4β1结合的r-bc154(ixb),但不抑制与α9β1的结合。相比之下,bop抑制>95%的与α4β1和α9β1二者结合r-bc154(ixb)。实施例3:r-bc154(ixb)和bop优先以二价阳离子和α9β1依赖方式结合人和鼠hsc和祖细胞以前已经证明,人hsc表达α9β1且其与tropn的相互作用调节hsc静息。为了测定双α9β1/α4β1或交叉反应性拮抗剂是否通过α9β1结合人hsc,评估了结合脐带血(cb)单核细胞(mnc)的r-bc154(ixb),显示其为二价阳离子和剂量依赖性,并且可饱和(图2a)。cbhsc(cd34+cd38-)、祖细胞(cd34+cd38+)和谱系定型细胞(cd34-cd38+)(图2b)的分析显示r-bc154(ixb)与hsc和祖细胞高度结合,但在1mmca2+/mg2+存在下与定型细胞仅适度结合(图2c)。此外,这些群体和r-bc154(ixb)与bio5192的组合的共孵育证实了部分抑制与hsc和祖细胞结合的r-bc154(ixb)(反映通过α9β1和α4β1的结合),并完全抑制与谱系定型细胞的结合(反映仅通过α4β1结合)(图2c)。相比之下,由于bop有效地结合α9β1和α4β1,其加入导致r-bc154(ixb)与所有细胞群结合的完全抑制(图2c)。这些数据共同证明了通过α9β1与hsc和祖细胞结合的r-bc154(ixb)的显著比例,而与定型细胞的结合只通过α4β1介导(图2d)。此外,r-bc154(ixb)在ca2+/mg2+的存在下有效地结合了从人bm分离的hsc和祖细胞(图2e),类似于cb细胞显示的那些,大多数这种结合通过α9β1,而定型的细胞主要通过α4β1结合(图2f)。这些数据与人bmhsc和祖细胞上明显的高α9β1表达一致(图2g)。使用人源化nodscidil2rγ-/-(hunsg)小鼠进一步评估与人hsc结合的r-bc154(ixb)(图2h)。r-bc154(ixb)在ca2+/mg2+存在下结合人bm定型细胞、祖细胞和hsc(图2i),但通过α9β1的显著结合只发生在hsc上(图2j),这与α9β1表达限于hsc一致(图2k)。相比之下,α4β1在所有三个群体上高度表达(图2l)。α4β1在造血细胞上的普遍表达,结合α9β1在hsc上的限制性表达,导致相对于祖细胞和定型细胞有附加的r-bc154(ixb)与hsc结合(图2m)。这些数据一起突出表明使用选择性α9β1拮抗剂人hsc和/或祖细胞优先靶向谱系定型细胞的潜力。实施例4:化合物r-bc154(ixb)与骨髓hsc和祖细胞的体内结合体外结合数据表明,r-bc154(ixb)是高亲和力α4β1和α9β1整联蛋白拮抗剂,其结合活性高度依赖于整联蛋白的活化。该实施例测试r-bc154(ixb)是否可用于体内结合实验以调查α9β1/α4β1整联蛋白对定义的hsc群体的活性。迄今为止,评估hsc上的整联蛋白活性主要依赖于使用荧光标记抗体的骨髓细胞或纯化hsc的体外或离体染色。虽然离体染色提供hsc整联蛋白表达的确认,但是骨髓内天然状态下的整联蛋白活化的研究只能通过体内结合实验来确定,因为复杂的骨髓微环境在体外不能被充分重建。为了评估r-bc154(ixb)和这类基于n-苯基磺酰基脯氨酸的模拟肽是否可以直接结合hsc,将r-bc154(ixb)(10mgkg-1)静脉内注射入小鼠,并使用多色流式细胞术分析用于表型定义的骨髓祖细胞(lsk细胞;谱系-sca-1+c-kit+)和hsc(lskslam细胞;lskcd48-cd150+)的r-bc154(ixb)标记。与来自未注射的小鼠的骨髓相比,从注射r-bc154(ixb)的小鼠中分离的祖细胞和hsc群观察到由于r-bc154(ixb)结合而增加的细胞相关荧光。此外,还通过对纯化的祖细胞(lineage-sca-1+c-kit+)群进行荧光显微镜检查证实了体内r-bc154(ixb)结合。r-bc154(ixb)标记的祖细胞显示荧光晕,指示r-bc154(ixb)结合主要是细胞表面,这与整联蛋白结合一致。体内结合结果表明,这类α9β1/α4β1整联蛋白拮抗剂能够与非常稀少的造血祖细胞和hsc群(分别仅占小鼠骨髓内单核细胞的0.2%和0.002%)结合。在这些实验中已证实纳摩尔抑制强度的bop抑制α9β1和α4β1整联蛋白与vcam-1和opn的体外结合。这些使用r-bc154(ixb)的体内结合结果表明hsc表达的α4β1和α9β1整联蛋白为原位活性结合构象。这表明小分子α9β1/α4β1整联蛋白拮抗剂如化合物ixb不仅直接与骨髓hsc结合,而且还能够抑制α9β1/α4β1依赖性粘附相互作用,并且可能用作诱导骨髓hsc进入外周循环的有效药物,如下面所示。实施例5:r-bc154(ixb)体外优先结合小鼠和人造血祖细胞为了确定是否需要活化整联蛋白以结合中心和骨内膜bm祖细胞(lin-sca-1+ckit+细胞;lsk)和hsc(lskcd150+cd48-细胞;lskslam)(图3a),在1mmca2+/mg2+存在下评价r-bc154(ixb)结合(图3b)。在这些条件下,与其骨内膜对应物相比,观察到与中心lsk和lskslam的更强的结合(p<0.005)(图3b)。通过与edta共处理使表面整联蛋白失活而完全消除活性,表明对于与hsc和祖细胞结合的有效的r-bc154(ixb)而言需要整联蛋白活化(图3b)。在不存在活化阳离子和edta的情况下,r-bc154(ixb)结合于骨内膜lsk细胞仍然是明显的,但不是结合于中心lsk(图3c)。这些结果表明由hsc表达的整联蛋白和从骨内膜bm分离的祖细胞在收获后保持活化。由于整联蛋白α4β1在所有白细胞上普遍表达,并且α9β1已知在嗜中性粒细胞上广泛表达,因此评价了与谱系-定型的造血细胞结合的r-bc154(ixb)。发现:在外源性活化下在从中心和骨内膜bm区域分离的所有谱系定型淋巴(b220+和cd3+)和骨髓(gr1/mac1+)后代观察到活化依赖性结合(图4)。然而,该结合相对于lskslam(p<0.0001)和lsk(p<0.0001)细胞显著较低(图3d)。为了确认结合hsc和祖细胞是否是α4β1和α9β1整联蛋白依赖性的,用r-bc154(ixb)处理在造血细胞(α4flox/floxα9flox/floxvav-cre小鼠)中的无α4和α9整联蛋白的bm细胞。lsk(p<0.005)和lskslam(p<0.005)α4-/-/α9-/-细胞基本上不存在结合,这证实了r-bc154(ixb)活性需要这两种整联蛋白(图3e)。在人类脐带血单核细胞(mnc)上也证实了r-bc154(ixb)的二价阳离子和剂量依赖性结合(图2(a))。在活化条件下,与谱系-定型cd34-细胞相比,在富集cd34+cd38-细胞的干细胞上观察到更大的结合,尽管相对于cd34+cd38-祖细胞的程度较小(图2(b))。这些结果表明结合鼠类和人的造血细胞的r-bc154(ixb)是二价金属阳离子依赖性的,并且在体外外源活化下相对于hsc也偏向造血祖细胞。实施例6:bop而不是r-bc154(ixb)快速且优先动员hsc和祖细胞由于bop快速且优先地结合bmhsc,因此首先在剂量和时间响应测定中并通过定量皮下bop施用后的祖细胞(lsk)和hsc(lskslam)来分析bop将hsc移动到外周血(pb)的能力(图5a,b)。bop的施用导致pb祖细胞和hsc的快速、显著和剂量依赖性的增加(图5a),其在单次剂量后60分钟达到峰值(图5b),并在施用后4小时内恢复至基线(图6a,b)。此外,虽然总pb淋巴细胞初始增加显著,但它们在18小时内也降低到基线(图6c)。相比之下,r-bc154(ixb)尽管能够在体外有效地结合bm祖细胞(lsk细胞)和hsc(lskslam细胞)(图7),但是在体内施用时仅导致pb祖细胞和hsc的中等程度增加(图6d)。r-bc154(ixb)相对于bop的降低的体内功效最有可能是由于前者具有较低结合亲和力(如通过体外结合和离解动力学研究所测定),从而降低了对整联蛋白依赖性粘附相互作用的抑制效力。实施例7:使用bop与amd3100组合增强hsc动员与单独使用amd3100治疗的小鼠相比,amd3100与bop的共同施用没有显著增加pb中lsk细胞的比例(图8a)。然而,与单独的bop或amd3100相比,发现使用amd3100添加bop显著增加pb中lskslam细胞的比例(p<0.05)。因此,相对于单独接受bop或amd3100的组,bop和amd3100的组合没有动员pb中中更多数量的lsk细胞(图8b),但发现pb中lskslam细胞数量显著增加(图8b)。为了证实动员的pb中lsk和lskslam细胞的表型特征是否反映了功能性hsc和祖细胞,评估了pb中低增殖潜力(lpp)和高增殖潜力(hpp)集落形成细胞(cfc)的存在。lpp-cfc是定型祖细胞的代表,且hpp-cfc已被证明与体内具有再生潜力的细胞密切相关。通过bop或amd3100动员的pb相对于盐水对照表现出更大的lpp-cfc(图8c)和hpp-cfc(图8d)含量。然而,当与单独的bop和amd3100相比时,bop和amd3100的组合对pb的动员并不具有显著更高的lpp-cfc(图8c)或hpp-cfc(图8c),虽然其对免疫表型lskslam的动员表现优异。这些结果反映了检测到的lsk和lskslam含量与动员的血液中分别观察到的hpp-cfc(r2=0.47和0.46)和lpp-cfc含量(r2=0.54和0.36)之间的中度相关性(图8e)。为了确定bop动员的pb是否包含具有长期多谱系移植潜力的真实hsc,进行了有限稀释移植分析。将从rfp供体通过bop、amd3100或bop和amd3100的组合处理所动员的极限体积(limitingvolumes)的pb移植到被致死辐照的c57受体,并在多达20周时评价多谱系重构(图8f)。与单独amd3100组相比,在接受bop和amd3100组合动员的pb的受试者观察到显著更高的存活率(图8g)。使用l-calc的poisson回归分析显示,与单独的bop(322中有1;95%ci=127中有1至612中有1)和amd3100(351中有1;95%ci=128中有1至958中有1)相比,通过bop和amd3100组合动员的pb,得到更高的再生频率:23μlpb中有1(95%ci=10中有1至51中有1),与单一治疗方案相比,提高了10倍以上(p<0.005)(图8h)。相对于lpp-cfc、hpp-cfc和lsk的测定,动员的pb中的lskslam含量最准确地预测长期移植结果。这些结果表明,单独或与amd3100组合的bop治疗可动员长期再生hsc,并验证lskslam表型的流式细胞仪监测是一种快速、方便和适度的“实时”hsc动员测定。实施例8:使用bop与靶向cxcr4组合增强hsc动员amd3100的施用导致相对于bop(7.0±0.8×106/ml)的wbc计数的相似增加(7.8±1.5×106/ml)和pb中祖细胞(lsk细胞)的比例相应增加(图8a)。然而,相对于amd3100,bop导致pb中的hsc(lskslam细胞)的比例显著增加(图8b;p<0.05),表明amd3100主要动员祖细胞,而bop还动员hsc。此外,与单独的bop或amd3100相比,bop和amd3100的组合协同动员wbc(16.4±1.9×106/ml)、祖细胞和hsc细胞(图8b)。有趣的是,相对于其体内的中心相应物(centralcounterparts),观察到bop与骨内膜lsk的显著更强的结合(图6e)。实施例9:与特异性靶向单一α4β1或α4β1与cxcr4的组合相比,α9β1与α4β1和cxcr4联合的抑制增强hsc动员为了测定α9β1的共抑制是否比单独抑制α4β1或抑制α4β1与cxcr4的组合具有动员优势,使用选择性α4β1抑制剂bio5192。据报道在使用和不使用amd3100的情况下,bio5192动员cfu和长期再生hsc,但未研究动员的特定细胞类型。bio5192的静脉内施用导致pb中wbc计数(图9a)、祖细胞(lsk细胞)和hsc(lskslam细胞)仅中等程度增加(图9b)。bio5192与amd3100的共同施用产生了总wbc的显著增加(图9a),但与单独的bio5192相比,祖细胞仅增加中等程度的2.4倍,hsc增加1.4倍(图9b)。这与bop和amd3100的组合形成鲜明的对比,所述组合尽管诱导了相似的pbwbc计数(图9a),但它们动员了显著更多的祖细胞和hsc数量(图9b)。这些数据表明,与cxcr4和α4β1的共同结合导致主要定型wbc的动员,但相反,与α4β1和α9β1的共同结合导致hsc动员显著增加。实施例10:有和没有cxcr4,对于α9β1和α4β1的抑制动员功能性hsc为证实动员的pb中的lskslam和lsk细胞表型是否反映具有长期多谱系移植潜力的功能性hsc和祖细胞,使用bop、amd3100或其组合进行有限稀释移植分析。相对于使用单独的bop和amd3100,使用bop和amd3100的组合在接受30μl动员的pb的受试者中观察到更高的存活率(p<0.05)(图8a)。此外,有限稀释移植后的poisson回归分析显示,与单独的bop(327μl中有1hsc;95%ci=150μl中有1hsc至715μl中有1hsc)或amd3100(351μl中有1hsc;95%ci=128μl中有1hsc至958μl中有1hsc)相比,通过bop和amd3100组合动员的pb导致更高的再生频率:23μlpb中有1hsc(95%ci=10μl有1hsc至51μl有1hsc),突出显示与单一治疗方案相比,改善10倍以上(p<0.005)(图8h)。这些结果表明,单独或与amd3100组合的bop治疗可动员长期再生hsc,并验证lskslam表型的流式细胞仪监测是评估鼠hsc动员的一种快速方法。实施例11:bop和amd3100的组合是g-csf动员的有效和快速的替代方案与使用4天g-csf的动员相比,使用单剂量的bop和amd3100的组合动员相当数量的hsc(图10a)。然而,有趣的是,单独使用g-csf动员了明显更多的祖细胞(图10a)。为了比较用多剂量g-csf和单剂量bop与amd3100动员的pb的造血潜力,使用了竞争性的长期重构测定(图10b)。尽管在g-csf以及bop与amd3100的组合施用之后动员了相当数量的hsc(图10a),但是使用后者观察到显著增强的短期和长期多谱系植入(图10d和图10e,f)。此外,在次级移植中保持了比数学上预期的显著更多的植入(图10g,h和图10i,j)。用bop和amd3100动员的pb观察到的更多的植入表明具有由g-csf动员的lsk/lskslam表型的细胞具有降低的造血潜能,这与先前的发现相一致,证明g-csf动员的lsk细胞相对于天然bmlsk具有显著受损的植入潜力。实施例12:bop和amd3100的组合还有效地动员人cd34+干细胞和祖细胞为了确定使用bop的hsc动员在人体中是否相当,使用了hunsg小鼠。使用单剂量bop或amd3100治疗或使用多剂量g-csf单独治疗4天不会导致pb人类wbc或人类cd34+干细胞和祖细胞显著增加(图11)。相比之下,单剂量的bop与amd3100组合导致人wbc和干细胞和祖细胞都显著增加(图11)。这些数据表明,hunsg小鼠是人类hsc动员的有用替代模型,并证明了bop与amd3100对于人类cd34+细胞的快速临床动员的有希望的功效。实施例13:n-(3-吡啶磺酰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸(py-bop)的制备还合成了不同于bop的py-bop,py-bop具有吡啶环而不是苯环,如下面的流程3所示:流程3因此,将胺29与3-吡啶磺酰氯反应得到磺酰胺31,将其随后用氢氧化钠水解,得到py-bop,产率优异。作为举例,本文提供了用于从胺29开始形成py-bop的实际反应条件。步骤1:n-(3-吡啶磺酰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸甲酯(31)将二异丙基乙胺(dipea)(110μl,0.63mmol)加入胺29(98mg,0.252mmol)、3-吡啶磺酰氯(295μl,0.33mmol;200mg/ml,在ch2cl2中)和4-二甲基氨基吡啶(dmap)(5mg,0.041mmol)在ch2cl2(5ml)中的搅拌的溶液中。将该混合物在室温在n2下搅拌2h,用饱和的nahco3水溶液、盐水洗涤,干燥(mgso4),并减压浓缩。将残余物经快速色谱(5%至10%meoh/etoac)纯化,得到产物31(129mg,96%),为无色油状物。δh(400mhz,cdcl3)1.51-1.62(3h,m),1.89-2.00(4h,m),2.06-2.09(1h,m),3.05(1h,dd,j=7.5,14.0hz),3.16(1h,m),3.27(1h,dd,j=5.6,14.0hz),3.41(1h,m),3.46(2h,t,j=6.6hz),3.55(2h,t,j=6.8hz),3.78(3h,s),4.11(1h,dd,j=2.8,8.5hz),4.84(1h,dt,j=5.7,11.4hz),7.06-7.14(5h,m),7.50(1h,ddd,j=1.0,5.0,8.2hz),8.13(1h,ddd,j=1.7,2.5,8.1hz),8.85(1h,dd,j=1.6,4.8hz),9.07(1h,dd,j=0.8,2.5hz)。步骤2:n-(3-吡啶磺酰基)-l-脯氨酰基-l-o-(1-吡咯烷基羰基)酪氨酸(py-bop)将0.2mnaoh(1.3ml,0.261mmol)加入酯31(116mg,0.218mmol)在etoh(5ml)中的溶液中,将该混合物在室温搅拌2h,浓缩,然后经c18反相色谱(30%-50%meoh/h2o)纯化,得到产物(99mg,88%),为无色玻璃状物。δh(400mhz,d2o)1.55-1.69(2h,m),1.75-1.92(6h,m),3.01(1h,dd,j=8.1,14.0hz)3.21-3.27(2h,m),3.32-3.36(2h,m),3.40-3.48(3h,m),4.12(1h,dd,j=4.4,8.7hz),4.46(1h,dd,j=4.9,8.0hz),7.03(2h,d,j=8.5hz),7.28(2h,d,j=8.5),7.64(1h,dd,j=5.0,8.2hz),8.15(1h,ddd,j=1.5,2.2,8.0hz),8.78(1h,dd,j=1.2,4.9hz),8.89(1h,d,j=1.7hz);δc(100mhz,d2o)24.22,24.64,25.26,30.86,37.01,46.54,46.61,49.67,56.10,62.12,121.86,125.13,130.59,132.83,135.15,136.57,147.24,149.69,153.55,155.17,172.85,177.38;hrms(esi+)m/z539.1574(c24h28nan4o7s[m+na]+理论值539.1571)。实施例14:py-bop和amd3100的组合有效动员人lsk和lskslam细胞pybop与amd3100的体内联合施用在1小时后引起pb祖细胞(图12a)和hsc(图12b)的显著增加,表明是快速且有效的动员。实施例15:bop快速动员hsc和bcp-all,其中α9β1起关键作用。bop在体内的施用引起pbhsc的剂量依赖性增加(图5a),其在1小时达到峰值,表明是快速且有效的动员(图5b)。此外,将amd3100添加到bop导致动员的hsc数量显著且协同地增加(图8b),并且这些具有显著更高频率的具有长期多谱系植入潜力的细胞(图8h)。重要的是,尽管当将α4β1特异性抑制剂bio519239或双重α4β1/α9β1抑制剂bop与amd3100组合使用时,观察到wbc计数相似的增加,但在后者观察到显著更高的hsc动员(图9a),突出显示了α9β1作为关键受体用于hsc的优先流出。使用bop与amd3100组合也可以快速且有效地动员人cd34+(如上所示)和bcp-all(图13a)细胞,与单独的bop或amd3100相比,这显著增加。重要的是,与单独的bop相比,当联合使用bop与amd3100时,观察到显著更大的bop与位于骨内膜的all细胞结合,表明在体内在bm区域amd3100增强α4β1/α9β1活性(图13b)。这些数据表明,bop加amd3100可有效动员hunsg异种移植模型中的人cd34+和bcp-all细胞,并突出显示bop加amd3100对bmall细胞临床动员和移植二者的效用。上述实施例显示使用小分子拮抗剂bop抑制α9β1/α4β1整联蛋白,通过抑制与vcam-1和opn的整联蛋白依赖性结合而诱导长期再生hsc的快速动员。使用仅在用二价金属阳离子活化时与α4β1和α9β1整联蛋白结合的荧光小分子整联蛋白拮抗剂(r-bc154(ixb)),首次显示了:小鼠和人类hsc上的这两种β1整联蛋白的活化状态在体内是内在活化的,并通过骨内膜龛区别指定。这些实施例显示包括hsc和祖细胞在内的骨内膜龛的bm细胞表达α9β1/α4β1整联蛋白,其具有比中央髓腔内所观察到的更高的亲和结合状态。申请人证明了:lskcd150+cd48-(lskslam)的测定可用作用于普遍的hsc的动员的快速便捷的替代筛选方法,其反映了比量化动员血液中cfc含量更接近的长期移植结果。具体来说,发现单独的或与amd3100组合的bop可以,以比hpp-cfc、lpp-cfc或lsk细胞含量测定更好地与lt-hsc相关的方式,有效地动员表型lskslam。因此,仅基于短期集落形成试验的hsc动员的评价,反而忽视了bop和amd3100的组合是有效的动员方法。在目前的研究中,g-csf在人源化nodscidil2rγ-/-小鼠中未能动员cd34+造血干细胞和祖细胞。相反,bop和amd3100的组合对人cd34+细胞产生了显著的动员,并表明该策略可适用于人类患者和供体的临床动员。申请人已经证明,使用单剂量的bop靶向α9β1/α4β1,通过抑制整联蛋白依赖性结合(最有可能是结合于tropn和vcam-1),诱导长期再生hsc的快速动员。使用荧光bop类似物r-bc154(ixb),显示出通过α9β1出现与人和鼠hsc显著比例的结合,而与谱系定型的细胞的结合几乎仅仅通过α4β1。因此,发现α9β1的抑制提供了超过单独抑制α4β1的对hsc动员产率的附加优势,如通过与选择性α4β1拮抗剂bio5192相比使用bop具有显著更大的hsc和祖细胞的动员所证明的那样;特别是当与amd3100组合使用时。与bop和amd3100的组合相比,使用bio5192和amd3100的组合在hsc动员(而非wbc动员)中协同作用减少,这支持了靶向α4偏向祖细胞动员,而靶向α9优先动员hsc。相对于bio5192,使用bop显著增加amd3100介导的动员表明,整联蛋白α9β1在hsc动员中的作用随着同时靶向cxcr4而被放大。总之,现在证明了单剂量的bop(一种靶向α4β1和α9β1整联蛋白的小分子),有效且快速地动员具有长期多谱系植入潜力的hsc,鉴定了在hsc动员中以前未被认识的α9β1的作用。当与cxcr4抑制剂如amd3100组合使用时,相对于g-csf,观察到显著增强的长期再生hsc的动员。在人源化nodscidil2rγ-/-小鼠中cd34+细胞的动员中,重点描述了使用bop和amd3100组合的hsc动员的功效。使用相关荧光标记的整联蛋白拮抗剂r-bc154(ixb),显示这类化合物通过骨内膜龛中内源性活化/引发的α4β1和α9β1与小鼠和人类hsc和祖细胞结合。此外,显示了大部分与人hsc结合的r-bc154(ixb)/bop通过在谱系定型细胞中不存在的α9β1发生。这些结果凸显了治疗性靶向骨内膜hsc的有效和方便的策略,其解决了与g-csf相关的许多缺点,并为开发用于优先hsc动员的另外的选择性小分子α9β1整联蛋白拮抗剂铺平了道路。虽然本发明的上述书面描述使得普通技术人员能够制备和使用目前被认为是最佳方式的方案,但是普通技术人员将理解和认可存在本文具体实施方案、方法和实施例的变型、组合和等同物。因此,本发明不应受上述实施方案、方法和实施例的限制,而是如本文广泛描述的本发明的范围和主旨内的所有实施方案和方法的限制。参考1.j.grassinger,d.n.haylock,m.j.storan,g.o.haines,b.williams,g.a.whitty,a.r.vinson,c.l.be,s.h.li,e.s.sorensen,p.p.l.tam,d.t.denhardt,d.sheppard,p.f.choongands.k.nilsson,blood,2009,114,49–59.2.d.n.haylock,b.williams,h.m.johnston,m.c.p.liu,k.e.rutherford,g.a.whitty,p.j.simmons,i.bertoncelloands.k.nilsson,stemcells,2007,25,1062–1069.3.j.grassinger,b.williams,g.h.olsen,d.n.haylockands.k.nilsson,cytokine,2012,58,218–225.4.nilsson,s.k.etal.osteopontin,akeycomponentofthehaematopoieticstemcellnicheandregulatorofprimitivehaematopoieticprogenitorcells.blood106,1232-1239,doi:10.1182/blood-2004-11-4422(2005).5.grassinger,j.etal.thrombin-cleavedosteopontinregulateshaematopoieticstemandprogenitorcellfunctionsthroughinteractionswithalpha(9)beta(1)andalpha(4)beta(1)integrins.blood114,49-59,doi:doi10.1182/blood-2009-01-197988(2009).6.bartelmez,s.h.etal.interleukin-1plusinterleukin-3pluscolony-stimulatingfactor-iareessentialforclonalproliferationofprimitivemyeloidbone-marrowcells.experimentalhematology17,240-245(1989).7.herbert,k.e.,levesque,j.p.,haylock,d.n.&princes,m.theuseofexperimentalmurinemodelstoassessnovelagentsofhaematopoieticstemandprogenitorcellmobilization.biolbloodmarrowtr14,603-621,doi:doi10.1016/j.bbmt.2008.02.003(2008).8.cao,b.等人design,synthesisandbindingpropertiesofafluorescentalpha(9)beta(1)/alpha(4)beta(1)integrinantagonistanditsapplicationasaninvivoprobeforbonemarrowhaemopoieticstemcells.org.biomol.chem.12,965-978,doi:doi10.1039/c3ob42332h(2014).9.pepinsky,r.b.等人comparativeassessmentoftheligandandmetalionbindingpropertiesofintegrinsalpha9beta1andalpha4beta1.biochemistry41,7125-7141,doi:doi10.1021/bi020024d(2002).10.schofield,r.relationshipbetweenspleencolony-formingcellandhaematopoieticstem-cell-hypothesis.bloodcells4,7-25(1978)11.shultz,l.d.,brehm,m.a.,garcia-martinez,j.v.&greiner,d.l.humanizedmiceforimmunesysteminvestigation:progress,promiseandchallenges.natrevimmunol12,786-798,doi:doi10.1038/nri3311(2012).12.ito,r.,takahashi,t.,katano,i.&ito,m.currentadvancesinhumanizedmousemodels.cellmolimmunol9,208-214,doi:doi10.1038/cmi.2012.2(2012).13.leone,d.r.等人anassessmentofthemechanisticdifferencesbetweentwointegrinalpha(4)beta(1)inhibitors,themonoclonalantibodyta-2andthesmallmoleculebio5192,inratexperimentalautoimmuneencephalomyelitis.j.pharmacol.exp.ther.305,1150-1162,(2003).当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1