一种脱细胞胶原凝胶微球支架的制备方法及应用与流程
本发明属于脱细胞支架组织工程技术领域,具体为一种脱细胞胶原凝胶微球支架的制备方法及应用。
背景技术:
脱细胞支架是常见的组织工程支架。脱细胞支架的来源主要有天然组织和体外组织工程。但是都存在一些问题。由于来源问题,人源天然组织比较少见。大多采用异种来源,猪眼角膜,牛心包等产品都非常常见。但是,异种来源的组织,更加容易出现排斥反应。体外组织工程也可以获得满足一定功能的组织,比如脂肪、软骨、骨,相比天然来源更加容易获得和大批量生产。脱细胞是制备脱细胞支架最关键的一步,细胞的脱除和基质以及生物因子的保存都非常重要。过分脱细胞,会导致基质和因子被破坏,无法保留脱细胞支架的生物学性能。细胞脱除不干净,残余的dna等物质会导致排斥反应。常见的手段,就是将天然组织或者组织工程获得的组织破碎成小块,再进行脱细胞处理。破碎过程的发热和机械力会导致包括生物因子的基质和微细结构变性或者被破坏。
技术实现要素:
本发明的目的在于提供一种脱细胞胶原凝胶微球支架的制备方法,通过直接制备包裹细胞的胶原凝胶微球,在体外培养得到微米级的组织块。在快速得到大量微米级组织的同时,能避免后续的破碎过程,可以直接进行脱细胞操作,更好的保留了组织中的基质以及微细结构。本发明目的通过下述技术方案来实现:
一种脱细胞胶原凝胶微球支架的制备方法,包括细胞-胶原混合液的制备,细胞-胶原凝胶微球的制备以及脱细胞胶原凝胶微球支架的制备。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述细胞-胶原混合液的制备为:将胶原溶液ph调节至6.5~7.5,并将细胞悬液均匀混合到胶原溶液中即得细胞-胶原混合液;所述细胞-胶原凝胶微球的制备为:将细胞-胶原混合液加入到油相溶液中,生成稳定悬浮液后,提供合适的成胶条件使微球凝胶化,然后经离心或过滤收集、清洗后即得细胞-胶原凝胶微球。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述脱细胞胶原凝胶微球支架的制备为:将上述制备的细胞-胶原凝胶微球在体外培养后收集所需的胶原凝胶微球,在液氮及水中反复冷冻-溶解1~10次,经清洗ⅰ、震荡ⅰ后将胶原凝胶微球加入到dnase1的水溶液中震荡1~24h,最后经清洗ⅱ、戊二醛处理及培养基清洗即得脱细胞胶原凝胶微球支架。本步骤中将dnase1的处理时间设定为1~24h小时,是因为当处理时间大于24小时会对基质造成很大的破坏。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述戊二醛处理后还包括酒精浸泡及超声处理,最后再用培养基清洗。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述液氮及水中反复冷冻-溶解前还包括用加有蛋白酶抑制剂的去离子水将凝胶微球清洗1~6次。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述水的温度为25~37℃;所述清洗ⅰ为用0.1%~2%的tritonx-100水溶液中清洗1~3次;所述震荡ⅰ为在100~1000rpm转速下震荡1~60min。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述dnase1的水溶液中dnase1的浓度为10~500units/ml;所述dnase1的水溶液中震荡温度为20~37℃,转速为10~140rpm,并间隔0.5~12h更换一次新鲜dnase1溶液,每次更换dnase1溶液前用0.05%~2%的tritonx-100水溶液清洗0~5min。
作为本发明一种脱细胞胶原凝胶微球支架的制备方法的一个具体实施例,所述清洗ⅱ为采用edta溶液清洗0~10次;所述戊二醛处理为采用0.1%戊二醛处理0~24小时;所述酒精浸泡为采用用75%酒精浸泡0~1小时;所述超声处理时间为0~10min。
本发明还提供一种脱细胞胶原凝胶微球支架,所述胶原凝胶微球支架采用上述制备方法制备得到。
本发明还提供所述脱细胞胶原凝胶微球支架的应用,所述脱细胞凝胶微球支架在软骨及软骨下骨缺损修复中的应用。
本发明的有益效果:
本发明通过直接制备包裹细胞的胶原凝胶微球,在体外培养得到微米级的组织块。在快速得到大量微米级组织的同时,可以直接进行脱细胞操作,避免后续的破碎过程,更好的保留了组织中的基质以及微细结构。本发明制备的脱细胞胶原凝胶微球支架无dna残留,可以将排斥反应降到最低。本发明还提供所述脱细胞胶原凝胶微球支架的应用,将其应用于软骨及软骨下骨缺损修复。本发明脱细胞胶原凝胶微球支架尺寸为微米级别,将其应用于软骨及软骨下骨缺损修复,有利于细胞的粘附及组织愈合,有利于后期形成均匀分布的组织,避免空心化现象,可以在关节镜下操作减少手术创伤和后期感染的概率。
附图说明
图1为本发明脱细胞胶原凝胶微球支架制备方法的流程图。
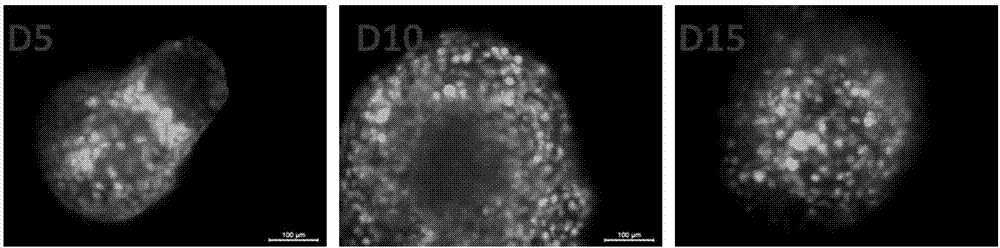
图2为实施例1制备的骨髓间充质干细胞-胶原凝胶微球在软骨诱导培养基中培养5天、10天和15天的细胞状态;
图3为骨髓间充质干细胞-胶原凝胶微球脱细胞前后的dapi染色,其中(a)表示脱细胞前,(b)表示脱细胞后;
图4为脱细胞前后骨髓间充质干细胞-胶原凝胶微球的tb染色,其中(a)表示脱细胞前,(b)表示脱细胞后;
图5为脱细胞胶原凝胶微球支架种植骨髓间充质干细胞得到的块状组织;
图6为脱细胞胶原凝胶微球支架种植骨髓间充质干细胞得到组织的fda染色;
图7为脱细胞胶原凝胶微球支架种植骨髓间充质干细胞得到组织的tb染色;
图8为在关节软骨修复时,植入脱细胞胶原凝胶微球支架的操作示意图;
图9为对比例四种脱细胞流程处理方式得到的脱细胞支架样品dapi染色。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
实施例1
按以下步骤制备装载骨髓间充质干细胞的胶原凝胶微球
1、取浓度为15mg/ml的胶原溶液,在冰水浴中用少量1mol/l的氢氧化钠溶液调节ph到7.0,稀释胶原溶液到8mg/ml;
2、将提前准备好的骨髓间充质干细胞,计数并且用α-mem培养基制备成细胞悬液,加入到胶原溶液中并分散均匀,胶原终浓度为6.5mg/ml,细胞密度为5×106个/ml;
3、选择粘度为100mpa·s的甲基硅油70ml,加入0.05%(v/v)的span-80,用磁力搅拌器以500rpm的转速搅拌;
4、在冰水浴条件下,将细胞-胶原混合液滴加到油相中,继续搅拌30分钟;然后将水相-油相混合体系升温至37度,继续搅拌20分钟;搅拌完成后,将水相-油相混合液离心,将底层沉淀分散到α-mem培养基中清洗;
5、将上述含有胶原微球的α-mem培养基经过40微米筛网过滤,用培养基冲洗3次即得本实施例骨髓间充质干细胞-胶原凝胶微球。
实施例2
按以下步骤制备装载软骨细胞的胶原凝胶微球
1、取浓度为15mg/ml的胶原溶液,在冰水浴中用少量1mol/l的氢氧化钠溶液调节ph到7.0,稀释胶原溶液到8mg/ml;
2、将提前准备好的软骨细胞,计数并且用α-mem培养基制备成细胞悬液,加入到胶原溶液中并分散均匀,胶原终浓度为5mg/ml,细胞密度为1×107个/ml;
3、选择粘度为100mpa·s的甲基硅油70ml,加入0.1%(v/v)的span-80,用磁力搅拌器以600rpm的转速搅拌;
4、在冰水浴条件下,将细胞-胶原混合液滴加到油相中,继续搅拌30分钟;然后将水相-油相混合体系升温至37度,继续搅拌20分钟;搅拌完成后,将水相-油相混合液离心,将底层沉淀分散到α-mem培养基中清洗;
5、将上述含有胶原凝胶微球的α-mem培养基经过40微米筛网过滤,用培养基冲洗3次即得本实施例软骨细胞-胶原凝胶微球。
实施例3
骨髓间充质干细胞-胶原凝胶微球的体外培养实验
将实施例1制备出骨髓间充质干细胞-胶原凝胶微球在软骨诱导培养基中培养5天、10天和15天,对样品进行荧光素双醋酸酯(fda)染色观察细胞状态,其结果如图2所示。
从图2可以看出,实施例1制备的骨髓间充质干细胞-胶原凝胶微球从第5天开始细胞形态都保持为圆球形态,说明干细胞已经向软骨细胞分化,而且细胞密度逐渐降低。微球的尺寸在第一天有一点收缩,因为此时细胞开始粘附还没有向软骨细胞分化,在第五天以后尺寸基本稳定。
实施例4
按照以下步骤对实施例1制备的骨髓间充质干细胞-胶原凝胶微球实施脱细胞处理,制备脱细胞胶原凝胶微球支架
1、将实施例1制备得到的骨髓间充质干细胞-胶原凝胶微球放入低粘附培养皿中,在软骨诱导培养基下培养。经过一定培养时间后,取50mg的骨髓间充质干细胞-胶原凝胶微球,用pbs清洗干净;
2、用加有蛋白酶抑制剂的去离子水和1mol/l氯化钠盐溶液中清洗3分钟,反复3次;然后将微球移至离心管中并放入液氮中冷冻,再放入37摄氏度热水浴中溶解,反复3次;
3、将微球移入到0.5%tritonx-100水溶液中(添加0.15%的氨水)清洗3次,并在500转速下震荡20分钟;然后加入到200u/ml的dnase1溶液中,在37℃下,转速为100转条件下震荡12小时,间隔4小时换液一次新鲜dnase1溶液,更换dnase1溶液前用0.05%的tritonx-100水溶液清洗5min。
4、将微球移入到10nmol/l的edta溶液中,震荡清洗5分钟,然后放入0.1%的戊二醛溶液中处理2小时,用pbs清洗6次即得本实施例脱细胞胶原凝胶微球支架,将脱细胞胶原凝胶微球支架用液氮冻存备用。
实施例5
脱细胞胶原凝胶微球支架的表征
按照实施例4中的操作,制备出脱细胞胶原凝胶微球支架。利用4',6-二脒基-2-苯基吲哚(dapi)染料来确认残余的dna,利用甲苯胺蓝(tb)来反应微球中软骨特异性多糖的情况。实验结果如图3、图4所示。
图3为骨髓间充质干细胞-胶原微球脱细胞前后的dapi染色,其中(a)表示脱细胞前,(b)表示脱细胞后。从图3可以看出,图(a)中大量蓝色荧光说明脱细胞前存在大量dna;图(b)中几乎没有蓝色荧光存在,说明实施例4中骨髓间充质干细胞-胶原微球支架的dna已经脱除干净。
图4为脱细胞前后髓间充质干细胞-胶原微球脱的tb染色,其中(a)表示脱细胞前,(b)表示脱细胞后。从图4中可以看出,脱细胞前胶原微球内存在大量的多糖基质,显示为深紫色,脱细胞后胶原微球的tb染色显示为淡紫色,说明有部分基质在脱细胞过程中被洗脱掉了。
实施例6
按照以下步骤对实施例4制备的脱细胞胶原凝胶微球支架种植细胞
1、取10mg实施例4制备的脱细胞胶原凝胶微球支架,用75%的乙醇溶液浸泡15分钟,用dmem培养基清洗6次,放入15ml离心管中备用;
2、将提前准备好的骨髓间充质干细胞,计数并且用α-mem完全培养基制备成细胞悬液,滴加到上述脱细胞胶原凝胶微球支架上,细胞密度为1×104个/mg,培养24小时,每间隔8小时震荡一次;
3、将微球周围的培养基吸净,更换为未添加生长因子的软骨诱导培养基,培养28天。对组织进行fda染色和切片染色来检测其中细胞形态和基质分泌状态。其检测结果如图5、图6及图7所示。
图5为脱细胞胶原凝胶微球支架种植细胞得到的块状组织,从图5可以看出,微球已经长成一个直径超过4mm的块状组织。
图6为脱细胞胶原凝胶微球支架种植细胞得到组织的fda染色,从图6可以看出,fda染色反应骨髓间充质干细胞为圆球表型。
图7为脱细胞胶原凝胶微球支架种植细胞得到组织的tb染色,从图7可以看出,在脱细胞胶原凝胶微球支架周围有大量的新生基质产生,说明种植的骨髓间充质干细胞已经分化为软骨细胞,并开始分泌软骨特异性基质。
图8是在关节软骨修复时,植入脱细胞胶原凝胶微球支架的操作示意图,该支架可以通过注射的方法进行微创手术。
对比例脱细胞流程顺序对比
为了说明本发明脱细胞流程顺序的有益效果,发明人设计了四组脱细胞流程与本专利脱细胞流程进行对比,四组脱细胞实验的dnase1处理时间24小时。
a组采用冻融-dnase1-tritonx100;
b组采用冻融-交联-dnase1-tritonx100;
c组采用tritonx100-dnase1;
d组采用交联-tritonx100-dnase1。
对采用上述四种脱细胞流程处理方式得到的脱细胞支架样品进行dapi染色,其结构如图9所示。从图9可以看出,四组不同脱细胞流程处理的脱细胞支架都还有剩余的dna没有被完全除去,其dna的清洗效果是c>a>d>b,说明tritonx100对于细胞膜的破坏作用比冻融要强,dnase1要在tritonx100处理后才能更好的降解dna,交联的作用是减少基质的流失,但是必须在脱细胞流程后操作,否则会影响脱细胞效果。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!