大运输物向多孔基质上的细胞中的高效递送的制作方法
本申请要求2014年3月28日提交的USSN 61/972,145的权益和优先权,所述专利全文出于所有目的以引用的方式并入本文。
政府资助声明
[不适用]
背景技术:
将宽1尺寸范围的运输物(cargo)传递至哺乳动物细胞中在许多生物学领域中是非常需要的,所述宽尺寸范围的运输物包括蛋白质、DNA、RNA、染色体、细胞核以及无生命颗粒,如量子点、表面增强拉曼散射(SERS)颗粒、以及微珠。诸如内吞作用的递送方法能够将运输物截获在核内体中,在核内体中低pH微环境和裂解酶经常使得运输物降解(Luo和Saltzman(2000)Nat.Biotechnol.18:33-37)。病毒和化学递送方法将运输物包装在病毒内或形成增强摄取的化学复合物(Naldini等人,(1996)Science,272:263-267;Felgner等人(1987)Proc.Natl.Acad.Sci.USA,84:7413–7417)。然而,毒性、细胞类型特异性摄取以及更重要的是受限的运输物包装能力对运输物尺寸和可传递的细胞类型施加了相当大的约束(Luo和Saltzman,同上。)。
物理传递方法包括电穿孔(Chu,等人(1987)Nucleic Acids Res.15:1311-1326)和声穿孔(Mitragotri(2005)Nat.Rev.Drug Discovery,4:255-260),其产生随机分布的纳米级孔;以及光穿孔(Tirlapur and Konig(2002)Nature,418:290-291;Vogel,等人(2005)Appl.Phys.B:Laser Opt.,81:1015-1047;Clark等人(2006)J.Biomed.Opt.,11:014034),其在激光焦点处在细胞膜上产生孔。通过这些孔,小运输物利用热扩散或利用电场被递送到细胞中。由于运输物扩散速度较慢且随着孔径增加而细胞活力降低,所以使用这些方法递送大运输物具有较低的效率(Stevenson等人(2006)Opt.Express,14:7125-7133)。微毛细管注射(King(2004)Methods in Molecular Biology 245:Gene Delivery to Mammalian Cells 1;Humana Press Inc.:Totowa,NJ)使用尖锐的尖端(lass tip)机械穿透细胞膜以用于递送。但是,为了维持细胞活力,来自膜穿透的机械性创伤将典型的移液管尖端直径限制在0.5um(Han等人(2998)J.Nanomed.Nanotechnol.Biol.Med.,4:215-225)。
由于移液管堵塞和运输物剪切,所以大于移液管尖端的运输物不能被注射。电注射(其结合了电穿孔与微毛细管注射)已证明通过用电场弱化接触细胞膜,之后温和地机械穿透进入细胞而进行的小分子递送,诸如将RNA和质粒DNA递送至活细胞中(Boudes等人(208)J.Neurosci.Meth.,170:204-211;Kitamura等人(2008)Nat.Meth.,5:61-67)以及将细菌递送到人工脂质囊泡中(Hurtig和Orwar(2008)Soft Matter,4:1515-1520)。另选地,简单的脂质辅助显微注射(SLAM)技术(Laffafian和Hallett(1998)Biophys.J.,75:2558-2563)在玻璃微毛细管的尖端处并入合成脂质分子。SLAM微量移液管与细胞膜的接触允许脂质分子与细胞膜融合以形成用于运输物递送的连续和临时途径。这一方法避免了微量移液管尖端穿过细胞膜造成的z字形刺穿动作。然而,运输物与细胞膜之间的亲脂性相互作用会在细胞中产生不想要的生物效应,同样,在递送的运输物下,也将此方法限制于特定的细胞类型和运输物含量。
概述
在各个方面,本文涵盖的本发明可包括但无需限于以下实施方案中的任何一个或多个:
实施方案1:一种将大运输物递送到真核细胞中的方法,所述方法包括:提供设置在多孔膜的一侧上的所述细胞;提供处于设置在所述多孔膜的相对侧上的储存室中的溶液中的所述运输物;以及对所述储存室施加足以使所述运输物通过构成所述多孔膜的孔的压力,其中所述运输物通过细胞膜并进入所述细胞。
实施方案2:根据实施方案1所述的方法,其中所述储存室的容积在约10μL直至约500μL、或约40μL至约500μL、或约50μL至约400μL、或约60μL至约300μL、或约70μL至约200μL、或约80μL至约150μL、或约10μL直至约1mL、或约10μL直至约500μL、或约10μL直至约100μL的范围内。
实施方案3:根据实施方案2所述的方法,其中所述储存室具有约100μL的容积。
实施方案4:根据实施方案1-3中任一项所述的方法,其中所述多孔膜的厚度在约5μm至约30μm、或约5μm至约20μm、或约5μm至约15μm的范围内。
实施方案5:根据实施方案4所述的方法,其中所述多孔膜具有约10μm的厚度。
实施方案6:根据实施方案1-5中任一项所述的方法,其中所述多孔膜的平均或中值孔径在约100nm直至约20μm或直至约20μm、或约500nm直至约8μm、或约1μm直至约5μm的范围内。
实施方案7:根据实施方案6所述的方法,其中所述多孔膜的中值或平均孔径为约1μm。
实施方案8:根据实施方案6所述的方法,其中所述多孔膜的中值或平均孔径为约3μm。
实施方案9:根据实施方案6所述的方法,其中所述多孔膜的中值或平均孔径为约5μm。
实施方案10:根据实施方案1-9中任一项所述的方法,其中所述多孔膜具有约1×105个孔/cm2直至约1×107个孔/cm2、或约5×105个孔/cm2直至约5×106、或约1×105个孔/cm2直至约1×107个孔/cm2。
实施方案11:根据实施方案10所述的方法,其中所述多孔膜在约1.6×106个孔/cm2下具有约1μm直径的平均孔径。
实施方案12:根据实施方案10所述的方法,其中所述多孔膜在约8×105个孔/cm2下具有约3μm直径的平均孔径。
实施方案13:根据实施方案1-12中任一项所述的方法,其中所述膜包括聚合物膜。
实施方案14:根据实施方案1-12中任一项所述的方法,其中所述膜包括选自由以下组成的组的材料:尼龙膜、尼龙网、过滤膜、聚四氟乙烯(PTFE)膜、膨体聚四氟乙烯(ePTFE)膜、聚酯膜、聚醚醚酮(PEEK)膜、膨体聚醚醚酮(ePEEK)膜、聚乙烯(PE)膜、聚丙烯(PP)膜、聚偏二氟乙烯(PVDF)膜、乙基乙酸乙烯酯(EVA)膜、热塑性聚氨酯(TPU)膜、聚醚砜(PES)膜、聚碳酸酯膜和聚对苯二甲酸乙二醇酯(PET)膜。
实施方案15:根据实施方案14所述的方法,其中所述膜包括聚酯膜、聚碳酸酯膜或聚对苯二甲酸乙二醇酯(PET)膜。
实施方案16:根据实施方案1-15中任一项所述的方法,其中所述施加压力产生所述多孔膜的偏转。
实施方案17:根据实施方案16所述的方法,其中所述偏转在约20μm、或约50μm、或约100μm、或约500μm直至约至约1cm、或直至约500mm、或直至约300mm、或直至约100mm的范围内。
实施方案18:根据实施方案1-17中任一项所述的方法,其中所述施加压力包括施加瞬时压力。
实施方案19:根据实施方案1-18中任一项所述的方法,其中所述施加压力包括施加约1毫秒直至约1分钟、或约100毫秒直至约1分钟、或约1秒直至约1分钟的压力。
实施方案20:根据实施方案1-19中任一项所述的方法,其中所述施加压力包括通过端口将压力施加到所述储存室。
实施方案21:根据实施方案1-19中任一项所述的方法,其中所述施加压力包括当所述腔室被填充和封闭时偏转所述储存室的壁。
实施方案22:根据实施方案1-19中任一项所述的方法,其中所述施加压力包括通过所述储存室的壁注入溶液。
实施方案23:根据实施方案1-22中任一项所述的方法,其中所述提供处于设置在储存室中的溶液中的所述运输物包括将所述溶液通过端口引入所述储存室。
实施方案24:根据实施方案1-22中任一项所述的方法,其中所述提供处于设置在储存室中的溶液中的所述运输物包括将运输物溶液移液至储存器中。
实施方案25:根据实施方案1-22中任一项所述的方法,其中所述提供处于设置在储存室中的溶液中的所述运输物包括为所述储存室装料,之后将所述多孔膜放置于所述腔室之上或之内。
实施方案26:根据实施方案1-22中任一项所述的方法,其中所述提供处于设置在储存室中的溶液中的所述运输物包括通过穿透所述储存室的壁的针注入所述溶液。
实施方案27:根据实施方案1-22中任一项所述的方法,其中所述提供处于设置在储存室中的溶液中的所述运输物包括使所述溶液通过所述膜来为所述储存室装料。
实施方案28:根据实施方案1-27中任一项所述的方法,其中所述运输物包括选自由以下组成的组的一个或部分:天然染色体或染色体片段、合成染色体、细菌、合成颗粒、细胞内真菌、细胞内原生动物、包装在脂质体(例如脂转染胺(lipofectamine))中的DNA和/或RNA,以及细胞器。
实施方案29:根据实施方案28所述的方法,其中所述运输物包括细胞核。
实施方案30:根据实施方案28所述的方法,其中所述运输物包括线粒体。
实施方案31:根据实施方案28所述的方法,其中所述运输物包括染色体或染色体片段。
实施方案32:根据实施方案28所述的方法,其中所述运输物包括人工染色体。
实施方案33:根据实施方案28所述的方法,其中所述运输物包括细菌。
实施方案34:根据实施方案1-33中任一项所述的方法,其中所述细胞选自由以下组成的组:脊椎动物细胞、真菌细胞和酵母细胞。
实施方案35:根据实施方案1-33中任一项所述的方法,其中所述细胞选自由以下组成的组:哺乳动物细胞、昆虫细胞和无脊椎动物细胞。
实施方案36:根据实施方案35所述的方法,其中所述细胞包括哺乳动物细胞。
实施方案37:根据实施方案35所述的方法,其中所述细胞包括人细胞。
实施方案38:根据实施方案35所述的方法,其中所述细胞包括非人哺乳动物细胞。
实施方案39:根据实施方案36-38中任一项所述的方法,其中所述细胞包括淋巴细胞或干细胞。
实施方案40:根据实施方案39所述的方法,其中所述细胞包括选自由以下组成的组的干细胞:成体干细胞、胚胎干细胞、脐带血干细胞和诱导多能干细胞。
实施方案41:根据实施方案36-38中任一项所述的方法,其中所述细胞包括分化的体细胞。
实施方案42:根据实施方案1-33中任一项所述的方法,其中所述细胞包括来自细胞系的细胞。
实施方案43:根据实施方案42所述的方法,其中所述细胞包括来自表1中列出的细胞系的细胞。
实施方案44:根据实施方案42所述的方法,其中所述细胞包括来自选自由以下组成的组的细胞系的细胞:HeLa、美国国家癌症研究所的60个癌细胞系(NCI60)、ESTDAB数据库、DU145(前列腺癌)、Lncap(前列腺癌)、MCF-7(乳腺癌)、MDA-MB-438(乳腺癌)、PC3(前列腺癌)、T47D(乳腺癌)、THP-1(急性骨髓性白血病)、U87(胶质母细胞瘤)、从骨髓瘤克隆的SHSY5Y人成神经细胞瘤细胞,以及Saos-2细胞(骨癌)。
实施方案45:根据实施方案1-44中任一项所述的方法,其中所述细胞在所述多孔膜上培养。
实施方案46:根据实施方案1-44中任一项所述的方法,其中所述细胞在所述多孔膜上作为粘附层培养。
实施方案47:根据实施方案45-46中任一项所述的方法,其中所述细胞在所述多孔膜上培养至汇合。
实施方案48:根据实施方案1-47中任一项所述的方法,其中所述多孔膜不具有金属膜或金属纳米颗粒。
实施方案49:根据实施方案1-48中任一项所述的方法,其中所述方法不涉及加热所述膜的表面。
实施方案50:根据实施方案1-48中任一项所述的方法,其中所述方法不涉及用激光加热所述膜的表面。
实施方案51:一种用于将大运输物递送到真核细胞中的装置,所述装置包括:多孔膜;和在所述多孔膜的一侧上的储存室,其中所述储存室的容积小于约500μL。
实施方案52:根据实施方案51所述的装置,其中所述储存室的容积在约40μL至约500μL、或约50μL至约400μL、或约60μL至约300μL、或约70μL至约200μL、或约80μL至约150μL、或约10μL直至约100μL的范围内。
实施方案53:根据实施方案2所述的装置,其中所述储存室具有约100μL的容积。
实施方案54:根据实施方案51-53中任一项所述的装置,其中所述多孔膜的厚度在约5μm至约30μm、或约5μm至约20μm、或约5μm至约15μm的范围内。
实施方案55:根据实施方案54所述的装置,其中所述多孔膜具有约10μm的厚度。
实施方案56:根据实施方案51-55中任一项所述的装置,其中所述多孔膜的平均或中值孔径在约100nm直至约20μm或直至约20μm、或约500nm直至约8μm、或约1μm直至约5μm的范围内。
实施方案57:根据实施方案56所述的装置,其中所述多孔膜的中值或平均孔径为约1μm。
实施方案58:根据实施方案56所述的装置,其中所述多孔膜的中值或平均孔径为约3μm。
实施方案59:根据实施方案56所述的装置,其中所述多孔膜的中间或平均孔径为约5μm。
实施方案60:根据实施方案51-59中任一项所述的装置,其中所述多孔膜具有约1×105个孔/cm2直至约1×107个孔/cm2、或约5×105个孔/cm2直至约5×106、或约1×105个孔/cm2直至约1×107个孔/cm2。
实施方案61:根据实施方案60所述的装置,其中所述多孔膜在约1.6×106个孔/cm2下具有约1μm直径的平均孔径。
实施方案62:根据实施方案60所述的装置,其中所述多孔膜在约8×105个孔/cm2下具有约3μm直径的平均孔径。
实施方案63:根据实施方案51-62中任一项所述的装置,其中所述膜包括聚合物膜。
实施方案64:根据实施方案51-62中任一项所述的装置,其中所述膜包括选自由以下组成的组的材料:尼龙膜、尼龙网、过滤膜、聚四氟乙烯(PTFE)膜、膨体聚四氟乙烯(ePTFE)膜、聚醚醚酮(PEEK)膜、膨体聚醚醚酮(ePEEK)膜、聚乙烯(PE)膜、聚丙烯(PP)膜、聚偏二氟乙烯(PVDF)膜、乙基乙酸乙烯酯(EVA)膜、热塑性聚氨酯(TPU)膜以及聚醚砜(PES)膜。
实施方案65:根据实施方案51-62中任一项所述的装置,其中所述膜包括聚酯膜、聚碳酸酯膜或聚对苯二甲酸乙二醇酯(PET)膜。
实施方案66:根据实施方案51-65中任一项所述的装置,其中所述储存室与被构造来将溶液引入所述腔室的端口或通道流体连通。
实施方案67:根据实施方案51-65中任一项所述的装置,其中所述储存室被封闭和/或密封(例如,从储存器的流动只能通过多孔膜发生)。
实施方案68:根据实施方案51-65中任一项所述的装置,其中储存室含有包含将被递送到所述真核细胞中的运输物的溶液。
实施方案69:根据实施方案68所述的装置,其中所述运输物包括选自由以下组成的组的一个或部分:天然染色体或染色体片段、合成染色体、细菌、合成颗粒、细胞内真菌、细胞内原生动物、包装在脂质体或脂质颗粒中的DNA和/或RNA,以及细胞器。
实施方案70:根据实施方案69所述的装置,其中所述运输物包括细胞核。
实施方案71:根据实施方案69所述的装置,其中所述运输物包括线粒体。
实施方案72:根据实施方案69所述的装置,其中所述运输物包括染色体或染色体片段。
实施方案73:根据实施方案69所述的装置,其中所述运输物包括人工染色体。
实施方案74:根据实施方案69所述的装置,其中所述运输物包括细菌。
实施方案75:根据实施方案51-74中任一项所述的装置,其中真核细胞设置在与所述储存室并置的一侧相对的所述多孔膜的表面上。
实施方案76:根据实施方案74所述的装置,其中所述细胞选自由以下组成的组:哺乳动物细胞、昆虫细胞和无脊椎动物细胞。
实施方案77:根据实施方案76所述的装置,其中所述细胞包括哺乳动物细胞。
实施方案78:根据实施方案76所述的装置,其中所述细胞包括人细胞。
实施方案79:根据实施方案76所述的装置,其中所述细胞包括非人哺乳动物细胞。
实施方案80:根据实施方案77-79中任一项所述的装置,其中所述细胞包括淋巴细胞或干细胞。
实施方案81:根据实施方案80所述的装置,其中所述细胞包括选自由以下组成的组的干细胞:成体干细胞、胚胎干细胞、脐带血干细胞和诱导多能干细胞。
实施方案82:根据实施方案77-79中任一项所述的装置,其中所述细胞包括分化的体细胞。
实施方案83:根据实施方案51-74中任一项所述的装置,其中所述细胞包括来自细胞系的细胞。
实施方案84:根据实施方案83所述的装置,其中所述细胞包括来自表1中列出的细胞系的细胞。
实施方案85:根据实施方案83所述的装置,其中所述细胞包括来自选自由以下组成的组的细胞系的细胞:HeLa、美国国家癌症研究所的60个癌细胞系(NCI60)、ESTDAB数据库、DU145(前列腺癌)、Lncap(前列腺癌)、MCF-7(乳腺癌)、MDA-MB-438(乳腺癌)、PC3(前列腺癌)、T47D(乳腺癌)、THP-1(急性骨髓性白血病)、U87(胶质母细胞瘤)、从骨髓瘤克隆的SHSY5Y人成神经细胞瘤细胞,以及Saos-2细胞(骨癌)。
实施方案86:根据实施方案51-85中任一项所述的装置,其中所述细胞在所述多孔膜上培养。
实施方案87:根据实施方案51-85中任一项所述的装置,其中所述细胞在所述多孔膜上作为粘附层培养。
实施方案88:根据实施方案86-87中任一项所述的装置,其中所述细胞在所述多孔膜上培养至汇合。
实施方案89:根据实施方案51-88中任一项所述的装置,其中所述多孔膜不具有金属膜或金属纳米颗粒。
实施方案90:根据实施方案51-89中任一项所述的装置,其中所述方法不涉及加热所述膜的表面。
实施方案91:一种用于将大运输物递送至真核细胞中的系统,所述系统包括:根据实施方案51-90中任一项所述的第一装置;和根据实施方案51-90中任一项所述的第二装置;其中所述第一装置和所述第二装置包括与构成所述第一装置和所述第二装置的储存室流体连通的端口和/或通道,并且所述端口和/或通道彼此流体连通;或其中所述第一装置和所述第二装置包括与构成所述第一装置和所述第二装置的储存室流体连通的端口和/或通道,并且所述端口和/或通道彼此不流体连通。
实施方案92:根据实施方案91所述的系统,其中所述第一装置和所述第二装置包括与构成所述第一装置和所述第二装置的储存室流体连通的端口和/或通道,并且所述端口和/或通道彼此流体连通。
实施方案93:根据实施方案91所述的系统,其中所述第一装置和所述第二装置包括与构成所述第一装置和所述第二装置的储存室流体连通的端口和/或通道,并且所述端口和/或通道彼此不流体连通。
实施方案94:根据实施方案93所述的系统,其中存在于所述第一装置的储存室中的运输物不同于存在于所述第二装置的储存室中的运输物。
实施方案95:根据实施方案91-94中任一项所述的系统,其中所述第一装置中存在的真核细胞与所述第二装置中的真核细胞是相同类型。
实施方案96:根据实施方案91-94中任一项所述的系统,其中所述第一装置中存在的真核细胞不同于所述第二装置中的真核细胞。
实施方案97:根据实施方案91-96中任一项所述的系统,其中所述系统包括根据实施方案51-90中任一项所述的第三装置;并且所述第一装置和所述第三装置包括与构成所述第一装置和所述第三装置的储存室流体连通的端口和/或通道,并且所述端口和/或通道彼此流体连通;或其中所述第一装置和所述第三装置包括与构成所述第一装置和所述第三装置的储存室流体连通的端口和/或通道,并且所述端口和/或通道彼此不流体连通。
定义
如本文所使用的关于递送到细胞中的术语“运输物”是指期望递送到细胞中的任何部分。示例性运输物包括但不限于细胞器、整个染色体或细菌、大核酸或蛋白质构建体、合成颗粒等。
术语“大运输物”是指在约100nm、或约500nm、或约800nm、或约1μm、或约3μm、或约5μm直至约20μm、或直至约15μm、或直至约10μm(长度和/或宽度和/或直径)的尺寸范围内的运输物。在某些实施方案中,大运输物的尺寸在约100nm(例如,脂质或脂质体复合物中的DNA和/或RNA)直至约10μm(例如,染色体、细胞核等)的范围内。
当关于密封和/或封闭的储存室使用时,术语“密封”或“封闭”表示流出储存器只能通过多孔膜发生或主要通过多孔膜发生。
附图简述
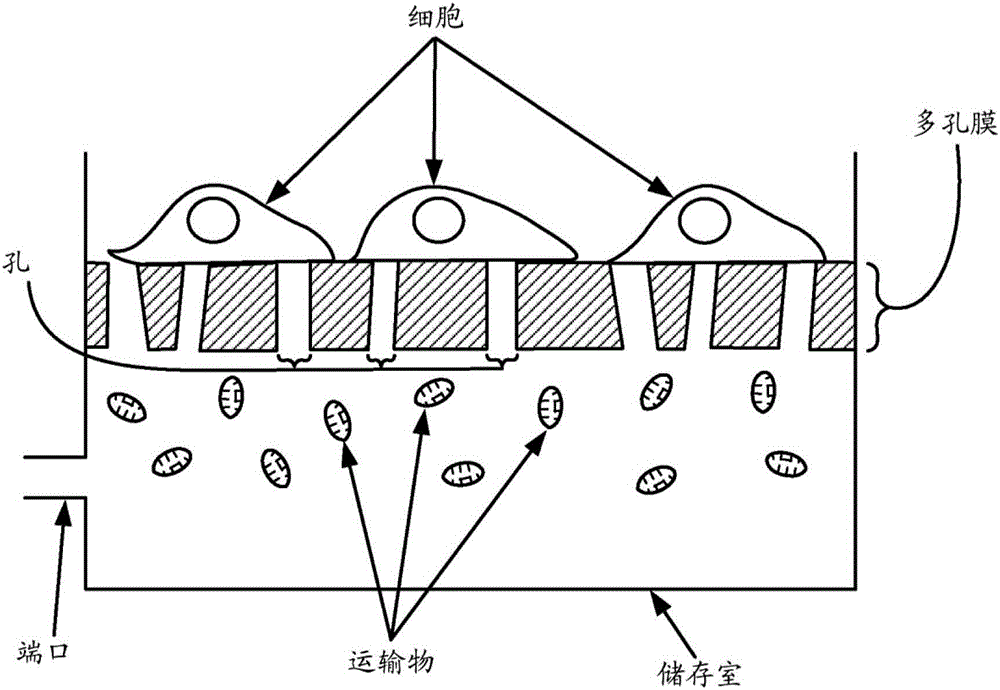
图1示出了说明递送方法的一个实施方案的示意图。
图2A和2B示出了如本文所述的转染系统的各种非限制性实施方案的示意图。
图3示出了线粒体递送后多孔膜上的受体143BTK rho(0)细胞。递送的DsRed标记线粒体可在细胞内和膜孔内部观察到。
图4示出了在限制性培养基中培养2周后,与没有mtDNA的rho(0)细胞中的大量死亡相比(右),含有递送的mtDNA形成的增殖中心的成功转化的143BTK rho(0)(左)。
图5示出了证实成功转化的受体143BTK rho(0)细胞含有与线粒体供体细胞系MDAMB453相同的并且不同于其亲代细胞系143BTK的mtDNA的线粒DNA序列。143BTK(SEQ ID NO:1)、143BTK rho(0)(SEQ ID NO:2)、MDAMB453(SEQ ID NO:3)。
图6示出了使用本文所述的方法获得84%的细菌递送效率。递送后九个小时,HeLa细胞的核(蓝色)和质膜(红色)被染色。递送的GFP细菌(绿色)在细胞胞液内复制。
图7A和7B示意性地示出了整合到转染系统中的多个转染装置。在某些实施方案中,转染装置提供用于包括所述系统的全部或不同转染装置的子集的共用装载通道/端口(图7A)和/或用于包括所述系统的全部或不同转染装置的子集的共用运输物装载通道/端口(图7B)。
详述
在各种实施方案中,本文提供了用于将运输物,特别是“大”运输物递送到细胞中的改进的方法和装置。本文所述的方法和装置以前所未有的通过量和简便性,将包括但不限于分离的线粒体和细菌的大运输物传递到哺乳动物细胞中。同时递送已经证明在几秒钟内实现了105个细胞,并且观察到细胞活力(>90%)。
递送方法的一个示例性但非限制性的实施方案描述于图1中。如图所示,将受体细胞(例如,真核细胞)置于或培养在具有通膜孔的多孔膜(例如10μm厚的聚合物膜)上。将要转染到受体细胞中的运输物置于溶液中,并且装载到多孔膜的相对侧上的储存室中。将压力施加到底部储存室,以将运输物悬浮液通过膜孔向受体细胞泵送。在某些实施方案中,聚合物膜由于压力驱动的流动而稍微变形。在加压后不久可观察到转染的细胞。
转染装置。
在某些实施方案中,提供了用于本文所述方法的转染装置。在某些示例性但非限制性的实施方案中,转染装置包括设置在储存室之上的本文所述的多孔膜(参见例如图2A)。
如图2A所示,储存室被配置为包含将被转染到受体细胞中的运输物。多孔膜也被选择为支持受体细胞,并且在某些实施方案中,允许将那些细胞在多孔膜上培养为粘附层。
在各种实施方案中,细胞不需要作为粘附层培养。例如,在某些实施方案中,细胞简单地吸附到膜上,例如通过直接沉积和/或通过离心。在某些实施方案中,细胞使用各种附着分子(例如整合素、钙粘素、选择素和各种合成接头(例如,异双功能或同双功能肽接头))附着到膜上。在某些实施方案中,细胞通过凝胶基体(例如明胶、胶原凝胶、水凝胶等)“附着”到膜上。
在某些实施方案中,储存室可设置有用于引入运输物溶液和/或用于在转染期间对腔室加压的端口和/或通道,尽管如下所述,并不要求有这样的端口或通道。
在各种示例性但非限制性的实施方案中,储存室的容积在约10μL、或约20μL、或约30μL、或约40μL、或约50μL、或约60μL、或约70μL、或约80μL直至约500μL、或直至约400μL、或直至约300μL、或直至约200μL、或直至约100μL的范围内。
在各种实施方案中,多孔膜和/或储存室基本上由与待递送到细胞中的真核细胞和运输物相容的任何材料制成。合适的材料包括但不限于陶瓷、玻璃和塑料。在某些实施方案中,储存室由刚性/坚硬的塑料(例如聚乙烯、聚丙烯等)制成,而在其他实施方案中,储存室由柔性聚合物(例如PDMS或其他聚合物)制成。
如上所述,转染方法使用多孔膜,并且在某些实施方案中使用柔性多孔膜。多孔膜可从广泛范围的材料(例如,尼龙或尼龙网、过滤膜、聚四氟乙烯(PTFE)、膨体聚四氟乙烯(ePTFE)、聚醚醚酮(PEEK)、膨体聚醚醚酮(ePEEK)、聚乙烯(PE)、聚丙烯(PP)、聚偏二氟乙烯(PVDF)、乙基乙酸乙烯酯(EVA)、热塑性聚氨酯(TPU)、聚醚砜(PES)等)中得到。在某些实施方案中,也考虑多孔刚性材料(例如,多孔陶瓷、多孔玻璃等)。多孔膜对本领域的那些技术人员是熟知的并且可以多种孔径从众多来源(参见,例如,Porex公司,Fairburn GA等)购得。
在某些实施方案中,多孔膜的厚度在约3μm、或约5μm、或约7μm直至约30μm、或直至约25μm、或直至约20μm、或直至约15μm、或直至约10μm的范围内。在某些实施方案中,多孔膜的厚度为约10μm。
在某些实施方案中,多孔膜的平均或中值孔径在约50nm、或约100nm、或约200nm、或约300nm、或约400nm、或约500nm、或约600nm、或约700nm、或约800nm、或约900nm、或约1μm直至约30μm、或直至约20μm、或直至约15μm、或直至约10μm、或直至约8μm、或直至约5μm的范围内。在某些实施方案中,所述多孔膜的中值或平均孔径为约1μm或约3μm或约5μm。
在典型的实施方案中,膜的孔密度足够高,使得平均而言其上至少具有细胞位于至少一个孔之上,或位于至少两个孔之上,或位于至少3个孔上,或位于至少4个孔之上,或位于至少5个孔之上,或位于至少10个孔之上。在某些实施方案中,多孔膜包括约1×105个孔/cm2直至约1×107个孔/cm2、或约5×105个孔/cm2直至约5×106、或约1×105个孔/cm2直至约1×107个孔/cm2。在某些实施方案中,多孔膜在约1.6×106个孔/cm2下具有约1μm直径的平均孔径,或在约8×105个孔/cm2下具有约3μm直径的平均孔径。
存在可在本文所述的转染装置的构造中使用的和在可并入有它们的微流体装置中使用的许多格式、材料和大小尺度。在一些实施方案中,转染装置和(当存在时)连接流体通道和/或端口由PDMS(或其他聚合物)构成,并且使用软光刻制造,而多孔膜通常从这类膜的供应商购买。
出于各种原因,包括但不限于低成本、光学透明性、易于模制和弹性特性,PDMS是用于制造本文所述装置的颇具吸引力的材料。PDMS还具有理想的化学特性,包括与常规的硅氧烷化学品和细胞培养物要求(例如低毒性、透气性)都相容。在示例性软光刻方法中,准备主模以形成一个或多个储存室和(当存在时)相关联的端口和/或通道。此主模可利用微机械加工工艺、光刻工艺或利用本领域中技术人员所熟知的任意种方法来产生。此类方法包括但不限于湿法蚀刻、电子束真空沉积、光刻、等离子增强的化学蒸气沉积、分子束外延、反应性离子蚀刻和/或化学辅助离子束铣削(Choudhury(1997)The Handbook of Microlithography,Micromachining,and Microfabrication,Soc.Photo-Optical Instru.Engineer.;Bard&Faulkner,Fundamentals of Microfabrication)。
一旦准备好,就将主模暴露于预聚合物中,随后使预聚合物固化以在PDMS中形成图案化的复制品。将复制品从主模中移除、修整,并且在需要时增加流体入口。聚合物复制品可任选地用等离子体处理(例如O2等离子体),并且结合到合适的基板如玻璃上。用O2等离子体处理PDMS产生在与合适的基板共形接触时紧密地和不可逆地密封的表面,并且具有在结合水性溶液使用时产生带负电荷的流体通道壁的优点。这些固定电荷支持可用来通过所述装置移动流体的电动泵送。虽然使用PDMS来制造上文所述的液滴产生装置,但是应认识到,诸多其他材料可代替这种聚合物或与这种聚合物结合使用。实例包括但不限于聚烯烃塑性体、全氟聚乙烯、聚氨酯、聚酰亚胺和交联的苯酚/甲醛聚合物树脂。
转染装置操作。
在某些实施方案中,本文所述的方法涉及:提供设置在多孔膜的一侧上的“受体细胞”;提供处于设置在多孔膜的相对侧上的储存室中的溶液中的运输物;以及对储存室施加足以使运输物通过构成多孔膜的孔的压力,其中运输物通过细胞膜并进入所述细胞。在某些实施方案中,腔室的加压伴随有多孔膜的变形。
可通过许多便利方法中的任何方法将含运输物的溶液引入储存室。例如,在一个示例性但非限制性的实施方案中,将含运输物的溶液通过进入那个腔室的端口或通道引入储存室(参见,例如,图2A)。
在另一个示例性但非限制性实施方案中,储存室被制造为连续通道的一部分。通道的流出部分可配置有阀。使运输物溶液流入并且通过腔室。当需要时,将阀关闭以密封贮存器通道,并且可保持压头以提供增加的压力,或者腔室可被进一步加压。当沿着一个运输物填充通道构造多个储存通道时,阀是特别有用的(参见,例如,图7B)。
在另一个示例性但非限制性的实施方案中,在将多孔膜(例如,带有细胞)放置在腔室上或腔室中之前,将含运输物的溶液装载到储存室中。
在另一个示例性但非限制性的实施方案中,将含运输物的溶液通过穿透储存室的壁的针注入储存室。在这种实施方案中,可容易地消除用于引入运输物溶液的端口或通道。
在另一个示例性但非限制性的实施方案中,可简单地使含运输物的溶液通过多孔膜来为储存室装料。
储存室还可通过多种方法中的任何方法加压。例如,在多孔腔室与通道或端口流体连通的情况下,可使用泵或重力进料将流体或气体压力施加到那个端口。
在另一个示例性实施方案中,可通过例如手动地使用微型操纵器使储存室的一个或多个壁简单地向内变形、使用机电致动器对内部设置有多孔腔室的容器加压等,使储存室密封和被施加压力。
在另一个示例性实施方案中,可通过例如使用注射器、注射泵或其他注射装置将含运输物的溶液或另外的溶液注入储存通道,使储存室密封和被施加压力。
在某些实施方案中,压力是瞬时施加的。在这类情况的各种实施方案中,施加压力的时间段范围为约1毫秒、或约10毫秒、或约20毫秒、或约50毫秒、或约80毫秒、或约100毫秒、或约500或约1秒、或约5秒、或约10秒、直至约20秒、或直至约30秒、或直至约40秒、或直至约50秒、或直至约1分钟、或直至约1.5分钟、或直至约2分钟、或直至约2.5分钟、或直至约5分钟或直至约10分钟。在某些实施方案中,施加压力的时间段范围为约100毫秒,直至约1分钟。
使用标准方法将细胞施加到多孔基体。通常,细胞可在多孔基体上培养。这可在转染装置中进行,或另选地,可单独进行,并且然后将带有细胞的多孔基体转移到转染装置。在某些实施方案中,细胞作为粘附层进行培养。在某些实施方案中,细胞在转染之前或之后被培养至汇合。
前述操作方法是示例性且非限制性的。使用本文提供的教义,本领域技术人员可常规地优化转染方法和装置以适应特定的细胞和/或运输物类型。
转染系统。
在某些实施方案中,将多个转染装置耦合到转染系统中。在这类实施方案中,每个转染装置可被配置来将不同的运输物装载/转染到存在于每个装置中的细胞中。因此,例如,在某些实施方案中,单个系统可为包括所述系统的不同转染装置提供不同的装载端口/通道(参见,例如,图7A)。另选地,包括所述系统的每个转染装置可使用其他装载手段(例如,如本文所述)装载不同的运输物。
在某些实施方案中,单个系统可为包括所述系统的不同转染装置提供共用装载端口/通道(参见,例如,图7A)。因此,包括所述系统的转染装置的全部或子集可共享共用运输物装载通道/端口(参见,例如,图7B)。不同的细胞可在构成位于共用通道上的每个装置的多孔膜上培养,从而便利于以共同运输物对不同细胞类型进行转染。
在某些实施方案中,这些配置可组合在单个系统中,从而提供共享共用运输物装载通道/端口的装置的子集以及具有单独的运输物装载通道/端口的装置的子集。
应当理解,这些配置是示例性的且非限制性的。使用本文提供的教义,本领域技术人员将可获得许多其他配置。
模块化系统。
在某些实施方案中,本文所述的转染平台作为可容易地与现存设备整合成一体的“模块”提供。例如,在某些实施方案中,转染基质以可添加至或可替代现存显微镜上的载物台的格式提供。在某些实施方案中,基质被格式化来替代和倒置显微镜(例如,蔡司(Zeis)倒置显微镜)上的x/y/z载物台。
在某些实施方案中,转染基质作为微流体系统(例如,芯片系统上的实验室)和/或作为可与微流体系统整合成一体的模块提供。
可递送的材料(运输物)。
据信,可使用本文所述的方法和装置将基本上任何所需的材料递送到细胞中。这类材料包括但不限于核酸、蛋白质、细胞器、药物递送颗粒、探针、标记等等。在实施方案中,运输物包括选自由以下组成的组的一个或多个部分:天然染色体或染色体片段、合成染色体、细菌、合成颗粒、细胞内真菌(例如,耶氏肺孢子菌(Pneumocystis jirovecii)、荚膜组织胞浆菌(Histoplasma capsulatum)、新型隐球菌(Cryptococcus neoformans)等)、细胞内原生动物(例如,顶复门(Apicomplexan)(例如,疟原虫属(Plasmodium spp.)、刚地弓形虫(Toxoplasma gondii)、小球隐孢子虫(Cryptosporidiumparvum))、锥虫(Trypanosomatid)(例如,利什曼原虫属(Leishmania spp.)、克氏锥虫(Trypanosoma cruzi)等)以及细胞器(例如,核、核仁、线粒体、叶绿体、核糖体、溶酶体等)。
在某些实施方案中,运输物包括核、和/或叶绿体、和/或核仁、和/或线粒体。
在某些实施方案中,运输物包括整个染色体、或染色体片段、或合成染色体(例如,BAC(细菌人工染色体))。据信,本文所述的装置和方法可用于递送整个或部分天然的或合成的染色体。与BAC类似,不能通过以前的方法转导至大多数细胞类型中的大染色体或染色体片段可通过本文所述的方法传递至细胞中,例如,特别是为了建立人类三体性病症(例如,唐氏(Down)和克兰费尔特(Klinefelter)综合征)的模型。
在某些实施方案中,运输物包括细胞内病原体,包括但不限于各种细菌、真菌和原生动物。也考虑了各种无生命颗粒的转染。这种颗粒包括但不限于量子点、表面增强拉曼散射(SERS)颗粒、微珠等。
将认识到,这些运输物旨在是示例性的且非限制性的。使用本文提供的教义,许多其他运输物,特别是大运输物可被转染到细胞中。
细胞类型
据信,本文所述的方法和装置可基本上用于具有细胞膜的任何细胞。因此,在各种实施方案中,预期基本上任何真核细胞都可使用本文描述的方法和装置转染。因此,例如,可使用本文所述的方法转染的合适的细胞包括但不限于脊椎动物细胞、真菌细胞和酵母细胞。在某些实施方案中,细胞是哺乳动物细胞、昆虫细胞或无脊椎动物细胞。
通常,本文所述的方法将使用包括人哺乳动物细胞和非人哺乳动物细胞(例如,非人灵长类动物、犬类、马类、猫类、猪类、牛类、有蹄类动物、兔类动物(largomorph)等)两者的哺乳动物细胞来执行。
在某些实施方案中,转染的细胞包括干细胞或定向祖细胞。在某些实施方案中,干细胞包括成体干细胞、胎儿干细胞、脐带血干细胞、酸恢复的(acid-reverted)干细胞以及诱导多能干细胞(IPSC)。
在某些实施方案中,细胞包括淋巴细胞或其他分化的体细胞。
在某些实施方案中,细胞包括来自细胞系的细胞。合适的细胞系包括例如HeLa、美国国家癌症研究所的60个癌细胞系(NCI60)、ESTDAB数据库、DU145(前列腺癌)、Lncap(前列腺癌)、MCF-7(乳腺癌)、MDA-MB-438(乳腺癌)、PC3(前列腺癌)、T47D(乳腺癌)、THP-1(急性骨髓性白血病)、U87(胶质母细胞瘤)、从骨髓瘤克隆的SHSY5Y人成神经细胞瘤细胞、Saos-2细胞(骨癌)等。
在某些实施方案中,合适的细胞系包括但不限于表1中所列出的细胞系。
在各种实施方案中,细胞在多孔膜上培养(例如,1小时或更久、或2小时或更久、或4小时或更久、或6小时或更久、或12小时或更久、或1天或更久、或2天或更久、或3天或更久、或4天或更久、或5天或更久、或6天或更久、或1周或更久、或2周或更久)。
表1.可使用本文所述的方法转染的示例性但非限制性的细胞。
应当理解,前述细胞类型旨在是示例性的和非限制性的。应当认识到,许多其他真核细胞类型可容易地用于本文所述的方法和装置中。
试剂盒。
实施例
提供以下实施例以说明,但不限制要求保护的本发明。
实施例1
大运输物向多孔基质上的细胞中的递送
我们证明了将分离的功能性线粒体递送到mtDNA耗尽的rho(0)细胞中并获得了含有供体细胞线粒体基因组的转化的rho(0)细胞系。获得稳定转化的转线粒体细胞系的频率为~10-4,对应于来自每个递送实验的几十个菌落-实际上,每次都将获得转线粒体细胞系。递送过程如图1中所示。将受体细胞在具有通膜孔(在1.6×106个孔/cm2下1μm直径孔或在8×105孔/cm2下3μm孔)的10μm厚的聚合物膜上培养。分离来自供体细胞的线粒体,并且将线粒体悬浮液(蛋白质浓度10mg/mL)装载到聚合物膜的相对侧上的储存室中。在具体实施方案中,使用聚酯、聚碳酸酯和聚对苯二甲酸乙二醇酯(PET)膜测试所述方法。储存室具有100μL的容量。将瞬时压力施加到底部储存室,以将线粒体悬浮液通过膜孔向受体细胞泵送。聚合物膜由于压力驱动的流动而轻微变形,并且递送后在受体细胞和膜孔内部观察到线粒体和线粒体聚集体(图3)。
递送后24小时收获细胞,并在限制性培养基中培养以选择含有递送的线粒体的成功转化体(图4)。D环高变区中线粒体DNA的直接测序进一步证实,转化体菌落含有源自递送的供体细胞线粒体的mtDNA(图5)。
为了比较线粒体递送效率,还进行了以下实验:
(A)将100μL线粒体悬浮液添加到在多孔膜上培养的受体细胞并共孵育24小时;以及
(B)将100μL线粒体悬浮液旋涂到多孔膜上,随后接种受体细胞并孵育24小时。
表2列出了来自这些实验的转化体菌落数和转化体频率。使用方法(A)和(B)没有获得活菌落。
表2.线粒体递送效率的比较。
使用我们的递送方法,重复性地产生了具有不同线粒体基因组的几个转线粒体细胞系。当前结果总结在表3中。
表3.使用所述递送方法产生的转线粒体细胞系的总结
为了证明细菌的递送,在具有3μm孔的聚合物膜上培养非吞噬性且不有效内化细菌的HeLa细胞。将1010个细菌/mL的GFP新凶手弗朗西丝菌(Francisella novicida)的细菌悬浮液装载到储存室中。在流体泵送和细菌递送后,用高浓度的抗生素(10mg/mL庆大霉素)处理细胞30分钟以杀死细胞外细菌。孵育9小时后,84%的HeLa细胞含有细胞内细菌,如细胞胞液内部复制的GFP细菌可见(图6)。
应了解,本文所述的实施例和实施方案仅出于说明目的,并且将建议本领域技术人员根据它们进行各种修改或变化,并且这些修改或变化被包括在本申请的精神和范围以及随附权利要求书的范围之内。出于所有目的,本文所引用的所有出版物、专利和专利申请特此以引用的方式整体并入。
- 还没有人留言评论。精彩留言会获得点赞!