一种细胞毒型混合杀伤细胞的制备方法与流程
本发明涉及免疫细胞治疗技术领域,具体来说是一种细胞毒型混合杀伤细胞的制备方法。
背景技术:
自20世纪80年代,美国人发现了LAK细胞,之后又研究了TIL细胞、CD3AK细胞,1991年CIK细胞出现,让免疫细胞治疗真正从实验室走上临床,近年来免疫细胞疗法的不断涌现,肿瘤临床治疗成功案例的大量报道,预示着免疫细胞治疗在临床治疗特别是肿瘤治疗方面独特的优势与不可替代的作用。
随着免疫细胞疗法受到越来越多人的重视,CIK细胞制备及临床应用中存在的问题也不断呈现:体外活化后,细胞的扩增效率低下,培养后的细胞含大量免疫抑制性T细胞群,抑制抗肿瘤免疫应答,对病人免疫系统损伤较大、导致病人对放化疗耐受性差,细胞培养过程繁琐,人为因素多、可控性差、规模化生产困难等等,因此需要对现有技术进行改进。
技术实现要素:
本发明所要解决的技术问题是为了克服现有技术存在细胞扩增效率低下以及含有大量免疫抑制性T细胞群的缺陷,而提供一种细胞毒型混合杀伤细胞的制备方法。
本发明解决上述技术问题提供的技术方案是:本发明公开了一种细胞毒型混合杀伤细胞的制备方法,包括以下步骤:
(1)、分离单个核细胞;
(2)、细胞毒型混合杀伤细胞细胞的培养。
作为优选,所述的步骤(1)分离单个核细胞采用如下步骤:
(1.1)、在生物安全柜中,使用电动助吸器将外周血转移至50ml无菌离心管中,每个无菌离心管内的外周血为20ml-35ml,然后在1500-2000rmp的转速下,离心8min;
(1.2)、对外周血离心后,外周血分为明显的两层:上层淡黄色血浆层和下层暗红色血细胞层,先吸取上层血浆,转移至50mL的无菌离心管中,将无菌离心管密封后,再放入恒温水浴箱中,在56℃的条件下灭活30min,灭活过后,在2000-3000rpm/min的转速下,再离心10min,管底可见明显的白色沉淀,转移上层血浆至50mL的无菌离心管中,制备得到灭活的血浆,封口,4℃保存,备用;
(1.3)、用生理盐水稀释血细胞,用生理盐水稀释血细胞,使得血细胞与生理盐水体积比为1:1,混匀后,缓慢均匀的加入到含有10-20ml的人淋巴细胞分离液的50ml无菌离心管中,在1600-2500rpm/min的转速下,20℃温度下,离心20-40min,可见明显分层,第一层为生理盐水与血浆混合层,第二层为单个核细胞聚集的“白膜层”,第三层为淋巴细胞分离液层,第四层为粒细胞层,第五层为红细胞层,吸取第二层的单个核细胞层,转移至50ml的无菌离心管中,向无菌离心管中加入生理盐水,定容至40ml,然后在1500-2000rpm/min的转速下,离心8min,弃上清液,再向无菌离心管内加入生理盐水,定容至40ml,然后使用电动助吸器吹打混匀,取500ul细胞悬液计数;
(1.4)、根据单个核细胞计数结果,然后在1500-2000rpm/min转速下,离心8min,沉淀细胞,再用CMK活化液悬浮细胞,调整细胞浓度至1x106-2x106/ml,转移到T175培养瓶中进行培养。
作为优选,所述的步骤(2)细胞毒型混合杀伤细胞的培养采用如下步骤:
(2.1)、配制LONZA无血清培养基:将1支IL-2试剂全部溶解至1瓶1000ml无血清培养基中,使得IL-2试剂的浓度控制在1000-2000U/ml;
(2.2)、细胞培养至第3天,加入50ml的LONZA无血清培养基;
(2.3)、细胞培养至第4天,加入140mL的LONZA无血清培养基;
(2.4)、第5-7天,分瓶培养,取出240ml细胞悬液按1.4:1的比例转移到两个新的T175培养瓶中,分别标记为fAC瓶和fBD瓶,然后两瓶均补加LONZA无血清培养基,直至两瓶内均定容至240ml;
(2.5)、第8天,装袋培养,将fAC培养瓶中细胞悬液转移到培养袋中,再加入500-1000ml的 LONZA无血清培养基,标记为培养袋A;
(2.6)、第9天,装袋培养,将fBD培养瓶中细胞悬液转移到培养袋中,再加入500-1000ml的LONZA无血清培养基,标记培养袋B;
(2.7)、第11天分袋:在两个新的培养袋中分别加入500-1500mL的LONZA无血清培养基,分别标记为培养袋C和培养袋D,然后通过无菌结合机将培养袋A与培养袋C无菌结合,结合后,将培养袋C中的LONZA无血清培养基倒出500-1000mL至培养袋A中,混匀,然后再从培养袋A中向培养袋C中倾倒返还等体积的培养液,然后将培养袋A与培养袋C热合分开即可,同样的方法,然后通过无菌结合机将培养袋B与培养袋D无菌结合,结合后,将培养袋D中的LONZA无血清培养基倒出500-1000mL至培养袋B中,混匀,然后再从培养袋B中向培养袋D中倾倒返还等体积的培养液,然后将培养袋B与培养袋D热合分开即可;
(2.8)、第15天,从培养袋A收获第一袋(bag1,b1)细胞毒型混合杀伤细胞;
(2.9)、第17天, 从培养袋B收获第二袋(bag2,b2)细胞毒型混合杀伤细胞;
(2.10)、第19天,从培养袋C收获第三袋(bag3,b3)细胞毒型混合杀伤细胞;
(2.11)、第21天,从培养袋D收获第四袋(bag4,b4)细胞毒型混合杀伤细胞。
作为优选,所述的步骤(1.3)中,所述的人淋巴细胞分离液的密度为1.077g/ml。
作为优选,所述的步骤(1.4)中,所述的CMK活化液的配制方法为:打开生物安全柜,将事先分装好的储液CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2取出,待溶解后转移到一个50ml离心管中,用无血清培养基涮洗各储液管,然后将CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2全部加入到50ml离心管中,定容至50ml,使得CD3mAb的浓度为100-500ng/ml,使得CD28mAb的浓度为100-500ng/ml,使得抗CTLA4单抗的浓度为100-500ng/ml,使得IFN-γ的浓度为500-2000U/ml,使得IL-1a的浓度为500-2000U/ml ,使得IL-2的浓度为500-2000U/ml,瓶身贴标签,即可制备得到CMK活化液。
与现有技术相比,本发明具有以下有益优点:
1、多重细胞因子组合筛选,在传统IFN-γ、CD3mAb、IL-1a和IL-2活化扩增因子的基础上,加入CD28mAb、抗CTLA4单抗等新的抗体细胞因子,进一步提高细胞毒型混合杀伤细胞活化通路,切断抑制T细胞对抗原识别第二信号产生的通路,抑制T细胞的免疫失能,提高细胞免疫效应;
2、细胞因子工作液浓度的再优化,现阶段培养CIK细胞的细胞因子浓度各异,不同实验室给出不同的培养浓度,我们通过单因素实验设计,逐一摸索出各个因子的最佳工作浓度,从而达到最大量的扩增细胞数和更强的细胞毒性,经过实验摸索,这些抗体和因子的最佳工作液浓度如下:CD3mAb、CD28mAb、抗CTLA4单抗为100-500ng/ml,IFN-γ、IL-1a、IL-2工作液浓度为500-2000U/ml;
3、无血清淋巴细胞培养基进行细胞培养,保证没有潜在的动物病源微生物的感染,且培养过程中不添加任何异源血液成份;
4、细胞扩增的高效性、高活性、高稳定性,以及强特异性杀伤能力;
6、扩增效率约为300~1000倍;
7、可保持细胞活性时间:24小时;
8、独特的细胞培养工艺,少量外周血即可满足多次细胞回输的要求;
9、可与化疗联合,完全满足多个化疗疗程对细胞治疗次数和细胞治疗数目的要求,从而产生较好的协同治疗肿瘤效果;
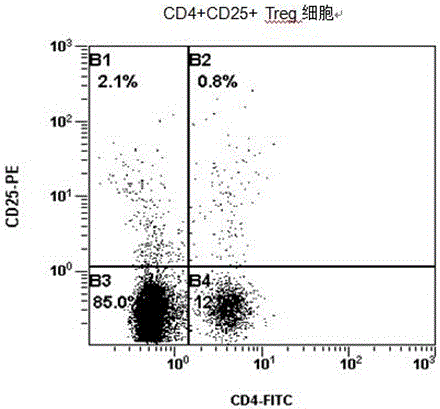
10、与传统行业内部标准CD3+CD56+ NKT≥10%,CD3+CD8+≥50%,CD4+CD25+Treg≤10%相比,细胞毒型混合杀伤细胞(CMK细胞)的自然杀伤性T 细胞(NKT)细胞群平均可达25%以上,CD3+CD8+细胞群可达60%以上,CD4+CD25+Treg≤5%,细胞培养效率和肿瘤杀伤能力显著增强。
附图说明
图1为实施例1的细胞毒型混合杀伤细胞免疫流式表型图;
图2为实施例2的细胞毒型混合杀伤细胞免疫流式表型图;
图3为实施例3的细胞毒型混合杀伤细胞免疫流式表型图;
图4为实施例4的细胞生长曲线图。
具体实施方式
以下结合具体实施例进一步说明,但本发明并不仅限于这些实施例。
实施例1
本发明公开了一种细胞毒型混合杀伤细胞的制备方法,包括以下步骤:
(1)、分离单个核细胞:
(1.1)、在生物安全柜中,使用电动助吸器将外周血转移至50ml无菌离心管中,每个无菌离心管内的外周血为25ml,然后在1800rmp的转速下,离心8min;
(1.2)、对外周血离心后,外周血分为明显的两层:上层淡黄色血浆层和下层暗红色血细胞层,先吸取上层血浆,转移至50mL的无菌离心管中,将无菌离心管密封后,再放入恒温水浴箱中,在56℃的条件下灭活30min,灭活过后,在2500rpm/min的转速下,再离心10min,管底可见明显的白色沉淀,转移上层血浆至50mL的无菌离心管中,制备得到灭活的血浆,封口,4℃保存,备用;
(1.3)、用生理盐水稀释血细胞,使得血细胞与生理盐水体积比为1:1,混匀后,缓慢均匀的加入到含有20ml的人淋巴细胞分离液的50ml无菌离心管中,在1800rpm/min的转速下,20℃温度下,离心30min,可见明显分层,第一层为生理盐水与血浆混合层,第二层为单个核细胞聚集的“白膜层”,第三层为淋巴细胞分离液层,第四层为粒细胞层,第五层为红细胞层,吸取第二层的单个核细胞层,转移至50ml的无菌离心管中,向无菌离心管中加入生理盐水,定容至40ml,然后在1800rpm/min的转速下,离心8min,弃上清液,再向无菌离心管内加入生理盐水,定容至40ml,然后使用电动助吸器吹打混匀,取500ul细胞悬液计数;
(1.4)、根据单个核细胞计数结果,然后在1800rpm/min转速下,离心8min,沉淀细胞,再用CMK活化液悬浮细胞,调整细胞浓度至2x106/ml,转移到T175培养瓶中进行培养。
(2)、细胞毒型混合杀伤细胞细胞的培养:
(2.1)、配制LONZA无血清培养基:将1支IL-2试剂全部溶解至1瓶1000ml无血清培养基中,使得IL-2试剂的浓度控制在1500U/ml;
(2.2)、细胞培养至第3天,加入50ml的LONZA无血清培养基;
(2.3)、细胞培养至第4天,加入140mL的LONZA无血清培养基;
(2.4)、第5-7天,分瓶培养,取出240ml细胞悬液按1.4:1的比例转移到两个新的T175培养瓶中,分别标记为fAC瓶和fBD瓶,然后两瓶均补加LONZA无血清培养基,直至两瓶内均定容至240ml;
(2.5)、第8天,装袋培养,将fAC培养瓶中细胞悬液转移到培养袋中,再加入700ml的 LONZA无血清培养基,标记为培养袋A;
(2.6)、第9天,装袋培养,将fBD培养瓶中细胞悬液转移到培养袋中,再加入700ml的LONZA无血清培养基,标记培养袋B;
(2.7)、第11天分袋:在两个新的培养袋中分别加入1000mL的LONZA无血清培养基,分别标记为培养袋C和培养袋D,然后通过无菌结合机将培养袋A与培养袋C无菌结合,结合后,将培养袋C中的LONZA无血清培养基倒出700mL至培养袋A中,混匀,然后再从培养袋A中向培养袋C中倾倒返还等体积的培养液,然后将培养袋A与培养袋C热合分开即可,同样的方法,然后通过无菌结合机将培养袋B与培养袋D无菌结合,结合后,将培养袋D中的LONZA无血清培养基倒出700mL至培养袋B中,混匀,然后再从培养袋B中向培养袋D中倾倒返还等体积的培养液,然后将培养袋B与培养袋D热合分开即可;
(2.8)、第15天,从培养袋A收获第一袋(bag1,b1)细胞毒型混合杀伤细胞;
(2.9)、第17天, 从培养袋B收获第二袋(bag2,b2)细胞毒型混合杀伤细胞;
(2.10)、第19天,从培养袋C收获第三袋(bag3,b3)细胞毒型混合杀伤细胞;
(2.11)、第21天,从培养袋D收获第四袋(bag4,b4)细胞毒型混合杀伤细胞。
所述的步骤(1.3)中,所述的人淋巴细胞分离液的密度为1.077g/ml。
所述的步骤(1.4)中,所述的CMK活化液的配制方法为:打开生物安全柜,将事先分装好的储液CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2取出,待溶解后转移到一个50ml离心管中,用无血清培养基涮洗各储液管,然后将CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2全部加入到50ml离心管中,定容至50ml,使得CD3mAb的浓度为300ng/ml,使得CD28mAb的浓度为300ng/ml,使得抗CTLA4单抗的浓度为300ng/ml,使得IFN-γ的浓度为1200U/ml,使得IL-1a的浓度为1200U/ml ,使得IL-2的浓度为1200U/ml,瓶身贴标签,即可制备得到CMK活化液。
实施例2
(1)、分离单个核细胞:
(1.1)、在生物安全柜中,使用电动助吸器将外周血转移至50ml无菌离心管中,每个无菌离心管内的外周血为35ml,然后在2000rmp的转速下,离心8min;
(1.2)、对外周血离心后,外周血分为明显的两层:上层淡黄色血浆层和下层暗红色血细胞层,先吸取上层血浆,转移至50mL的无菌离心管中,将无菌离心管密封后,再放入恒温水浴箱中,在56℃的条件下灭活30min,灭活过后,在3000rpm/min的转速下,再离心10min,管底可见明显的白色沉淀,转移上层血浆至50mL的无菌离心管中,制备得到灭活的血浆,封口,4℃保存,备用;
(1.3)、用生理盐水稀释血细胞,使得血细胞与生理盐水体积比为1:1,混匀后,缓慢均匀的加入到含有20ml的人淋巴细胞分离液的50ml无菌离心管中,在2500rpm/min的转速下,20℃温度下,离心40min,可见明显分层,第一层为生理盐水与血浆混合层,第二层为单个核细胞聚集的“白膜层”,第三层为淋巴细胞分离液层,第四层为粒细胞层,第五层为红细胞层,吸取第二层的单个核细胞层,转移至50ml的无菌离心管中,向无菌离心管中加入生理盐水,定容至40ml,然后在2000rpm/min的转速下,离心8min,弃上清液,再向无菌离心管内加入生理盐水,定容至40ml,然后使用电动助吸器吹打混匀,取500ul细胞悬液计数;
(1.4)、根据单个核细胞计数结果,然后在2000rpm/min转速下,离心8min,沉淀细胞,再用CMK活化液悬浮细胞,调整细胞浓度至1x106/ml,转移到T175培养瓶中进行培养。
(2)、细胞毒型混合杀伤细胞细胞的培养:
(2.1)、配制LONZA无血清培养基:将1支IL-2试剂全部溶解至1瓶1000ml无血清培养基中,使得IL-2试剂的浓度控制在2000U/ml;
(2.2)、细胞培养至第3天,加入50ml的LONZA无血清培养基;
(2.3)、细胞培养至第4天,加入140mL的LONZA无血清培养基;
(2.4)、第5-7天,分瓶培养,取出240ml细胞悬液按1.4:1的比例转移到两个新的T175培养瓶中,分别标记为fAC瓶和fBD瓶,然后两瓶均补加LONZA无血清培养基,直至两瓶内均定容至240ml;
(2.5)、第8天,装袋培养,将fAC培养瓶中细胞悬液转移到培养袋中,再加入1000ml的 LONZA无血清培养基,标记为培养袋A;
(2.6)、第9天,装袋培养,将fBD培养瓶中细胞悬液转移到培养袋中,再加入1000ml的LONZA无血清培养基,标记培养袋B;
(2.7)、第11天分袋:在两个新的培养袋中分别加入1500mL的LONZA无血清培养基,分别标记为培养袋C和培养袋D,然后通过无菌结合机将培养袋A与培养袋C无菌结合,结合后,将培养袋C中的LONZA无血清培养基倒出1000mL至培养袋A中,混匀,然后再从培养袋A中向培养袋C中倾倒返还等体积的培养液,然后将培养袋A与培养袋C热合分开即可,同样的方法,然后通过无菌结合机将培养袋B与培养袋D无菌结合,结合后,将培养袋D中的LONZA无血清培养基倒出1000mL至培养袋B中,混匀,然后再从培养袋B中向培养袋D中倾倒返还等体积的培养液,然后将培养袋B与培养袋D热合分开即可;
(2.8)、第15天,从培养袋A收获第一袋(bag1,b1)细胞毒型混合杀伤细胞;
(2.9)、第17天, 从培养袋B收获第二袋(bag2,b2)细胞毒型混合杀伤细胞;
(2.10)、第19天,从培养袋C收获第三袋(bag3,b3)细胞毒型混合杀伤细胞;
(2.11)、第21天,从培养袋D收获第四袋(bag4,b4)细胞毒型混合杀伤细胞。
所述的步骤(1.3)中,所述的人淋巴细胞分离液的密度为1.077g/ml。
所述的步骤(1.4)中,所述的CMK活化液的配制方法为:打开生物安全柜,将事先分装好的储液CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2取出,待溶解后转移到一个50ml离心管中,用无血清培养基涮洗各储液管,然后将CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2全部加入到50ml离心管中,定容至50ml,使得CD3mAb的浓度为500ng/ml,使得CD28mAb的浓度为500ng/ml,使得抗CTLA4单抗的浓度为500ng/ml,使得IFN-γ的浓度为2000U/ml,使得IL-1a的浓度为2000U/ml ,使得IL-2的浓度为2000U/ml,瓶身贴标签,即可制备得到CMK活化液。
实施例3
(1)、分离单个核细胞;
(2)、细胞毒型混合杀伤细胞细胞的培养。
作为优选,所述的步骤(1)分离单个核细胞采用如下步骤:
(1.1)、在生物安全柜中,使用电动助吸器将外周血转移至50ml无菌离心管中,每个无菌离心管内的外周血为20ml,然后在1500rmp的转速下,离心8min;
(1.2)、对外周血离心后,外周血分为明显的两层:上层淡黄色血浆层和下层暗红色血细胞层,先吸取上层血浆,转移至50mL的无菌离心管中,将无菌离心管密封后,再放入恒温水浴箱中,在56℃的条件下灭活30min,灭活过后,在2000rpm/min的转速下,再离心10min,管底可见明显的白色沉淀,转移上层血浆至50mL的无菌离心管中,制备得到灭活的血浆,封口,4℃保存,备用;
(1.3)、用生理盐水稀释血细胞,使得血细胞与生理盐水体积比为1:1,混匀后,缓慢均匀的加入到含有15ml的人淋巴细胞分离液的50ml无菌离心管中,在1600rpm/min的转速下,20℃温度下,离心20min,可见明显分层,第一层为生理盐水与血浆混合层,第二层为单个核细胞聚集的“白膜层”,第三层为淋巴细胞分离液层,第四层为粒细胞层,第五层为红细胞层,吸取第二层的单个核细胞层,转移至50ml的无菌离心管中,向无菌离心管中加入生理盐水,定容至40ml,然后在1500rpm/min的转速下,离心8min,弃上清液,再向无菌离心管内加入生理盐水,定容至40ml,然后使用电动助吸器吹打混匀,取500ul细胞悬液计数;
(1.4)、根据单个核细胞计数结果,然后在1500rpm/min转速下,离心8min,沉淀细胞,再用CMK活化液悬浮细胞,调整细胞浓度至2x106/ml,转移到T175培养瓶中进行培养。
作为优选,所述的步骤(2)细胞毒型混合杀伤细胞的培养采用如下步骤:
(2.1)、配制LONZA无血清培养基:将1支IL-2试剂全部溶解至1瓶1000ml无血清培养基中,使得IL-2试剂的浓度控制在1000U/ml;
(2.2)、细胞培养至第3天,加入50ml的LONZA无血清培养基;
(2.3)、细胞培养至第4天,加入140mL的LONZA无血清培养基;
(2.4)、第5-7天,分瓶培养,取出240ml细胞悬液按1.4:1的比例转移到两个新的T175培养瓶中,分别标记为fAC瓶和fBD瓶,然后两瓶均补加LONZA无血清培养基,直至两瓶内均定容至240ml;
(2.5)、第8天,装袋培养,将fAC培养瓶中细胞悬液转移到培养袋中,再加入500ml的 LONZA无血清培养基,标记为培养袋A;
(2.6)、第9天,装袋培养,将fBD培养瓶中细胞悬液转移到培养袋中,再加入500ml的LONZA无血清培养基,标记培养袋B;
(2.7)、第11天分袋:在两个新的培养袋中分别加入500mL的LONZA无血清培养基,分别标记为培养袋C和培养袋D,然后通过无菌结合机将培养袋A与培养袋C无菌结合,结合后,将培养袋C中的LONZA无血清培养基倒出500mL至培养袋A中,混匀,然后再从培养袋A中向培养袋C中倾倒返还等体积的培养液,然后将培养袋A与培养袋C热合分开即可,同样的方法,然后通过无菌结合机将培养袋B与培养袋D无菌结合,结合后,将培养袋D中的LONZA无血清培养基倒出500mL至培养袋B中,混匀,然后再从培养袋B中向培养袋D中倾倒返还等体积的培养液,然后将培养袋B与培养袋D热合分开即可;
(2.8)、第15天,从培养袋A收获第一袋(bag1,b1)细胞毒型混合杀伤细胞;
(2.9)、第17天, 从培养袋B收获第二袋(bag2,b2)细胞毒型混合杀伤细胞;
(2.10)、第19天,从培养袋C收获第三袋(bag3,b3)细胞毒型混合杀伤细胞;
(2.11)、第21天,从培养袋D收获第四袋(bag4,b4)细胞毒型混合杀伤细胞。
所述的步骤(1.3)中,所述的人淋巴细胞分离液的密度为1.077g/ml。
所述的步骤(1.4)中,所述的CMK活化液的配制方法为:打开生物安全柜,将事先分装好的储液CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2取出,待溶解后转移到一个50ml离心管中,用无血清培养基涮洗各储液管,然后将CD3mAb、CD28mAb、抗CTLA4单抗、IL-1a、IFN-γ、IL-2全部加入到50ml离心管中,定容至50ml,使得CD3mAb的浓度为100ng/ml,使得CD28mAb的浓度为100ng/ml,使得抗CTLA4单抗的浓度为100ng/ml,使得IFN-γ的浓度为500U/ml,使得IL-1a的浓度为500U/ml ,使得IL-2的浓度为500U/ml,瓶身贴标签,即可制备得到CMK活化液。
实施例4
选择市售的常用淋巴细胞培养基:培养基A、培养基B、培养基C及本发明制得的LONZA无血清培养基四种培养基做细胞生长曲线,实验分为培养基A、培养基B、培养基C、LONZA无血清培养基四组,按1x106/ml初始细胞浓度接种6孔板,各组按上述优选方案添加各相应的培养基,分别在第3、6、10、14天取样计数细胞,绘制各组细胞生长曲线,见图1。
由图1可知,14天细胞生长曲线,LONZA组为LONZA无血清培养基组,培养基A、培养基B、培养基C分别为三种不同品牌的淋巴细胞扩增培养基,由图可见,LONZA无血清培养基较其他三种的培养基,在培养细胞的生长速率和细胞总量上都有明显的优势。
实验例
采集5人份外周血,按上述方案提取外周血MNC,扩增培养细胞毒型混合杀伤细胞(CMK细胞),第15、17、19、21天收获细胞,计数,流式细胞表型检测,结果如下表1:
表1
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!