金色酰胺醇酯在抗流感病毒药物中的应用及其制备的制作方法
本发明属于医药
技术领域:
,特别涉及金色酰胺醇酯在制备抗流感病毒药物中的应用,还涉及从板蓝根中分离金色酰胺醇酯的方法。
背景技术:
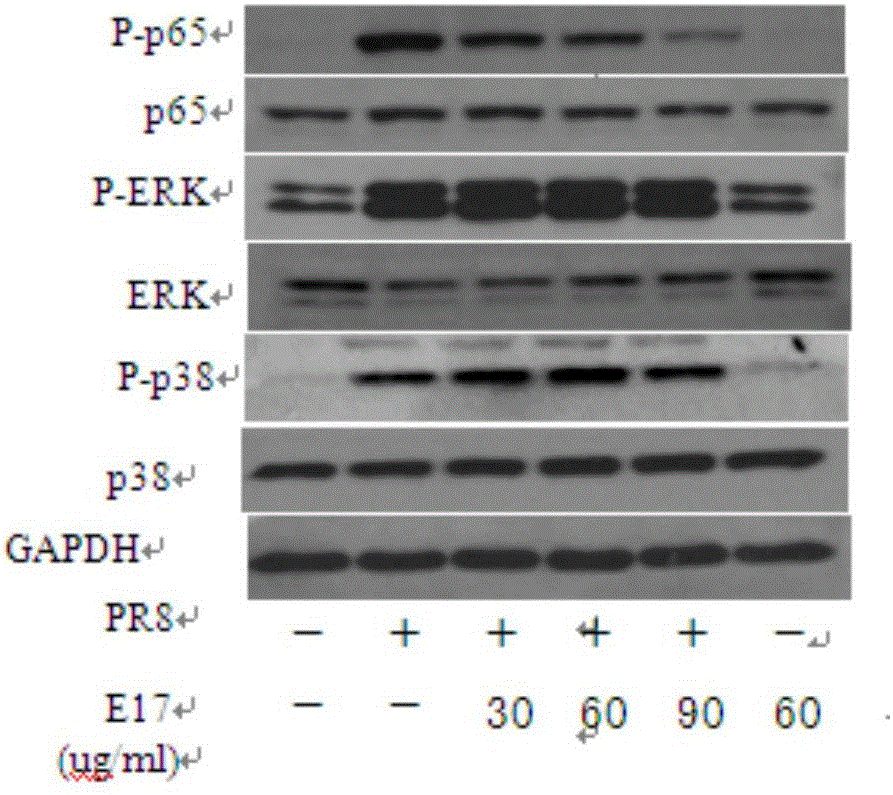
:流感病毒属于单股负链的RNA病毒,可引起急性和高度传染性的呼吸道疾病,严重威胁人类的健康。1918年爆发的“西班牙大流感”是史上最为严重流感疫情,造成全球5000多万人的死亡。2013年3月在中国东部地区暴发的A/China/2013(H7N9)病毒新疫情,受到广泛关注,至2015年7月确诊658感染H7N9病例,死亡率高达33.5%。目前应用于临床上防治流感药物有两类:M2离子通道抑制剂和神经氨酸酶抑制剂。但由于流感基因复制时依赖的PA、PB1和PB2异源三聚体构成的RNA依赖的RNA聚合酶(RNA-dependentRNApolymerase,RDRP)缺乏矫正活性及,病毒基因组突变率非常高。已有大量报导流感病毒对两类药物产生耐药性。因此,寻找预防控制流感流行有效新型药物极度重要。流感病毒感染宿主细胞后导致细胞内信号级联反应被激活,引起促炎因子如干扰素等基因表达启动宿主抗病毒免疫应答。但,同时流感病毒通过操纵宿主信号分子使病毒自身有效复制。因此,国内外的学者提出通过靶向宿主的信号通路而抑制流感复制是很好设计抗流感药物研发方向。核因子kB(Nuclearfactor-kB,NF-kB)是可诱导性转录因子。NF-kB被激活后,入核与靶基因的启动子结合,调控众多细胞因子、化学趋化因子、细胞粘附分子、生长因子、免疫受体等表达,调节细胞生长、分化、凋亡、癌变等生理病理进程。转录因子NF-kB的活化是各种病原微生物(包括流感病毒)感染的主要标志之一。流感病毒感染后,激活的NF-kB入核通过启动炎症因子、抗病毒因子(IFN-α/β)和促凋亡基因表达,使得宿主机体及时应对及控制流感的继续进一步感染传播。研究发现,抑制NF-kB活化导致抗病毒因子IFN-β表达水平下降。因此,人们认为NF-kB主要功能启动抗病毒免疫应答。与此观点相反,其他的研究表明负性突变上游分子IKK2或IkBα,从而抑制NF-kB活化,但发现病毒滴度明显下降。这一研究结果提示我们NF-kB是病毒复制繁殖所必需的。进一步的研究发现其机制是病毒活化NF-kB而上调促凋亡因子TRAIL或FasL表达而活化caspases启动细胞程序性死亡,从而有助于病毒核蛋白核输出。另一研究表明,流感病毒活化NF-kB上调细胞因子信号抑制物(SOCS)而抑制IFN介导JAK-STAT信号通路而发挥抗病毒的免疫应答作用。研究显示非甾体抗炎药物乙酰水杨酸(ASA)靶向NF-kB下调凋亡分子表达,抑制病毒核蛋白的核输出。肺部雾化ASA,发现病毒滴度明显下降,并且延长小鼠的生存时间。利用NF-kB特异的抑制剂Bay11-7082或PDTC能抑制病毒基因vRNA的合成,但对病毒的核蛋白NP的输出无影响,这说明了宿主因子NF-kB是流感合成其vRNA所需的。在宿主应对流感感染的免疫应答中,NF-kB是参与炎症基因表达的重要调节转录因子。NF-kB不仅转录促炎基因如:TNF-a,IL-1β,IL-6,IL-8,同时也调节粘附分子的表达(如:ICAM-1,V-CAM-1,E-selectin),这表明NF-kB在免疫细胞粘附后迁移聚集至炎症部位发挥重要的作用。但有研究表明,NF-kB介导产生的IL-1b和TNF-a分别能抑制ENaC(钠离子通道的)的活性和破坏肺泡上皮之间的紧密连接,导致肺泡中的水潴留和肺泡的间隔的损伤导致急性呼吸窘迫综合征ARDS的发生。然而,也有研究表明流感感染后募集到肺部的巨噬细胞,活化了NF-kB与PKR共同介导产生IFN-β而上调并分泌凋亡因子TRAIL,使得肺泡上皮的损伤。流感病毒通过活化宿主的转录因子NF-kB而使得自身有效复制;宿主细胞中活化NF-kB介导抗病毒免疫反应,但已有研究报道其介导的免疫反应导致免疫损伤。因此,以NF-kB为靶点既达到控制流感复制传播,又能调控宿主应对流感免疫反应产生有害的损伤,是一个很好预防及治疗流感感染的策略。技术实现要素:本发明提供金色酰胺醇酯在制备抗流感病毒的药物中的应用,从而为现在临床上流感的预防和治疗提供一种有效的药物。进一步的,金色酰胺醇酯在制备能够抑制流感病毒诱导的炎症反应的药物中应用。金色酰胺醇酯具有如下结构式:进一步的,金色酰胺醇酯在制备能够抑制甲型流感病毒诱导的炎症反应的药物中应用,对甲型流感病毒介导的细胞病变效应呈抑制作用。进一步的,所述金色酰胺醇酯可以通过商业渠道获得,也可从天然产物中分离获得。作为一种具体实施方式,金色酰胺醇酯可从板蓝根中分离获得,优选的,所述板蓝根为南板蓝根。本发明还提供一种用于预防或治疗流感病毒感染的药物,其活性成分包括金色酰胺醇酯,金色酰胺醇酯可作为唯一活性成分,也可和其他药用许可的物质组合。作为一种具体实施方式,该药物的剂型可以制成药学上可接受的任一种剂型,为制备所需的剂型,该药物可以加入药学上允许的辅料或载体。剂型例如为片剂、硬胶囊、软胶囊、注射液、颗粒剂、滴丸等剂型。所需的药学上可接受的载体或辅料,具体如药学上常用的稀释剂和吸收剂,例如淀粉、糊精、硫酸钙、乳糖、甘露醇、蔗糖、氯化钠、葡萄糖、尿素、碳酸钙、白陶土、微晶纤维素、硅酸铝等;药学上常用的湿润剂与粘合剂,如水、甘油、聚乙二醇、乙醇、丙醇、淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、紫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮等;药学上常用的崩解剂,例如干燥淀粉、海藻酸盐、琼脂粉、褐藻淀粉、碳酸氢钠与枸橼酸、碳酸钙、聚氧乙烯、山梨糖醇脂肪酸酯、十二烷基磺酸钠、甲基纤维素、乙基纤维素等;崩解抑制剂,例如蔗糖、三硬脂酸甘油酯、可可脂、氢化油等;润滑剂,例如滑石粉、二氧化硅、玉米淀粉、硬脂酸盐、硼酸、液体石蜡、聚乙二醇等。关于药学上可接受的载体或辅料不再一一例举,本领域普通技术人员可根据所掌握的公知常识进行具体选择。作为一种具体实施方式,药物中的金色酰胺醇酯可以通过商业渠道获得,也可通过从天然产物中分离获得。作为一种具体实施方式,金色酰胺醇酯可从板蓝根中分离获得,优选的,所述板蓝根为南板蓝根。本发明还提供一种从板蓝根中分离金色酰胺醇酯的方法,该方法包括如下步骤:S1:将板蓝根药材用体积浓度60—90%的乙醇水溶液加热回流提取,将提取液浓缩成浸膏;提取次数可以是1次或多次。S2:将浸膏用水溶解成混合液,用氯仿萃取混合液得水层和氯仿层,将氯仿层减压浓缩得氯仿层浸膏;S3:将氯仿层浸膏加入硅胶中,用乙酸乙酯-石油醚进行梯度洗脱,收集含有金色酰胺醇酯的馏分,减压浓缩去除溶剂;S4:将步骤S3中所得的产物用水溶解,加入到反相C18柱中,先用水-甲醇梯度洗脱,然后再用甲醇-丙酮梯度洗脱,收集含有金色酰胺醇酯的馏分,减压浓缩去除溶剂。优选的,还包括步骤S5:用水溶解步骤S4得到的产物,采用体积比为70∶30的乙腈-水作为洗脱剂进行液相制备,制得纯度≥90%的金色酰胺醇酯,作为一种具体实施方式,液相制备所用液相色谱仪为安捷伦1100HPLC。作为一种具体实施方式,在步骤S3、S4进行洗脱时,均用TLC对洗脱液进行定性分析,根据TLC分析结果来收集所需馏分。作为一种具体实施方式,所述板蓝根为南板蓝根;优选的,所述硅胶为正相硅胶。优选的,步骤S3中,乙酸乙酯-石油醚按照体积比9∶1-5∶1进行梯度洗脱;作为一种更为优选的方案,步骤S3中,乙酸乙酯-石油醚按照五个梯度进行洗脱,五个梯度的体积比依次分别是:9∶1、8∶2、7∶3、6∶4、5∶5。优选的,步骤S4中,先用水-甲醇按照体积比100∶0~0∶100的比例进行梯度洗脱,然后再用甲醇-丙酮按照体积比100∶0~50∶50的比例进行梯度洗脱。作为更进一步优选的方案,步骤S4中,用水-甲醇洗脱时按照11个梯度进行洗脱,水和甲醇的体积比依次分别是100∶0、90∶10、80∶20、70∶30、60∶40、50∶50、40∶60、30∶70、20∶80、10∶90、0∶100;用甲醇-丙酮洗脱时按照6个梯度进行洗脱,甲醇和丙酮的体积比依次分别是100∶0、90∶10、80∶20、70∶30、60∶40、50∶50。本申请发明人发现南板蓝根化合物E17(金色酰胺醇酯)具有抗流感病毒作用,对甲型流感病毒介导的细胞病变效应呈抑制作用;本申请发明人发现南板蓝根化合物E17(金色酰胺醇酯)具有抑制宿主细胞信号通路活性的作用;采用稳定转染荧光报告质粒细胞证实,南板蓝根化合物E17(金色酰胺醇酯)可抑制NF-kB的活化。采用免疫印迹法证实,南板蓝根化合物E17(金色酰胺醇酯)抑制与流感诱导的宿主炎症相关信号通路NF-kB的活化。采用荧光实时定量PCR证实,南板蓝根化合物E17(金色酰胺醇酯)能够明显抑制H1N1病毒感染A549细胞炎症因子(IL-6,IP-10,MCP-1,MIP-1β,MIP-1a,IL-8,TNF-a,CCL-5,IFN-b,IFN-lambda1,MIG)的异常表达并呈剂量依赖关系;并且进一步使用液相芯片技术在蛋白水平证明,南板蓝根化合物E17抑制流感感染A549诱导炎症因子(IL-6,TNF-a,IP-10,MCP-1,IL-8,Rantes)的异常表达。与现有药物比较,南板蓝根化合物E17(金色酰胺醇酯)用于制备抗流感新型药物具有以下有益效果:1、南板蓝根化合物E17(金色酰胺醇酯)作用靶标是宿主细胞的信号分子而不是病毒,既能发挥抗病毒作用,也能发挥调节流感诱导过度炎症的作用;2、化合物E17(金色酰胺醇酯)靶向宿主细胞的信号分子,不易产生耐药性;3、在一种优选方案中,金色酰胺醇酯是从植物南板蓝中分离获得单体成分,结构明确,化学性质稳定,易于质量控制,毒副作用小。附图说明图1是利用荧光素酶报告基因技术检测南板蓝根化合物E17对NF-кB通路活化的抑制作用;图2是南板蓝根化合物化合物E17抑制流感诱导信号通路活化的作用;图3为采用实时定量PCR(qRT-PCR)技术检测南板蓝根化合物E17对流感病毒感染诱导宿主细胞的炎症因子基因表达水平;图4为采用悬浮液相芯片技术,在蛋白水平检测南板蓝根化合物E17对流感病毒感染诱导宿主细胞的炎症应答的作用;图5为采用实时定量PCR(qRT-PCR)技术,检测南板蓝根化合物E17对流感病毒感染后诱导细胞凋亡而导致机体损伤的凋亡因子TRAIL的基因表达水平;图6为采用流式细胞技术,检测南板蓝根化合物E17对流感病毒感染后诱导A549细胞凋亡的作用。具体实施方式为了更好地理解本发明的内容,下面结合具体实施例对本发明的内容作进一步说明,但本发明的保护内容不局限于以下实施例。以下实施例中的金色酰胺醇酯可以通过商业渠道获得,也可以通过如下实施例一的方法制得。实施例一制备南板蓝根E17化合物(金色酰胺醇酯)步骤S1:提取将3Kg南板蓝根药材切成碎片,而碎片则采用体积浓度80%的乙醇水溶液加热回流分别提取三次,每次乙醇的体积为30L、24L、18L,得到乙醇提取液,合并乙醇提取液,加热减压回收乙醇得总提取物浸膏。步骤S2:溶剂处理将所得浸膏与水混合,并加热搅拌,采用1L的氯仿萃取所得混合液3次得到水层和氯仿层,随后采用1L乙酸乙酯萃取所得水层3次,得乙酸乙酯层和水层。分别合并氯仿层和乙酸乙酯层,并用加热减压回收溶剂得氯仿层浸膏和乙酸乙酯层浸膏。步骤S3:正相硅胶处理将所得的氯仿层浸膏加入硅胶中,采用乙酸乙酯-石油醚(体积比为9∶1-5∶1)梯度洗脱,本实施例中乙酸乙酯-石油醚共有五个梯度,依次分别为9∶1、8∶2、7∶3、6∶4、5∶5,每个梯度洗脱量为2L。通过TLC显示确定分为了13个馏分,并用加热减压回收溶剂得13个固体残留物。步骤4:反相C18处理7号馏分(2.0g)水溶解后加入反相C18柱中,先采用水和甲醇按照体积比100∶0-0∶100的比例进行梯度洗脱,本实施例中,水和甲醇具体是依次按照如下体积比进行梯度洗脱:100∶0、90∶10、80∶20、70∶30、60∶40、50∶50、40∶60、30∶70、20∶80、10∶90、0∶100,每个梯度洗脱量为1L;然后再用甲醇和丙酮按照体积比100∶0—50∶50的比例进行梯度洗脱,本实施例中,甲醇和丙酮具体是依次按照如下体积比进行梯度洗脱:100∶0、90∶10、80∶20、70∶30、60∶40、50∶50,每个梯度洗脱量为1L;洗脱过程中,通过TLC显示确定分为了12个次馏分。步骤S5:半制备处理步骤S4中收集的7—8号次馏分(63.0mg)用水溶解后,采用乙腈-水(体积比70∶30)为洗脱剂在安捷伦1100HPLC上进行液相制备,制得化合物E17(4.1mg),纯度≥90%。所得产物进行检测,数据入下:化合物(E17)1H-NMR(600MHz,CDCl3)δ:4.35(1H,m,H-2),2.80(2H,heptet,H-3),7.20(2H,m,H-5,H-9),7.07(2H,d,J=8.1Hz,H-6,H-8),7.16(1H,m,H-7),3.93(1H,dd,J=11.3,4.9Hz,H-10b),3.82(1H,dd,J=11.3,4.2Hz,H-10a),2.03(3H,s,H-12),4.76(1H,q,J=5.82Hz,H-13),7.72(2H,d,J=7.77Hz,H-16,H-20),7.44(2H,t,J=7.81Hz,H-17,H-19),7.53(1H,t,J=7.46Hz,H-18),3.21(1H,dd,J=13.7,5.91Hz,H-21b),3.06(1H,dd,J=13.7,8.5Hz,H-21a),7.31(2H,m,H-23,H-27),7.28(2H,m,H-24,H-26),7.25(1H,m,H-25).13C-NMR(150MHz,CDCl3)δ:170.3(C-1),49.5(C-2),37.4(C-3),136.6(C4),128.7(C-5),128.8(C-6),126.8(C-7),128.8(C-8),128.7(C-9),64.6(C-10),170.8(C-11),20.4(C-12),55.0(C-13),167.1(C-14),133.6(C-15),127.0(C-16),128.6(C-17),131.9(C-18),128.6(C-19),127.0(C-20),38.4(C-21),136.7(C-22),128.1(C-23),128.3(C-24),127.2(C-25),128.3(C-26),128.1(C-27)。E17结构解析:E17为白色晶体。1H-NMR和1H-1H-COSY提示该化合物为ABX系统:δ4.76(1H,q,J=5.8Hz,H-13),δ3.21(1H,dd,J=13.7,5.9Hz,H-21b),δ3.06(1H,dd,J=13.7,8.5Hz,H-21a);δ4.35(1H,m,H-2),δ3.93(1H,dd,J=11.3,4.9Hz,H-10b)δ3.82(1H,dd,J=11.3,4.2Hz,H-10a)。同时还显示了氢化学位移为δ4.76(1H,q,J=5.8Hz,H-13)与氮氢基团化学位移为δ6.76(1H,d,J=7.7Hz,N-Hb)和氢化学位移为δ4.35(1H,m,H-2)与另两个基团(δ2.80(2H,m)和δ5.95(1H,d,J=8.4Hz,N-Ha))的联系。对芳香族氢的分析得出该化合物含有三个AA’BB’C,每一个都是单一取代苯环。13C-NMR和13C-DEPT135则提示该化合物含有两个氨基(δC170.3和167.1),一个酯基(8C170.8),两个苯亚甲基(δC37.4和38.4),一个醛基(δC64.6),一个甲基(δc20.4),十七个亚甲基和三甲基。所有以上证据表明该化合物为金色酰胺醇酯。其结构式如下:实施例二细胞病变效应法(CPE)检测南板蓝根化合物E17的抗病毒作用1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备),经HPLC检测其纯度为90%。阳性对照药物:奥司他韦Oseltamivir。1.2细胞狗肾细胞(MDCK)引自中国科学院典型培养物保藏委员会细胞库。1.3病毒株甲型H1N1流感病毒PR8株(A/PR/8/34,H1N1),甲型H3N2流感病毒Aichi株(A/HK/8/68,H3N2),甲型09H1N1流感病毒(A/GZ/GIRD07/09(H1N1)),乙型流感病毒(B/Lee/1940(FluB))为本室临床分离株,禽流感H9N2(A/HK/Y280/97,H9N2)由华南农业大学兽医学院陈建新教授惠赠。2.实验方法包括如下步骤:1)单层MDCK细胞接种96孔板用PBS洗1次;2)过后加入100个TCID50不同毒株:(A/PR/8/34,H1N1)、(A/HK/8/68,H3N2)、(A/GZ/GIRD07/09(H1N1))、(B/Lee/1940(FluB)、(A/HK/Y280/97,H9N2)的病毒液分别吸附MDCK细胞,100μL/孔,37℃孵育2小时;3)弃去病毒孵育液,加入含终浓度1.5ug/mLTPCK的DMEM培养液100uL/孔,A排左6个复孔不加病毒培养基,而是加入200uL含药物E17和阳性对照药物的培养基,药物E17最高浓度为500ug/ml,之后由上至下用排枪倍比梯度稀释,48小时后观察结果。4)病毒引起的细胞病变(CPE)6级标准及南板蓝根化合物E17的抗病毒活性检测数据分别如下表1、2所示:表1病毒引起的细胞病变(CPE)6级标准细胞形态病变范围细胞生长正常,无病变出现-细胞病变少于整个单层细胞的10%±细胞病变约占整个单层细胞的25%+细胞病变约占整个单层细胞的50%2+细胞病变约占整个单层细胞的75%3+细胞病变约占整个单层细胞的75%以上4+5)观察记录CPE结果后,根据Reed-Muench法计算南板蓝根化合物E17和阳性对照物奥司他韦对不同流感株的TC50,IC50和SI(SI=TC50/IC50)。表2南板蓝根化合物E17的抗病毒活性SI>2:低毒高效;1<SI<2:高毒低效;SI<1:无效3.实验结果细胞病变效应法(CPE)检测结果如表2所示,南板蓝根化合物E17对甲型流感病毒的不同病毒株:A/PR/8/34(H1N1),A/GZ/GIRD07/09(H1N1),A/HK/8/68(H3N2)具有抗病毒作用。实施例三荧光素酶报告基因技术检测南板蓝根化合物E17对NF-kB通路活化的抑制作用1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备)。1.2细胞已稳定共转NF-κB-TATA-F-LUCI和pQCXIP-eGFP质粒的HEK293T细胞由广州呼吸疾病国家重点实验室李楚芳博士惠赠。(文献:LiJ,ZhouB,LiC,ChenQ,WangY,Liz,ChenT,YangC,JiangZ.ZhongNetal:Larieiresinol-4-O-beta-D-glucopyranosidefromtherootofIsatisindigoticainhibitsinfluenzaAvirus-inducedpro-inflammatoryresponse.JEthnopharmacol2015,174:379-386.)1.3试剂荧光素酶检测系统(货号:E2610,购自promega公司),重组人细胞因子TNF-a购自promega公司2.实验方法,如下述:1)HEK293T细胞已稳定共转NF-κB-TATA-F-LUCI和pQCXIP-eGFP质粒,该细胞系由NF-kB启动表达报告基因荧光素酶并可持续表达Egfp作为内参(该细胞系由广州呼吸疾病国家重点实验室李楚芳博士惠赠)。2)HEK293T细胞以5X104浓度接种到96孔板,于温度37℃,5%CO2的培养箱中过夜培养;3)细胞贴壁后,设置实验组分别为:对照组,TNF-a组(20ng/ml)(购自peprotect公司),TNF-a+E17(30ug/ml)组,TNF-a+E17(60ug/ml),TNF-a+E17(90ug/ml)组,单独E17组(60ug/ml)组。弃去细胞培养上清液,加入设置实验组中相应的试剂或(和)药物;4)24h后,弃去培养上清使用PBS重悬细胞,将重悬细胞分为两份,其中一份加入稳定荧光素酶检测系统(E2610,promega公司)检测荧光素酶的表达,同时另一份检测GFP荧光强度,以检测荧光素酶发光强度与内参EGFP的比值进行评价药物E17对NF-KB通路的抑制作用。3.实验结果结果参见图1,荧光素酶报告基因检测发现,南板蓝根化合物E17对NF-κB通路活化具有抑制作用,并呈剂量依赖关系。实施例四南板蓝根化合物E17抑制流感诱导信号通路活化1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备)。1.2细胞A549细胞购自ATCC,保存于本实验室;1.3化学试剂及抗体DMEM/DF12(1∶1)培养基购自Gibco公司;Trisbase购自Ameresco公司;氯化钠(NaCl)购自广州化学试剂厂;氯化钾(KCl)购自广州化学试剂厂;磷酸二氢钾(KH2PO4)购自广州化学试剂厂;磷酸氢二钠(Na2HPO4·12H2O)购自广州化学试剂厂;甘氨酸Glycine购自广州化学试剂厂;十二烷基磺酸钠(SDS)购自美国sigma公司;吐温Tween-20购自广州化学试剂厂;BCA蛋白浓度测定试剂盒购自美国Thermo公司;RIPA裂解液购自美国Thermo公司;EasyseeWesternmarker(20-90kDa)购自中国TransgenBiotech公司;BlueplusIIproteinmarker购自中国TransgenBiotech公司;过硫酸胺(APS)购自美国Ameresco公司;PVDF膜购自美国Lifescience公司;Cocktail(蛋白酶抑制剂)购自美国sigma公司;脱脂奶粉购自Gibco公司;胎牛血清购自Gibco公司;TEMED(N,N-亚甲基双丙烯酰胺)购自美国Bio-rad公司;兔抗人p-p65抗体购自美国CST公司;兔抗人p65抗体购自美国CST公司;兔抗人p-pERK抗体购自美国CST公司;兔抗人ERK抗体购自美国CST公司;兔抗人p-p38抗体购自美国CST公司;兔抗人p38抗体购自美国CST公司;兔抗人GAPDH抗体购自美国CST公司;羊抗兔二抗购自美国Earthox公司。2.实验方法,如下述:1)用胰酶将T75瓶中的A549细胞进行消化,待细胞全部脱落后,加入适量含10%FBS(体积比)的DMEM/DF12(1∶1)培养基进行终止胰酶的作用;2)将消化下来的细胞转移到15ml的离心管中,进行离心1000rpm×5min;3)加入适量含10%FBS的DMEM/DF12(1∶1)培养基将细胞重悬,调整细胞的密度将细胞铺于6孔板中,放置于培养箱中,培养12h细胞贴壁后待用;4)进行实验组的设置,包括:正常组;流感病毒组,低剂量药物干预组(流感病毒+E17(30μg/ml)),中剂量药物干预组(流感病毒+E17(60μg/ml)),高剂量药物干预组(流感病毒+E17(90μg/ml)),单独药物组(E17(60μg/ml))。将A549细胞取出,弃去原有的培养基,加入PBS洗涤两次,然后加入含流感病毒A/PR8/3/4(H1N1)(MOI=0.1)无血清的DMEM/DF12(1∶1)培养基吸附细胞2h;5)用PBS将细胞洗涤除去未吸附的病毒,药物组干预组加入不同浓度的E17(30μg/ml、60μg/ml、90μg/ml),单独药物组加入60μg/ml的E17。继续培养24小时后;将细胞6孔板置于冰上,弃去细胞培养上清,并用冷的PBS洗涤两次;洗涤完毕,迅速加入130ul细胞裂解液RIPA(含有蛋白酶抑制剂cocktail,其与细胞裂解液RIPA体积比(V/V)为1∶100加入及终浓度为10uM的PMSF),进行提取细胞总蛋白。6)将1.5mlEP管进行标记并它们置于冰上,将细胞裂解物转移至标记好各组的EP管,并在摇床上摇30min,让蛋白充分裂解;7)将细胞裂解物移至4℃预冷的离心机,进行13000rpm×15min离心;8)离心毕,将裂解物的沉淀弃去,并将上清进行分装保存在-80℃;对细胞总提取物的蛋白浓度进行测定,按BCA蛋白检测试剂盒说明书进行配置标准品,取96孔板,加入10ul/孔的标准品及样品(2复孔),然后逐孔加入BCA检测工作液200ul/孔(配置工作液A∶B=1∶50),混匀后37℃孵育30min,取出96孔板冷却至室温,于酶标仪上在吸光度572nm测定OD值。绘制标准曲线,将样品OD值转换为浓度。9)SDS聚丙烯酰胺凝胶的准备:根据配方先配置10%SDS聚丙烯酰胺凝胶电泳分离胶:成份体积ddH2O4ml30%ACr(丙烯酰胺)3.3ml1.5MTris.HCl(PH=8.8)2.5ml10%SDS0.1ml10%APS(过硫酸铵)0.1mlTEMED0.004ml充分混匀后在分离玻璃板间灌注分离胶,灌注完毕在最上层加入ddH2O封住分离胶液面,等待30min,分离胶凝结完好;10)根据配方先配置5%SDS聚丙烯酰胺凝胶电泳浓缩胶:成份体积ddH2O3.4ml30%ACr(丙烯酰胺)0.83ml1MTris.HCl(PH=6.8)0.63ml10%SDS0.05ml10%APS(过硫酸铵)0.05mlTEMED0.005ml充分混匀后在分离玻璃板间灌注浓缩胶,灌注毕插入梳子,等待30min,浓缩胶凝结完好,可以使用。10)变性蛋白:用5xSDS聚丙烯凝胶加样缓冲液(5xloadingbuffer)与样品(20μg)按体积与质量比(u1/ug)的比例(1∶4))混合,95℃变性10min,立即转至冰上冷却5min防止蛋白复性。11)加样:离心3000rpm×1min,逐孔加样;12)电泳:用Bio-Rad垂直电泳仪,90V恒压电泳约(1—1.5)h,待溴酚蓝指示剂到达分离胶底部时停止电泳;12)Western转膜:预先甲醇浸泡15min激活PVDF膜。电泳结束后取下凝胶,切除多余的空白凝胶,修剪后按其大小裁剪6张Whatman3M滤纸。按3张滤纸-凝胶-PVDF膜-3张滤纸的顺序叠放整齐后置于湿转负极板上,用干净玻璃棒排去凝胶与PVDF膜间的气泡,在冷库中,以380mA的恒电转膜2h。13)封闭:转膜结束后,取出膜并加入5%脱脂奶粉(5%milk/TBST)封闭PVDF膜并于室温摇床上轻摇2h;13)抗体稀释及孵育:配置5%BSA/TBST,按购自CST公司的抗体NF-kB、P38MAPK、ERK1/2MAPK、GAPDH说明书相应的比例分别稀释NF-kB,P38MAPK,ERK1/2MAPK、GAPDH抗体,加入到已转膜完毕的PVDF膜上,置于4℃冷库中过夜孵育;14)第二天,取出PVDF膜并恢复至室温,移去一抗并用洗液TBST洗膜3次,5min/次。随后加入按体积比(V/V)1∶1000进行稀释的与辣根过氧化物酶(HRP)偶联的羊抗兔二抗,室温孵育1h。移去二抗并用洗液TBST洗膜3次,5min/次;15)取出膜,滤纸上滴干水分,加入ECL免疫荧光化学发光显色剂;16)于暗室中进行压片,并在显影液显影及定影液固定胶片;17)结果分析与整理。3.实验结果结果见图2。免疫印迹结果显示,流感A/PR8/3/4(H1N1)感染A54924h后,细胞信号通路NF-kB,P38MAPK,ERK1/2MAPK明显活化。南板蓝根化合物E17明显抑制流感A/PR8/3/4(H1N1)诱导人A549细胞信号通路NF-κB信号通路的活化。实施例五南板蓝根化合物E17对流感病毒感染诱导宿主炎症基因表达的影响1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备)。1.2细胞和毒株A549细胞购自ATCC,保存于本实验室;甲型H1N1流感病毒PR8株(A/PR/8/34,H1N1),保存于本实验室。1.3试剂逆转录反应试剂盒(购自Takara公司;货号:RR036A);实时定量PCR反应试剂盒(购自Takara公司;货号:RR390A)2.实验方法,如下述:1)将A549细胞以5X106的细胞密度种至6孔板,放置于温度37℃,5%CO2的培养箱中;2)过夜培养细胞贴壁后,弃去原培养基,加入PBS洗涤2次。然后加入含流感病毒A/PR8/3/4(H1N1)无血清的DMEM/DF12(1∶1)培养基吸附细胞2h;然后,用PBS将细胞洗涤除去未吸附的病毒;3)实验组设置为病毒组、药物干预组,其中药物干预组采用药物治疗模式,药物组干预组(图3中对应于H1N1+E17)加入不同浓度E17(30μg/ml、60μg/ml、90μg/ml);病毒组(图3中对应于H1N1)不加药物进行干预。还设有单独药物组(图3中对应于E17),其A549细胞未经病毒吸附,加入60μg/ml的E17。4)继续培养24小时后,弃去6孔板中细胞培养上清后,冷PBS洗涤2遍,加入1mlTrizol(Lifetechnologies公司)并在室温下孵育5min;(可选:或转至1.5mlEP管中,于-80°冰箱中保存;或直接进行提取);5)后续按照如下步骤进行:①加入200ul氯仿,震荡15sec,于室温中孵育2-3min;置于4°离心机中进行离心:13000rpmx15min;②离心毕,将上清转移至新的1.5EP管,加入500ul异丙醇;室温下孵育10min;置于4℃离心机中进行离心:12000rpmx10min;③离心毕,加入1ml75%乙醇洗涤一次,置于4%离心机中进行离心:7500rpmx10min;④弃去上清,室温放置5-10min,加入无RNase水溶解RNA,立刻进行逆转录成cDNA。⑤分光光度计中测定总RNA的浓度(ng/μl)并计算总RNA的体积:拟加入逆转录反应体系中总RNA的量为1000ng,则计算所需总RNA的体积V=1000/RNA浓度;mRNA逆转录成cDNA,配置逆转录反应体系如下(试剂盒:TakaraRR036A):⑥进行逆转录反应,反应条件如下:37℃15min85℃5Sec4℃∞收取样品进行后续定量PCR实验或保存于-20℃。⑧实时定量PCR反应试剂盒(货号:TakaraRR390A)配置反应体系如下:进行RealtimePCR反应条件(ABI7500)引物序列及探针序列如下:3.实验结果结果如图3显示,流感A/PR8/3/4(H1N1)感染A549细胞进行药物E17干预后,明显抑制流感诱导的炎症因子IL-6,IL-8,IP-10,MCP-1,MIP-1α,MIP-1β,MIG,IFN-β,IFN-λ1的基因水平的表达。实施例六Bio-plex悬浮芯片技术在蛋白水平检测南板蓝根E17对流感病毒感染诱导宿主细胞的炎症因子分泌的作用1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备)。1.2细胞和毒株A549细胞购自ATCC;甲型H1N1流感病毒PR8株(A/PR/8/34,H1N1),保存于本实验室。1.3试剂Bio-Plex悬液芯片检测试剂盒(货号:Y500CR7L16)2.实验方法,如下述:1)将A549细胞以5X106的细胞密度种至6孔板,放置于培养箱中,过夜培养;2)细胞贴壁后,弃去原培养基,加入PBS洗涤两次,然后加入含流感病毒A/PR8/3/4(H1N1)无血清的DMEM/DF12(1∶1)培养基吸附细胞2h;然后,用PBS将细胞洗涤除去未吸附的病毒;3)设Control(对照组)(正常A549细胞)、病毒组、药物干预组;其中,药物干预组采用药物治疗模式,药物干预组加入不同浓度的南板蓝根化合物E17(30μg/ml、30μg/ml、90μg/ml);病毒组未添加药物干预。还设有单独药物组,其A549细胞未经病毒吸附,加入60μg/ml的南板蓝根化合物E17;4)继续培养24小时后,将细胞培养上清移至1.5mlEP管。然后,置于4℃预冷的离心机中进行13000rpmx15min的离心。离心毕,弃去沉淀的细胞碎片,并将上清进行小份分装,然后于-80°冰箱中冻存,避免反复冻融,待检测时使用。5)Bio-plex悬浮芯片技术检测细胞上清中炎症因子含量:①细胞因子检测实验:取出Bio-Plex悬液芯片检测试剂盒(BioRad公司),使其平衡恢复至室温。同时,取出样品于冰上进行缓慢解冻。②设置平底板(96孔板)上标准品孔、空白孔、control孔及样品孔的位置,标准品孔及空白孔2个复孔。③按照说明书(Bio-Plex悬液芯片检测试剂盒)比例加入到检测缓冲液assaybuffer中进行稀释抗体微球,涡旋均匀磁性吸引微球,每孔50ul微球混合液加入到平底板中。④每孔加入100ul冲洗缓冲液washbuffer,并将平底板置于磁力架上进行洗涤磁性吸引微球,洗涤2次。⑤加样:将系列稀释好的标准品、准备好的样品分别加入到平底板的标准品孔、样品孔中,空白孔加入assaybuffer,用封口膜封板。⑥孵育:用铝箔包好,室温下,将平底板在96孔板摇床300rpm孵育30min。⑦洗涤:孵育完毕,并将平底板置于磁力架上弃去液体。每孔加入100ulwashbuffer,并将平底板置于磁力架上弃去液体,重复此过程洗涤3次。⑧加检测抗体:使用前涡旋摇匀检测抗体,将检测抗体按照说明书比例加入到检测抗体稀释液中,涡旋均匀炎症因子IL-6、IL-8、IL-10、IFN-γ、IP-10、MCP-1(MCAF),RANTES、TNF-a的检测抗体,在平底板每孔加入25ul。在室温下,将平底板置于96孔板摇床300rpm孵育30min。⑨洗涤:孵育完毕,并将平底板置于磁力架上弃去液体,并每孔加入100ulwashbuffer。并将平底板置于磁力架上弃去washbuffer,重复此过程洗涤3次。⑩在平底板每孔加入50ul荧光素PE标记的链霉亲和素,室温下,在96孔板摇床300rpm孵育10min。洗涤、孵育完毕,并将平底板置于磁力架上弃去液体,并每孔加入100ulwashbuffer。并置于磁力架上弃去washbuffer,重复洗涤3次检测将平底板每孔加入125ul检测缓冲液assaybuffer,避光室温下摇板1100rpm*30秒,用Bio-plex200进行检测。3.实验结果结果如图4所示,南板蓝根化合物E17干预后明显抑制流感病毒诱导的炎症因子(IL-6,TNF-alpha,IP-10,MCP-1,IL-8,Rantes)的水平。提示南板蓝根化合物E17干预能调节流感感染诱导过度炎症应。实施例六南板蓝根化合物E17对流感病毒感染诱导宿主凋亡基因TRAIL的表达影响1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备)。1.2细胞和毒株A549细胞购自ATCC;甲型H1N1流感病毒PR8株(A/PR/8/34,H1N1),保存于本实验室。1.3试剂逆转录反应试剂盒(购自Takara公司;货号:RR036A);实时定量PCR反应试剂盒(购自Takara公司;货号:RR390A)2.实验方法,如下述:1)将A549细胞以5X106的细胞密度种至6孔板,放置于温度37℃,5%CO2的培养箱中;2)过夜培养细胞贴壁后,弃去原培养基,加入PBS洗涤2次。然后加入含流感病毒A/PR8/3/4(H1N1)无血清的DMEM/DF12(1∶1)培养基吸附细胞2h;然后,用PBS将细胞洗涤除去未吸附的病毒;3)实验组设置为病毒组、药物干预组,其中药物干预组采用药物治疗模式,药物组干预组(图5中对应为PR8+E17)加入不同浓度E17(30μg/ml、60μg/ml、90μg/ml);病毒组不加药物进行干预。还设有单独药物组,其A549细胞未经病毒吸附,加入60μg/ml的E17。4)继续培养24小时后,弃去6孔板中细胞培养上清后,冷PBS洗涤2遍,加入1mlTrizol(Lifetechnologies公司)并在室温下孵育5min;(可选:或转至1.5mlEP管中,于-80°冰箱中保存;或直接进行提取);之后按照如下步骤进行:细胞总RNA提取、mRNA逆转录成cDNA、及实时定量PCR反应均参照实施例五的相应步骤进行;其中,本实施例在实时定量PCR反应中所用的凋亡因子TRAIL引物序列及探针序列如下:3.实验结果结果如图5所示,流感病毒感染A549细胞24h后凋亡因子TRAIL的基因表达水平明显上调,南板蓝根化合物E17干预后明显抑制流感病毒诱导的凋亡因子TRAIL的基因表达水平,并呈剂量依赖关系。提示南板蓝根化合物E17干预抑制流感感染诱导凋亡所致的机体损伤。实施例八AnnexinV检测南板蓝根E17干预流感诱导凋亡1.实验材料:1.1药物受试样品南板蓝根化合物E17(实施例一制备)。1.2细胞和毒株A549细胞购自ATCC,保存于本实验室;甲型H1N1流感病毒PR8株(A/PR/8/34,H1N1)1.3试剂AnnexinV凋亡检测试剂盒(购自affymetrixebioscience公司,货号:88-8005)2.实验方法,如下述:1)用胰酶将T75瓶中的A549细胞进行消化,待细胞全部脱落后,加入适量培养基进行终止胰酶的作用;2)将消化下来的细胞转移到15ml的离心管中,进行离心1000rpmx5min;3)加入培养基将细胞重悬,调整细胞的密度将细胞铺于6孔板中,放置与培养箱中,培养12h细胞贴壁后待用;4)进行实验组的设置,包括:正常组;流感病毒组;药物干预组:流感病毒+E17(60ug/ml)组、流感病毒组+E17(90ug/ml)组;5)将A549细胞取出,弃去原有的培养基,加入PBS洗涤两次,流感病毒组和药物干预组在PBS洗涤后加入含流感病毒A/PR8/3/4(H1N1)无血清的培养基吸附细胞2h,正常组不做该处理;6)用PBS将细胞洗涤除去未吸附的病毒,药物干预组加入不同浓度的药物,流感病毒组和正常组则用PBS替代,继续培养24小时;7)然后,将细胞6孔板置于冰上,弃去细胞培养上清,并用冷的PBS洗涤两次;8)洗涤完毕,加入无EDTA的胰酶消化细胞;并将细胞移至1.5ml的离心管于4℃离心机进行离心,1000rpmx3min,离心毕弃去上清;9)加入PBS洗涤细胞一次,4℃离心1000rpmx3min;10)加入1xbingingbuffer洗涤一次,4℃离心1000rpmx3min;11)加入500ul的细胞悬液重悬细胞,制备细胞悬液;12)加入5ulAnnexinV和5ulPropidiumiodide染色细胞,室温避光静置15min;13)1xbingingbuffer洗涤一次;14)上机分析3.实验结果结果如图6所示,南板蓝根E17抑制流感A/PR8/3/4(H1N1)感染诱导A549细胞的凋亡。由上述实验结果可知,南板蓝根化合物E17(金色酰胺醇酯)具有抗流感病毒作用,对甲型流感病毒介导的细胞病变效应呈抑制作用;南板蓝根化合物E17可抑制NF-kB的活化。采用免疫印迹法证实,南板蓝根化合物E17抑制与流感诱导的宿主炎症相关信号通路NF-kB的活化。采用荧光实时定量PCR证实,南板蓝根化合物E17能够明显抑制H1N1病毒感染A549细胞炎症因子(IL-6,IP-10,MCP-1,MIP-1β,MIP-1a,IL-8,TNF-a,CCL-5,IFN-b,IFN-lambdal,MIG)的异常表达并呈剂量依赖关系;并且进一步使用液相芯片技术在蛋白水平证明,南板蓝根化合物E17抑制流感感染A549诱导炎症因子(IL-6,TNF-a,IP-10,MCP-1,IL-8,Rantes)的异常表达。与现有药物比较,南板蓝根化合物E17(金色酰胺醇酯)作用靶标是宿主细胞的信号分子而不是病毒,既能发挥抗病毒作用,也能发挥调节流感诱导过度炎症的作用;化合物E17靶向宿主细胞的信号分子,不易产生耐药性;作为一种优选方案中,金色酰胺醇酯是从植物南板蓝中分离获得单体成分,结构明确,化学性质稳定,易于质量控制,毒副作用小。文中未特别说明,均为本领域普通技术人员根据其掌握的公知常识或常规技术手段所能理解或知晓的,对此不再一一赘述。以上所述,仅是本发明的较佳实施例而已,并非对本发明做任何形式上的限制,故凡未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 人源抗H7N9禽流感病毒中和性抗体1F7L及其应用的制造方法与工艺
- 吲哚衍生物及其制备方法和其抗流感病毒作用与制造工艺
- 检测H5亚型禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 检测禽流感病毒与鸡细小病毒的成套试剂与方法与制造工艺
- 一种流感病毒逆转录环介导等温扩增试剂盒及其应用的制造方法与工艺
- 用于快速检测流感病毒的狗肾细胞MDCK-NS1的离心小瓶及其应用方法与制造工艺
- 一种保护和稳定病毒RNA的采血管的制造方法与工艺
- H6亚型禽流感病毒荧光定量RT‑PCR检测方法与制造工艺
- 表达H7N9亚型禽流感病毒血凝素蛋白的重组火鸡疱疹病毒株rHOH及构建方法与制造工艺
- 一种提高禽流感疫苗毒株增殖滴度的方法与制造工艺