抑癌丝氨酸-苏氨酸激酶11真核表达载体及其构建方法与流程
本发明属于基因工程技术领域,尤其涉及一种抑癌丝氨酸-苏氨酸激酶11真核表达载体及其构建方法。
背景技术:
已检索的文献中只有LKB1瞬时表达的研究,没有稳定表达LKB1研究文献。
本发明应用经典分子生物学与细胞生物学技术,主要有RT-PCR、分子克隆、酶切、基因重组、真核表达载体构建、脂质体转染、稳定表达细胞株的筛选以及抗肿瘤相关实验。以下是检索到的与本发明相关的研究。
解晓晨等在《hLKB1基因重组质粒构建及蛋白表达和定位》(解剖科学进展,2012,18(4):320~322)中构建了pCDNA3.1/flag-hLKB 1真核表达载体,将构建的重组质粒转染到胃癌SGC-7901细胞中,分别利用Western blot和激光共聚焦扫描显微技术检测其表达和在胃癌细胞中的定位,没有进行LKB1对肿瘤细胞的功能检测。张志强等在《LKB1对胰腺癌细胞迁移侵袭及上皮间质转化的影响及机制研究》(实用癌症杂志,2016,31(3):362-365)中将沈阳万类公司购买的pCDNA3.1-LKB1质粒转染至人胰腺癌细胞ASPC-1,检测细胞转染后LKB1蛋白的表达水平,LKB1对人胰腺癌细胞ASPC-1迁移、侵袭能力的影响,LKB1过表达对AMPKa、P-AMPKa及上皮间质转化相关蛋白E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(Vimentin)表达的影响。该研究主要研究了LKB1瞬时表达对人胰腺癌细胞ASPC-1的影响及作用机制,不能确定能否在肿瘤细胞中稳定表达及作用如何。唐乔乔等在《慢病毒介导的LKB1基因在子宫内膜癌HEC.1A细胞中的表达》(中国癌症防治杂志,2014,6(2):133-136)中构建慢病毒表达载体LKB1/pWP,用包装成功后的病毒液感染子宫内膜癌HEC-1A细胞,以荧光定量PCR、Westem blot法检测HEC-1A细胞中LKB1的相对表达量,没有检测其功能如何。包传恩等在《LKB1协同二甲双胍影响宫颈癌HeLa细胞的增殖与凋亡及其可能的机制》(中国肿瘤生物治疗杂志,2014,21(2)153-159)中构建含有LKB1基因的重组质粒LKB1-pEGFP-nl并转染HeLa细胞,MTI检测LKB1基因对经二甲双胍处理的HeLa细胞增殖的影响,流式细胞术检测对细胞周期和凋亡的影响,相关蛋白AMPK、ACC和Rb磷酸化水平的影响,该研究也没有对LKB1的功能进行检测。
以上都是在瞬时表达状态下进行的相关研究,瞬时表达主要是载体本身携带的启动子发挥作用,一般在48小时后即不表达,不能确定能否在肿瘤细胞中稳定表达。而抗肿瘤要经较长时间才能观察到其作用效果,因此建立起LKB1的稳定表达细胞株,对进行抗肿瘤的研究与应用才具有临床意义和应用价值。
技术实现要素:
本发明的目的在于提供一种抑癌丝氨酸-苏氨酸激酶11真核表达载体及其构建方法,旨在解决目前只有LKB1瞬时表达的研究,没有有效的方法建立起LKB1的稳定表达细胞株的问题。
本发明是这样实现的,一种抑癌丝氨酸-苏氨酸激酶11真核表达载体,所述抑癌丝氨酸-苏氨酸激酶11真核表达载体为pCMV-LKB1,基因序列为SEQ ID NO:NM_000455.4。
本发明的另一目的在于提供一种所述抑癌丝氨酸-苏氨酸激酶11真核表达载体的构建方法,所述构建方法包括:
步骤一,通过提取293-T细胞的总RNA、反转录成cDNA、设计引物PCR扩增目的片段和PCR产物行琼脂糖凝胶电泳后回收目的片段获取LKB1目的片段;
步骤二,pCMV-blank质粒的扩增和提取;
步骤三,克隆载体pMD18-LKB1;
步骤四,重组真核表达载体pCMV-LKB1。
进一步,所述提取293-T细胞的总RNA的方法包括:
将培养好的贴壁细胞用PBS清洗;
按照每25cm2生长面积加入1ml的TRizol,使裂解液均匀分布于细胞表面;
用无RNA酶的枪头反复吹打细胞,使之裂解充分;
将细胞裂解液转移至无RNA酶的EP管中,室温静置5min,使RNA从核蛋白中分离出来;
向裂解液中加入1/5所用TRizol体积的氯仿,反复颠倒混匀,使溶液呈乳白色,室温静置5min;
12000r/min 4℃离心15min,将裂解液分为明显的三层,吸取上层清液转移至另外一只新的不含RNA酶的EP管中;
向新管中加入0.5倍TRizol体积的异丙醇,上下颠倒离心管充分混匀室温静置10分钟;
12000r/min 4℃离心10分钟后,试管底部会出现少许白色RNA沉淀;
弃去上清液,加入1ml75%的乙醇,使RNA漂浮起来,7500r/min离心5min,弃上清;
打开离心管盖,室温干燥沉淀几分钟,加入RNase-free水溶解RNA沉淀,-20℃保存备用。
进一步,所述PCR产物行琼脂糖凝胶电泳后回收目的片段方法包括:
制胶,称取琼脂粉倒入锥形瓶中,按照0.5%w/v的比例加入1×TAE溶液;微波炉高火加热溶解琼脂粉,每次1min,重复3次,直至完全溶解;取出锥形瓶室温冷却至50℃左右,向琼脂糖凝胶中滴入溴化乙锭溶液,终浓度为0.5ug/ml;将制胶梳子插于制胶模板中,使梳子底部与模板有2mm间隙,将溶解充分的胶缓慢均匀倒入模板中,室温冷却30min,使琼脂糖凝胶冷却成型,取下凝胶切割成适当大小,保存于TAE溶液中;
电泳,制好的胶放入电泳槽中,将PCR产物与上样缓冲液按比例混和均匀后点入加样孔,并将5ul DNA Marker加于胶最左边的孔;设置电压为120V,电泳20min;取出凝胶于紫外线投射仪下切取目的片段。
进一步,所述胶回收目的片段方法包括:
将切取的含目的片段的凝胶放于一只洁净EP管中,称取凝胶质量并换算成凝胶体积,100mg=100ul,加入3倍于凝胶体积的Buffer DE-A溶液;
将含有凝胶的溶液放于75℃水浴锅中加热融化,加热过程中每隔2-3min颠倒混匀EP管,使受热均匀,加快溶解速度;
加入0.5Buffer DE-A体积的Buffer DE-B溶液,反复颠倒使二者充分混匀;
将混合液分批次加入制备管中,12000g离心1min,弃滤液;
将制备管放回离心管,加500ul Buffer W1,12000g离心30s,弃滤液;
将制备管放回离心管,加700ul Buffer W2,12000g离心30s,弃滤液。重复一次;
⑦将制备管放回离心管,12000g离心1min;
将制备管置于新的洁净的EP管中,在膜上滴加20ul去离子水,室温静置1min,12000g离心1min洗脱DNA目的片段。
进一步,所述pCMV-blank质粒的扩增和提取具体包括:
扩增质粒:将冻存的含真核表达载体pCMV-blank的菌株由冰箱取出,室温溶解;取200ul冻存菌液,加入Kana的LB溶液中;37℃振荡培养箱过夜培养16h;
提取质粒:向吸附柱CP4中加入500μl的平衡液BL,12000rpm离心1min,倒掉收集管中的液体,将吸附柱重新放回收集管中;取15ml培养16h的菌液进行离心,12000rpm离心1min,弃上清并用枪头小心吸干上清液,获细菌沉淀;加500μl溶液P1至有菌体沉淀的离心管中,并将细菌沉淀用移液枪彻底悬浮;加入500μl溶液P2至上述离心管中,温和地上下翻转6-8次使菌体充分裂解;加入700μl溶液P3至上述离心管中,温和地上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀;12000rpm离心10min,此时在离心管底部会形成沉淀;将收集的上清液分次加入吸附柱CP4中,12000rpm离心1min,倒掉收集管中的液体,将吸附柱CP4放入收集管中;加入0.6ml漂洗液PW至吸附柱CP4中,12000rpm离心1min,倒掉收集管中的液体,将吸附柱CP4放入收集管中;吸附柱CP4放入收集管中,再次12000rpm离心2min,目的是将吸附柱中残余的漂洗液去除,排除对后续实验的影响;将吸附柱CP4放于一干净的离心管中,向吸附膜的中间部位悬空滴加100-300μl洗脱液,室温放置2-5min,12000rpm离心2min,将质粒溶液收集到离心管中;测定质粒浓度后,将质粒浓度标记在EP管上,-20℃保存备用。
进一步,所述克隆载体pMD18-LKB1的方法包括:
(1)连接反应,在微量离心管中配置下列连接反应体系,用于T-Vector和目的片段的连接,反应液配置好后,添加与总体积一样的Solution I;16℃反应3h后放入4℃冰箱过夜,次日进行转化反应;
(2)转化反应,取连接反应液,轻柔缓慢地加入提前准备好的感受态细胞中,轻弹管壁使连接反应液与感受态细胞混合均匀,冰上冷却30min;将感受态细胞放入42℃恒温水浴锅,热击90s;将其插入冰中进行冷却,5min;向感受态细胞中加入900ul的新鲜LB溶液,盖紧管盖于37℃孵箱扶壮2h;取200ul扶壮后菌液涂布于含x-Gal、IPTG、AMP的LB琼脂平板上,菌液晾干后于37℃倒置过夜;24小时,观察菌落的长出情况,挑取理想菌落进行鉴定;
(3)菌落鉴定,从平板上挑取几株单个菌落,接种于LB溶液中,37℃震荡培养过夜;提取质粒,以质粒为模板进行PCR;将PCR产物进行琼脂糖凝胶电泳,挑选出含有目的条带的样品;把含目的条带的质粒进行序列测定并明确目的片段插入方向。
进一步,所述重组真核表达载体pCMV-LKB1具体包括:
(1)根据真核表达载体pCMV-Blank和含目的片段的pMD18-T的酶切位点分布图及LKB1基因三者所不包含的酶切位点的情况汇总,分别将真核表达载体pCMV-Blank和pMD18-T-LKB1行双酶切反应,选取酶切位点为Sal I和EcoR I
(2)将酶切得到的反应液行琼脂糖凝胶电泳,分离出目的条带;在紫外线投射仪下切取目的片段,进行胶回收,获得目的片段;将双酶切完成的pCMV-Blank和两端带相应酶切位点的LKB1片段在T4连接酶作用下,16℃连接过夜,16h;转化后,继续培养;挑取单个菌落在LB溶液中扩增;PCR后将可扩增出目的片段的质粒进行测序;将重组质粒测序结果与NCBI公布的LKB1基因的核酸序列进行比对,显示目的片段与NCBI公布的完全一致,提示真核表达载体pCMV-LKB1构建成功。
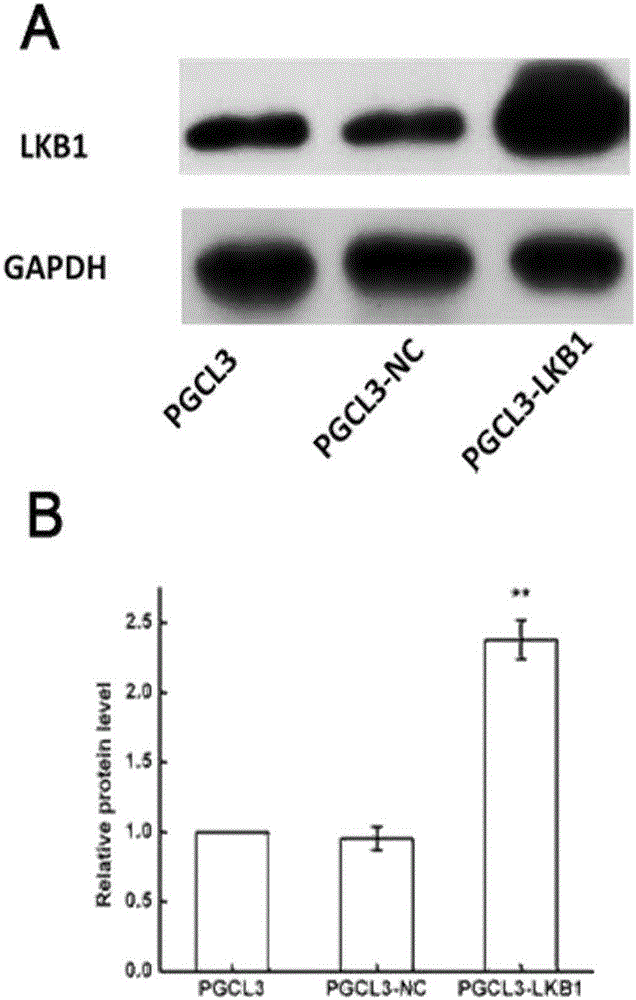
本发明提供的抑癌丝氨酸-苏氨酸激酶11真核表达载体及其构建方法,构建抑癌基因丝氨酸-苏氨酸激酶11真核表达载体pCMV-LKB1,其表达产物可抑制肿瘤的转移、侵袭;能稳定表达抑癌基因LKB1产物,用于肿瘤的辅助治疗。与两对照组相比,PGCL3-LKB1组中LKB1表达显著增加,空质粒组与空白对照组相比,LKB1表达基本不变,提示LKB1在PGCL3细胞中成功高表达。如图2。用Transwell小室检测各组转染细胞迁移能力,结果显示与对照组相比,PGCL3-LKB1组细胞迁移能力显著下降;而空白对照组和阴性对照组细胞迁移力无变化,如图3所示,提示LKB1可显著抑制PGCL3细胞的迁移力。转染LKB1后用Transwell小室检测细胞侵袭能力,结果显示与对照组相比,转染pCMV-LKB1组细胞的侵袭能力显著下降;而空白对照组与转染空质粒组细胞侵袭力无显著性差异,如图4所示,提示LKB1可显著抑制PGCL3细胞的侵袭力。
附图说明
图1是本发明实施例提供的抑癌丝氨酸-苏氨酸激酶11真核表达载体的构建方法流程图。
图2是本发明实施例提供的LKB1在PGCL3细胞中成功高表达示意图;
图中:A为Western blotting检测转染的PGCL3细胞中LKB1蛋白的表达图;B为统计分析后的柱状图。
图3是本发明实施例提供的提示LKB1可显著抑制PGCL3细胞的迁移力示意图;
图中;a为Transwell法检测LKB1转染PGCL3细胞后细胞的迁移图;b为PGCL3细胞迁移数目统计分析柱状图。
图4是本发明实施例提供的提示LKB1可显著抑制PGCL3细胞的侵袭力示意图;
图中;a为Transwell法检测LKB1转染PGCL3细胞后细胞的侵袭图;b为PGCL3细胞侵袭数目统计分析柱状图。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
下面结合附图对本发明的应用原理作详细的描述。
本发明实施例的抑癌丝氨酸-苏氨酸激酶11真核表达载体的基因序列为SEQ ID NO:1。
如图1所示,本发明实施例的抑癌丝氨酸-苏氨酸激酶11真核表达载体的构建方法包括以下步骤:
S101:通过提取293-T细胞的总RNA、反转录成cDNA、设计引物PCR扩增目的片段和PCR产物行琼脂糖凝胶电泳后回收目的片段获取LKB1目的片段;
S102:pCMV-blank质粒的扩增和提取;
S103:克隆载体pMD18-LKB1;
S104:重组真核表达载体pCMV-LKB1。
下面结合具体实施例对本发明的应用原理作进一步的描述。
一、构建重组真核表达载体pCMV-LKB1
1.LKB1目的片段的获得
(1)提取293-T细胞的总RNA
①将培养好的贴壁细胞用PBS清洗;
②按照每25cm2生长面积加入1ml的TRizol,轻轻晃动,使裂解液均匀分布于细胞表面;
③用无RNA酶的枪头反复吹打细胞,使之裂解充分;
④将细胞裂解液转移至无RNA酶的EP管中,室温静置5min,使RNA从核蛋白中分离出来;
⑤向上述裂解液中加入1/5所用TRizol体积的氯仿,反复颠倒混匀,使溶液呈乳白色,室温静置5min;
⑥12000r/min 4℃离心15min,将裂解液分为明显的三层,小心吸取上层清液转移至另外一只新的不含RNA酶的EP管中;
⑦向新管中加入0.5倍TRizol体积的异丙醇,上下颠倒离心管充分混匀室温静置10分钟;
⑧12000r/min 4℃离心10分钟后,试管底部会出现少许白色RNA沉淀;
⑨小心弃去上清液,加入1ml75%的乙醇,轻弹管壁使RNA漂浮起来,7500r/min离心5min,弃上清;
⑩打开离心管盖,室温干燥沉淀几分钟,加入适量的RNase-free水溶解RNA沉淀。-20℃保存备用。
(2)反转录成cDNA
第一链cDNA合成反应步骤
①按照下表配置反应液
cDNA合成反应体系
②65℃保温5min后,冰上迅速冷却。
③按下表配制20μl反应液
cDNA合成反应液的配置
④将上述20ul反应液按照如下条件进行反转录反应
42℃ 60min
70℃ 15min
使酶灭火,冰上放置,之后保存于-20℃备用。
(3)设计引物PCR扩增目的片段
根据基因文库中登录号设计引物如下表,引物送上海捷瑞生物工程有限公司合成。
引物
扩增LKB1目的片段的PCR反应体系及条件分别如下表
PCR扩增LKB1长片段反应体系
PCR扩增LKB1长片段反应条件
(4)PCR产物行琼脂糖凝胶电泳后回收目的片段
1.制胶
①称取一定质量的琼脂粉倒入锥形瓶中,按照0.5%(w/v)的比例加入1×TAE溶液;
②微波炉高火加热溶解琼脂粉,每次1min,重复3次,直至完全溶解;
③取出锥形瓶室温冷却至50℃左右,向琼脂糖凝胶中滴入溴化乙锭溶液(使终浓度为0.5ug/ml);
④将制胶梳子插于制胶模板中,使梳子底部与模板有2mm间隙,将溶解充分的胶缓慢均匀倒入模板中,室温冷却30min,使琼脂糖凝胶冷却成型,取下凝胶切割成适当大小,保存于TAE溶液中。
2.电泳
①点样:制好的胶放入电泳槽中,将PCR产物与上样缓冲液按比例混和均匀后点入加样孔,并将5ul DNA Marker加于胶最左边的孔;
②电泳:设置电压为120V,电泳20min;
③取出凝胶于紫外线投射仪下切取目的片段。
(5)胶回收目的片段
①将切取的含目的片段的凝胶放于一只洁净EP管中,称取凝胶质量并换算成凝胶体积,100mg=100ul,加入3倍于凝胶体积的Buffer DE-A溶液;
②将含有凝胶的溶液放于75℃水浴锅中加热融化,加热过程中每隔2-3min颠倒混匀EP管,使受热均匀,加快溶解速度;
③加入0.5Buffer DE-A体积的Buffer DE-B溶液,反复颠倒使二者充分混匀;
④将混合液分批次加入制备管中,12000g离心1min,弃滤液;
⑤将制备管放回离心管,加500ul Buffer W1,12000g离心30s,弃滤液;
⑥将制备管放回离心管,加700ul Buffer W2,12000g离心30s,弃滤液。重复一次;
⑦将制备管放回离心管,12000g离心1min;
⑧将制备管置于新的洁净的EP管中,在膜上滴加20ul去离子水,室温静置1min,12000g离心1min洗脱DNA目的片段。
2.pCMV-blank质粒的扩增和提取
扩增质粒:
①将冻存的含真核表达载体pCMV-blank的菌株由冰箱取出,室温溶解;
②取200ul冻存菌液,加入Kana的LB溶液中;
③37℃振荡培养箱过夜培养16h。
提取质粒:使用天根的小提中量试剂盒
①柱平衡:向吸附柱CP4中加入500μl的平衡液BL,12000rpm离心1min,倒掉收集管中的液体,将吸附柱重新放回收集管中;
②取15ml培养16h的菌液进行离心,12000rpm离心1min,弃上清并用枪头小心吸干上清液,获细菌沉淀;
③加500μl溶液P1至有菌体沉淀的离心管中,并将细菌沉淀用移液枪彻底悬浮;
④加入500μl溶液P2至上述离心管中,温和地上下翻转6-8次使菌体充分裂解。注意:此步一定要温和而充分地混合溶液,且停留时间不能超过5min;
⑤加入700μl溶液P3至上述离心管中,立即温和地上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀。12000rpm离心10min,此时在离心管底部会形成沉淀;
⑥将上一步收集的上清液分次加入吸附柱CP4中(吸附柱放入收集管),12000rpm离心1min,倒掉收集管中的液体,将吸附柱CP4放入收集管中;
⑦加入0.6ml漂洗液PW至吸附柱CP4中,12000rpm离心1min,倒掉收集管中的液体,将吸附柱CP4放入收集管中;
⑧吸附柱CP4放入收集管中,再次12000rpm离心2min,目的是将吸附柱中残余的漂洗液去除,排除对后续实验的影响;
⑨将吸附柱CP4放于一干净的离心管中,向吸附膜的中间部位悬空滴加100-300μl洗脱液,室温放置2-5min,12000rpm离心2min,将质粒溶液收集到离心管中;
⑩测定质粒浓度后,将质粒浓度标记在EP管上,-20℃保存备用。
3.克隆载体pMD18-LKB1
(1)连接反应
①在微量离心管中配置下列连接反应体系,用于T-Vector和目的片段的连接,如下表。
载体与目的片段连接反应体系
②上述反应液配置好后,添加与上述总体积一样的Solution I;
③16℃反应3h后放入4℃冰箱过夜,次日进行转化反应。
(2)转化反应
①取上述连接反应液,轻柔缓慢地加入提前准备好的感受态细胞(约100ul)中,轻弹管壁使连接反应液与感受态细胞混合均匀,冰上冷却30min;
②热击:将感受态细胞放入42℃恒温水浴锅,热击90s;
③迅速将其插入冰中进行冷却,约5min左右;
④扶壮:向感受态细胞中加入900ul的新鲜LB溶液,盖紧管盖于37℃孵箱扶壮2h;
⑤涂板:取200ul扶壮后菌液涂布于含x-Gal、IPTG、AMP的LB琼脂平板上,菌液晾干后于37℃倒置过夜;
⑥约24小时,观察菌落的长出情况,挑取理想菌落进行鉴定。
(3)菌落鉴定
①从上述平板上挑取几株单个菌落,接种于LB(AMP+)溶液中,37℃震荡培养过夜;
②提取质粒(详细方法见上),以质粒为模板进行PCR;
③质粒PCR反应体系及反应条件分别如下表。
质粒PCR反应体系
质粒PCR反应条件
④电泳:将以上几管PCR产物进行琼脂糖凝胶电泳,挑选出含有目的条带的样品。
⑤送样检测:把含目的条带的质粒送北京金维智科学技术有限公司进行序列测定并明确目的片段插入方向。
4.重组真核表达载体pCMV-LKB1
双酶切反应:
根据真核表达载体pCMV-Blank和含目的片段的pMD18-T的酶切位点分布图及LKB1基因三者所不包含的酶切位点的情况汇总,分别将真核表达载体pCMV-Blank和pMD18-T-LKB1行双酶切反应,选取酶切位点为Sal I和EcoR I,酶切反应体系如下表。
重组质粒酶切反应体系及条件
(5)电泳、胶回收、连接、转化和菌株鉴定
①电泳:将以上酶切得到的反应液行琼脂糖凝胶电泳,分离出目的条带。
②胶回收:在紫外线投射仪下切取目的片段,进行胶回收,获得目的片段。
③连接:将双酶切完成的pCMV-Blank和两端带相应酶切位点的LKB1片段在T4连接酶作用下,16℃连接过夜,16h。
④转化后,继续培养。
⑤挑取单个菌落在LB溶液中扩增。
⑥PCR后将可扩增出目的片段的质粒送往北京金维智公司进行测序。
⑦将重组质粒测序结果与NCBI公布的LKB1基因的核酸序列进行比对,显示目的片段与NCBI公布的完全一致,提示真核表达载体pCMV-LKB1构建成功。
下面结合重组真核表达载体pCMV-LKB1在肿瘤细胞中的表达及对肿瘤细胞的作用对本发明的应用效果作详细的描述。
1.细胞转染及稳定表达LKB1细胞株的筛选
用含10%胎牛血清的RPMI/1640培养液培养PGCL3细胞于37℃、含5%CO2的细胞培养箱内,每2-3天更换培养液,当细胞生长至90%汇合度时用0.25%胰酶消化,传代至新培养瓶中。当细胞生长至对数期且汇合度达80%时,将真核表达载体pCMV-LKB1与转染试剂Lipofect2000以2:1比例混合转染至细胞。转染后24h将细胞消化平铺至六孔板行G418压力筛选,经筛选获得稳定表达LKB1的细胞株,扩增培养后做细胞迁移、侵袭以及提取细胞总蛋白等实验。
2.免疫印迹法(Western Blotting,WB)检测细胞中各蛋白表达水平
A.免疫印迹细胞样品制备
①待处理的25cm2培养瓶的细胞,弃去生长培养基,PBS冲洗2次,放于冰上。
②按0.75ml/瓶RIPA加入细胞裂解液,裂解液使用前按10ul/ml的比例加入PMSF,用枪反复吹打细胞后收集到1.5mlEP管中,放于冰上继续裂解30min,在此期间,补加一次PMSF。
③14000r/min离心5min后收集上清,将上清煮沸5min。
④测定蛋白浓度后,按比例加入4×SDS上样缓冲液,-20℃保存备用。
B.免疫印迹步骤
配胶
按照下表配方配置分离胶和浓缩胶,浓度分别为12%和3.9%。
①加6.5ml配置好的分离胶至胶槽;
②加满异丙醇使分离胶与空气隔绝,并使胶平面压平;
③室温25min左右,胶完全凝固后倾去异丙醇,用双蒸水冲洗胶槽滤纸吸干水分;
④加入2.5ml浓缩胶灌满胶槽,插入1.5mm厚的梳子,待胶完全凝固后拔去;
⑤加满电泳缓冲液,并反复冲洗泳道;
12%的聚丙烯酰胺分离胶和3.9%的聚丙烯酰胺浓缩胶配方
根据每种蛋白在细胞中含量的不同,加入不同量蛋白样品,并加5ul的蛋白预染Marker,进行聚丙烯酰胺凝胶电泳。
电泳浓缩胶胶段,电压40V、50min,进行蛋白样品的浓缩,使溴芬蓝指示剂电泳到浓缩胶与分离胶的交界处,改为恒压80V进行电泳,开始分离蛋白样品,直到溴芬蓝电泳至凝胶底部。
转膜将分离胶中的蛋白质转印到PVDF膜上:从胶槽中卸下凝胶,切去浓缩胶后将SDS-PAGE凝胶与PVDF膜贴一起,顺序分别为负极(黑色)→海绵→滤纸→凝胶→PVDF膜→滤纸→凝胶→海绵→正极(红色),PVDF膜在使用前需要用甲醇活化5-10min。恒流220mA,转膜1h 45min。
封闭转膜结束后,取出PVDF膜,放于用5%TBST配置的脱脂奶粉中室温封闭1h。
孵育一抗封闭结束后,取出PVDF膜,加入适量比例稀释的一抗(羊抗兔),于4℃过夜。
洗膜取出PVDF膜,用TBST洗膜3次、每次15min。
孵育二抗加入适量已经稀释的二抗(山羊抗兔)(稀释比例为1:5000),室温孵育2h。
洗膜取出PVDF膜,用TBST洗膜3次、每次15min。
曝光、显影取出PVDF膜放于保鲜膜上,滴加发光液,观察是否有荧光出现,并及时对胶片进行曝光。取出曝光完成的胶片,先后放于显定影液中进行显影和定影并用清水冲洗显定影完成的胶片。
C.LKB1蛋白表达结果:
与两对照组相比,PGCL3-LKB1组中LKB1表达显著增加,空质粒组与空白对照组相比,LKB1表达基本不变,提示LKB1在PGCL3细胞中成功高表达。如图2。
3.Transwell小室法检测细胞的迁移侵袭能力
1.对细胞进行饥饿处理
实验前12h,饥饿处理细胞,更换成无血清培养基,常规培养至实验开始。使细胞具备感知营养的能力,更有动力穿过Transwell小室膜。饥饿处理后的细胞消化并计数,制成相同浓度的细胞悬液备用。
2.Martigen基质胶的准备及侵袭实验铺胶
①取出冻存于-20℃的Martigen人工基质胶,放于4℃冰箱充分冻融。
②将需使用的枪头、Transwell小室、1.5mlEP管提前放于-20℃冰箱预冷。
③将Martigen人工基质胶和RPMI/1640溶液按照1:8的比例进行混合,此操作步骤在冰上进行。
④按照100ul/孔混合液垂直滴加到Transwell小室上室,放于37℃细胞培养箱、1h,使胶凝固。
⑤取出Transwell小室,吸取上层培养液,放于24孔板中备用。
3.LKB1对PGCL3迁移的影响
用Transwell小室检测各组转染细胞迁移能力,结果显示与对照组相比,PGCL3-LKB1组细胞迁移能力显著下降;而空白对照组和阴性对照组细胞迁移力无变化,如图3所示,提示LKB1可显著抑制PGCL3细胞的迁移力。
4.LKB1对PGCL3侵袭的影响
转染LKB1后用Transwell小室检测细胞侵袭能力,结果显示与对照组相比,转染pCMV-LKB1组细胞的侵袭能力显著下降;而空白对照组与转染空质粒组细胞侵袭力无显著性差异,如图4所示,提示LKB1可显著抑制PGCL3细胞的侵袭力。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 带Flag标签的LAMP1真核表达载体及其在溶酶体分离中的应用
- 带ha标签的lamp1真核表达载体及其在溶酶体分离中的应用
- 重组人cc16基因、其真核表达载体的构建及重组蛋白的纯化的制作方法
- pVAX-PTX3真核表达载体、构建方法及所表达的PTX3蛋白对猪链球菌2型的抗菌应用
- 作为体外检测试剂的真核通用表达载体系统及其构建方法
- 人胱抑素c真核表达载体的构建及其表达、纯化的制作方法
- 一种标记细胞骨架蛋白的多肽及其真核表达载体的制作方法
- hALR基因微环真核表达载体在降低肝脏胶原蛋白合成方面的应用的制作方法
- 重组肿瘤抑素-肿瘤坏死因子分泌型真核表达载体及其制备方法和用途的制作方法
- 人ski基因真核表达载体、制备方法及其应用的制作方法