一种β‑木糖苷酶体内酶聚集体及其制备方法与流程
本发明属于生物工程、生物催化领域。本发明具体涉及一种通过在β-木糖苷酶(ThXylC)末端添加双亲短肽,大幅度提高该β-木糖苷酶比酶活、催化效率和热耐受性的方法。
背景技术:
工农业生产中常常需要热耐受性较好的酶作为催化剂进行反应。这是因为与常温酶相比,热耐受性好的酶具有如下优势:(1)反应速率加快;根据范霍夫规律(van’t Hoff),在适宜的温度范围内,温度每升高10℃,反应速率响应提高2-4倍。(2)催化过程在高温下进行,能改善底物如淀粉、纤维素、脂类等的溶解性和可利用性,降低化合物的粘度而有利于物质扩散和混合;(3)在反应温度高于50℃时,大大减少了杂菌生长的机会,从而减少了微生物对产物的污染,有利于简化产物分离步骤。基于上述优点,热耐受性好的酶在食品、化工、制药、能源开发和环境保护等领域都具有广阔的应用前景。
通常来讲,获得热耐受性良好的酶的方法有3种,(1)从天然极端微生物中筛选获得(Sharma PK,et al,Gene 2012,491:264-271),(2)采用基因工程方法,如定点突变、定向进化、饱和突变等方法,获得酶突变体(Li S,et al,Comput Struct Biotechnol J.2012,2:e201209017)(3)采用酶固定化等工程方法,提高酶催化过程的稳定性(K.Steiner and H.Schwab,Comput.Struct.Biotechnol.J.2012,2,e201209010)。此外,近年来有报道通过在目标酶的N端或C端融合表达某类双亲短肽例如口蹄疫病毒衣壳蛋白VP1、人β-淀粉样蛋白Aβ42(F19D)(García-Fruitós,Elena,et al.Microbial Cell Factories4.1(2005):207-219),麦芽糖结合蛋白突变体(Arie JP,Miot M,Sassoon N,Betton JM:Mol Microbiol 2006,62:427-437),纤维素结合域(Nahálka and Jozef.Journal of biotechnology 134.1(2008):146-153.),ELK16、L6KD和18A(Lin Z,Zhou B,Wu W,et al.Faraday discussions,2013,166:243-256.),以优化酶的催化特性。如在单加氧酶(lipoxygenase)的N端融合表达一段自聚集短肽(Self-assembly peptide,SAP),该酶在50℃的热稳定性从10min延长至46min(Lu XY,et al,Appl.Microbiol.Biotechnol.2013,97,9419–9427)。本课题组前期研究中,通过在腈水解酶C端引入18A短肽,也成功的将腈水解酶在50℃的半衰期从13h延长至56h(Yang X,et al,RSC Advances 2014,4:60675-84)。但上述这些通过在目标蛋白末端融合表达短肽的方法,仅能部分提高酶的稳定性,而对酶的最适反应温度并没有影响,也即最适酶促反应温度并没有变化。
技术实现要素:
本发明的目的是提供一种提高β-木糖苷酶热耐受性的方法,此处热耐受性包括酶的最适酶促反应温度和酶的热稳定性。更具体的,本发明通过在β-木糖苷酶的C端或者N端融合表达双亲性短肽ELK16来实现β-木糖苷酶的热耐受性的提高。
本发明的另一目的在于提供一种获得具有较好温度耐受性的β-木糖苷酶活性聚集体的方法。
本发明的目的通过下述技术方案实现:
(1)将连接肽与双亲短肽拼接,构建得到表达载体;所述双亲短肽为ELK16;
(2)将β-木糖苷酶编码基因与上述表达载体连接,转化入受体菌,获得能表达β-木糖苷酶–短肽融合蛋白的工程菌;
(3)将上述工程菌诱导表达,并对细胞进行破壁处理,离心和/或过滤获得沉淀,即获得β-木糖苷酶体内酶聚集体ThXylC-ELK16。
所述表达载体为可在微生物中过量表达的载体。
所述的连接肽序列包括常见的连接融合蛋白表达所用的连接肽,包括但不限于PT-linker(PTPPTTPTPPTTPTPTP)、(GGGGS)3、(Gly)6、(Gly)8、(EAAAK)n(n=1-3)。
所述的连接肽与双亲短肽的拼接顺序可以是连接肽-双亲肽或者双亲肽-连接肽,相应的双亲肽与β-木糖苷酶融合表达,双亲肽可位于β-木糖苷酶的C端或者N端。
所述连接肽与双亲短肽拼接后的核苷酸序列如SEQ ID No:1所示。
所述的β-木糖苷酶基因,并不严格要求恰好为β-木糖苷酶编码基因的开放阅读框,只要该序列插入表达载体可正常转录翻译出β-木糖苷酶编码氨基酸序列即可。优选β-木糖苷酶编码基因的开放阅读框。所述β-木糖苷酶基因可选自,但不限于Thermoanaerobacterium aotearoense SCUT27。
步骤(3)所述的受体菌,只要步骤(1)所述的表达载体可在其体内表达即可,包括但不局限于E.coli DH5α,E.coli JM109,E.coli JM110,E.coli TOP10,E.coli BL21,E.coli BL21(DE3),E.coli BL21(DE3)/pLysS,E.coli BL21Rosetta,E.coli BL21Rosetta(DE3),优选E.coli BL21(DE3)。
步骤(3)所述沉淀采用缓冲液洗涤进行纯化。
步骤(2)所述的转化方法包括但不局限于热激法,CaCl2方法、电转化方法等方法。
步骤(3)所述对细胞进行破壁处理方法,包括但不局限于超声破碎法、高压破碎法、溶菌酶破壁法等,优选超声破碎法。
以对硝基苯基-β-D-木糖苷(pNPX)为底物,测定ThXylC和ThXylC-ELK16的酶促动力学参数的以及进行酶学性质的表征。其反应体系如下:pH为4.0~8.0的缓冲液,初始浓度为1mmol/L~10mmol/L的对硝基苯基-β-D-木糖苷(pNPX),优选为4mmol/L,反应温度为45~85℃,ThXylC和ThXylC-ELK16优选温度分别为65℃和70℃。
所述的缓冲液无特殊要求,只要能有效调节缓冲液pH值即可,所述缓冲液包括但不限于乙酸-乙酸钠缓冲液、磷酸钾缓冲液、磷酸盐缓冲液。优选pH值为6.5的磷酸钾缓冲液。
与现有技术相比,本发明具有如下有益效果:
(1)本发明通过双亲短肽诱导β-木糖苷酶在大肠杆菌体内聚集,通过常规的细胞破碎离心即可获得纯度约95%的活性β-木糖苷酶聚集体。由于本发明活性聚集体具有强的机械操作稳定性,可以承受超声,高压或其他强烈的物理破碎细胞过程,因此可通过简单的细胞破碎、离心操作即可获得纯度较高的蛋白样品,相较于原可溶表达β-木糖苷酶(记为ThXylC)的亲和纯化更为简单。
(2)本发明所得的ThXylC-ELK16相较于ThXylC水溶性较差,有利于长期储存;催化特性得到明显改善,有利于推进β-木糖苷酶的工业应用,具有广阔的应用前景。
(3)相比于常规表达获得的ThXylC,本发明所得ThXylC-ELK16活性酶聚集体,比酶活和催化效率得到了提高,且其热耐受性(包括最适催化反应温度和温度稳定性)也明显提高。
附图说明
图1为pET-ELK质粒示意图。
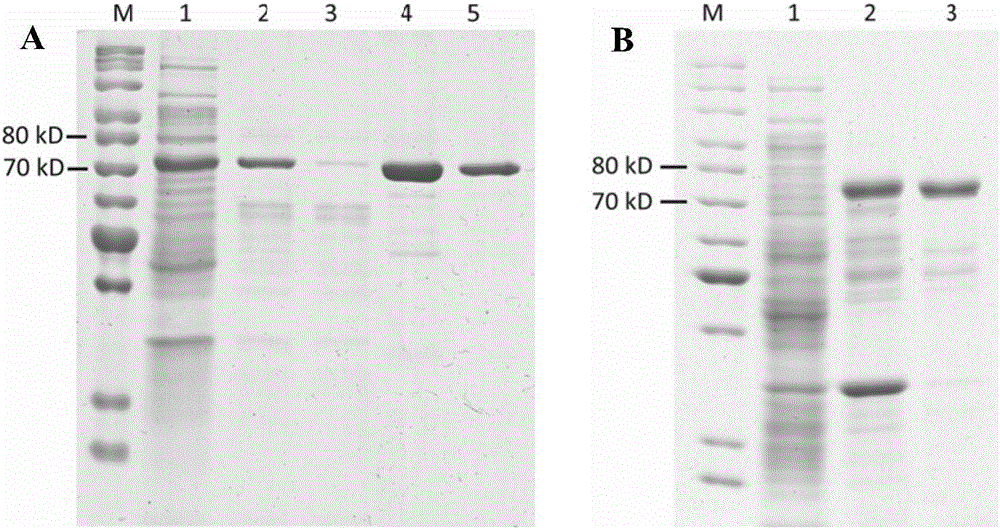
图2 SDS-PAGE分析β-木糖苷酶表达纯化(A)ThXylC蛋白样品,M,蛋白分子量标准;1,E.coli BL21(DE3)/pET-xylC1菌体超声破碎裂解后的粗酶液(上清);2,热处理后的粗酶液;3,镍柱亲和层析的穿过液;4,亲和层析收集得到的样品;5,脱盐后样品。(B)ThXylC-ELK16蛋白样品,M,蛋白分子量标准;1,E.coli BL21(DE3)/pET-xylC2-ELK菌体超声破碎裂解后的上清液;2,超声破碎后的沉淀部分(含目标蛋白);3,缓冲液洗涤2次后获得的ThXylC-ELK16。
图3为本发明ThXylC-ELK16和ThXylC的最适pH曲线。
图4为本发明ThXylC-ELK16和ThXylC的最适酶促反应温度曲线。
图5为本发明ThXylC-ELK16和ThXylC的温度稳定性曲线。
具体实施方式
下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
所采用的β-木糖苷酶基因来源于嗜热厌氧杆菌Thermoanaerobacterium aotearoense SCUT27,其基因在GenBank数据库ID为KX372717。下述实施例中有未注明具体条件的实验方法,则是按照常规的分子克隆手册所述的条件进行操作。
实施例1
含有编码短肽的表达载体的构建
根据ELK16的氨基酸序列(LELELKLKLELELKLK,见SEQ ID:2),在基因合成公司合成相应含终止密码子的DNA序列。其中在ELK16序列上游引入PT-linker(PTPPTTPTPPTTPTPTP)序列,并在合成序列两端引入HindIII和XhoI酶切位点,完整的基因序列见SEQ ID:1。以质粒pET-30a(+)为基本质粒,用HindIII和XhoI双酶切,连接入相应酶切的ELK16DNA序列,连接产物转化至E.coli DH5α感受态细胞,通过菌落PCR、酶切及测序分析鉴定阳性转化子,得到表达载体pET-ELK,如图1所示。
实施例2
β-木糖苷酶表达菌株的构建
1.β-木糖苷酶基因的扩增
以Thermoanaerobacterium aotearoense SCUT27的基因组DNA为模板,扩增β-木糖苷酶基因(GenBank:KX372717),所用的PCR引物如下:
XylC-F:5′-TCGGCTCATATGGAATACCATGTGGCTAAAA-3′(见SEQ ID:3),下划线碱基为NdeI酶切位点。
XylC-R:5′-TAGCAACTCGAGAGAAGAGCCCCAAACTTTTATGTAATTATTTCCT-3′(见SEQ ID:4),下划线碱基为XhoI酶切位点。
XylC-E-R:5'-CTGTTCAAGCTTCCAAACTTTTATGTAATTATTTCCT-3'(见SEQ ID:5),下划线碱基为HindIII酶切位点。
分别用引物对XylC-F/XylC-R和XylC-F/XylC-E-R扩增获得长度约为2kb的β-木糖苷酶基因xylC1和xylC2。
2.重组表达载体构建
将纯化的PCR产物xylC1和pET30a(+)分别用Nde I和XhoI进行双酶切,酶切产物经纯化、连接后转入受体菌E.coli BL21(DE3),获得β-木糖苷酶常规表达菌E.coli BL21(DE3)/pET30-xylC1。
将纯化的PCR产物xylC2和pET-ELK分别用Nde I和HindIII进行双酶切,酶切产物经纯化、连接后转入受体菌E.coli BL21(DE3),获得β-木糖苷酶聚集体表达菌E.coli BL21(DE3)/pET30-xylC2-ELK。
实施例3
常规表达的可溶β-木糖苷酶(ThXylC)和活性β-木糖苷酶聚集体(ThXylC-ELK16)的获得。
将过夜培养的重组工程菌E.coli BL21(DE3)/pET-xylC1和E.coli BL21(DE3)/pET30-xylC2-ELK以1:100比例分别接种于含有50μg/ml卡那霉素的新鲜LB液体培养基中,在37℃、250rpm条件下培养至菌体密度OD600约为0.5-0.7,加入终浓度1mmol/L的IPTG诱导β-木糖苷酶的表达,随后在于30℃、180rpm条件下继续培养24小时。
在4℃、8000g条件下离心收集菌体,每1g湿菌加入10ml的PB缓冲液(50mmol/L磷酸盐缓冲液,50mmol/L氯化钠,pH 7.5)重悬,超声破碎细胞。15000g高速离心20分钟。
对E.coli BL21(DE3)/pET-xylC1,离心后弃去沉淀,上清部分首先在65℃条件下保温30min以失活热不稳定蛋白样品,样品离心后上清采用常规镍柱亲和层析纯化和脱盐方法,获得纯化的常规β-木糖苷酶(记为ThXylC,图2A)。各步骤纯化蛋白样品回收率如表1所示。
表1ThXylC蛋白样品纯化
对E.coli BL21(DE3)/pET30-xylC2-ELK菌体裂解液,离心后弃去上清,沉淀部分样品进一步采用如下步骤进行纯化(图2B):如表2所示。
(1)用与细胞重悬等体积(每1g湿重细胞用10ml PB buffer重悬)的PB buffer(pH 7.5)充分重悬洗涤沉淀,置冰上10min;
(2)15000g,4℃离心25min,去尽上清;
(3)重复一次步骤1、2;
(4)用适量100mmol/L磷酸钾缓冲液(pH 6.5)重悬沉淀,4℃保存。
表2ThXylC-ELK16蛋白纯化
此处所得的即为具有催化活性的β-木糖苷酶聚集体ThXylC-ELK16。
实施例4
β-木糖苷酶的酶促动力学研究
酶动力学研究以对硝基苯基-β-D-木糖苷(pNPX)为底物测定实施例3中所得的ThXylC和ThXylC-ELK16的酶动力学参数。具体方法为:在170μl pH6.5的100mmol/L的磷酸钾缓冲液中添加20μl的pNPX至终浓为1mmol/L~10mmol/L,加入10μL酶液,65℃反应5min后,快速加入600μL 1M Na2CO3终止反应。在405nm测定吸光度值,通过查询对硝基苯酚(pNP)与A405之间的标准曲线,获得所催化生成的pNP量。
β-木糖苷酶活力单位定义为(U)1min催化释放1μmol pNP所需要的酶量。
根据米氏方程计算所得ThXylC和ThXylC-ELK16的酶动力学参数如表3所示。
表3不同表达形式β-木糖苷酶酶动力学参数
实施例5
β-木糖苷酶酶学性质的表征
1.最适反应pH的研究
pH 4.0-5.5:由100mmol/L乙酸-乙酸钠缓冲液配制。
pH 5.5-8.0:由100mmol/L磷酸钾缓冲液配制。
分别在不同pH缓冲液中测定纯化的ThXylC和ThXylC-ELK16酶活。分别以其在pH 6.5条件下的酶活为100%,结果如图3所示。ThXylC和ThXylC-ELK16最适反应pH都为6.5,且ThXylC-ELK16在极端pH条件下,相较于ThXylC有较高的催化活力。
2.最适反应温度的研究
在不同温度下测定实纯化的ThXylC和ThXylC-ELK16酶活。分别以其最高催化酶活为100%,结果如图4所示,ThXylC的最适反应温度为65℃,而ThXylC-ELK16最适反应温度提高至70℃。且在高温区(70℃-80℃),ThXylC-ELK16相较于ThXylC明显具有更高的催化酶活。
3.温度稳定性的研究
将纯化的ThXylC和ThXylC-ELK16分别在65℃和70℃条件下保温不同时间测定残余酶活,分别以其保温初始酶活为100%,结果如图5所示。ThXylC在65℃条件下保温48h酶活保留率约为27.5%,而在70℃条件下保温6h左右,酶活就已几乎完全丧失。而β-木糖苷酶的活性聚集颗粒ThXylC-ELK16在65℃条件下保温48h,酶活保留率仍达到55%,且其在70℃条件下保温48h,残余酶活仍有27.8%。
由上述实验结果可见,在β-木糖苷酶(ThXylC)C端添加双亲短肽ELK16所得的β-木糖苷酶活性聚集体颗粒(ThXylC-ELK16),其催化效率(比酶活、Kcat/Km)热耐受性(最适催化反应温度和热稳定性)都得到了明显的提高,为其进一步的工业化推广应用提供了应用基础。
- 还没有人留言评论。精彩留言会获得点赞!