用于检测猪Delta冠状病毒抗体的多肽、制备方法及其应用与流程
本发明涉及生物技术领域,具体涉及用于检测猪Delta冠状病毒抗体的多肽、制备方法及其应用。
背景技术:
冠状病毒目前有四个亚群,分别为Alpha、Beta、Gamma和Delta冠状病毒。猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)均属于Alpha亚群,Delta亚群最初只在禽类体内发现,猪源Delta冠状病毒(Deltacoronavirus,缩写为PDCoV)是一种新型的猪源肠道冠状病毒,最早在2012年香港的一次监测调查中识别发现,2014年2月,在美国俄亥俄州和印第安纳州第一次检测出PDCoV。猪源PDCoV属于冠状病毒科冠状病毒属,是具有囊膜的单股正链RNA病毒,其基因组全长约25kb,编码四种主要的结构蛋白:纤突(S)蛋白,囊膜(E)蛋白,膜(M)蛋白和核衣壳(N)蛋白。PDCoV能导致感染猪出现呕吐、腹泻和脱水等症状,哺乳仔猪发病率较高,威胁着猪群的健康,对养殖业造成了严重的经济损失。
目前,针对PDCoV或其抗体的检测方法尚处于发展阶段,操作复杂、耗时长、灵敏度较低、特异性较低、准确性较低。
技术实现要素:
本发明的主要目的是提供用于检测猪Delta冠状病毒抗体的多肽,免疫反应性良好,用于检测猪Delta冠状病毒时,特异性、敏感性高、准确性高。
本发明的另一目的是提供所述多肽的制备方法,采用该方法能够大量可溶性表达该多肽,且免疫反应性良好。
本发明的再一目的是提供检测猪Delta冠状病毒抗体的试剂盒,操作简单、耗时短、特异性高、敏感性高、准确性高、重复性好。
本发明的目的采用如下技术方案实现。
本发明提供一种用于检测猪Delta冠状病毒抗体的多肽,其氨基酸序列如SEQ ID NO:1所示。
本发明还提供所述多肽的制备方法,包括将含有所述多肽编码基因的重组菌在35-40℃条件下采用IPTG诱导表达的步骤,所述重组菌是将所述多肽编码基因插入pcold 1质粒后导入大肠杆菌获得的。
在本发明中,以猪Delta冠状病毒的RNA为模板,通过RT-PCR方法扩增获得所述多肽的编码基因。
优选的技术方案中,将所述多肽编码基因插入pcold 1质粒中BamH I和Sal I两个酶切位点之间。
优选的技术方案中,所述重组菌在35-40℃条件下培养后再进行诱导表达。
本发明还提供包括采用所述多肽包被的ELISA板条。
在本发明中,所述试剂盒还包括洗涤液、血清稀释液、底物显色液、羊抗猪酶标二抗、终止液、PDCoV阳性血清和PDCoV阴性血清。
在本发明中,血清稀释液是2%脱脂乳粉水溶液,终止液是浓度为2M的H2SO4水溶液,洗涤液是添加有0.05%吐温-20的0.01M、pH7.4磷酸盐缓冲液。
本发明用于检测猪Delta冠状病毒抗体的多肽(多肽A),仅是PDCoV核衣壳(N)蛋白的部分序列,通过Western Blot实验证明免疫反应性良好。用于检测猪Delta冠状病毒时,特异性、敏感性、准确性高。发明人采用了多种表达载体对多肽A进行表达,发现使用常规的载体常规方法并不能够表达该蛋白,例如采用PET-28a载体在37℃条件下诱导未能成功表达多肽A;采用pcold 1载体在常规的诱导温度(16℃)未能成功表达多肽A,只有在37℃条件下才实现了多肽A的可溶性表达,且表达的多肽A易于纯化,免疫反应性良好。本发明检测猪Delta冠状病毒抗体的试剂盒,操作简单、耗时短、特异性高、敏感性高、重复性好。由于本发明试剂盒采用重组多肽A作为包被抗原,其浓度易于确定与控制,有利于该试剂盒的大量生产与成本控制。
附图说明
图1 PET-28a-N重组质粒酶切鉴定电泳图。1-3:成功构建的PET-28a-N重组质粒
图2 PET-28a-N/BL21菌液表达情况的SDS-PAGE电泳图。1:导入PET-28a空载体的重组菌(未诱导);2:导入PET-28a空载体的重组菌(诱导);3:PET-28a-N/BL21菌液(未诱导);4-6:诱导6h的PET-28a-N/BL21菌液
图3 pcold 1-N/BL21菌液在16℃诱导后的SDS-PAGE电泳图。1:导入pcold 1空载体的重组菌(未诱导);2:导入pcold 1空载体的重组菌(诱导);3:pcold 1-N/BL21菌液未诱导;4-6:在16℃诱导12h的pcold 1-N/BL21菌液
图4 pcold 1-N重组质粒的酶切鉴定电泳图。M:DL 10000Marker;1:未构建成功的重组质粒;2:成功构建的pcold 1-N重组质粒;3:未构建成功的重组质粒。
图5多肽A的诱导表达。M:蛋白Marker;1:导入pcold 1空载体的重组菌(未诱导);2:导入pcold 1空载体的重组菌(诱导);3:pcold 1-N/BL21菌液未诱导;4-9:在37℃条件下诱导培养1-6h的pcold 1-N/BL21菌液。
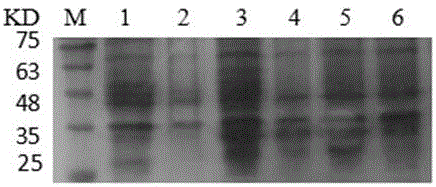
图6 Western Blot鉴定。M:蛋白Marker;1:纯化后的多肽A。
图7多肽A可溶性表达鉴定。M:蛋白Marker;1:在37℃条件下诱导培养1-6h的pcold 1-N/BL21全菌;2:在37℃条件下诱导培养1-6h的pcold 1-N/BL21裂解液上清;3:在37℃条件下诱导培养1-6h的pcold 1-N/BL21裂解液沉淀。
图8纯化后的多肽A的SDS-PAGE电泳图。M:蛋白Marker;1-2:纯化后的多肽A。
通过下列实施例将更具体的说明本发明,但是应理解所述实施例尽是为了说明本发明,而不是以任何方式限制本发明的范围。
具体实施方式
实施例1
通过比对已经公开发表的猪Delta冠状病毒N蛋白的氨基酸序列,发现如SEQ ID NO:1所示多肽的同源性较大,将该多肽命名为多肽A。通过重组表达方法制备的多肽A具有良好的免疫反应性。
1.多肽A编码基因的获得
根据多肽A的氨基酸序列,得到其对应的DNA序列,使用Primer 5.0软件设计引物PDCoV-NF和PDCoV-NR扩增多肽A编码基因。引物的具体序列如下:
PDCoV-NF:5’-TTTGGATCCAACTCCGCCATCAAACCCGTT-3’;
PDCoV-NR:5’-TGTGTCGACTGAACACCAGGCACATGTCT-3’。
引物中划线的部分分别为BamH I与Sal I酶切位点。
提取猪Delta冠状病毒的总RNA,以取得的总RNA为模板,使用One-stepRT-PCR SuperMix试剂盒(购自TransGen Biotech),采用PDCoV-NF和PDCoV-NR为引物,扩增多肽A的编码基因。RT-PCR的反应参数是:45℃,30min;94℃,5min;94℃30s,60℃30s,72℃1min,共35个循环;最后72℃延伸10min。PCR产物用1%琼脂糖凝胶电泳进行检测。
将多肽A编码基因扩增片段与pMD19-T载体,在4℃连接过夜。连接产物转化Trans5α感受态细胞,并涂布至氨苄青霉素抗性的LB平板,37℃培养过夜。挑取单克隆,于氨苄青霉素抗性的LB培养基中振荡培养8h后,提取质粒,酶切鉴定。将初步鉴定为阳性的菌液进行测序。选取测序正确的重组质粒,命名为pMD19-T-N质粒。
2.多肽A的制备
(1)试用PET-28a载体进行原核表达:将pMD19-T-N质粒和PET-28a载体分别采用BamH I酶和Sal I酶进行双酶切,然后将两酶切片段相连,将多肽A编码基因插入PET-28a载体内,获得重组表达质粒PET-28a-N,经双酶切鉴定为阳性质粒(图1)。将质粒PET-28a-N转化BL21(DE3)感受态细胞,获得重组菌PET-28a-N/BL21。将重组菌PET-28a-N/BL21于37℃培养,待OD600值达到0.6时,加入终浓度为1μmol/L的IPTG在37℃条件下进行诱导表达,收集诱导表达后6h的菌体,进行SDS-PAGE电泳鉴定。结果未表达出目的蛋白(图2)。
(2)试用PET-32a载体进行原核表达:将pMD19-T-N质粒和PET-32a载体分别采用BamH I酶和Sal I酶进行双酶切,然后将两酶切片段相连,将多肽A编码基因插入PET-32a载体内,获得重组表达质粒PET-32a-N,经双酶切鉴定为阳性的质粒转化BL21(DE3)感受态细胞,获得重组菌PET-32a-N/BL21。将重组菌PET-32a-N/BL21于37℃培养,待OD600值达到0.6时,加入终浓度为1μmol/L的IPTG在37℃条件下进行诱导表达,收集诱导表达后6h的菌体,进行SDS-PAGE电泳鉴定,结果未表达出目的蛋白。
(3)试用pcold 1载体,在16℃下诱导表达:将pMD19-T-N质粒和pcold 1载体分别采用BamH I和Sal I进行双酶切,然后将两个酶切片段相连,连接产物转化Trans5a感受态细胞,常规化选取阳性克隆,提取菌体质粒酶切鉴定(图4)。取阳性质粒,命名为pcold 1-N重组质粒。将重组表达质粒pcold 1-N转化BL21(DE3)感受态细胞,获得阳性重组菌pcold 1-N/BL21。将pcold 1-N/BL21在37℃条件下培养至OD600值达到0.6时,加入终浓度为1μmol/L的IPTG,在16℃条件下进行诱导表达,收集诱导表达后的菌体,进行SDS-PAGE电泳鉴定。结果未表达出目的蛋白(图3)。
(4)试用pcold 1载体,在37℃温度下诱导表达:将阳性重组菌pcold 1-N/BL21在37℃条件下培养至OD600值达到0.6时,加入终浓度为1μmol/L的IPTG,在37℃条件下进行诱导表达,每隔1h取1ml菌液,至诱导后6h。将收集到的菌液4℃、12000r/min离心1min收集沉淀。每管沉淀用100微升的PBS悬起后加入25μl SDS-PAGE上样缓冲液,沸水浴10min,用SDS-PAGE电泳分析。从SDS-PAGE电泳结果(图5)可见,有大量分子量约为28kD的蛋白被表达,与预测的多肽A加his-tag大小一致,说明多肽A在大肠杆菌中成功表达。
取37℃诱导6h的pcold 1-N/BL21菌液1ml,12000rpm离心1min,用100μL PBS缓冲液重悬菌体。超声破碎,离心分离上清液与包涵体。用100μl PBS缓冲液重悬包涵体沉淀,加入25μl SDS-PAGE上样缓冲液,沸水浴10min,进行SDS-PAGE电泳。电泳结果(图7)可见大量多肽A在上清液中表达,即多肽A实现了可溶性表达。
(5)制备多肽A:将3mL pcold 1-N/BL21菌液加入到300mL氨苄青霉素抗性的LB培养基中,在37℃条件下活化培养,当OD600=0.6时,加入终浓度为1μmol/L的IPTG,在37℃条件下诱导6h,诱导后的菌液8000r/min离心10min后获得菌体沉淀,重悬菌体,超声波破碎后离心取上清,采用His标签的Ni柱纯化重组多肽A。纯化后的多肽A蛋白浓度为372.9μg/mL,共获得1.85mg纯化后的多肽A。经SDS-PAGE检验,纯度约为100%(图8),可见多肽A易于制备与纯化。
3.重组多肽A的Western Blot实验
将纯化后的多肽A进行SDS-PAGE电泳,不染色,使用转印装置转印到硝酸纤维素滤膜(NC膜)上,将NC膜取出后放入封闭液中(含3%-5%脱脂奶粉的TBST缓冲液),4℃封闭过夜。封闭后放入TBST缓冲液中洗3次,每次10min。将NC膜放入用TBST以1:5000稀释的His-Tag mAb(组氨酸标记的单克隆抗体,购自武汉博士德生物工程有限公司)中,在摇床上室温低速孵育2h,取出NC膜TBST缓冲液洗3次,每次10min。将NC膜放入用TBST以1:10000稀释的HRP标记的羊抗鼠IgG中(购自武汉博士德生物工程有限公司),室温低速孵育1h,取出NC膜TBST缓冲液洗3次,每次10min。采用增强型ECL化学发光检测试剂盒(Vazyme公司)进行显色。结果如图6,凝胶上在大约28KD大小的位置,出现一条特异性条带,证明该蛋白是His标签的蛋白质,且多肽A具有良好的免疫反应性。
实施例2检测猪Delta冠状病毒抗体的试剂盒
试剂盒组成:洗涤液、血清稀释液、终止液、底物显色液、羊抗猪酶标二抗、PDCoV阳性血清和PDCoV阴性血清、ELISA板条。
(1)洗涤液
洗涤液配制方法:在0.01M、pH7.4磷酸盐缓冲液中添加终浓度为0.05%(体积百分浓度)的吐温-20。称取KH2PO40.2g,KCl 0.2g,Na2HPO4·12H2O 2.9g,NaCl 8g,溶于水,然后定容至1000mL,得到0.01M、pH7.4磷酸盐缓冲液。在0.01M、pH7.4磷酸盐缓冲液中加入0.5mL吐温-20,得到洗涤液。
(2)血清稀释液:2%脱脂乳粉水溶液,配制方法:在洗涤液中添加终浓度为20g/L的脱脂乳粉后获得的。
(3)终止液:2M硫酸溶液,具体配制方法:11.1mL浓硫酸,用水稀释后定容至100mL。
(4)底物显色液:包括显色液A和B。
显色液A:21mg TMB(3,3',5,5'-四甲基联苯胺,购自BIOSHARP公司)溶于5ml无水乙醇,混匀分装,1ml/支,作为显色液A。
显色液B:33mg UHP(过氧化脲素,购自上海晶纯生化科技股份有限公司)溶于200ml、pH为5.2的磷酸盐缓冲液(取2.7g Na2HPO4·12H2O、13.2g KH2PO4溶于去离子水,定容至500ml),加终浓度为25μg/ml的庆大霉素,用0.22μm滤膜过滤除菌,无菌分装,15ml/瓶,作为显色液B。
在使用前,将显色液A与显色液B按照体积比为1:40进行混合,得到底物显色液。
(5)羊抗猪酶标二抗:HRP标记的羊抗猪lgG,购自BETHYL公司。
(6)PDCoV阳性血清:使用重组多肽A作为抗原,利用Western Blot方法对临床血清进行筛选,选取能够与重组多肽A发生抗原抗体反应的血清。
(7)PDCoV阴性血清:使用重组多肽A作为抗原,利用Western Blot方法对临床血清进行筛选,选取不能与重组多肽A发生抗原抗体反应的血清。
(8)ELISA板条:采用多肽A包被的ELISA板条。
①抗原最适包被浓度和血清最适稀释度的确定
采用方阵滴定法确定抗原最适包被浓度和血清最适稀释度。
将纯化后的多肽A(372.9μg/mL)作为抗原,用包被液(0.05M、pH 9.6的碳酸盐缓冲液)依次做1:20、1:40、1:80、1:160、1:320稀释,各稀释度按100μl/孔滴加到ELISA板条中,4℃包被过夜。弃液,用洗涤液洗三次,200μl/孔,每次3-5min。用封闭液(洗涤液中添加终浓度为5%(质量百分浓度)的脱脂乳粉)按200μl/孔的量封闭1h,弃去封闭液后按上述方法洗涤。将PDCoV阴阳性血清分别用稀释液依次做1:10、1:20、1:40、1:80、1:160稀释,组成方阵,100μl/孔,37℃条件下作用1h,弃液后按上述方法洗涤,加入用稀释液作1:10000稀释的HRP标记的羊抗猪lgG(购自BETHYL公司),100μl/孔,37℃条件下作用1h,弃液,按上述方法洗涤,加入底物显色液,100μl/孔,室温避光显色10min,加入终止液(50μl/孔)终止反应,用酶标仪在450nm波长下读取OD值(OD450值)。比较阴阳性血清的OD450值,选取阳性血清OD450值为1.0左右,阴性OD450值为0.2以下,且阳性与阴性血清OD450值之比(P/N)最大时的抗原包被浓度为抗原最佳包被浓度,对应的阴阳性血清稀释度为血清最佳稀释度。
方阵滴定结果(表1)表明,当抗原以1:80稀释(0.466μg/100μl),血清以1:40稀释时,阳性血清OD450值在1.0以上,阴性血清OD450值在0.2以下,且P/N值较大。因此确定重组多肽A的包被最佳浓度为0.466μg/100μl,血清最佳稀释度为1:40。
表1 ELISA方阵滴定结果
②包被条件的选择
按抗原最佳包被浓度,分别考察下述不同包被条件下的包被效果:4℃包被12h、4℃包被12h后37℃包被1h、37℃包被1h或37℃包被2h。按血清最佳稀释度加入阴阳性血清,其他步骤同标题①中方法,测定OD450并分析P/N变化情况,分析各条件下的包被效果。包被条件最终选择:4℃包被12h后37℃包被1h。
③封闭液的选择
按抗原最佳包被浓度和最佳包被条件包被酶标板,分别用5%脱脂乳粉溶液、1%BSA溶液、1%明胶溶液作为封闭液,封闭1h,封闭液的溶剂为洗涤液。血清按照最佳稀释度稀释,其他步骤同标题①中方法,用阴、阳性血清进行ELISA检测,分析各封闭液的封闭效果。最终选择5%脱脂乳粉溶液为封闭液。
④封闭条件的确定
按照上述优化后的条件,分别在37℃条件下封闭30min、1h、2h或3h,其他步骤同标题①中方法,用阴、阳性血清进行ELISA检测,分析各条件下的封闭效果。最终确定封闭时间为1h。
⑤ELISA板条的制备
在ELISA板条的各孔中,加入100μl多肽A(0.466μg/100μl),在4℃包被12h然后在37℃包被1h;弃液,用洗涤液洗三次,每次洗涤过程中洗涤液加入量为200μl/孔,洗涤时间为3-5min。用封闭液(洗涤液中添加终浓度为5%(质量百份浓度)的脱脂乳粉)按200μl/孔的量在37℃条件下封闭1h,弃去封闭液,按上述方法洗涤,最后用吸水纸拍干,4℃保存,得到ELISA板条。
实施例3试剂盒的使用方法
1.最适抗原抗体反应时间的确定
在ELISA板条中,以最佳稀释度加入100μl/孔PDCoV阴阳性血清后,37℃分别孵育30、45、60或75min,弃液后按上述方法洗涤,加入1:10000稀释的HRP标记的羊抗猪lgG,100μl/孔,37℃条件下作用1h,弃液,洗涤,加入底物显色液,100μl/孔,室温避光显色10min,加入终止液(50μl/孔)终止反应,用酶标仪在450nm波长下读取OD值。评价不同时间的反应效果。最终确定抗原抗体的最适反应时间为30min,此时阳性血清平均值在1.0以上,阴性血清平均值在0.2以下,且P/N值最大。
2.最适二抗工作浓度的确定
在ELISA板条中,以最佳稀释度加入PDCoV阴阳性血清后,37℃孵育30min,弃液后按上述方法洗涤,加入1:5000、1:7500、1:10000、1:15000或1:20000稀释的酶标二抗(HRP标记的羊抗猪lgG),100μl/孔,37℃条件下作用1h,弃液,洗涤,加入底物显色液,100μl/孔,室温避光显色10min,加入终止液(50μl/孔)终止反应,用酶标仪在450nm波长下读取OD值。评价不同时间的反应效果。最终确定二抗最适工作浓度为1:10000,此时阳性血清平均值在1.0以上,阴性血清平均值在0.2以下,且P/N值最大。
3.最佳酶标二抗反应时间的确定
抗原抗体的最适反应时间为30min,二抗最适工作浓度为1:10000,考察HRP标记的羊抗猪lgG在37℃条件下反应时间分别为15、30、45、60min对OD450值的影响,其他步骤同本实施例标题1中方法。最终确定二抗最佳反应时间为30min,此时阳性血清平均值在1.0以上,阴性血清平均值在0.2以下,且P/N值最大。
4.最适显色时间的确定
抗原抗体的最适反应时间为30min,二抗最适工作浓度为1:10000,二抗反应时间为30min,考察显色时间为3、4、5、6、8、10、12或15min对反应效果的影响,其他同本实施例标题1中方法。结果如表2,最佳显色时间为10min,此时,阳性血清平均值在1.0以上,阴性血清平均值在0.2以下,且P/N值最大。
表2 最适显色时间的确定
5.本发明试剂盒的ELISA操作程序的确定
按以上各项所确定的最佳操作条件,确定ELISA操作程序为:取出已包被并封闭好的ELISA板条,用血清稀释液将待检血清做1:40稀释,加入酶标板各孔,每孔100μL,每份待检血清与PDCoV阴性、阳性血清各加2孔,37℃反应30分钟;弃去孔内液体,每孔用200μL洗涤液洗涤3次,每次5分钟,最后一次洗涤完后,在吸水纸上拍打,弃尽孔内液体;每孔加入1:10000稀释的HRP标记的羊抗猪lgG100μL,37℃反应30分钟;弃去孔内液体,每孔用200μL洗涤液洗涤3次,每次5分钟,最后一次洗涤完后,在吸水纸上拍打,弃尽孔内液体;每孔加入100μL底物显色液后,室温避光显色10分钟后,加入终止液50μL/孔终止反应;用酶标仪在450nm波长读取各孔OD值,计算待检血清的S/P值,待检血清的S/P值=(待检血清OD450值-阴性血清OD450值)/(阳性血清OD450值-阴性血清OD450值)。
6.阴阳性临界值的确定
在包被好的ELISA板条中,按本实施例标题5中间接ELISA方法筛选临床血清,选取其中OD450值<0.2的样品血清,计算S/P值,S/P值=(样品血清OD450值-阴性血清OD450值)/(阳性血清OD450值-阴性血清OD450值),计算各血清S/P值的平均值X及标准方差SD,当样品S/P值<X+2SD时,判为阴性;样品S/P值>X+3SD时判为阳性;X+2SD≤样品S/P值≤X+3SD时,判为疑似。
经计算,84份样品血清的S/P值的平均数X=0.126,S/P值的标准方差SD=0.058。因此,X+3SD=0.3,X+2SD=0.242。
当待检血清S/P值<0.242时,判为阴性;待检血清S/P值>0.3时判为阳性;0.242≤待检血清S/P值≤0.3时,判为疑似。
实施例4试剂盒的特异性、敏感性和重复性
1.特异性实验
采用实施例2中试剂盒及实施例3中使用方法,检测已知的CSFV(猪瘟病毒)、PRRSV(猪繁殖与呼吸障碍综合征病毒)、PRV(猪伪狂犬病病毒)、FMDV(口蹄疫病毒)、PCV2(猪圆环病毒2型)、PEDV(猪流行性腹泻病毒)、TGEV(猪传染性胃肠炎病毒)阳性猪血清,每份血清设置3个重复,同时设立PDCoV阴阳性血清对照。测定各孔OD450值,判定其阴阳性,分析该ELISA方法的特异性。
结果表明,采用本发明试剂盒检测PDCoV抗体与其它常见病毒的阳性血清均没有交叉反应,说明本发明试剂盒的特异性较好。
2.敏感性实验
采用实施例2中试剂盒及实施例3中使用方法,将3份PDCoV阳性血清从1:40开始倍比稀释,在酶标仪下测定各孔OD450值,分析本发明试剂盒的敏感性。
结果表明,3份阳性血清分别在血清稀释度为1:640、1:320、1:320时变为阴性,表明本次试验建立的ELISA方法敏感性较好。
3.重复性实验
(1)批内重复实验:
取同批诱导纯化制备的多肽A制备检测PDCoV抗体的试剂盒,在不同时间分别检测8份随机选择的PDCoV抗体水平不同的血清及标准阴阳性血清,测定各孔OD450值,计算各份血清S/P值,以及每份血清S/P值的平均值X,标准差SD,变异系数CV,分析批内重复的效果。
结果如表3,可见8份血清在不同时间检测的变异系数在0.33%~9.47%之间,表明同批多肽A包被的ELISA板在不同时间检测的重复性良好。
表3 批内重复性实验结果
(2)批间重复实验:
使用不同批次诱导纯化制备的多肽A制备试剂盒,同时检测8份随机选择的PDCoV抗体水平不同的血清及标准阴阳性血清。计算各份血清S/P值,以及每份血清S/P值的平均值X,标准差SD,变异系数CV,分析批间重复的效果。
结果如表4,可见8份血清检测结果的变异系数在0.76%~8.83%之间,表明不同批次多肽A作为抗原检测的重复性良好。
表4 批间重复性实验结果
SEQUENCE LISTING
<110> 江苏省农业科学院
<120> 用于检测猪Delta冠状病毒抗体的多肽、制备方法及其应用
<130> 20161111
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 204
<212> PRT
<213> 猪Delta冠状病毒
<400> 1
Asn Ser Ala Ile Lys Pro Val Glu Asn His Gly Tyr Trp Leu Arg Tyr
1 5 10 15
Thr Arg Gln Lys Pro Gly Gly Thr Pro Ile Pro Pro Ser Tyr Ala Phe
20 25 30
Tyr Tyr Thr Gly Thr Gly Pro Arg Gly Asn Leu Lys Tyr Gly Glu Leu
35 40 45
Pro Pro Asn Asp Thr Pro Ala Thr Thr Arg Val Thr Trp Val Lys Gly
50 55 60
Ser Gly Ala Asp Thr Ser Ile Lys Pro His Val Ala Lys Arg Asn Pro
65 70 75 80
Asn Asn Pro Lys His Gln Leu Leu Pro Leu Arg Phe Pro Thr Gly Asp
85 90 95
Gly Pro Ala Gln Gly Phe Arg Val Asp Pro Phe Asn Ala Arg Gly Arg
100 105 110
Pro Gln Glu Arg Gly Ser Gly Pro Arg Ser Gln Ser Val Asn Ser Arg
115 120 125
Gly Thr Gly Asn Gln Pro Arg Lys Arg Asp Gln Ser Ala Pro Ala Ala
130 135 140
Val Arg Arg Lys Thr Gln His Gln Ala Pro Lys Arg Thr Leu Pro Lys
145 150 155 160
Gly Lys Thr Ile Ser Gln Val Phe Gly Asn Arg Ser Arg Thr Gly Ala
165 170 175
Asn Val Gly Ser Ala Asp Thr Glu Lys Thr Gly Met Ala Asp Pro Arg
180 185 190
Ile Met Ala Leu Ala Arg His Val Pro Gly Val Gln
195 200
- 还没有人留言评论。精彩留言会获得点赞!