一种具有抗菌效果的梅花鹿角盘抗菌肽/蛋白及其应用的制作方法
本发明涉及生物蛋白质技术领域,尤其涉及一种具有抗菌效果的梅花鹿角盘抗菌肽/蛋白及其应用。
背景技术:
鹿角盘指的是雄性鹿在锯茸后残留在角柄上的骨化物,到了第二年新茸长出前自动脱落的盘状物质,也命名为“鹿花盘”、“鹿角帽”,主要含有多种必需氨基酸及多种矿物质元素。鹿角盘呈盔状或扁盔状,直径2-5cm,高2-4.5cm,表面为灰黄色或灰褐色,呈蜂窝状,底面较平并富有一定光泽,上部呈现出不规则的半球形形状,质地较为坚硬,颜色呈灰白色。近些年来,对于鹿角盘的成分主要从以下几个部分进行研究,主要是氨基酸、无机元素、蛋白多肽类物质等等,同时也有少量报道称鹿角盘中含有甾体类、多糖类等物质。
相比于分子量较大的蛋白,小分子蛋白及多肽更容易被机体所吸收从而具有更加明显的医疗保健效果,而蛋白质或多肽单体的研究及氨基酸序列的获得可以为蛋白质工程研究与基因工程研究之间搭建桥梁并为蛋白质组学的发展做出贡献,因此,近年来,越来越多的人把对梅花鹿角盘研究的目光集中在了小分子多肽、蛋白多肽单体上。姜薇用5mM的预冷醋酸钠溶液对梅花鹿角盘粉末中的可溶性蛋白进行搅拌提取,并通过醇沉、旋蒸、冻干、葡聚糖凝胶除盐、离子交换层析和高效液相法得到纯化的蛋白单体,电泳检测(SDS-PAGE)显示其相对分子质量大小为17.2kDa,经MALDI-TOF-MS鉴定,确定其为肽聚糖识别蛋白1(PGRP 1),匹配的序列为RLYEIIQ KWPHYRA,将其命名为cnPGRP1,并通过抑菌试验证明其具有明显的抑菌活性(志贺氏菌、金黄色葡萄球菌、酵母菌、大肠杆菌、枯草杆菌)。黄凤杰等人通过pH3.5稀醋酸缓冲液匀浆提取、色谱柱Resource S纯化、Superdex 75凝胶柱层析、反相高效液相等方法得到相对分子质量大小为7.1276kDa的梅花鹿角盘多肽单体,将其给药于KK-ay小鼠观察其降糖活性,并建立胰岛素抵抗模型(利用高胰岛素诱发HepG2细胞),研究该多肽对胰岛素抵抗HepG2细胞糖消耗的影响,结果显示,该多肽既可降低KK-ay小鼠血糖水平,又可显著促进胰岛素抵抗模型的糖消耗,说明该蛋白单体具有一定的降糖活性。唐任能通过超滤(中空纤维膜)、离子交换层析、凝胶过滤层析等手段纯化出一个相对分子质量大小为17.0kDa的小分子蛋白单体,经MALDI-TOF-MS分析发现其与哺乳动物的肽聚糖识别蛋白同源性较高,并发现该小分子蛋白单体对L929等细胞的增殖有显著影响。王志兵等人通过酶解得到梅花鹿角盘蛋白CPP,电泳检测(SDS-PAGE)其相对分子质量在8-15kDa之间,活性试验证明CPP能够抗大鼠乳腺增生,并对小鼠的吞噬功能产生显著影响。邱芳萍等人将梅花鹿角盘低温粉碎成粒度0.01mm的微粉后,45℃蒸馏水浸提并抽滤浸提液,上清液进行盐析得到蛋白沉淀并对蛋白沉淀进行复性,再通过透析及层析(Sephadex G-100)手段得到鹿角盘蛋白APPB,电泳检测(SDS-PAGE)其相对分子质量在20.1-31.0kDa之间,并对其进行醋酸致小鼠扭体实验,结果显示其具有镇痛作用。
抗生素的发现与应用对病原菌感染性疾病治疗的巨大贡献是不可否认的,然而,抗生素滥用所导致的细菌耐药性、环境污染、过敏反应及家畜产品中残留等问题迫使我们不得不寻找一种新的良性抗菌替代物,可以说,抗菌肽和抗菌蛋白就是这样应运而生的不二之选。抗菌肽和抗菌蛋白具有广谱的抗细菌能力,部分抗菌肽和抗菌蛋白还能抵抗寄生虫、病毒及真菌。抗菌肽和抗菌蛋白受基因编码,广泛存在于昆虫、动植物及人体中,是人体先天性免疫系统中重要的免疫分子,因此在应用于人体的同时不会产生毒副作用,是比抗生素更加健康的抗菌物质,其开发和利用具有良好的前景,也是近年来科学研究者关注的焦点。
目前,针对鹿角盘水溶性总肽的活性研究多集中在动物实验及抗肿瘤细胞的研究上,有关抑菌作用的报道甚少出现;而针对鹿角盘酶解产物(本发明制得的酶解产物为胶原水解肽)的活性研究则大部分集中在抗氧化作用方面;有关梅花鹿角盘抑菌作用的研究仅集中于部分分离纯化获得的蛋白质及多肽单体上,而由于这些抑菌实验研究所用的菌大都不超过4种从而无法全面、客观的反映梅花鹿角盘蛋白质及多肽的实际抑菌情况,因此,本发明对梅花鹿角盘蛋白多肽的抑菌活性进行了初步的研究。
技术实现要素:
为了对梅花鹿角盘蛋白多肽的抑菌活性进行研究,本发明提供一种具有抗菌效果的梅花鹿角盘抗菌肽/蛋白及其应用。
一种具有抗菌效果的梅花鹿角盘抗菌肽/蛋白,包括梅花鹿角盘小分子多肽、梅花鹿角盘胶原水解肽和梅花鹿角盘小分子蛋白单体。
优选的,所述的梅花鹿角盘小分子多肽,按照下述步骤进行提取:
A、鹿角盘总肽的提取:
称取450-550g鹿角盘粉末,加入3000mL于4℃冰箱充分预冷的pH为3.2-3.8的醋酸-醋酸钠缓冲液,磁力搅拌器充分搅拌后,对匀浆液进行离心,取上清;向其中缓慢加入4℃冰箱充分预冷的95%乙醇直至上清液终浓度达到55%后,4℃冰箱放置并每隔1h搅拌一次,3.5-5h后离心,取上清;以上操作除旋转蒸发外均在4℃条件下进行;
上清液用真空旋转蒸发仪在40℃-45℃条件下旋转蒸发至浓缩液体积为400mL左右;
浓缩液过滤后置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘总肽粗提物,装于自封袋后于-20℃冰箱保存待用;
两次离心的速度为5000-6500rpm,时间为25min;
B、总肽粗提物的除盐:
取梅花鹿角盘总肽粗提物1.2-1.8g,用10mL去离子水溶解充分后,过0.45μm滤器,为上样液;
用胶头滴管将上样液沿柱内壁缓缓滴入层析柱内并注意不要冲击胶面,用去离子水洗脱,并通过调节蠕动泵转速控制流速稳定在0.8-1.2mL/min,核酸蛋白检测仪在280nm处检测吸光值,出峰后用干净烧杯收集,待吸光值回归基线时停止收集,并继续用三倍柱体积去离子水洗脱,洗脱后关闭出水口;
收集液冻干,装于自封袋后于-20℃冰箱保存待用;
C、总肽的分级分离:
取梅花鹿角盘总肽除盐品80-125mg,用2mL去离子水溶解充分后,过0.45μm微孔滤器,为上样液;
用胶头滴管将上样液沿柱内壁缓缓滴入层析柱内并注意不要冲击胶面,用去离子水洗脱,并通过调节蠕动泵转速控制流速稳定在0.3-0.6mL/min,核酸蛋白检测仪在215nm处检测吸光值,自动收集器收集并标记收集各峰的试管,待吸光值回归基线时停止收集,并继续用三倍柱体积去离子水洗脱,洗脱后关闭凝胶柱出水口;
D、冷冻干燥:将收集液置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘小分子蛋白多肽。
优选的,所述的梅花鹿角盘胶原水解肽,按照下述步骤进行提取:
称取梅花鹿角盘粉末置于烧杯中,加入蒸馏水,在沸水浴中加热,加热过程中用玻璃棒不断搅拌,且不断用蒸馏水补充使提取匀浆体积维持恒定,4-6h后离心,离心条件为7000rpm,25℃,20min,取上清液4℃冰箱保存,沉淀置于烧杯中加入蒸馏水继续水浴提取,共提取4次,合并4次上清液,合并时水浴加热5min并不断搅拌,即为梅花鹿角盘明胶提取液;
B、取梅花鹿角盘明胶提取液,按酶与梅花鹿角盘粉末1∶1250的比例加入适量的胰蛋白酶解液,37℃水浴条件下酶解50-70min,期间不断用玻璃棒轻轻搅拌使酶与梅花鹿角盘粉末充分接触,酶解后的明胶提取液马上于100℃沸水浴中煮沸3-8min使胰蛋白酶失活,沸水浴后的酶解液离心,离心条件为8000rpm,25℃,10min,取上清,即获得梅花鹿角盘胶原水解肽;
C、将梅花鹿角盘胶原水解肽液置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘胶原水解肽冻干品,装于自封袋后于-20℃冰箱保存待用。
优选的,所述的梅花鹿角盘小分子蛋白单体,按照下述步骤进行提取:
A、鹿角盘总肽的提取:
称取450-550g鹿角盘粉末,加入3000mL于4℃冰箱充分预冷的pH为3.2-3.8的醋酸-醋酸钠缓冲液,磁力搅拌器充分搅拌后,对匀浆液进行离心,取上清;向其中缓慢加入4℃冰箱充分预冷的95%乙醇直至上清液终浓度达到55%后,4℃冰箱放置并每隔1h搅拌一次,3.5-5h后离心,取上清;以上操作除旋转蒸发外均在4℃条件下进行;
上清液用真空旋转蒸发仪在40℃-45℃条件下旋转蒸发至浓缩液体积为400mL左右;
浓缩液过滤后置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘总肽粗提物,装于自封袋后于-20℃冰箱保存待用;
所述的两次离心的速度为5000-6500rpm,时间为25min;
B、总肽粗提物的除盐:
取梅花鹿角盘总肽粗提物1.2-1.8g,用10mL去离子水溶解充分后,过0.45μm滤器,为上样液;
用胶头滴管将上样液沿柱内壁缓缓滴入层析柱内并注意不要冲击胶面,用去离子水洗脱,并通过调节蠕动泵转速控制流速稳定在0.8-1.2mL/min,核酸蛋白检测仪在280nm处检测吸光值,出峰后用干净烧杯收集,待吸光值回归基线时停止收集,并继续用三倍柱体积去离子水洗脱,洗脱后关闭出水口;
收集液冻干,装于自封袋后于-20℃冰箱保存待用;
C、反相高效液相层析分离鹿角盘蛋白单体:取梅花鹿角盘除盐品100mg,溶解于2mL 15%乙腈溶液中,过0.22μm微孔滤器,为进样液,流动相分为A、B两相,A相为:1mL色谱纯三氟乙酸(TFA)+1000mL脱气超纯水,B相为:0.85ml色谱纯三氟乙酸(TFA)+1000mL脱气乙腈,洗脱的梯度设置为:乙腈浓度0%,0-5min;0%-70%,5-35min;70%-100%,35-50min;进样量为每次梯度80μL进样液,进样液浓度为50mg/ml;检测波长为280nm;柱温22℃;流速1mL/min;每次梯度结束后,用20%乙腈平衡色谱柱40min,流速仍为1.0mL/min,收集各峰并保存于-20℃冰箱中;
D、SDS-PAGE电泳检测:
电泳所用玻璃板夹层宽度为1.0mm,用清水清洗玻璃板并用蒸馏水及去离子水润洗,将玻璃板固定于电泳槽中,坐于制胶夹上:
分离胶的配制:向干净的小烧杯中依次加入1.620mL去离子水、1.675mL凝胶缓冲液、1.675mL胶贮备液II、25μL 10%过硫酸铵和2.5μL TEMED,移液枪吹打均匀后灌胶,灌胶高度为4cm左右时停止灌胶,用移液枪向胶面上层灌入1mL异丙醇,室温下凝固1h;
间层胶的配制:滤纸除去异丙醇:向干净的小烧杯中依次加入1.149mL去离子水、0.838mL凝胶缓冲液、0.500mL胶贮备液I、12.5μL 10%过硫酸铵和1.25μL TEMED,移液枪吹打均匀后灌胶,灌胶高度为1.5cm左右时停止灌胶,用移液枪向胶面上层灌入1mL异丙醇,室温下凝固1h;
浓缩胶的配制:滤纸除去异丙醇:向干净的小烧杯中依次加入1.677mL去离子水、0.620mL凝胶缓冲液、0.200mL胶贮备液I、30μL 10%过硫酸铵和1.20μL TEMED,移液枪吹打均匀后灌胶,拆入制胶梳子,室温下凝固1h;
取分级分离收集峰液体20μL,加入等体积2×电泳上样缓冲液,移液枪吹打混匀10s:样品同电泳Marker共同沸水浴处理5min后,上样;电泳起始电压为60V,当溴酚蓝指示线迁移至浓缩胶与间层胶分界线时将电压调至100V,待溴酚蓝指示线迁移至距离分离胶底0.2cm处时,关闭电泳仪,停止电泳:电泳过程中缓冲液保持冰浴:
将胶片转移至干净大培养皿中,加入适量固定液,于摇床上固定1h:固定完毕后,倒掉固定液并用蒸馏水清洗胶片,加入染色液染色5h:染色完毕后,倒去染色液并用蒸馏水清洗胶片,脱色液脱色至背景干净为止:胶片于紫外成像仪中拍照并保存E、电喷雾质谱检测:
F、目标小分子蛋白的富集:选择液相出峰时间为28.93min的的峰为目标进行富集;
G、冷冻干燥:将保存于-20℃冰箱的小分子蛋白富集液取出,待其融化后置于青瓶内,真空冷冻干燥,即获得梅花鹿角盘蛋白单体,于-20℃冰箱保存待用。
对梅花鹿角盘抗菌肽/蛋白进行抑菌试验,具体分组如下:
1.A组:取梅花鹿角盘总肽除盐品10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
2.B组:取梅花鹿角盘小分子蛋白单体冻干品10mg,用1mL去离子水充分溶解并分装于后,-20℃冰箱中保存备用。
3.C组:取梅花鹿角盘小分子多肽冻干品10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
4.D组:取梅花鹿角盘胶原肽冻干品10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
5.AMP阳性对照组:取氨苄青霉素10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
6.阴性对照组:去离子水。
本发明采用纸片扩散法对梅花鹿角盘各蛋白多肽制备品的抑菌活性进行初步探讨,试验评定结果通过测量各抑菌剂产生的抑菌环直径来进行,可初步判断各制备品抑菌能力的强弱。具体步骤如下:
将小培养皿、镊子、去离子水、圆形滤纸片、移液枪等抑菌试验所用物品放入超净工作台中,开启紫外灭菌30min。紫外照射后,点燃酒精灯并用酒精棉反复擦拭台面及试验所用器具。取六个干净小培养皿置于酒精灯附近,分别标记为阳性对照组、阴性对照组(阴性对照组为去离子水)、A组、B组、C组、D组,并向各组培养皿中放入圆形滤纸片若干。按照分组,用移液枪取对应的抑菌剂浸润到对应的滤纸片上,平均每个滤纸片浸润10μL对应的抑菌剂,待滤纸片干燥后才可进行贴片。在等待滤纸片干燥的过程中,融化固体培养基并分装于若干干净小培养皿中(每个小培养皿中20mL培养基)。待固体培养基充分凝固且温度接近于室温后,取活化后的菌液200μL均匀涂布于固体培养基中,待涂布均匀后贴片。贴片后的各固体培养基用封口膜封住周边且做好标记,倒置培养。白色念珠菌需在30℃培养箱中倒置培养18~20h,其余革兰氏阴性菌及革兰氏阳性菌均在37℃培养箱中倒置培养16~18h。倒置培养完毕后,用游标卡尺测量各抑菌剂的抑菌环直径并记录,并拍照保存。
本发明所提供的具有抗菌效果的梅花鹿角盘抗菌肽/蛋白,包括梅花鹿角盘小分子多肽、梅花鹿角盘胶原水解肽和梅花鹿角盘小分子蛋白单体。对其进行抑菌环试验,包括对革兰氏阴性菌、革兰氏阳性菌及真菌的抑制效果。其中,革兰氏阴性菌包括:产气肠杆菌、奇异变形菌、绿脓杆菌和大肠杆菌;革兰氏阳性菌包括:缓慢葡萄球菌、格氏乳球菌、木糖葡萄球菌、枯草芽孢杆菌和中间葡萄球菌;真菌为白色念珠菌。在各抑菌剂的作用下,产气肠杆菌、枯草芽孢杆菌、大肠杆菌、绿脓杆菌、中间葡萄球菌、木糖葡萄球菌皆出现不同程度的抑制效果,而白色念珠菌、格氏乳球菌、奇异变形菌、缓慢葡萄球菌则未被抑制。
附图说明
图1为实施例1中产气肠杆菌抑菌图1。
图2为实施例1中产气肠杆菌抑菌图2。
图3为实施例1中绿脓杆菌抑菌图1。
图4为实施例1中绿脓杆菌抑菌图2。
图5为实施例1中大肠杆菌抑菌图1。
图6为实施例1中大肠杆菌抑菌图2。
图7为实施例1中枯草芽孢杆菌抑菌图1。
图8为实施例1中枯草芽孢杆菌抑菌图2。
图9为实施例1中中间葡萄球菌抑菌图1。
图10为实施例1中中间葡萄球菌抑菌图2。
图11为实施例1中木糖葡萄球菌抑菌图1。
图12为实施例1中木糖葡萄球菌抑菌图2。
具体实施方式
实施例1
一种具有抗菌效果的梅花鹿角盘抗菌肽/蛋白,包括梅花鹿角盘小分子多肽、梅花鹿角盘胶原水解肽和梅花鹿角盘小分子蛋白单体。
所述的梅花鹿角盘小分子多肽,按照下述步骤进行提取:
A、鹿角盘总肽的提取:
称取500g鹿角盘粉末,加入3000mL于4℃冰箱充分预冷的pH为3.5的醋酸-醋酸钠缓冲液,磁力搅拌器充分搅拌后,对匀浆液进行离心,取上清;向其中缓慢加入4℃冰箱充分预冷的95%乙醇直至上清液终浓度达到55%后,4℃冰箱放置并每隔1h搅拌一次,4h后离心,取上清;以上操作除旋转蒸发外均在4℃条件下进行;
上清液用真空旋转蒸发仪在42℃条件下旋转蒸发至浓缩液体积为400mL左右;
浓缩液过滤后置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘总肽粗提物,装于自封袋后于-20℃冰箱保存待用;
两次离心的速度为5000-6500rpm,时间为25min;
B、总肽粗提物的除盐:
取梅花鹿角盘总肽粗提物1.5g,用10mL去离子水溶解充分后,过0.45μm滤器,为上样液;
用胶头滴管将上样液沿柱内壁缓缓滴入层析柱内并注意不要冲击胶面,用去离子水洗脱,并通过调节蠕动泵转速控制流速稳定在1.0mL/min,核酸蛋白检测仪在280nm处检测吸光值,出峰后用干净烧杯收集,待吸光值回归基线时停止收集,并继续用三倍柱体积去离子水洗脱,洗脱后关闭出水口;
收集液冻干,装于自封袋后于-20℃冰箱保存待用;
C、总肽的分级分离:
取梅花鹿角盘总肽除盐品100mg,用2mL去离子水溶解充分后,过0.45μm微孔滤器,为上样液;
用胶头滴管将上样液沿柱内壁缓缓滴入层析柱内并注意不要冲击胶面,用去离子水洗脱,并通过调节蠕动泵转速控制流速稳定在0.45mL/min,核酸蛋白检测仪在215nm处检测吸光值,自动收集器收集并标记收集各峰的试管,待吸光值回归基线时停止收集,并继续用三倍柱体积去离子水洗脱,洗脱后关闭凝胶柱出水口;
D、冷冻干燥:将收集液置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘小分子蛋白多肽。
所述的梅花鹿角盘胶原水解肽,按照下述步骤进行提取:
A、称取梅花鹿角盘粉末置于烧杯中,加入蒸馏水,在沸水浴中加热,加热过程中用玻璃棒不断搅拌,且不断用蒸馏水补充使提取匀浆体积维持恒定,5h后离心,离心条件为7000rpm,25℃,20min,取上清液4℃冰箱保存,沉淀置于烧杯中加入蒸馏水继续水浴提取,共提取4次,合并4次上清液,合并时水浴加热5min并不断搅拌,即为梅花鹿角盘明胶提取液;
B、取梅花鹿角盘明胶提取液,按酶与梅花鹿角盘粉末1∶1250的比例加入适量的胰蛋白酶解液,37℃水浴条件下酶解60min,期间不断用玻璃棒轻轻搅拌使酶与梅花鹿角盘粉末充分接触,酶解后的明胶提取液马上于100℃沸水浴中煮沸5min使胰蛋白酶失活,沸水浴后的酶解液离心,离心条件为8000rpm,25℃,10min,取上清,即获得梅花鹿角盘胶原水解肽;
C、将梅花鹿角盘胶原水解肽液置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘胶原水解肽冻干品,装于自封袋后于-20℃冰箱保存待用。
所述的梅花鹿角盘小分子蛋白单体,按照下述步骤进行提取:
A、鹿角盘总肽的提取:
称取500g鹿角盘粉末,加入3000mL于4℃冰箱充分预冷的pH为3.5的醋酸-醋酸钠缓冲液,磁力搅拌器充分搅拌后,对匀浆液进行离心,取上清;向其中缓慢加入4℃冰箱充分预冷的95%乙醇直至上清液终浓度达到55%后,4℃冰箱放置并每隔1h搅拌一次,4h后离心,取上清;以上操作除旋转蒸发外均在4℃条件下进行;
上清液用真空旋转蒸发仪在42℃条件下旋转蒸发至浓缩液体积为400mL左右;
浓缩液过滤后置于大培养皿内,真空冷冻干燥机冻干,得梅花鹿角盘总肽粗提物,装于自封袋后于-20℃冰箱保存待用;
所述的两次离心的速度为5000-6500rpm,时间为25min;
B、总肽粗提物的除盐:
取梅花鹿角盘总肽粗提物1.5g,用10mL去离子水溶解充分后,过0.45μm滤器,为上样液;
用胶头滴管将上样液沿柱内壁缓缓滴入层析柱内并注意不要冲击胶面,用去离子水洗脱,并通过调节蠕动泵转速控制流速稳定在1.0mL/min,核酸蛋白检测仪在280nm处检测吸光值,出峰后用干净烧杯收集,待吸光值回归基线时停止收集,并继续用三倍柱体积去离子水洗脱,洗脱后关闭出水口;
收集液冻干,装于自封袋后于-20℃冰箱保存待用;
C、反相高效液相层析分离鹿角盘蛋白单体:取梅花鹿角盘除盐品100mg,溶解于2mL 15%乙腈溶液中,过0.22μm微孔滤器,为进样液,流动相分为A、B两相,A相为:1mL色谱纯三氟乙酸(TFA)+1000mL脱气超纯水,B相为:0.85ml色谱纯三氟乙酸(TFA)+1000mL脱气乙腈,洗脱的梯度设置为:乙腈浓度0%,0-5min;0%-70%,5-35min;70%-100%,35-50min;进样量为每次梯度80μL进样液,进样液浓度为50mg/ml;检测波长为280nm;柱温22℃;流速1mL/min;每次梯度结束后,用20%乙腈平衡色谱柱40min,流速仍为1.0mL/min,收集各峰并保存于-20℃冰箱中;
D、SDS-PAGE电泳检测:
电泳所用玻璃板夹层宽度为1.0mm,用清水清洗玻璃板并用蒸馏水及去离子水润洗,将玻璃板固定于电泳槽中,坐于制胶夹上:
分离胶的配制:向干净的小烧杯中依次加入1.620mL去离子水、1.675mL凝胶缓冲液、1.675mL胶贮备液II、25μL 10%过硫酸铵和2.5μL TEMED,移液枪吹打均匀后灌胶,灌胶高度为4cm左右时停止灌胶,用移液枪向胶面上层灌入1mL异丙醇,室温下凝固1h;
间层胶的配制:滤纸除去异丙醇:向干净的小烧杯中依次加入1.149mL去离子水、0.838mL凝胶缓冲液、0.500mL胶贮备液I、12.5μL 10%过硫酸铵和1.25μL TEMED,移液枪吹打均匀后灌胶,灌胶高度为1.5cm左右时停止灌胶,用移液枪向胶面上层灌入1mL异丙醇,室温下凝固1h;
浓缩胶的配制:滤纸除去异丙醇:向干净的小烧杯中依次加入1.677mL去离子水、0.620mL凝胶缓冲液、0.200mL胶贮备液I、30μL 10%过硫酸铵和1.20μL TEMED,移液枪吹打均匀后灌胶,拆入制胶梳子,室温下凝固1h;
取分级分离收集峰液体20μL,加入等体积2×电泳上样缓冲液,移液枪吹打混匀10s:样品同电泳Marker共同沸水浴处理5min后,上样;电泳起始电压为60V,当溴酚蓝指示线迁移至浓缩胶与间层胶分界线时将电压调至100V,待溴酚蓝指示线迁移至距离分离胶底0.2cm处时,关闭电泳仪,停止电泳:电泳过程中缓冲液保持冰浴:
将胶片转移至干净大培养皿中,加入适量固定液,于摇床上固定1h:固定完毕后,倒掉固定液并用蒸馏水清洗胶片,加入染色液染色5h:染色完毕后,倒去染色液并用蒸馏水清洗胶片,脱色液脱色至背景干净为止:胶片于紫外成像仪中拍照并保存E、电喷雾质谱检测:
F、目标小分子蛋白的富集:选择液相出峰时间为28.93min的的峰为目标进行富集;
G、冷冻干燥:将保存于-20℃冰箱的小分子蛋白富集液取出,待其融化后置于青瓶内,真空冷冻干燥,即获得梅花鹿角盘蛋白单体,于-20℃冰箱保存待用。
对梅花鹿角盘抗菌肽/蛋白进行抑菌试验,具体分组如下:
1.A组:取梅花鹿角盘总肽除盐品10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
2.B组:取梅花鹿角盘小分子蛋白单体冻干品10mg,用1mL去离子水充分溶解并分装于后,-20℃冰箱中保存备用。
3.C组:取梅花鹿角盘小分子多肽冻干品10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
4.D组:取梅花鹿角盘胶原水解肽冻干品10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
5.AMP阳性对照组:取氨苄青霉素10mg,用1mL去离子水充分溶解并分装后,于-20℃冰箱中保存备用。
6.阴性对照组:去离子水。
本发明采用纸片扩散法对梅花鹿角盘各蛋白多肽制备品的抑菌活性进行初步探讨,试验评定结果通过测量各抑菌剂产生的抑菌环直径来进行,可初步判断各制备品抑菌能力的强弱。具体步骤如下:
将小培养皿、镊子、去离子水、圆形滤纸片、移液枪等抑菌试验所用物品放入超净工作台中,开启紫外灭菌30min。紫外照射后,点燃酒精灯并用酒精棉反复擦拭台面及试验所用器具。取六个干净小培养皿置于酒精灯附近,分别标记为阳性对照组、阴性对照组(阴性对照组为去离子水)、A组、B组、C组、D组,并向各组培养皿中放入圆形滤纸片若干。按照分组,用移液枪取对应的抑菌剂浸润到对应的滤纸片上,平均每个滤纸片浸润10μL对应的抑菌剂,待滤纸片干燥后才可进行贴片。在等待滤纸片干燥的过程中,融化固体培养基并分装于若干干净小培养皿中(每个小培养皿中20mL培养基)。待固体培养基充分凝固且温度接近于室温后,取活化后的菌液200μL均匀涂布于固体培养基中,待涂布均匀后贴片。贴片后的各固体培养基用封口膜封住周边且做好标记,倒置培养。白色念珠菌需在30℃培养箱中倒置培养18~20h,其余革兰氏阴性菌及革兰氏阳性菌均在37℃培养箱中倒置培养16~18h。倒置培养完毕后,用游标卡尺测量各抑菌剂的抑菌环直径并记录,并拍照保存。
本发明所提供的具有抗菌效果的梅花鹿角盘抗菌肽/蛋白,包括梅花鹿角盘小分子多肽、梅花鹿角盘胶原水解肽和梅花鹿角盘小分子蛋白单体。对其进行抑菌环试验,包括对革兰氏阴性菌、革兰氏阳性菌及真菌的抑制效果。
革兰氏阴性菌的抑菌试验结果
1.产气肠杆菌
如表1、图1和图2所示,当试验菌为产气肠杆菌时,阳性对照的抑菌环直径为4.87mm,其余蛋白多肽根据抑菌环直径由大到小顺序依次为B组(蛋白单体)6.13mm,A组(总肽)5.11mm,C组(小分子多肽)5.03mm,D组(胶原水解肽)4.56mm。
2.绿脓杆菌
如表1、图3和图4所示,当试验菌为绿脓杆菌时,阳性对照的抑菌环直径为3.62mm,其余蛋白多肽根据抑菌环直径由大到小顺序依次为B组(蛋白单体)3.37mm,D组(胶原水解肽)3.05mm,C组(小分子多肽)2.75mm,A组(总肽)2.21mm。
3.大肠杆菌
如表1、图5和图6所示,当试验菌为大肠杆菌时,阳性对照的抑菌环直径为1.51mm,其余蛋白多肽根据抑菌环直径由大到小顺序依次为B组(蛋白单体)2.02mm,C组(小分子多肽)1.41mm,D组(胶原水解肽)1.26mm,A组(总肽)1.15mm。
革兰氏阳性菌的抑菌试验结果
1.枯草芽孢杆菌
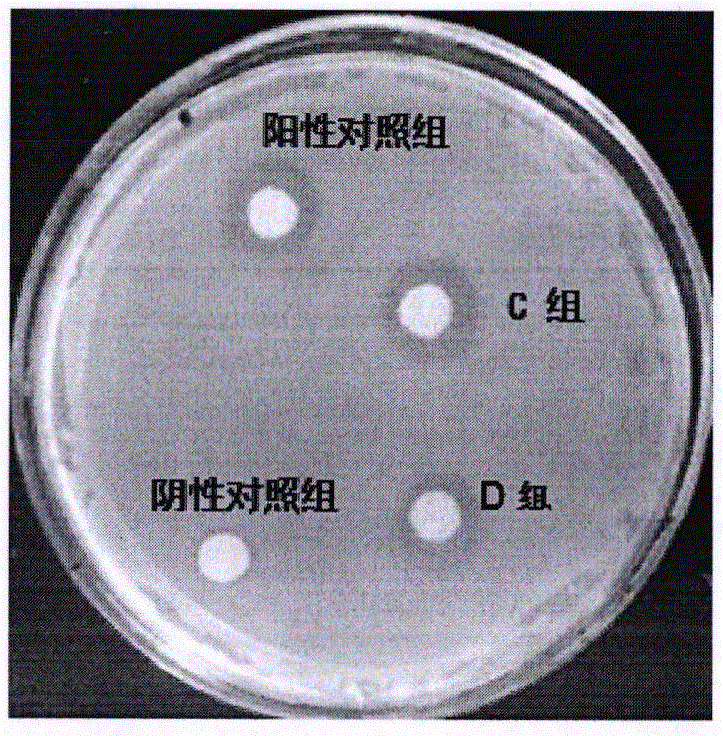
如表1、图7和图8所示,当试验菌为枯草芽孢杆菌时,阳性对照的抑菌环直径为4.99mm,其余蛋白多肽根据抑菌环直径由大到小顺序依次为C组(小分子多肽)8.89mm,D组(胶原水解肽)8.04mm,B组(蛋白单体)7.01mm,A组(总肽)0mm。
2.中间葡萄球菌
如表1、图9和图10所示,当试验菌为中间葡萄球菌时,阳性对照的抑菌环直径为3.88mm,其余蛋白多肽根据抑菌环直径由大到小顺序依次为B组(蛋白单体)3.94mm,C组(小分子多肽)3.18mm,D组(胶原水解肽)2.36mm,A组(总肽)2.27mm。
3.木糖葡萄球菌
如表1、图11和图12所示,当试验菌为木糖葡萄球菌时,阳性对照的抑菌环直径为5.77mm,其余蛋白多肽根据抑菌环直径由大到小顺序依次为B组(蛋白单体)8.93mm,C组(小分子多肽)6.02mm,D组(胶原水解肽)4.91mm,A组(总肽)3.44mm。
表1 各菌抑菌环直径
注:A组:总肽,B组:蛋白单体,C组:小分子多肽,D组:胶原水解肽
在研究抗菌肽和抗菌蛋白的抑菌活性时,选择菌种很重要,所选用的菌种尽可能的要包括革兰氏阳性菌、革兰氏阴性菌和真菌,因为选择单一的或个别几个菌并不能客观地反映该抑菌物质的抑菌情况。本发明共选择了10种菌,其中,革兰氏阴性菌包括:产气肠杆菌、奇异变形菌、绿脓杆菌和大肠杆菌;革兰氏阳性菌包括:缓慢葡萄球菌、中间葡萄球菌、木糖葡萄球菌、枯草芽孢杆菌和格氏乳球菌;真菌为白色念珠菌。所有实验用菌都要保证其传代次数必须在5代以下。本发明中设定的阳性对照为氨苄青霉素,实验中各试验组的抑菌剂浓度均为10mg/mL。结果发现梅花鹿角盘总肽、鹿角盘蛋白单体、鹿角盘小分子多肽及鹿角盘胶原水解肽均能在不同程度上抑制部分实验所用的革兰氏阴性菌和革兰氏阳性菌,而对实验所用真菌(白色念珠菌)未产生抑制作用;综合抑菌能力由大到小依次为小分子蛋白单体>小分子多肽>胶原水解肽>总肽组,小分子蛋白单体、小分子多肽及胶原水解肽的抑菌作用要强于总肽组,而小分子蛋白单体的抑菌活性最强;梅花鹿角盘四种蛋白多肽对革兰氏阳性菌产生的抑制效果明显强于对革兰氏阴性菌产生的抑菌效果。本发明结果将为梅花鹿角盘蛋白抗菌谱的研究提供具有重要参考价值的理论依据。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!