用于检测HLA‑B27基因的检测试剂盒和方法与流程
本发明属于生物技术领域,具体涉及一种用荧光定量PCR技术检测HLA-B27基因的检测试剂盒和方法。
背景技术:
人类白细胞抗原(HLA)别名主要组织相容性抗原(MHC),位于第6号染色体短臂6p21.3区域,全长约3.6Mb。HLA基因是目前已知的人类最复杂基因系统,根据其在染色体上的排列可分为3类:Ⅰ类基因区包含HLA-A、HLA-B与HLA-C;Ⅱ类基因区包含HLA-DR、HLA-DP与HLA-DQ;Ⅲ类基因区位于上述两类基因区域之间,主要编码补体、热休克蛋白等产物。
1973年Brewerton首次报道人类组织相容性抗原HLA-B27(human leucocyte antigen B27,HLA-B27)与强直性脊柱炎(AS)高度相关。AS是一种以骶髂关节和脊柱慢性炎症为主的自身免疫性疾病。该疾病病因尚未明确,一般认为本病发生与遗传因素和感染有关。该疾病直接诊断证据为,X线下脊柱的特征性改变及骶髂关节炎,但在该疾病发生早期,这种影像学诊断特征往往不明显,容易发生误诊和漏诊。近来,通过全基因组关联分析,证实HLA-B27基因与AS发生高度相关。HLA-B27是目前发现的与AS关联性最强的基因,对AS易感性贡献率为16%。国内外学者大量的研究表明90%以上AS患者为HLA-B27阳性,而正常人群中只有5%~10%的个体为HLA-B27阳性。即便HLA-B27阳性是AS确诊的既非必要也非充分条件,但HLA-B27对AS的早期诊断和治疗具有重要价值。
与HLA I类其他分子一样,HLA-B27具有较高的遗传多态性。这些多态性位点大多数分布在第2、3外显子区域,编码抗原结合槽的α1和α2结构域。截止2016年10月,已发现的HLA-B27亚型已达155个,命名为HLA-B*27:01~HLA-B*27:156,其中,HLA-B*27:22由于在以后的研究中,发现其序列错误,因此被取消了该命名。
研究发现,不同种族、不同地区人群疾病相关HLA-B27亚型基因分布差异很大,HLA-B*27:05多见于高加索人,HLA-B*27:02多见于地中海人,HLA-B*27:04多见于中国人。在中国人群中,HLA-B*27:04、HLA-B*27:05与AS均有较强的关联性,但前者关联性强于后者。而另外的亚型如HLA-B*27:06和HLA-B*27:09则被认为是对AS发生有保护作用。
目前,HLA-B27基因检测方法,主要有聚合酶链反应-直接测序(PCR-SBT)法、序列特异性引物-聚合酶链式反应(PCR-SSP)法、流式细胞仪(FCM)法等。PCR-SBT法,是基于测序分型的聚合酶链反应,可直接获得DNA序列,确定所有存在的多态性,为最直接、最直观的方法。但是,由于基因结构的特殊性和所设计PCR引物等因素,测序结果可能会出现套峰,不利于结果的判读。且测序对试剂和仪器有特殊要求,操作复杂,成本相对较高,速度慢、通量低,不适合临床疾病快速辅助诊断。PCR-SSP法,其原理是根据已知HLA-B27基因片段,设计特异性引物直接进行PCR扩增,并通过琼脂糖凝胶电泳检测PCR产物,尽管该方法对仪器要求不高、操作简单、结果直观,在基层医疗卫生单位易于推广,但该方法最大的弊端是步骤多、操作易污染,易出现假阳性,无法实现批量化和自动化。流式细胞仪法(FCM)具有快速、自动化程度高,适合大规模样本检测的优点,但该方法中依赖的荧光单克隆抗体特异性不高,易与多种其他HLA抗原,如HLA-B7、HLA-B22等发生干扰反应,影响结果准确性。此外,流式细胞仪法属于血清学水平检测,无法确定样本准确的基因型。且流式细胞仪器材昂贵,维护成本高,对操作人员技术要求较高,因此限制了它在基层医疗单位的推广与应用。
技术实现要素:
为克服现有技术检测能力的不足,本发明的目的是提供一种用于检测HLA-B27基因的检测试剂盒。本发明的另一个目的是提供一种用于检测HLA-B27基因的检测方法。
为实现上述目的,本发明采用以下技术方案:
一种用于检测HLA-B27基因的检测试剂盒,该检测试剂盒包括用于HLA-B*27:04基因检测的引物对1及检测探针1,和用于HLA-B*27:05基因检测的引物对2及检测探针2;其中,所述引物对1的核苷酸序列如SEQ ID No.1和SEQ ID No.2所示,所述检测探针1的核苷酸序列如SEQ ID No.3所示,所述引物对2的核苷酸序列如SEQ ID No.4和SEQ ID No.5所示,所述检测探针2的核苷酸序列如SEQ ID No.6所示。
如上所述的检测试剂盒,优选地,所述检测试剂盒还包括内部质控,其包括质控引物对和质控探针,所述质控引物对的核苷酸序列如SEQ ID No.7和SEQ ID No.8所示,所述质控探针的核苷酸序列如SEQ ID No.9所示。
如上所述的检测试剂盒,优选地,所述检测试剂盒还包括HLA-B*27:04阳性对照物、HLA-B*27:05阳性对照物,其中,所述HLA-B*27:04阳性对照物含有如SEQ ID No.10和SEQ ID No.12所示的核苷酸序列,所述HLA-B*27:05阳性对照物含有如SEQ ID No.11和SEQ ID No.12所示的核苷酸序列。
如上所述的检测试剂盒,优选地,所述检测探针1和所述检测探针2的5'端连接荧光基团,3'端连接淬灭基团。
如上所述的试剂盒,优选地,试剂盒还包括10×PCR缓冲液、热启动DNA聚合酶、dNTPs、矿物油、阴性对照物:ddH2O。
如上所述的试剂盒,优选地,所述荧光基团为FAM、JOE、CY3、HEX、VIC中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
一种快速检测HLA-B27基因的方法,该方法包括以下步骤:
(1)从样品中提取DNA;
(2)对提取的所述DNA,同时进行HLA-B*27:04基因检测的反应体系1和HLA-B*27:05基因检测的反应体系2的实时荧光PCR扩增;其中,在所述反应体系1中检测引物对1的核苷酸序列如SEQ ID No.1和SEQ ID No.2所示,检测探针1的核苷酸序列如SEQ ID No.3所示;在所述反应体系2中检测引物对2的核苷酸序列如SEQ ID No.4和SEQ ID No.5所示,检测探针2的核苷酸序列如SEQ ID No.6所示,所述检测探针1和所述检测探针2的5'端连接荧光基团,3'端连接淬灭基团;
(3)收集荧光信号,选择对应荧光基团的荧光检测模式,基线调整取3~15个循环的荧光信号,以阈值线刚好超过正常阴性对照的最高点设定阈值线;
(4)结果判定:待测样品的所述HLA-B*27:04基因检测的反应体系1或所述HLA-B*27:05基因检测的反应体系2任一体系的荧光扩增曲线呈现典型的“S”型曲线,且Ct值≤26,则该待检样本基因型为HLA-B27阳性,否则为HLA-B27阴性。
如上所述的方法,优选地,在步骤(2)中,所述反应体系1和所述反应体系2中还包括有作为内部质控的质控引物对和质控探针,所述质控引物对的核苷酸序列如SEQ ID No.7和SEQ ID No.8所示,所述质控探针的核苷酸序列如SEQ ID No.9所示,该质控探针的5'端连接有不同于所述检测探针1和检测探针2的荧光基团,3'端连接有不同于所述检测探针1和检测探针2的淬灭基团。
如上所述的方法,优选地,在步骤(2)中,如上所述的方法,优选地,在步骤(2)中,在所述反应体系1和所述反应体系2中,各自的检测引物和检测探针的终浓度均为300nmol/L,所述质控引物对和质控探针的终浓度均为200nmol/L;所述检测探针1和检测探针2的5'端连接FAM,3'端连接MGB,所述质控探针的5'端连接JOE,3'端连接TAMRA。
如上所述的方法,优选地,步骤(2)中,所述实时荧光PCR扩增的反应程序为:
第一阶段:95℃变性10min;
第二阶段:94℃30s,58℃30s,10个循环;
第三阶段:94℃30s,60℃30s,30个循环;
信号收集:第三阶段收集荧光信号。
如上所述的方法,优选地,在所述步骤(4)中,检测样本的所述内部质控的JOE信号应有典型的“S”型扩增曲线,且Ct值<25,再确定所述样本DNA的阴阳性;否则应重新进行检测。
如上所述的方法,优选地,在步骤(2)中,还设有阳性对照和阴性对照,所述阳性对照为以含有如SEQ ID No.10和SEQ ID No.12核苷酸序列所示的HLA-B*27:04阳性对照物、含SEQ ID No.11和SEQ ID No.12核苷酸序列所示的HLA-B*27:05阳性对照物为模板,进行所述反应体系1和反应体系2的实时荧光PCR扩增;
所述阴性对照为以ddH2O为模板,进行所述反应体系1和反应体系2的实时荧光PCR扩增;
在步骤(4)中,所述阳性对照的反应体系1和反应体系2的FAM均有典型的“S”型扩增曲线,FAM信号的Ct值≤26,且JOE有典型的“S”型扩增曲线且JOE信号的Ct值<25,符合要求;
所述阴性对照的反应体系1和反应体系2的FAM、JOE均没有扩增曲线或Ct值,符合要求;否则,应重新进行体系配置,重新检测。
本发明公开了一种用于快速检测HLA-B27基因的检测试剂盒,同时建立了一种比较高效、灵敏的HLA-B27基因快速检测方法。其检测试剂盒,使用方便,操作简单,大大简化了操作过程,并减少了在操作过程的污染,检测效果好,具有高灵敏度、高特异性、高选择性的特点,并实现对HLA-B27基因的分型检测。提供的检测方法采用完全闭管操作,操作简单、方便快捷,通过直接检测PCR过程中荧光信号Ct值获得检测结果,不需要PCR电泳检测等后处理,克服了常规PCR技术的易污染、假阳性率高的缺点,能有效避免非特异性扩增,并且适合大批量样本的检测。
本发明提供的检测试剂盒及方法,用于检测HLA-B27基因时,为了避免漏检、及初步判断样本DNA加入量是否在允许范围内,设有内部质控;为了判断检测体系是否正常,还设有阴性对照和检测引物的阳性对照;为了避免假阴性,设有阳性对照,其阳性对照检测呈阳性结果,说明检测体系没有问题,不会出现假阴性结果及漏检,如阳性对照检测呈阴性结果,说明检测体系有问题,或试剂已经失效,应重新配置体系进行检测;为了避免假阳性,设有阴性对照,其阴性对照检测呈阴性结果,说明检测体系没有问题,不会出现假阳性结果,如阴性对照检测呈阳性结果,说明检测体系有问题,已被污染,应重新配置体系进行检测;本发明提供检测试剂盒及方法设计严谨,有效避免漏检、错检的可能。
与现有技术相比,本发明有如下有益效果和显著进步:
(1)本发明基于Taqman-MGB探针的荧光定量PCR法,操作简单,PCR结束后无需开盖进一步分析,因此减少了交叉污染的风险;
(2)本发明针对中国人群HLA-B27亚型基因的分布特点,选取了中国人群中与强直性脊柱炎相关性最高的2个基因,即HLA-B*27:04和HLA-B*27:05。针对这2个基因特异性保守序列分别设计了一套引物,且这些特异性位点与引物3'末端互补配对,而阴性DNA样本由于与引物3'末端存在几个碱基的错配,限制了其PCR扩增。在靠近上游引物位置上,设计了一段Taqman-MGB探针,该探针只与HLA-B*27:04或HLA-B*27:05阳性DNA保守位点结合,保证了检测结果的特异性。本发明方法检测结果与测序法100%吻合,结果可靠,特异性强;
(3)本发明方法灵敏度高,可准确检出低至0.1ng/μL的基因组DNA,只需少量DNA样本即可完成检测;
(4)本发明所提供的检测方法能在90分钟内完成检测,所需时间远低于其他法,特别适合临床疾病快速诊断。
附图说明
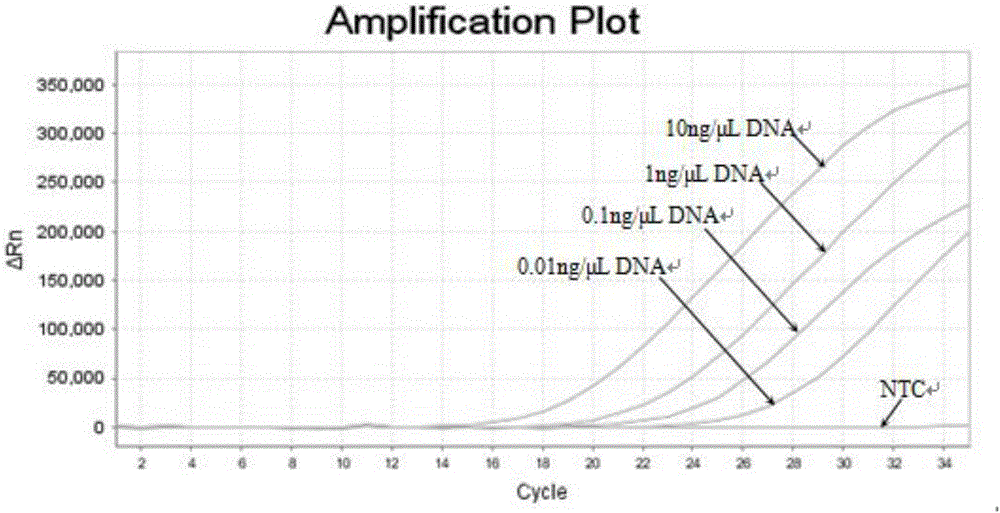
图1为本发明优选试剂盒中HLA-B*27:04反应体系灵敏度检测的扩增曲线。
图2为本发明优选试剂盒中HLA-B*27:05反应体系灵敏度检测的扩增曲线。
图3为本发明优选试剂盒对HLA-B*27:04阳性样本的扩增曲线。
图4为本发明优选地试剂盒对HLA-B*27:05阳性样本的扩增曲线。
图5为本发明优选地试剂盒对HLA-B*27:04/HLA-B*27:05杂合型样本的扩增曲线。
图6为本发明优选地试剂盒对HLA-B*27阴性样本的扩增曲线。
具体实施方式
以下结合具体实例对本发明做进一步详细说明,并非对本发明的限定,本发明的实施方式并不限于此,本发明提供的核苷酸序列的互补序列也可实现本发明,如无特殊说明,所用试剂为常规试剂,因此凡依照本公开内容所作出的本领域的等同替换,均属于本发明的保护范围。
实施例1引物、探针、阳性参考基因序列设计
根据NCBI数据库以及IPD-IMGT/HLA数据库(http://www.ebi.ac.uk/ipd/imgt/hla/)公布的HLA-B*27:04(5个亚型)、HLA-B*27:05(31个亚型)基因序列以及其参考座位HLA-B*07:02:01基因序列,通过序列比对确定该基因的特异性保守位点,根据以上多态性位点分别设计引物和探针,本发明所设计的引物和探针均与HLA-B*27:04或HLA-B*27:05基因的保守性位点结合,能检测出其所有基因亚型。经过试验验证,最终确定检测引物和探针序列如下:
(1)用于HLA-B*27:04基因检测的PCR引物对1及其特异性检测探针1,核苷酸序列如下:
HLA-B*27:04基因扩增上游引物(1F),SEQ ID No.1:
5'-GCAAGGCCAAGGCACAGAC-3';
HLA-B*27:04基因扩增下游引物(1R),SEQ ID No.2:
5'-CTCTCAGCTGCTCCGGCT-3';
HLA-B*27:04基因检测探针(1P),SEQ ID No.3:
FAM 5'-CGAGAGAGCCTGCGGACCCT-3';
(2)用于HLA-B*27:05基因检测的PCR引物对2及其特异性检测探针2:
HLA-B*27:05基因扩增上游引物(2F),SEQ ID No.4:
5'-GGAGTATTGGGACCGGGAG-3';
HLA-B*27:05基因扩增下游引物(2R),SEQ ID No.5:
5'-CTCTCAGCTGCTCCGGCA-3';
HLA-B*27:05基因检测探针(2P),SEQ ID No.6:
5'-CGAGAGGACCTGCGGACCCT-3'。
根据HLA数据库公布的HLA-B*27:04(5个亚型)和HLA-B*27:05(31个亚型)基因序列,分别设计了其阳性参考基因序列。HLA-B*27:04、HLA-B*27:05阳性参考基因序列分别如SEQ ID No.10、SEQ ID No.11所示。
SEQ ID No.10:
5'-GCAAGGCCAAGGCACAGACTGACCGAGAGAGCCTGCGGACCCTGCTCCGCTACTACAACCAGAGCGAGGCCGGGTCTCACACCCTCCAGAATATGTATGGCTGCGACGTGGGGCCGGACGGGCGCCTCCTCCGCGGGTACCACCAGGACGCCTACGACGGCAAGGATTACATCGCCCTGAACGAGGACCTGAGCTCCTGGACCGCCGCGGACACGGCGGCTCAGATCACCCAGCGCAAGTGGGAGGCGGCCCGTGAGGCGGAGCAGCTGAGAG-3'
SEQ ID No.11:
5'-GGAGTATTGGGACCGGGAGACACAGATCTGCAAGGCCAAGGCACAGACTGACCGAGAGGACCTGCGGACCCTGCTCCGCTACTACAACCAGAGCGAGGCCGGGTCTCACACCCTCCAGAATATGTATGGCTGCGACGTGGGGCCGGACGGGCGCCTCCTCCGCGGGTACCACCAGGACGCCTACGACGGCAAGGATTACATCGCCCTGAACGAGGACCTGAGCTCCTGGACCGCCGCGGACACGGCGGCTCAGATCACCCAGCGCAAGTGGGAGGCGGCCCGTGTGGCGGAGCAGCTGAGAG-3'。
在本发明具体实施过程中,所加待检样本DNA中可能存在PCR抑制剂,这些抑制剂可能严重影响PCR正常扩增,产生假阴性结果;另外,操作过程中的样品DNA漏加也可能导致假阴性结果。因此,本发明还提供了一对针对人类GAPDH基因的内部质控的质控引物和探针,用于规避上述风险,确保检测结果的准确性和可靠性。本发明选用的内部质控是人类看家基因GAPDH的一段DNA序列,看家基因高度保守并且持续表达,在实验中有利于除去不同标本在产量及质量等上的差别,能够对实验结果进行校正和标准化。因此GAPDH基因作为人类基因组的保守基因,不仅可以作为试剂盒内部的质控,还可作为样本DNA的质控。通过对内部质控的质控引物对、质控探针的筛选和体系优化,建立了实时荧光PCR内部质控检测体系,要求设计的质控引物对、质控探针及扩增产物,不会与用于检测HLA-B*27:04和HLA-B*27:05基因的引物对、探针等有交叉反应,及引物二聚体的形成,优选地,质控引物对(3F、3R)、质控探针(3P)如下:
质控上游引物(3F),SEQ ID No.7:5'-TGAGGGTTCTTTGTGCTGA-3'
质控下游引物(3R),SEQ ID No.8:5'-AGGAAGGGCTTTGTGAGG-3'质控探针(3P),SEQ ID No.9:5'-CATCCCTCACCCCTTCAATGCCC-3'。
作为内部质控的质控引物对进行PCR扩增时,其扩增序列的大小为158bp,将扩增序列作为内部质控阳性对照物,即包含如SEQ ID No.12所示序列。
SEQ ID No.12:
5’-TGAGGGTTCTTTGTGCTGAGCGGGGCCCTGCAGGGGAGAAAGGCCCATCCCTCACCCCTTCAATGCCCCCACTGTGGCATCCCTGGGACTGGGGAGGCTGATGGGGAAGGTTGAGCCTTTACTAGCTGGATCTCCCAGTTCCTCACAAAGCCCTTCCT-3’。
实施例2用于检测HLA-B27基因位点的试剂盒
用于快速检测HLA-B27基因位点的实时荧光PCR试剂盒包括以下成分:
用于HLA-B*27:04基因检测的PCR引物对1和检测探针1:
HLA-B*27:04基因扩增上游引物1:核苷酸序列如SEQ ID No.1所示;
HLA-B*27:04基因扩增下游引物1:核苷酸序列如SEQ ID No.2所示;
HLA-B*27:04基因检测探针1:核苷酸序列如SEQ ID No.3所示;
用于HLA-B*27:05基因检测的PCR引物对2及检测探针2:
HLA-B*27:05基因扩增上游引物2:核苷酸序列如SEQ ID No.4所示;
HLA-B*27:05基因扩增下游引物2:核苷酸序列如SEQ ID No.5所示;
HLA-B*27:05基因检测探针2:核苷酸序列如SEQ ID No.6所示;
其中,检测探针1和检测探针2的5'端连接荧光基团,3'端连接淬灭基团。
为了避免漏检,错检,还包括:作为内部质控的质控引物对、质控探针,其中,质控引物对的核苷酸序列如SEQ ID No.7和SEQ ID No.8所示,质控探针的核苷酸序列如SEQ ID No.9所示,该质控探针的5'端连接有不同于所述检测探针1和2的荧光基团,3'端连接有不同于所述检测探针1和2的淬灭基团。
在本发明具体实施过程中,为有效监控PCR反应体系是否正常,本发明还分别提供了针对HLA-B*27:04和HLA-B*27:05基因检测的阳性对照物。HLA-B*27:04阳性对照物由人工合成的含SEQ ID No.10序列的重组质粒DNA与人工合成含SEQ ID No.12序列重组质粒DNA按1:1等拷贝混合所得的DNA混合物;HLA-B*27:05阳性对照物由人工合成的含SEQ ID No.11序列的重组质粒DNA与人工合成含SEQ ID No.12序列重组质粒DNA按1:1等拷贝混合所得的DNA混合物。
为了防止反应体系在PCR扩增过程中挥发,影响检测效果,试剂盒还包括有矿物油。
为了便于反应体系的配置,试剂盒还包括10×PCR缓冲液(含Mg2+);热启动DNA聚合酶、dNTPs、阴性对照物:ddH2O。其中热启动DNA聚合酶可采用TaKaRa Ex Taq HS,10×PCR buffer(Mg2+Plus)采用TaKaRa宝生物工程(大连)有限公司,也可应用市场上其他公司的缓冲液与DNA聚合酶。
实施例3采用实时荧光PCR检测HLA-B27基因位点的方法
根据实施例1筛选设计的HLA-B*27:04基因检测引物对及检测探针、HLA-B*27:05基因检测引物对及检测探针进行合成,可在检测探针的5'端连接荧光基团,3'端连接淬灭基团,其中,荧光基团为FAM、JOE、CY3、HEX、VIC中任意一种,所述淬灭基团为MGB、BHQ1、TAMRA、BHQ2中任意一种。
其中,在本实施例中探针合成时,探针与荧光和淬灭基团相连,检测探针1和2的荧光-淬灭基团为优选为FAM-MGB,质控探针的荧光-淬灭基团优选为JOE-TAMRA。当然,检测探针1、2和质控探针采用其它荧光-淬灭基团组合也同样适用,比如,HEX-BHQ1、HEX-TAMRA、FAM-TAMRA、FAM-BHQ1、CY3-BHQ1、CY3-BHQ2等,检测时选择相应的荧光检测模式。
应用本发明设计的引物对和检测探针,对检测样品的DNA模板,进行HLA-B*27:04、HLA-B*27:05基因的实时荧光PCR扩增检测,采用HLA-B*27:04和HLA-B*27:05的反应体系,均用25μL反应体系,反应体系如表1配置,进行实时荧光PCR扩增;
表1荧光定量PCR反应体系组成
将PCR管放入荧光定量PCR仪器中,进行荧光PCR扩增检测。PCR扩增反应条件为:
第一阶段:95℃变性10min;
第二阶段:94℃30s,58℃30s,10个循环;
第三阶段:94℃30s,60℃30s(该阶段收集荧光信号),30个循环。
PCR程序运行结束后,选择对应荧光基团的荧光检测模式,基线调整取3~15个循环的荧光信号,以阈值线刚好超过正常阴性对照的最高点设定阈值线。
对样品进行检测时,避免漏检,如避免有的反应孔中未加检测样本的情况出现,在每个反应孔中设置有内部质控,应当注意的是检测探针与质控探针荧光基团标记为不同检测模式的荧光基团。具体的实时荧光PCR扩增反应体系组成按表1配置。
结果分析时,对内部质控分析:根据ROC分析方法将内控信号Ct值的分界点定为25。每个样品内控JOE信号应有典型的“S”型扩增曲线,且Ct值<25;若Ct≥25,说明反应体系中DNA模板上样量不足或待检样本DNA中可能存在PCR抑制剂,建议适量增加DNA上样量或重新提取样品DNA;若内控无Ct值,可能存在待检样本DNA漏加等。
为了避免反应体系受到污染或体系成分错加,而导致检测结果不准确,还设有阳性对照和阴性对照,所述阳性对照为以含有如SEQ ID No.10和SEQ ID No.12核苷酸序列所示的HLA-B*27:04阳性对照物、含SEQ ID No.11和SEQ ID No.12核苷酸序列所示的HLA-B*27:05阳性对照物为模板,进行所述反应体系1和反应体系2的实时荧光PCR扩增;所述阴性对照为以ddH2O为模板,进行所述反应体系1和反应体系2的实时荧光PCR扩增;对应的检测结果,在步骤(4)中,所述阳性对照的反应体系1和反应体系2的FAM均有典型的“S”型扩增曲线,FAM信号的Ct值Ct≤26,且其JOE信号有典型的“S”型扩增曲线,JOE信号的Ct值<25,符合要求;所述阴性对照的反应体系的FAM、JOE均没有扩增曲线或Ct值,符合要求;否则,应重新进行体系配置,重新检测。
上述实时荧光PCR反应可使用的仪器包括ABI实时PCR系统(例如7300、7500、7900等);BioRad实时PCR检测系统、LightCycler480实时荧光定量PCR仪。
实施例4:检测实施例2中制备的试剂盒的灵敏度
1、DNA梯度稀释、上样
选取经Sanger测序验证后的HLA-B*27:04和HLA-B*27:05阳性基因型DNA样本,经微量紫外分光光度计测量浓度和纯度后,用双蒸水分别10倍等梯度稀释到10ng/μL、1ng/μL、0.1ng/μL、0.01ng/μL。
参照实例3方法中配置PCR反应液并加样,设定PCR反应程序,在ABI7500荧光定量PCR仪上运行程序。
2、灵敏度分析
自动设置阈值线获取各浓度样本Ct值。10ng/μL、1ng/μL、0.1ng/μL的DNA上样浓度均获得了该位点阳性检测结果,而0.01ng/μL的DNA上样浓度由于Ct值超过阴阳性结果界定值,而判别为阴性结果。HLA-B*27:04反应体系灵敏度检测和HLA-B*27:05反应体系灵敏度检测的扩增图如图1和图2所示,因此,本发明的试剂盒能准确检测低至0.1ng/μL的DNA样本。
实施例5:用本发明制备的试剂盒检测临床样本
1、从人外周血或口腔拭子中抽提DNA样本
从自愿者获得20例人外周血样本,使用天根生化科技有限公司相关DNA提取试剂盒获取DNA样本(详细操作细节见相关说明书)。DNA抽提完成后,用微量紫外分光光度计检测其浓度和纯度,样本DNA浓度不小于20ng/μL,且OD260/280在1.7~1.8之间。样本DNA应于-20℃长期保存,避免反复冻融。
2、PCR反应液配制
按实施例3检测方法中分别配制人HLA-B*27:04、HLA-B*27:05检测体系PCR反应液(PCR反应体系见表1),其中PCR反应液包括引物、探针、热启动DNA聚合酶、dNTPs混合液、PCR缓冲液(含Mg2+)、ddH2O。反应液配好后分装于PCR管中,分别向以上2个检测体系管中加入2.0μL同一样本DNA模板。每次实验均应安排阳性对照孔和阴性对照(NTC)孔。加好样品后盖好管盖,在孔板离心机上短暂离心数秒。
3、荧光PCR检测
将PCR管放入荧光定量PCR仪器中,进行荧光PCR扩增检测。PCR扩增反应条件为:
第一阶段:95℃变性10min;
第二阶段:94℃30s,58℃30s,10个循环;
第三阶段:94℃30s,60℃30s(该阶段收集FAM和JOE信号),30个循环。
PCR程序运行结束后,使用仪器自动设置的基线和阈值线获取各样本Ct值。
4、结果判读
NTC分析:正常情况下,NTC孔应无扩增曲线或Ct值;若NTC孔有Ct值,说明在实验过程中可能存在污染,应排除污染来源后重新开始新的实验。
内控分析:每个样品内控JOE信号应有典型的“S”型扩增曲线,且Ct值<25;若Ct≥25,说明反应体系中DNA模板上样量不足或待检样本DNA中可能存在PCR抑制剂,应适量增加DNA上样量或重新提取样品DNA;若内控无Ct值,可能存在待检样本DNA漏加等。
样本基因型分析:本试剂盒包含2个检测体系,能分别检测HLA-B*27:04、HLA-B*27:05基因型,利用这2个检测体系对同一样本DNA进行检测,根据FAM信号Ct值对样本HLA-B27基因型进行判断。根据ROC分析方法将FAM信号Ct值分界点定为26。在以上2孔检测体系中,当至少有一孔体PCR反应体系FAM信号呈现典型的“S”型扩增曲线,且Ct值≤26时,该待检DNA样本才为HLA-B27阳性,否则,为HLA-B27阴性。具体可见表2样本基因型判断标准。
扩增图的结果,如图3为HLA-B*27:04阳性样本扩增曲线,如图4为HLA-B*27:05阳性样本扩增曲线,如图5为HLA-B*27:04/HLA-B*27:05杂合型样本扩增曲线,如图6为HLA-B*27阴性样本扩增曲线。
表2样本基因型判断标准
将提取的20例人外周血样本基因组DNA,分别用本发明试剂盒和Sanger测序法对样本HLA-B27基因进行检测,其中测序送由武汉擎科生物技术有限公司完成。检测结果见表3,本试剂盒检测结果与“金标准”Sanger测序法相比较,符合率100%。结果说明本试剂盒检测准确性高、操作简单、耗时短。
表3本试剂盒检测结果与测序法比较
以上所述实施例仅是为充分说明本发明而所举的较佳的实施例,本发明的保护范围不限于此。本技术领域的技术人员在本发明基础上所作的等同替代或变换,均在本发明的保护范围之内。
SEQUENCE LISTING
<110> 武汉海吉力生物科技有限公司
<120> 用于检测HLA-B27基因的检测试剂盒和方法
<130>
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 19
<212> DNA
<213> 人工序列
<400> 1
gcaaggccaa ggcacagac 19
<210> 2
<211> 18
<212> DNA
<213> 人工序列
<400> 2
ctctcagctg ctccggct 18
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
cgagagagcc tgcggaccct 20
<210> 4
<211> 19
<212> DNA
<213> 人工序列
<400> 4
ggagtattgg gaccgggag 19
<210> 5
<211> 18
<212> DNA
<213> 人工序列
<400> 5
ctctcagctg ctccggca 18
<210> 6
<211> 20
<212> DNA
<213> 人工序列
<400> 6
cgagaggacc tgcggaccct 20
<210> 7
<211> 19
<212> DNA
<213> 人工序列
<400> 7
tgagggttct ttgtgctga 19
<210> 8
<211> 18
<212> DNA
<213> 人工序列
<400> 8
aggaagggct ttgtgagg 18
<210> 9
<211> 23
<212> DNA
<213> 人工序列
<400> 9
catccctcac cccttcaatg ccc 23
<210> 10
<211> 273
<212> DNA
<213> 人工序列
<400> 10
gcaaggccaa ggcacagact gaccgagaga gcctgcggac cctgctccgc tactacaacc 60
agagcgaggc cgggtctcac accctccaga atatgtatgg ctgcgacgtg gggccggacg 120
ggcgcctcct ccgcgggtac caccaggacg cctacgacgg caaggattac atcgccctga 180
acgaggacct gagctcctgg accgccgcgg acacggcggc tcagatcacc cagcgcaagt 240
gggaggcggc ccgtgaggcg gagcagctga gag 273
<210> 11
<211> 302
<212> DNA
<213> 人工序列
<400> 11
ggagtattgg gaccgggaga cacagatctg caaggccaag gcacagactg accgagagga 60
cctgcggacc ctgctccgct actacaacca gagcgaggcc gggtctcaca ccctccagaa 120
tatgtatggc tgcgacgtgg ggccggacgg gcgcctcctc cgcgggtacc accaggacgc 180
ctacgacggc aaggattaca tcgccctgaa cgaggacctg agctcctgga ccgccgcgga 240
cacggcggct cagatcaccc agcgcaagtg ggaggcggcc cgtgtggcgg agcagctgag 300
ag 302
<210> 12
<211> 158
<212> DNA
<213> 人工序列
<400> 12
tgagggttct ttgtgctgag cggggccctg caggggagaa aggcccatcc ctcacccctt 60
caatgccccc actgtggcat ccctgggact ggggaggctg atggggaagg ttgagccttt 120
actagctgga tctcccagtt cctcacaaag cccttcct 158
- 还没有人留言评论。精彩留言会获得点赞!