一种靶向抑制血小板聚集的抗栓小肽ωKWR的制作方法
本发明涉及蛋白质多肽领域,具体地讲,涉及一种更加稳定的、活性更高的靶向识别血小板表面整合素αIIbβ3的小肽的制备及用途。
背景技术:
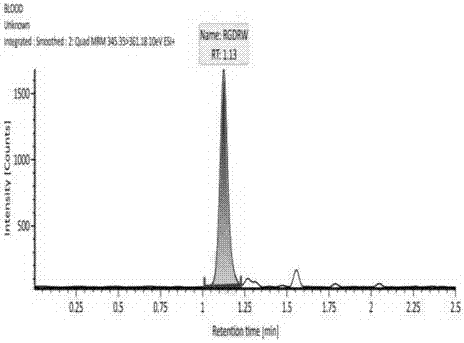
:心脑血管疾病如心肌梗死、脑梗塞是一种严重威胁人类健康的重大疾病,全世界每年死于心脑血管疾病的人数高达1500万人以上,且呈现逐年递增和年轻化的趋势。心脑血管疾病“发病率高、致残率高、死亡率高、复发率高、并发症多”(四高一多)的特点,已成为人类健康的主要威胁,其发生发展与动脉粥样斑块破裂、血栓形成及血栓栓塞等因素密切相关。因此,抗栓药物成为防治心血管疾病的重要基石。抗栓是治疗各种血栓栓塞性疾病的核心,了解各类抗栓药物的作用机制以及新型抗栓药物的特点才能更好地预防和治疗心血管疾病。目前用于临床的血栓抑制剂有很多种。1、一些溶栓药物如溶栓药尿激酶、链激酶,TPA等具有一定的溶解血栓作用,尤其在短时间内介入治疗无法实施的情况下,溶栓治疗能尽早地开放血管,使缺血心肌更早得到再灌注,从而减少梗死面积、改善患者预后。但溶栓治疗后早期和持续开通率相对冠脉介入治疗低,90分钟梗死相关血管的开通率为40%〜85%,溶栓后90分钟内梗死相关血管向前血流达TIMIG3级者约占20%〜60%。另外,溶栓治疗的出血的并发症是个不可忽视的问题;2、目前常用的抗血小板药物包括环氧酶抑制药,以阿司匹林(缺点是出血、胃肠道反应和变态反应)为主要代表,通过肠道可以完全吸收;ADP受体拮抗药:如氯吡格雷(缺点是出血和胃肠道反应)和替格瑞洛(缺点是呼吸困难和皮下出血);血小板αIIbβ3受体拮抗药:如阿昔单抗和替罗非班,目前是最强的抗血小板药物(一般只能从静脉或冠状动脉给药);3、抗凝药物:可以从各个途径阻断凝血途径,用于预防和治疗各种静脉和动脉血栓,代表性药物有华法林(缺点是治疗窗狭窄、需定期检测INR)和肝素(有诱发血小板减少的风险),肝素钠(容易导致出血、血小板减少和骨质疏松);4、口服抗凝药近年来,起效快、安全性高、无需常规监测的新型口服抗凝药物不断涌现,为临床提供了更为有效、方便、安全的选择。如达比加群酯(缺点是缺乏特异拮抗药,影响肾功能),利伐沙班(缺点是缺乏特异拮抗药,影响肝功能)和阿哌沙班(治疗窗狭窄)。前面提到的多数抗栓药物普遍在临床得以应用,都或多或少存在用药量大,停药易反复、价格昂贵及需要多次给药的缺点,特别是除了血小板αIIbβ3受体拮抗药(阿昔单抗和替罗非班)外,多数的抗血小板聚集药只能阻止血小板活化途径中的一条通路,当某一特定通路被充分抑制时,血小板仍可通过其它途径活化,引起血小板聚集。血栓形成的共同通路也即关键环节是:血小板活化后,表面膜受体发生构象改变,αIIbβ3受体暴露,纤维蛋白RGD序列被αIIbβ3受体特异性识别,介导纤维蛋白与血小板的结合,该过程犹如链条把相邻血小板聚在一起形成血栓,正是由于RGD序列与αIIbβ3受体的特异性结合,因此含有RGD序列的多肽即可以竞争性抑制纤维蛋白与血小板的结合,从而抑制血栓形成,即可以阻断血栓形成的最后通路。RGD是精氨酸-甘氨酸-天冬氨酸组成的三肽。1984年Pierschbacher和Ruoslahti首次确定了RGD序列为人纤维连接蛋白与其受体结合位点。研究发现:RGD广泛存在于细胞识别系统。基质蛋白中的RGD是与细胞表面特异受体相互作用的识别位点,这些细胞表面膜蛋白是广泛分布的超级家族—粘附受体的成员,称为整合素。整合素在正常情况下无活性,一旦在激素,细胞因子或其它因素的刺激下,其构型和亲合力发生改变,整合素受体与特异性配体的RGD结构结合,引起细胞内一系列生化改变,进而影响多种组织细胞功能的调控,包括细胞凋亡,分化,增殖,迁移,粘附,血小板聚集等一系列病理生理过程。国内外对RGD多肽的生物学活性进行的大量研究,证明了RGD多肽在疾病治疗方面具有广阔的应用前景。RGD及类似物对预防和治疗心脑血管疾病、骨质疏松以及由细胞粘连异常而导致的肿瘤等疾病具有重要作用,人工合成的RGD多肽或化合物也具有类似的生物学活性,含有RGD多肽已成为医学研究的热点。1991年J.Samanen等合成了一系列含有RGD序列的小肽,经过药理活性试验发现了它们可抑制纤维蛋白原与血小板的结合,抑制血栓的形成。众多实验研究表明,RGD多肽作为αIIbβ3受体拮抗剂,可以阻断血栓形成的最终通路,理论上具有彻底抑制血栓形成的功能。目前一些科学家已通过人工合成一些RGD序列的小肽进行基础及临床试验,并取得一定成果。如RGDS,DRGDW,GRGDSPA等都可抑制纤维蛋白与血小板结合,抑制血栓形成。研究表明,通过改变RGD周边氨基酸或结构能改变与血小板αIIbβ3结合的特性,用Val取代Arg将使RGD的活性降低10倍,用Ala取代Gly出现类似结果,用Glu取代Asp将使其功能完全丧失。逆转RGDS和RGDV序列将使其对血小板抑制功能完全丧失。另有实验研究表明:GRGDSP六肽(Gvy-Ay-Gy-Asy-Ser-Pro)可直接抑制纤维蛋白(Fg)与血小板的结合;Eward等发现RGDS明显抑制Fg和ADP激活的血小板结合;Rote等发现含RGD序列的SC-4992呈量依赖地抑制血栓形成,抑制ADP和花生四烯酸引起的血小板聚集。天然存在的含RGD的多肽和人工合成含RGD的小肽,一般都具有相似的功能,既可以抑制血栓形成、也具有抑制肿瘤转移和骨质疏松的功能,因此,RGD类似物作用广泛但不特异,如何提高其作用的特异性和活性是研究人员的关注热点,也是我们多年来的研究重点。近年来,我们通过突变EchistatinRGD模体周边部分氨基酸,得到两种不同的突变体。建立了这两种突变体的基因工程生产工艺,通过药效学研究RGD周边氨基酸的变化对其活性的影响,在RGD模体周边氨基酸突变研究方面积累了一定的经验。研究表明,第四位氨基酸对其活性影响最大,以疏水氨基酸为佳,疏水性越强,其抑制纤维蛋白与αIIbβ3结合力越强。在RGD基础上,增加一个疏水性氨基酸和一个碱性氨基酸,序列为Arg-Gly-Asp-Trp-Arg(命名为RWR)。在后来在药代动力学研究中发现,RWR性质不稳定,半衰期很短,非常容易降解,如果应用到临床,就需要多次大剂量给药,给临床用药造成一定的麻烦,还可能引起一些副作用,为了提高其稳定性,我们在RWR氨基端增加ω-氨基辛酸,结构式为H2N(CH2)7-CO-Arg-Gly-Asp-Trp-Arg,并将其命名为ωRWR。又根据去整合素Barbourin含有KGD(Lys-Gly-Asp)而不是RGD更倾向于结合αIIbβ3,但对αvβ3,α5β1结合能力较弱,可能由于R、K侧链基团的不同,引起对不同整合素的识别特异性不同,并且根据RGD环较宽时,对αIIbβ3的结合能力增强的特点,将ωRWR中的第一个R突变为K,将Asp和Trp互换,形成一种新的小肽ωKWR,其一级结构为式为H2N(CH2)7-CO-Lys-Gly-Trp-Asp-Arg。本发明的目的,在于提供一种能够高效、特异识别和抑制血栓形成的多肽,特别是理化性质非常稳定,从而克服现有血栓生成抑制剂及一些溶栓药物存在的副作用大、特异性不强,特别是解决了小肽稳定性差的问题,以期在临床治疗中发挥高效、稳定、特异的抑制血栓形成的作用。技术实现要素:本发明提供了一种全新的小分子多肽,对RWR进行改造。根据RGD能结合αIIbβ3的特性,第一位增加一个ω-氨基辛酸,第二位为K,第四位为疏水性氨基酸W,W的引入在结构上可以增加与αIIbβ3结合的范围,第五位为碱性氨基酸R,既通过突变K,进一步提高了特异结合αIIbβ3能力,而且通过增加ω氨基辛酸提高了其稳定性,解决了现有抗血栓制剂存在的一系列缺点。该小肽序列为H2N(CH2)7-CO-Lys-Gly-Trp-Asp-Arg。其蛋白质一级结构为ωKGWDR,该化合物能显著提高其生物学活性,降低RGD小肽的副作用。本发明的要点之一在于,提供一种新的小分子多肽设计与合成,将氨基酸序列设计为:H2N(CH2)7-CO-Lys-Gly-Trp-Asp-Arg,其蛋白质一级结构为ωKGWDR,将其命名为ωKWR。本发明的要点之二在于,ωKWR作用机理独特,和纤维蛋白原竞争αIIbβ3受体拮抗剂,竞争性的抑制纤维蛋白原与血小板的结合(即抑制血栓形成的最后共同通路)的作用,特别课题组创造性引入第一位ω-氨基辛酸(提高稳定性),第二位氨基酸为K(氨基酸组成上提高其选择性和活性)第四位氨基酸W(空间结构上提高其活性),第六位氨基酸R与KGW模体共同发挥作用,提高了活性,特异性以及稳定性,高效抑制任何激活剂引起的血小板聚集,它作用的选择性、高效性和稳定性是显而易见的。发明优点:本发明的优点与积极效果在于,利用化学合成或者基因工程技术设计并制备了一种小分子多肽,所述多肽具有明显抑制血栓生成的作用,且具有副作用小,特异性强,活性高,稳定性强的优点。有望成为一种新型血栓生成抑制剂,为临床提供一种新的抗血栓药物和治疗血栓的方法。发明效果:本发明的优点和效果是具有很强的抑制血小板聚集的活性;具有副作用小,特异性强,活性高,特别是非常稳定。该分子成本低,易于合成,因此有很广阔的市场和临床应用前景。附图说明图1-刚制备的RWR血浆样本;图2-配置后冰上放置4h小时的含RWR血浆样本。图3-为刚制备的wKWR的血浆样本;图4-配置后冰上放置4h小时的含ωKWR血浆样本表1-ωKWR与替罗非班抑制血小板聚集的比较表2-ωKWR在不同条件下的稳定性实施方案:以下实施例仅为帮助本领域技术人员更好地理解本发明,但不以任何方式限制本发明。<实施例1>:ωKWR的合成、纯化、鉴定:1、树脂溶胀将RinkAmide-MBHA树脂和DCM(15ml/g)加入反应管,氮气振荡(20min)。继而滤掉DCM,加入4倍的Fmoc-Arg(Pbf)-OH氨基酸、HBTU,和10倍的DIEA,最后加入DMF溶解。室温下氮气震荡20min。滤掉DMF,用20%哌啶DMF溶液(15ml/g)震荡10min,滤掉哌啶,重复一次哌啶DMF震荡10min。滤掉哌啶,取树脂用乙醇过滤,并加入茚三酮、KCN、苯酚溶液各一滴,105℃-110℃加热10min颜色变蓝为止。最后可将反应管中的载体树脂分别用DMF、甲醇、DCM洗两次。将载体树脂上残余的哌啶洗掉。2、缩合反应重复1步骤,从右到左依次连接序列中的氨基酸。将树脂用DCM洗涤多次,真空抽干,向装有树脂的多肽固相反应器中缓慢加入切割液10ml/g(TFA94%;H2O2.5%;EDT2.5%;TIS1%)。恒温摇床震荡3h,用氮气去除大部分溶剂,向残液中加入无水乙醚呈现白色沉淀。离心去除杂质。将切割液用氮气尽量吹干,再用乙醚漂洗多次,常温挥发掉溶剂,得到ωKWR粗品。3、ωKWR纯度检测与定性表征鉴定选用C18高效液相色谱法,将环己醇和三氯甲烷以9:11~13:7的体积比混合,加入粒径为5μm的C18硅胶制备成浓度为14.5%的匀浆液,充分搅拌,超声波振荡10min,匀浆呈无色透明液体;将甲醇和异丙醇以1:1混合作为顶替液;把制备的匀浆液倒入已连接色谱柱管的匀浆罐中;将顶替液加入到顶替罐,在装柱机6000psi压力下,将顶替液输入匀浆罐中,并进入到色谱柱中,待色谱柱中流出顶替液70ml~100ml,关闭装柱机,停止加压,至系统压力降至常压时,静置30分钟,卸下色谱柱。ωKWR继续经电喷雾离子化质谱(Electrosprayionizationmass,ESI-MS)进行鉴定。<实施例2>:ωKWR抑制血小板聚集实验选取30只新西兰家兔(雌雄各半),体重(2.5±0.5)kg,分为10组,分为NS组,对照组(Tirofiban:4.8,16.32,64,μmol/L),干预组(ωKWR:4.8,16.32,64,μmol/L),家兔于清醒状态下心脏采血,以3.8%枸橼酸钠抗凝(血与抗凝剂的体积比为9:1),800r/min离心8min,分离富血小板血浆(Platelet-RichPlasma,PRP),余血再以3000r/min离心10min,分离贫血小板血浆(Platelet-PoorPlasma,PPP)。将血小板聚集仪预热30min,温度控制在(37±1.2)℃,将分离出的PPP和PRP各取400μl,加至比色杯中,用PPP管调零,插入PRP管,读取吸光度(A)值,并计算血小板数。用PPP调整PRP中血小板浓度至30万~40万/μl;取400μl和磁珠一起放入比色杯中,预热5~10min,分别加入生理盐水或Tirofiban或ωRWR50μl,加入10mg/ml的ADP溶液50μl,测定血小板最大聚集率,连续记录10min。按下式计算RWR对血小板聚集抑制率(%)。血小板聚集抑制率(%)=(对照组血小板最大聚集率该组血小板最大聚集率/对照组血小板最大聚集率×100%结果见表1。<实施例3>:利用LC-MS/MS法定量比较ωKWR和RWR的稳定性1、方法1.1液相条件:色谱柱:ACQUITYUPLCBEHHILIC,2.1´50mm,1.7μm,Waters(可根据实际情况使用相同类型的其他色谱柱),流速:0.6ml/min,柱温:40℃,进样器温度:4℃,进样体积:10μl,流动相:A相为含有0.1%甲酸水溶液,B相为含有0.1%甲酸的乙腈溶液,运行时间:2.5min。梯度:Time(min)A(%)B(%)0.0090100.3090101.0010902.0010902.5090101.2质谱条件:串联四极杆质谱,带有ESI源,采用正离子扫描方式,MRM扫描,源参数:Sourcetemperature(°C):150,Desolvationgasflow(L/h):900,Capillaryvoltage(kV):3.00,Desolvationtemperature(°C):550。1.3试剂准备内标工作溶液,精确称量盐酸二甲双胍,用超纯水将盐酸二甲双胍配制成浓度为1mg/ml的内标储备液。PMSF用乙醇稀释成35mg/ml的溶液,配制HCl的浓度为0.25mol/l。RWR溶于生理盐水配制10μg/mL储备液1,wKWR溶于生理盐水配制10μg/ml储备液2(储备液现用现配)。1.4分析样本1.4.1RWR的检测样本配制①取20μl储备液1,加入空白血浆980μl,配置成200ng/ml的血浆样本。②分别用PMSF(VPMSF:V血浆=2:98)、HCl(VHCL:V血浆=1:2)、HCl+PMSF(VPMSF:VHCL:V血浆=1:25:50)处理空白血浆,取20μl储备液2,分别加入到980μl处理好的血浆中,配制成200ng/ml含有PMSF、HCl、HCl+PMSF的血浆样本。1.4.2ωKWR的检测样本配制①取20μL储备液2,加入空白血浆980μl,配置成200ng/ml的血浆样本。②分别用PMSF(VPMSF:V血浆=2:98)、HCl(VHCL:V血浆=1:2)、HCl+PMSF(VPMSF:VHCL:V血浆=1:25:50)处理空白血浆,取20μl储备液2,分别加入到980μl处理好的血浆中,配制成200ng/ml含有PMSF、HCl、HCl+PMSF的血浆样本。1.4.3不同条件下ωKWR血浆样本的稳定性精密移取适量储备液2,用空白血浆配置成2ng/ml、800ng/ml的样本,分别在10~30℃放置4h、-70℃以下放置7d和13d、反复冻融3次及样本处理后进样器中放置24h,检测其稳定性情况。1.4分析流程分别取50μl各组份配制时和放置4h后的样本至微孔管,加入150μl内标工作溶液(100ng/ml二甲双胍甲醇溶液),涡旋混匀,3000g离心10min,取100μl上清加入50μl超纯水混匀,进样分析。稳定性以准确度表示,准确度介于85~115%视为样品稳定,准确度(%)=实测值的平均值/理论值×100(%)。、结果刚制备的含RWR的血浆样本冰上放置4h小时后,其峰面积由11625降为3875,降到原来的33.3%,表明药物RWR明显降解,见图1、图2;图3、图4为ωKWR的血浆样本,图3峰面积为251910,图4峰面积为250367,4h后血浆样本中ωKWR的量为配制时的99.4%,说明ωRWR在血浆样本中非常稳定;表2提示,在各种不同的环境中,ωKWR降解不明显,性质非常稳定。H2N(CH2)7-CO-Lys-Gly-Trp-Asp-Arg当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法