一种靶向沉默HDAC1基因的LV‑HDAC1shRNA慢病毒合成方法及应用与流程
本发明涉及一种生物技术领域,尤其是涉及一种靶向沉默hdac1基因的lv-hdac1shrna慢病毒合成方法,本发明还涉及将该慢病毒作为高效调控胞内hdac1表达的表观遗传修饰药物的应用。
背景技术:
近年来,干细胞替代疗法为包括创伤性脑损伤(tbi)在内的中枢神经损伤疾病的治疗带来希望。脐带源性间充质干细胞(huc-msc)具有一定的增殖分化能力,是伦理争议小、临床应用价值高的种子细胞。但鉴于干细胞在体内外增殖和分化效率有限,目前亟需更为安全、有效的诱导调控方式提高其成神经分化潜能。
学者struhlk提出:组蛋白乙酰化修饰的表观遗传干预手段,可调控细胞内乙酰化酶(hat)和去乙酰化酶(hdac)的动态平衡来调控干细胞的增殖和定向分化。本申请的发明人团队前期研究表明,与未分化的干细胞相比,已分化的成熟神经元中hdac1的表达量降低。学者吕建祎认为:影响干细胞分化、增殖的阻遏复合物上,hdac1、2都有表达;且学者macdonaldjl指出:敲除hdac2可能会抑制神经祖细胞的增殖。这与本申请发明人团队的前期研究结果一致。这表明,靶向调控hdac1有助于干细胞神经命运决定的启动。
目前,调控细胞组蛋白乙酰化水平的常用手段是使用hdac抑制剂。但是仍存在很多不足:1.广谱性的hdac抑制剂特异性不强,且可能存在剂量依赖性,损害脑认知能力;2.特异性的hdac1抑制剂虽可改善胞内hdac1水平,但细胞传代、增殖后,干预效果呈现递减效应;3.hdac抑制剂价格昂贵,体内实验成本高。因此,有效稳定的靶向干预hdac1对于调控干细胞神经分化潜能十分重要。
技术实现要素:
本发明的目的在于针对组蛋白去乙酰化酶1(hdac1)抑制剂存在的不足,提供一种靶向沉默hdac1基因的lv-hdac1shrna慢病毒合成方法;本发明还提供合成的lv-hdac1shrna慢病毒作为高效调控胞内hdac1表达的表观遗传修饰药物的应用。
为实现上述目的,本发明可采取下述技术方案:
1、本发明所述的靶向沉默hdac1基因的lv-hdac1shrna慢病毒合成方法,包括下述步骤:
第一步,genbank上检索人hdac1的mrna序列,合成特异性的shrna片段;
第二步,用lipofectamin2000转染sirna到hek293细胞中,置于co2培养箱培养72h,提取细胞总rna;利用实时荧光pcr技术筛选具有最佳干扰hdac1效率最高的shrna;
第三步,利用mu6-mcs-ubi-egfp工具载体质粒、phelper1.0载体质粒、phelper2.0载体质粒,合成慢病毒lv-hdac1shrna。
2、本发明合成的lv-hdac1shrna慢病毒作为高效调控胞内hdac1表达的表观遗传修饰药物的应用。
2.1本发明采取上述慢病毒lv-hdac1shrna感染huc-msc筛选可靶向沉默hdac1基因、调控胞内乙酰化水平、增殖良好的hdac1shrna-msc细胞株,评估其周期、凋亡、迁移能力:
(1)将huc-mscs细胞按3~5×104ml-1密度接种于96孔板中的12个孔内,体积为90μl,细胞培养箱中培养24h;
(2)利用慢病毒lv-hdac1shrna感染huc-mscs,在倒置荧光显微镜下,通过比较各组细胞感染效果,确认huc-mscs的感染条件和感染参数;
(3) 使用已确定复感染指数的慢病毒lv-hdac1shrna感染huc-mscs,流式分选获取稳定整合慢病毒lv-hdac1shrna细胞,记作hdac1shrna-msc细胞;
(4)荧光定量pcr、westernblot检测慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞内hdac1基因沉默情况、乙酰化水平;
(5)cck8法测定慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞的增殖曲线;
(6)pi染色检测慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞周期;
(7)sa-β-gal实验检测hdac1shrna-msc细胞衰老情况;
(8)caspase3检测评估hdac1shrna-msc细胞凋亡;
(9)transwell迁移实验检测hdac1shrna-msc细胞细胞迁移。
2.2本发明用神经分化诱导培养基诱导msc和hdac1shrna-msc细胞,qrt-pcr、免疫荧光评估慢病毒lv-hdac1shrna对huc-mscs神经诱导分化的影响:
(1)利用复合诱导培养基对msc和hdac1shrna-msc细胞进行神经分化诱导;
(2)提取诱导分化后的msc、hdac1shrna-msc组细胞rna,用荧光定量pcr检测慢病毒lv-hdac1shrna对huc-mscs细胞神经分化相关基因mrna水平的影响;
(3)免疫荧光检测诱导神经元样细胞神经元迁移蛋白dcx、神经元特异性烯醇化酶nse表达情况:dcx表达阳性者为神经前体细胞,nse表达阳性者为神经元样细胞。
2.3侧脑室移植hdac1shrna-msc细胞,利用qrt-pcr检测小鼠神经分化相关基因与神经营养因子的表达情况,利用新事物识别实验评估移植后小鼠神经记忆恢复情况:
(1)侧脑室移植hdac1shrna-msc细胞,qrt-pcr检测小鼠神经分化相关基因与神经营养因子的表达情况;
(2)利用新事物识别实验评估移植后小鼠神经记忆恢复情况。
本发明的优点在于:
1、合成的lv-hdac1shrna慢病毒携带gfp荧光标签,便于跟踪、选择和富集转染的细胞;且有较高的转染效率,可长时间维持基因沉默;采用第2代系统的慢病毒载体,所收集的慢病毒为“自杀”性病毒,即病毒感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒。
2、慢病毒lv-hdac1shrna感染huc-mscs,hdac1基因表达水平明显下调,h3k9ac表达显著增加。慢病毒改变huc-mscs细胞乙酰化水平的同时,可明显促进其增殖和神经分化潜能的提高,更有利于后续细胞移植治疗;
3、侧脑室移植lv-hdac1shrna感染的huc-mscs,可以通过提高神经分化相关基因与神经营养因子的表达,继而改善tbi小鼠学习记忆能力,促进其神经修复。
附图说明
图1是本发明制备的shrna3转染人脐带间充质干细胞后,应用荧光定量pcr、westernblot检测shrna3干扰hdac1基因表达效率的结果。
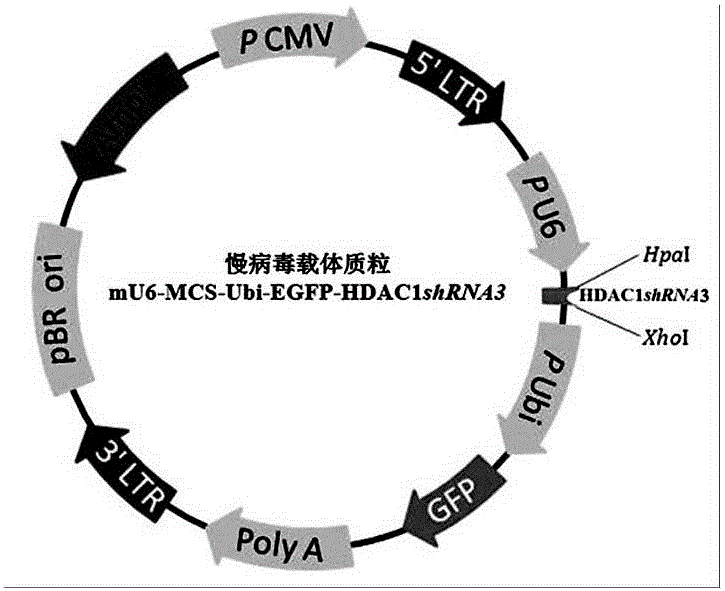
图2 是本发明制备的mu6-mcs-ubi-egfp-hdac1shrna3慢病毒载体质粒结构图。
图3是采用本发明制备的慢病毒lv-hdac1shrna感染分选收获的hdac1shrna-msc细胞,倒置荧光显微镜下细胞形态学照片(100x)。
图4是采用本发明制备的慢病毒lv-hdac1shrna感染分选收获的hdac1shrna-msc细胞应用荧光定量pcr、westernblot检测hdac1基因沉默情况、细胞乙酰化水平结果。
图5是采用本发明制备的慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞应用cck8法测定的增殖曲线。
图6是采用本发明制备的慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞应用pi染色法测定的细胞周期结果。
图7是采用本发明制备的慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞应用sa-β-gal法测定的细胞衰老结果。
图8是采用本发明制备的慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞应用caspase3检测的细胞凋亡结果。
图9是采用本发明制备的慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞应用transwell迁移实验检测的细胞迁移结果。
图10是采用本发明制备的复合诱导培养基诱导慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞4d后,应用荧光定量pcr检测神经分化相关基因mrna水平影响的结果。
图11是采用本发明制备的复合诱导培养基诱导慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞4d后,dcx、nse阳性细胞免疫荧光染色结果(x200)。
图12是侧脑室移植慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞治疗脑损伤模型小鼠28d后,应用荧光定量pcr技术检测小鼠神经分化相关基因与神经营养因子表达情况的结果。
图13是侧脑室移植慢病毒lv-hdac1shrna感染的hdac1shrna-msc细胞治疗脑损伤模型小鼠28d后,应用新事物识别实验评估移植后小鼠神经记忆恢复情况的结果。
具体实施方式
下面通过具体实施例对本发明做更详细的说明。其中采用的实验方法,若无特别说明,均为常规方法;实验所用的器具、仪器、试剂均可通过商业途径获得。
实施例1:合成、筛选具有稳定靶向沉默能力的lv-hdac1shrna慢病毒
(1)genbank上检索人hdac1的mrna序列(nm_004964.2),送吉玛基因合成3条特异性的shrna片段,分别记作shrna1、shrna2、shrna3,序列信息详见表1;
(2)按sirna:lipofectamin2000(1:0.05)转染hek293细胞,置于co2培养箱培养72h,提取细胞总rna;利用实时荧光pcr技术(引物见表2,结果见图1-a)、westernblot检测筛选出了具有最佳干扰hdac1效率最高的shrna片段(图1-b,c,c为b的灰度分析结果),即shrna3。注:*:与shrna1组相比,p<0.05;#,与shrna2组相比,p<0.05。
(3)把shrna3正义链和反义链溶于退火缓冲液中,90℃水浴15min,冷却至室温,合成双链dnaoligo片段。用hpai和xhoi酶双酶切mu6-mcs-ubi-egfp工具载体质粒并回收;缓冲液中用t4dna连接酶将线性化mu6-mcs-ubi-egfp质粒和已退火dnaoligo片段16℃过夜连接,反应体系如下:
(4)取得到连接液转化ecoli感受态细胞,将pcr鉴定后的阳性克隆进行测序和比对,比对正确的克隆即为构建成功的u6-mcs-ubi-egfp-hdac1shrna3慢病毒载体质粒(图2)。
(5)离心管中混匀dna溶液(mu6-mcs-ubi-egfp-hdac1shrna3载体质粒20μg、phelper1.0载体质粒15μg、phelper2.0载体质粒15μg),用转染试剂定容至1ml,室温孵育15min。
(6)混合液缓慢滴加至293t细胞培养液中,混匀,静置于37℃、5%co2细胞培养箱中培养。
(7)培养6h后弃去含有转染混和物的培养基,加入10ml的pbs液清洗一次,轻柔晃动培养皿以洗涤残余的转染混和物后倒弃。
(8)缓慢加入含10%血清的细胞培养基20ml,于37℃、5%co2培养箱内继续培养48-72h。
(9)根据细胞状态,收集转染后48h(转染即可计为0h)的293t细胞上清液。
(10)于4℃、4000g离心10min,除去细胞碎片。
(11)以0.45μm滤器过滤上清液于40ml超速离心管中。
(12)分别配平样品,将带有病毒上清液的超速离心管逐一放入至beckman超速离心机内,设置离心参数为25000rpm,离心时间为2h,离心温度控制在4℃。
(13)离心结束后,弃去上清,尽量去除残留在管壁上的液体,加入病毒保存液(可用pbs或细胞培养基替代),轻轻反复吹打重悬。
(14)经充分溶解后,高速离心10000rpm、5min后,取上清按要求分装,即为慢病毒lv-hdac1shrna。
实施例2:慢病毒lv-hdac1shrna感染huc-msc,筛选hdac1shrna-msc细胞株
采用实施例1配制的慢病毒lv-hdac1shrna感染huc-msc,筛选可靶向沉默hdac1基因、调控胞内乙酰化水平、增殖良好的hdac1shrna-msc稳定株,具体步骤如下:
(1)将huc-mscs细胞按3~5×104ml-1密度接种于96孔板中的12个孔内,体积为90μl,细胞培养箱中培养24h;
(2)感染试剂的配制:
配制polybrene(m):使用completemedium稀释polybrene,至终浓度50μg/ml;
配制polybrene(e):使用eni.s稀释polybrene,至终浓度50μg/ml;
使用eni.s将病毒稀释为三种滴度:a组1×108tu/ml、b组1×107tu/ml、c组1×106tu/ml。
(3)以横坐标从左向右为:completemedium、polybrene(m)、eni.spolybrene(e), 纵坐标从上至下为:a组1×108tu/ml、b组1×107tu/ml、c组1×106tu/ml,按表3《感染条件筛选表》分别更换培养液和加入病毒液进行细胞感染;
(4)混匀后继续培养,8-10h后观察细胞状态,并更换为新鲜培养基;
(5)感染3-4天后,观察各组荧光表达情况。其中,每隔1天换液1次,以保持细胞活性;
(6) 在倒置荧光显微镜下,确认huc-mscs复感染指数(multiplicityofinfection,moi)为10,慢病毒lv-hdac1shrna感染p3代huc-mscs2~3天,传代1次后,流式分选获取稳定整合慢病毒lv-hdac1shrna细胞系,倒置荧光显微镜存留荧光照片后(图3),记作hdac1shrna-msc细胞。
(7) 提取msc、hdac1shrna-msc组细胞rna和蛋白,利用荧光定量pcr(引物见表2)检测hdac1基因沉默情况、westernblot检测慢病毒lv-hdac1shrna对huc-mscs细胞乙酰化影响,结果显示:与mscs组相比,hdac1shrna-msc组蛋白去乙酰化酶hdac1在mrna水平的表达明显下调(图4-a,p<0.05);huc-msc经慢病毒感染后,hdac1蛋白表达下调,h3k9ac表达上调,且差异显著(图4-b,c,p<0.05)。注:*:mscs组相比,p<0.05。
(8)取状态良好的p4代msc、hdac1shrna-msc组细胞用2.5g/l的胰酶消化离心后,将少许细胞悬液滴加细胞计数盖片边缘,进行细胞计数;根据测定的计数结果,用培养基重悬为密度为2×104ml-1的单细胞悬液。96孔板中,按1500个细胞每孔进行接种,置于37℃、5%co2细胞培养箱中过夜孵育。使用cck8法检测msc、hdac1shrna-msc组细胞增殖情况,结果显示:与对照组相比,感染慢病毒lv-hdac1shrna的细胞有先缓后增的增殖趋势,但无统计学差异(图5)。
(9)将状态良好的p4代msc、hdac1shrna-msc组细胞,培养24h后,用胰蛋白酶消化离心后,弃上清;将细胞沉淀用1ml预冷pbs溶液重悬、清洗后,离心去上清;用70%乙醇固定细胞24h后,离心去上清;在避光条件下,各组细胞分别加入0.5ml的pi染色液,于37℃孵育30min,流式细胞仪检测细胞周期。流式结果显示:较mscs组,hdac1shrna-msc组细胞,g0/g1期下调(由89.245%降至75.861%),s期上调(由8.662%升至20.254%),与细胞增殖联系密切(图6)。
(10)用生长状态良好的p4代msc、hdac1shrna-msc组细胞,以每孔105个细胞接种于6孔板中,待细胞贴壁,完全伸展开后更换培养基。弃去细胞培养液,每孔加入1ml清理液,清洗生长中的细胞表面;弃去清理液,每孔再加入1ml固定液,覆盖整个生长表面,室温孵育10min;弃去固定液,每孔再加入1ml酸性液,清洗细胞表面;弃去酸性液,再次用酸性液清洗细胞一次;弃去酸性液,每孔加入1ml预热30min后的配置好的的β-gal染色工作液,放入37℃培养箱孵育7h,光学显微镜下观察并计数蓝染细胞(蓝染程度与细胞衰老程度相关性),结果显示,hdac1shrna-msc细胞蓝染率比msc细胞高,细胞衰老亦有增加(图7a,b)。注:*:mscs组相比,p<0.05。
(11)用生长状态良好的p4代msc、hdac1shrna-msc组细胞,取密度为1*105/孔每组设置3个复孔,每孔100μl,用含血清的dmem-f12培养48h。均匀混合caspase3底物和缓冲液,取100μl加入各孔中,孵育1h后酶标仪检测od405nm处的吸光值,结果显示:与msc组相比,hdac1shrna-msc组48h时,caspase3催化产生的pna产生的吸光度有显著增强(图8),细胞凋亡有所增多,但无显著差异。
(12)用生长状态良好的p4代msc、hdac1shrna-msc组细胞,取密度为2*105/孔取细胞悬液200μl接种于transwell小室的上室,将600μl含20%胎牛血清的dmem-f12培养基加入下室,每组设三个复孔;常规培养24h后,用棉签擦去transwell小室上室内面的细胞,4%多聚甲醛固定15min,0.1%结晶紫溶液染色15min,pbs洗3遍,随机取10个视野显微镜下观察、计数拍照。结果显示:较msc组,hdac1shrna-msc组细胞,细胞迁移数目有显著增强(图9)。注:**:mscs组相比,p<0.001。
实施例3:复合诱导培养基神经分化诱导msc和hdac1shrna-msc细胞,评估慢病毒对mscs神经分化的影响
本发明用神经分化诱导培养基诱导msc和hdac1shrna-msc细胞,qrt-pcr、免疫荧光评估慢病毒lv-hdac1shrna对huc-mscs影响,具体步骤如下:
(1)用dmem-lg培养基调整msc和hdac1shrna-msc细胞密度为2×105ml-1,恒温培养至60%汇聚度,da分化培养液预诱导2天、db分化培养液分化诱导1天、dc分化培养液维持诱导1天,完成神经分化诱导,其中诱导培养基特征为:
da分化培养液是由每1000mldmem-lg培养基中添加40mlfbs和10μgbfgf组成,其中bfgf的终浓度达10ng/ml;
db分化培养液是由每1000ml的dmem-lg培养基中添加50mlcerebrolysin、4mgforskolin、5mginsulin、0.36mghydrocortisone、1.86gkcl、7gnacl、2.2gnahco3、190mgnah2po4、95mgmgcl2、222mgcacl2、1.8gd-glucose组成;其中各组分的终浓度达到5%cerebrolysin、10μmforskolin、5μg/mlinsulin、1μmhydrocortisone、2.5mmkcl、120mmnacl、26mmnahco3、1.25mmnah2po4、1mmmgcl2、2mmcacl2、10mmd-glucose;
dc分化培养液是由每1000ml的dmem-f12培养基中添加10μgbfgf、10μgegf、10ml100xn2、20ml50xb27、0.3gl-glutamine组成;其中各组分的终浓度达到:10ng/mlegf、10ng/mlbfgf、1xn2、1xb27、2mml-glutamine;
(2)提取诱导分化后的mscs、dmscs、hdac1shrna-msc组细胞rna,用荧光定量pcr检测慢病毒lv-hdac1shrna对huc-mscs细胞神经分化相关基因mrna水平的影响,结果显示:与对照组相比,经神经诱导后重组慢病毒lv-hdac1shrna感染huc-mscs细胞dcx、nse表达增加,且除ngn1外神经分化相关基因mash1、ngn2表达普遍显著上调(图10,p<0.05)。注:*:p<0.05。
(3)免疫荧光检测msc、dmscs、hdac1shrna-msc组细胞神经元迁移蛋白dcx、神经元特异性烯醇化酶nse表达情况:dcx表达阳性者为神经前体细胞,nse表达阳性者为神经元样细胞。步骤如下:
a.用pbs漂洗不同分化方案诱导完毕后48孔板3遍,4%多聚甲醛于4℃过夜固定。
b.用0.2%tritonx-100室温通透10min,pbs润洗3次,每次10分钟。
c.用5%bsa室温封闭30min,分别加入鼠抗dcx单抗(稀释比例1:50)、兔抗nse抗体(稀释比例1:100稀释),置于4℃孵育过夜(pbs替代一抗作阴性对照)。
d.次日,用pbs漂洗3次,每次10min,各组分别按200μl/孔加入fitc标记羊抗鼠或羊抗兔igg二抗,室温避光孵育1h。
.pbs润洗3次,加dapi染色,封片,倒置荧光显微镜上镜观察,计数。
免疫荧光结果显示:重组慢病毒lv-hdac1shrna感染huc-mscs细胞经神经诱导4d后,dcx、nse阳性表达率分别为(45.9±3.614)%、(89.1±1.387)%,向神经元样细胞分化更显著,免疫荧光照片如图11所示,具有统计学意义。
实施例4:侧脑室移植hdac1shrna-msc细胞,qrt-pcr检测小鼠神经分化相关基因与神经营养因子的表达情况,新事物识别实验评估移植后小鼠神经记忆恢复情况。
(1)饲养24只c57bl/6j小鼠一周后制作脑损伤小鼠模型,分为四组:
a.sham组:只打开骨窗,不进行脑损伤,不移植细胞,共6只;
b.vehicle组:中度脑损伤模型,不移植细胞,仅侧脑室注射生理盐水,共6只;
c.mscs组:中度脑损伤模型,移植huc-mscs,共6只小鼠;
d.hdac1shrna-msc组:中度脑损伤模型,移植lv-hdac1shrna感染后的hdac1shrna-msc,共6只小鼠。
(2)造模前,更换垫料1次,并禁食禁水24h,所涉及的动物操作程序符合动物保护与伦理要求。所有实验动物均购自市场商业化的实验动物技术有限公司。
a.脑损伤动物模型制作:采用自由落体脑皮质损伤模型,步骤如下:
1)术前10%水合氯醛按0.04ml/10g对小鼠给予麻醉后,头部备皮、消毒。
2)脑立体定位仪上俯卧位固定小鼠,校零各轴读数,确保小鼠头部水平。
3)用手术刀沿脑中线纵切5cm开口,钝性分离皮下组织、暴露颅骨。在前囱后1.5mm、中线旁侧1.5mm处环钻开3mm直径骨窗,保证硬脑膜完好。
4)立体定位仪上,距骨窗20cm高度释放20g撞针(直径2mm)制作2mm深度脑损伤模型。
b.侧脑室移植诱导分化的细胞:
1)牙科钻在前囟后2mm、旁开1.5mm处建立直径1mm小孔;
2)脑立体定位仪上,5min内用微量注射针在左侧脑室(前囟后2mm、旁开1.5mm、深度2mm)移植5×104个细胞,留针5min后,缓慢拨出,消毒缝合
(3)qrt-pcr检测小鼠神经分化相关基因与神经营养因子的表达情况:
小鼠动物行为学实验结束后,麻醉处死,取出脑组织,将损伤侧组织匀浆后通过rna提取试剂盒获取总rna。以gapdh为内参,使用荧光定量pcr仪检测各组小鼠脑内dcx、map2、bdnf、ngf、nt3基因的表达情况,引物见表4。
结果显示:与vehicle组相比,治疗28d后,mscs、hdac1shrna-msc组小鼠损伤侧dcx、map2表达水平明显升高(p<0.05),且后者神经元相关基因表达显著上调(图12,p<0.05)。与vehicle组相比,治疗28d后,mscs、hdac1shrna-msc组小鼠脑内神经营养因子表达水平明显升高(p<0.05),且后者海马内神经营养因子bdnf、ngf、nt3基因表达明显上调(图12,p<0.05)。注:*:与sham组相比,p<0.05;#:与vehicle组相比,p<0.05;
(3)新事物识别实验评估移植后小鼠神经记忆恢复情况:脑外伤后28d,本实验采取新事物识别实验检测动物学习记忆能力。
.为了保证实验数据真实有效,实验过程应严格按照以下步骤进行:
1)训练前72h,每天轻柔抚摸实验小鼠1min,消除其与测试者间陌生感。
2)训练前24小时,将动物放一个测试用50cm×50cm×25cm不透明箱子中,适应测试环境10min。
3)训练前准备a,b,c三个物体,其中a,b物体为体积约4×4×4cm3红色立方体,c物体是直径4cm的绿色球形物体。实验开始后,首先将a、b放入箱中在一侧壁的左右两端;将小鼠背朝两物体放入场内后,开启录像设备,离开测试房间,记录实验动物用鼻子或嘴巴触及物体的次数和距离物体2~3cm范围内探究的时间。10min后,把小鼠放回笼子。1h后,用c替换a,并重新让小鼠在此箱中探索5分钟,重复观察相同指标。待全部实验结束后,将小鼠送回饲养房。
4)通过公式辨别指数=新物体所用时间/(新物体所用时间+旧物体所用时间)×100%,分析小鼠的辨别指数。
b.通过统计其探索新旧事物所用时间后发现:与vehicle组相比,经细胞治疗后mscs、hdac1shrna-msc小鼠新物体鉴别指数显著增加,二者间hdac1shrna-msc组变化较大(图13,p<0.05)。注:*:与sham组相比,p<0.05、**:与sham组相比,p<0.01;#:与vehicle组相比,p<0.05。
采用spss17.0进行数据分析,实验数据用
- 还没有人留言评论。精彩留言会获得点赞!
- 采用寡核苷酸介导的基因修复提高靶向基因修饰的效率的方法和组合物与流程
- CRISPR/Cas9靶向敲除人ezrin基因增强子关键区的方法及其特异性gRNA与流程
- CRISPR/Cas9 靶向敲除人PD‑1基因及其特异性gRNA的制作方法与工艺
- 靶向人TSPAN8基因的siRNA及其应用的制作方法与工艺
- 靶向人TSPAN8基因的siRNA及其应用的制作方法与工艺
- CRISPR/Cas9靶向敲除人乙肝病毒P基因及其特异性gRNA的制作方法与工艺
- 一种特异靶向人ABCG2基因的sgRNA导向序列及其应用的制作方法与工艺
- 一种利用CRISPR‑Cas9靶向敲除MSTN基因的方法与流程
- CRISPR/Cas9靶向敲除人CNE10基因及其特异性gRNA的制作方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程