一种含高度浓缩的脂肪来源干细胞和细胞外基质的脂肪移植材料及其纯物理制备方法和应用与流程
本发明属于脂肪移植和干细胞治疗领域,涉及脂肪面部移植后年轻化和软组织损伤修复技术,具体为一种对颗粒脂肪纯物理处理后富集干细胞及细胞外基质的移植材料及其制备方法和用途。
背景技术:
脂肪干细胞(Adipose-derived stem/stromal cells,ASCs)和基质血管片段细胞(stromal vascular fraction cells,SVFs)在干细胞治疗领域的应用越发广泛,尤其是SVF的应用已在众多国家展开临床试验,其在提高脂肪移植后保存率以及创面修复方面优势明显:1、脂肪组织新鲜分离得到的SVFs中含有大量的、具有生物学活性的自体ASCs;2、来源于自身脂肪组织,无免疫排斥反应;3、人体内储量丰富;4、无需体外培养,降低细菌污染的风险。
然而,SVF的应用也在存在众多限制,例如:1、移植后,因为SVFs脱离了生理状态下的微环境,作为细胞悬液,其定植于靶组织的能力十分有限;2、分离过程复杂,并且需要加入外源性消化酶;3、提取过程需要在特定的实验环境下操作,花费成本较高,并且需要专业的技术人员。因此,需要寻找一种富集SVFs的新方法,改变SVF应用的现状。
技术实现要素:
为了克服上述现有技术的不足,本发明旨在提供一种对颗粒脂肪组织纯物理的机械化处理后,达到富集SVFs及细胞外基质(ECM)的目的,其中SVFs中含有大量的、具有生物学活性的ASCs,并且保留了SVFs黏附在ECM上的生理关系,使得SVFs浓缩的同时,更易定植在移植区域,本发明中将此种新型移植材料明名为SVF-gel (脂肪组织干细胞凝胶)。SVF-gel将在促进面部年轻化及创伤修复应用方面展现广泛的应用前景。
本发明的目的在于提供一种含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料。
本发明的另一目的在于提供一种含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料的纯物理制备方法。
本发明的再一目的在于提供上述移植材料的应用。
本发明所采取的技术方案是:
一种含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料的纯物理制备方法,包括以下操作步骤:
1)将获得的颗粒脂肪以800~1200g/min离心3~5min,将离心后上层油脂回收备用,底层液体弃去,将中层高密度脂肪组织转移至注射器中;
2)将上步装有高密度脂肪组织的注射器与一枚新注射器通过注射口密封对接,推动含有脂肪组织的注射器活塞,将脂肪组织推注至对侧注射器中,推注速度为10~20ml/s,如此连续往返推注1~2min;
3)将步骤1)回收的油脂加入到上步经反复推注过的脂肪组织中,混匀;
4)将步骤3)获得的脂肪组织过滤,将滤液装入密封注射器内,拉开注射器栓,保持注射器内负压,然后轻微震荡;将震荡后的混合物以1800~2200g/min离心3~5min;
5)经步骤4)离心后,若混合物分层,顶层为油脂,底层为肿胀液,且油脂层体积占整个混合物体积的80%及以上,则取中间层产物,得SVF-gel,即得含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料;
若离心后,混合物不分层,或顶层油脂层的体积占整个混合物体积的80%以下,则将混合物重复步骤2)~4)的操作。
进一步的,步骤2)中高密度脂肪组织在被往返推注之前先剪碎。
进一步的,步骤2)中注射器间的密封对接是通过鲁尔接头将2个注射器注射口连接起来,即可实现注射器间的密封对接。
进一步的,步骤4)中过滤所用滤膜的孔径不大于0.2mm。
进一步的,步骤4)轻微震荡过程中有絮凝现象出现,表现为蛋花汤样。
进一步的,步骤4)轻微震荡的时间为25~45s。
进一步的,步骤5)中所述重复步骤2)~4)操作的重复次数不超过3次。
进一步的,上述方法最终获得的SVF-gel的脱油率≥80%。
一种含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料,其制备方法为上述所述的方法。
上述所述移植材料在作为面部年轻化及软组织损伤修复的应用。
本发明的有益效果是:
1)本制备方法自始至终未使用任何外源性试剂,且为对自体组织的处理,不存在伦理问题。
2)本发明应用流体涡旋原理,将脂肪组织中绝大多数成熟脂肪细胞破碎;同时应用絮凝沉淀技术,将破碎脂肪细胞产生的油滴汇集并去除。
3)本发明制备的SVF-gel中,脂肪来源干细胞及内皮祖细胞高度浓缩;浓缩的SVF细胞依然黏附在ECM之上,移植后定植于局部的干细胞数量远远大于普通脂肪移植数量,作为干细胞疗法,远期疗效更佳。
4)本发明操作过程简便、成本低廉。
5)本发明制备的SVF-gel可通过27G细针头进行真皮内注射或局部精确注射填充。
6)本发明方法制备的SVF-gel来源丰富、制备方法简单可靠、成本低廉、安全有效、无排斥反应、可进行锐针注射。SVF-gel的制备方法具有普遍意义,适用于每个需要干细胞疗法或容量填充面部年轻化的患者。
7)本发明提供了一种将颗粒脂肪组织进行一系列机械化处理后,获得的去除成熟脂肪细胞及油滴的、富集干细胞的新型移植材料,该方法获得的移植材料富含高浓度基质血管片段细胞以及细胞外基质,其所含脂肪来源干细胞与未处理的颗粒脂肪组织相比高出8倍,内皮前体细胞高出7.5倍。
8)本发明采用一系列机械化处理过程,采用纯物理手段,不添加任何外源性物质。运用多种物理方法的目的为去除移植后影响组织保留率的成熟脂肪细胞及油脂。而SVF中的干细胞在经历本发明一系列特定的机械化处理后几乎不受影响,且脂肪组织体积可达到减少80%以上的水平,干细胞得到高度浓缩。处理后,脂肪组织中细胞外基质(ECM)的基本结构和特性并未受到影响。
附图说明
图1为实施例1所用到的鲁尔接头;
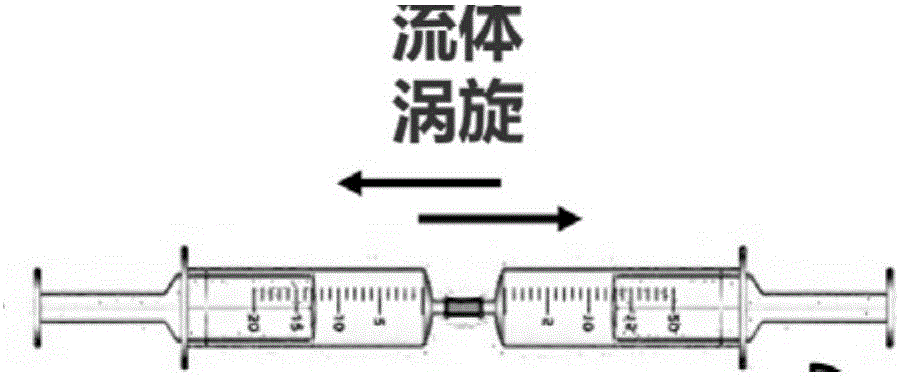
图2为实施例1中往返推注过程中形成流体涡旋的示意思图;
图3为实施例1所用到的Nano Transfer;
图4为本发明制得的SVF-gel的外观及体积浓缩比例;
图5为本发明制备的SVF-gel的扫描电镜检测结果;
图6为不同处理所得脂肪组织的全组织染色结果;图中Hoechst用于细胞核染色,为蓝色;Lectin用于血管内皮细胞(vascular ECs)染色,为红色;BODIPY用于脂肪细胞(adipocytes)染色,为黄色;(Bar = 200 μm.)
图7为本发明SVF-gel中各亚群细胞数量的检测结果;
图8为对本发明SVF-gel进行成脂、成骨、成软骨诱导分化的检测结果;
图9为SVF-gel促进创面愈合的检测结果,A为创面愈合过程图,B为创面愈合过程中受伤创面面积的对比统计。
具体实施方式
下面结合具体实施例对本发明作进一步的说明,但并不局限于此。
实施例1
1)将获得的颗粒脂肪经Coleman技术处理:即以1200g/min,离心3分钟,将离心后上层油脂回收备用,底层液体弃去,保留中层高密度脂肪组织转移至无针头注射器中,并用剪刀进一步将脂肪组织剪碎。
上述颗粒脂肪的获取采用湿性吸脂技术,使用吸脂针,从患者腹部或大腿抽吸脂肪组织。
2)将上步装有脂肪的注射器与一枚新的注射器通过鲁尔接头(如图1所示)将2个注射器注射口连接起来,达到密封对接,推动含有脂肪组织的注射器活塞,将脂肪组织通过连接器推注至对侧注射器中,推注速度为20ml/s,如此连续往返推注2min(如图2所示)。
3)取步骤1)留存的油脂,混至上步反复推注过的脂肪组织中;
4)将步骤3)获得的脂肪组织通过Tulip公司的Nano Transfer(如图3所示)进行过滤(过滤的孔径不大于0.2mm),将滤液装入密封注射器内,拉开注射器栓,保持注射器内负压,然后轻微震荡30秒;轻微震荡过程中有絮凝现象出现,表现为蛋花汤样;将震荡后的混合物以1800~2200g/min离心3~5min。
5)经步骤4)离心后,混合物分层,顶层为油脂,底层为肿胀液,且油脂层体积占整个混合物体积的80%以上,则取中间层产物,得SVF-gel,即为含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料;
若离心后,混合物不分层,或顶层油脂层的体积占整个混合物体积的80%以下,则将混合物重复步骤2)~4)的操作,重复次数不超过3次。
上述制备的SVF-gel可应用于面部年轻化及软组织损伤修复,直接将SVF-gel移植材料置于注射器中,通过27G细针头进行真皮内注射或局部精确注射填充即可。
实施例2
1)将获得的颗粒脂肪经Coleman技术处理:即以800g/min,离心5分钟,将离心后上层油脂回收备用,底层液体弃去,保留中层高密度脂肪组织转移至无针头注射器中,并用剪刀进一步将脂肪组织剪碎。
上述颗粒脂肪的获取采用湿性吸脂技术,使用吸脂针,从患者腹部或大腿抽吸脂肪组织。
2)将上步装有脂肪的注射器与一枚新的注射器通过鲁尔接头将2个注射器注射口连接起来,达到密封对接,推动含有脂肪组织的注射器活塞,将脂肪组织通过连接器推注至对侧注射器中,推注速度为10ml/s,如此连续往返推注1min。
3)取步骤1)留存的油脂,混至上步反复推注过的脂肪组织中;
4)将步骤3)获得的脂肪组织通过Tulip公司的Nano Transfer进行过滤(过滤的孔径不大于0.2mm),将滤液装入密封注射器内,拉开注射器栓,保持注射器内负压,然后轻微震荡45秒;轻微震荡过程中有絮凝现象出现,表现为蛋花汤样;将震荡后的混合物以1800g/min离心3min。
5)经步骤4)离心后,混合物分层,顶层为油脂,底层为肿胀液,且油脂层体积占整个混合物体积的80%及以上,则取中间层产物,得SVF-gel,即为含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料;
若离心后,混合物不分层,或顶层油脂层的体积占整个混合物体积的80%以下,则将混合物重复步骤2)~4)的操作,重复次数不超过3次。
上述制备的SVF-gel可应用于面部年轻化及软组织损伤修复,直接将SVF-gel移植材料置于注射器中,通过27G细针头进行真皮内注射或局部精确注射填充即可。
实施例3
1)将获得的颗粒脂肪经Coleman技术处理:即以1200g/min,离心5分钟,将离心后上层油脂回收备用,底层液体弃去,保留中层高密度脂肪组织转移至无针头注射器中,并用剪刀进一步将脂肪组织剪碎。
上述颗粒脂肪的获取采用湿性吸脂技术,使用吸脂针,从患者腹部或大腿抽吸脂肪组织。
2)将上步装有脂肪的注射器与一枚新的注射器通过鲁尔接头将2个注射器注射口连接起来,达到密封对接,推动含有脂肪组织的注射器活塞,将脂肪组织通过连接器推注至对侧注射器中,推注速度为20ml/s,如此连续往返推注1min。
3)取步骤1)留存的油脂,混至上步反复推注过的脂肪组织中;
4)将步骤3)获得的脂肪组织通过Tulip公司的Nano Transfer进行过滤(过滤的孔径不大于0.2mm),将滤液装入密封注射器内,拉开注射器栓,保持注射器内负压,然后轻微震荡25秒;轻微震荡过程中有絮凝现象出现,表现为蛋花汤样;将震荡后的混合物以2200g/min离心5min。
5)经步骤4)离心后,混合物分层,顶层为油脂,底层为肿胀液,且油脂层体积占整个混合物体积的80%及以上,则取中间层产物,得SVF-gel,即为含高度浓缩的脂肪来源干细胞和细胞外基质的移植材料;
若离心后,混合物不分层,或顶层油脂层的体积占整个混合物体积的80%以下,则将混合物重复步骤2)~4)的操作,重复次数不超过3次。
上述制备的SVF-gel可应用于面部年轻化及软组织损伤修复,直接将SVF-gel移植材料置于注射器中,通过27G细针头进行真皮内注射或局部精确注射填充即可。
下面对上述实施例制备的SVF-gel作进一步的生物学特性检测。
(1)处理前后SVF-gel的体积浓缩比例及大体观察
实验方法:
实验方法同实施例1,除了将实施例1步骤2)中反复推注时间从30s至5min(即0.5min、1min、2min、3min、4min、5min)进行梯度增加外,其他步骤不变,检测不同推注时间条件下制得的SVF-gel体积,及相应的脱油率。
实验结果与结论:
检测结果如图4所示,从中图4A可以看出,相比Control组(对照组,未经处理的颗粒脂肪组织)和Coleman组(实施例1步骤1)离心后的产物),经本发明一系列物理处理后,大量油脂可被析出,获得体积非常小的SVF-gel,见图4A中的0.5min、1min、5min组中下层物质。
从中图4B可以看出,与普通吸脂法(非机械处理法)获得的脂肪组织(Control组)相比,本发明方法所得SVF-gel质地均匀富有弹性,可以轻松通过27g针头。
从中图4C可以看出,随着实施例1步骤2)中反复推注时间的延长,所得SVF-gel的浓缩比例逐渐增加,当推注时间为0.5min时,SVF-gel的产出率约为总体积的25%,1min时SVF-gel的产出率约为总体积的10%,1min以后再增加推注处理时间,产出率无明显变化。
(2)扫描电镜观察SVF-gel的结构变化
实验方法:
实验方法同实施例1,除了将实施例1步骤2)中反复推注时间从1min至5min(即1min、3min、5min)进行梯度增加外,其他步骤不变,对不同推注时间条件下制得的SVF-gel进行扫描电镜检测。
实验结果与结论:
检测结果如图5所示,通过扫描电镜观察,随着往复推注处理时间的延长,ECM的破碎程度逐渐增加(图5A),但是,通过定量分析,当往复推注处理时间在3min及以内,所得SVF-gel中的ECM破碎程度与未处理相比不具有显著差异,不具有统计学意义(图5B);上述结果说明在反复推注的过程中,时间在不大于3min情况下,ECM仍能保持相对完整性。
(3)全组织染色观察脂肪组织与SVF-gel
实验方法:将对照组(未经处理的脂肪组织)、推注后负压震荡前的脂肪组织(即实施例1步骤2)处理后的产物)、SVF-gel三种脂肪组织进行全组织染色,其中用Hoechst进行细胞核染色,为蓝色;用Lectin进行血管内皮细胞(vascular ECs)染色,为红色;用BODIPY进行脂肪细胞(adipocytes)染色,为黄色;于共聚焦显微镜下观察全组织染色结果。
实验结果与结论:
检测结果如图6所示,从中可以看出,全组织染色结果中,未经处理的脂肪组织对照组和推注后负压震荡前的脂肪组织(即实施例1步骤2)处理后的产物)中可见大量微小脂滴(图6,白色箭头所示);而经絮凝离心并去除油脂后的SVF-gel中,细胞外基质明显增加(图6,红色箭头所示),成熟脂肪细胞显著减少。上述结果说明本发明所得SVF-gel中成熟细胞几乎完全被破碎,其释放的油脂被完全去除,ECM得到了高度浓缩。
(4)流式细胞分析SVF-gel中各亚群细胞数量
实验方法:
实验方法同实施例1,除了将实施例1步骤2)中反复推注时间从30s至5min(即0.5min、1min、2min、3min、4min、5min)进行梯度增加外,其他步骤不变,将不同推注时间条件下制得的SVF-gel分别进行胶原酶消化获得单个SVF细胞,标记CD45、CD31、CD34抗体后,进行流式细胞分析,分析各亚群细胞数量。
实验结果与结论:
流式细胞分析结果如图7所示, 本发明SVF-gel中各细胞亚群均在推注处理时间为1min时数量达到最多(图7 A~E),尤其是其中的脂肪来源干细胞ASCs (CD45-/CD31-/CD34+)(图7C)和内皮祖细胞(图7D)ECs (CD45-/CD31+/CD34+)得到极高程度的浓缩;其中脂肪来源干细胞ASCs与未处理的颗粒脂肪组织相比高出约8倍(图7C),内皮前体细胞ECs高出约7.5倍(图7D)。上述结果说明在处理1分钟时,SVF-gel中SVF细胞浓缩程度最高,本发明方法获得的移植材料富含高浓度基质血管片段细胞以及细胞外基质。
(5)SVF-gel提取SVF贴壁培养后成脂、成骨诱导分化
实验方法:
将本发明制备的SVF-gel进行贴壁培养至第三代后,分别进行成脂、成骨及成软骨诱导分化并进行相应产物染色检测。
实验结果与结论:
上述检测结果如图8所示,图7A为贴壁培养至第三代所得到的ASCs;图8B为油红O染色的成脂诱导实验结果;图8C为茜素红染色的成骨诱导实验结果;图8D为阿尔新蓝染色的成软骨诱导实验结果。从中可以看出,本发明制备的SVF-gel中ASCs增殖及成脂、成骨、成软骨诱导均正常,并未受到机械处理的影响。
(6)SVF-gel促进创面愈合的检测
实验方法:
于裸鼠背部构建多处皮肤全层缺损模型,将本发明SVF-gel于创面处注射入创面周围皮内及皮下,于术后2、4、7、10、14日观察创面愈合情况并统计相应的受伤面积。同时设立对照组(对照组采细胞量为2×104的SVF细胞悬液进行注射)。
实验结果与结论:
实验结果如图9A和9B所示,从中可以看出,从手术后的第7天起,本发明SVF-gel处理后的受伤面积开始显著小于对照组,到第14天时,基本无受伤创面,而对照组还存在明显的受伤创面。上述结果说明本发明制备的SVF-gel组进行创面愈合的速度明显优于对照组,本发明SVF-gel具有很好的创面愈合效果。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!