白细胞介素36α在制备治疗、诊断或预防脓毒症药物中的用途的制作方法
本发明涉及医药生物技术领域,特别涉及IL-36α新的药物用途。
背景技术:
脓毒血症(Sepsis)是由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),是创伤、烧伤、休克、感染等临床急危重患者的严重并发症之一,是院内感染的主要致死原因。脓毒血症通常由细菌感染引起,也可有真菌、寄生虫感染引起。脓毒血症的病程进展主要为四个部分:一般感染,全身炎症反应综合征,脓毒血症,重症脓毒血症;如得不到及时有效的控制则可能会进入休克,器官衰竭,甚至是死亡。由于脓毒症来势凶猛,病情进展迅速,进一步引发多器官功能衰竭,病死率高,给临床救治工作带来极大困难,国际卫生组织为了提高社会各界对脓毒血症的关注和了解,将每年的9月13号设为世界败血症。
脓毒血症发生机制十分复杂,与感染、炎症、免疫、凝血及组织损害等一系列生理病理过程均有相关联系。感染释放的炎症因子通过神经-内分泌免疫调节系统涉及了全身多种细胞和多个系统,形成了了庞大复杂的网络,级联效应放大,彼此相互制约,因此临床诊治十分困难。目前的治疗方法是给予有效的抗菌治疗,并结合对各脏器系统改变的综合治疗,但效果不佳,死亡率仍然很高。据统计,全球每年有1800万人发病,人们的普遍认知会觉得癌症或艾滋病很恐怖,但殊不知败血症每年导致的死亡超过了前列腺癌、肺癌与HIV/AIDS数量的总和。在美国,脓毒症患者死亡率占住院患者的17%。在我国ICU,重症脓毒血症的发生率是8.68%,死亡率高达44.7%。
脓毒血症起病急,病程危重,死亡率很高,且治疗费用较高,医疗资源消耗大,对人类健康造成巨大威胁,严重影响患者和家人的生活质量。如果患者未正确诊断和接受有效的抗生素治疗,死亡风险将逐步上升,每推迟一小时,死亡率增加7.6%。因此可见,寻找快速诊断、有效治疗的新靶点对提高病人的生存率具有十分重要的意义。
空格白细胞介素是由多种细胞产生并作用于多种细胞的一类细胞因子,由于最初是由白细胞产生又在白细胞间发挥作用,所以由此得名,现仍一直沿用。白细胞介素英文为interleukin,缩写为IL。在对免疫应答的研究过程中,在丝裂原刺激的细胞培养上清中发现了许多具有生物活性的分子,研究者各以自己测得的活性进行命名,十几年报道了近百种因子。后来借助分子生物学技术进行比较研究发现,以往许多以生物活性命名的因子实际上是具有多效性的同一物质。为了避免命名的混乱,1979年第二届国际淋巴因子专题会议将免疫应答过程中白细胞间相互作用的细胞因子统一命名为白细胞介素,在名称后加阿拉伯数字编号以示区别,例如IL-1、IL-2……,新确定的因子依次命名。
白细胞介素是非常重要的细胞因子家族,截止目前已发现的家族已达38个;它们在免疫细胞的成熟、活化、增殖和免疫调节等一系列过程中均发挥作用,此外它们还参与机体的多种生理及病理反应。
IL-1又称淋巴细胞刺激因子,细胞来源:主要由活化的单核-巨噬细胞产生。存在形式:IL-1α和IL-1β。主要生物学功能(1)局部低浓度-免疫调节:协同刺激APC和T细胞活化,促进B细胞增殖和分泌抗体。(2)大量产生-内分泌效应:诱导肝脏急性期蛋白合成;引起发热和恶病质。IL-2又称T细胞生长因子,TCGF。细胞来源:主要由T细胞产生。作用方式:以自分泌和旁分泌方式发挥效应。主要生物学功能(1)活化T细胞,促进细胞因子产生;(2)刺激NK细胞增殖,增强NK杀伤活性及产生细胞因子,诱导LAK细胞产生;(3)促进B细胞增殖和分泌抗体;(4)激活巨噬细胞。IL-4细胞来源:主要由Th2细胞、肥大细胞及嗜碱性、粒细胞产生。主要功能(1)促B细胞增殖、分化;(2)诱导IgG1和IgE产生;(3)促进Th0细胞向Th2细胞分化;(4)抑制Th1细胞活化及分泌细胞因子;(5)协同IL-3刺激肥大细胞增殖等。IL-6抗人白细胞介素,细胞来源主要由单核巨噬细胞、Th2细胞、血管内皮细胞、成纤维细胞产生。主要功能:(1)刺激活化B细胞增殖,分泌抗体;(2)刺激T细胞增殖及CTL活化;(3)刺激肝细胞合成急性期蛋白,参与炎症反应;(4)促进血细胞发育。IL-10细胞来源主要是Th2细胞和单核巨噬细胞产生。主要功能:(1)抑制前炎症细胞因子产生。(2)抑制MHC-II类分子和B-7分子的表达等细胞因子。(3)抑制T细胞合成IL-2、IFN-γ。(4)可促进B细胞分化增殖。IL-12细胞来源:主要由单核-巨噬细胞、B细胞产生。主要功能:(1)激活和增强NK细胞杀伤活性及IFN-γ(2)促进Th0向Th1细胞分化,分泌IL-2、IFN-γ。(3)增强CD8+CTL细胞杀伤活性;(4)可协同IL-2诱生LAK细胞;(5)抑制Th0细胞向Th2细胞分化和IgE合成。
白细胞介素36α(Interleukin-36α,IL-36α)是自2000年以来新发现的IL-1细胞因子家族的新成员,同时被发现的还有IL-36β,IL-36γ,统称为IL-36。IL-36主要包含:IL-36α(IL-1F6),IL-36β(IL-1F8),IL-36γ(IL-1F9),IL-36Ra受体拮抗物,IL-37,还有由IL-36R和IL-1RAcP组成的受体二聚体。IL-36α可由单核细胞,T淋巴细胞,角质细胞等多种细胞产生,主要分布在皮肤、肺脏、关节、肠道、肾脏和大脑中。IL-36α主要通过与其相应受体结合后激活丝裂原活化蛋白激酶(MAPK)和核因子B(NF-κB)信号转导途径在固有免疫和适应性免疫中发挥着重要作用。
技术实现要素:
本发明的目的在于在脓毒血症复杂调控网络中,寻找到新的治疗、诊断、预防靶点,对脓毒症的防治带来新的突破。
本发明的目的是通过以下措施实现的:
白细胞介素36α(Interleukin-36α,IL-36α)在制备治疗、诊断或预防脓毒症药物中的应用。
白细胞介素36α(Interleukin-36α,IL-36α)在制备调节巨噬细胞功能药物中的应用。
白细胞介素36α(Interleukin-36α,IL-36α)在制备治疗、诊断或预防脓毒症药物中的应用,剂量为1-1000μg/kg体重。
本发明提供了白细胞介素36α(IL-36α)在脓毒血症的治疗、诊断、预防中的应用,给予外源性的IL-36α能够对脓毒症有显著治疗作用,可显著提高其生存率。
本发明发现给予外源性的IL-36α蛋白,可以显著提高机体清除细菌的能力,并使肝肺肾等多器官炎症损伤程度减轻。
附图说明
图1:动物脓毒血症模型中IL-36α,IL-36β,IL-36γ检测实验:
图2:生存率检测实验
图3:脓毒血症动物模型的细菌载量实验:A图为24小时,B图为48小时
图4:各器官损伤的病理学检测
图5:IL-36α对小鼠巨噬细胞的吞噬杀菌功能的影响
图6:CLP建模过程图
具体实施方式
以下所述是本发明的优选实施例,但本发明并不限于以下实施例。所述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径而得。
实施例1
脓毒症动物模型的建立(盲肠结扎穿刺术Cecal ligation andpuncture,CLP)
实验动物:实验所用小鼠为雄性,体重为18-22g,约6-8周龄。饲养在重庆医科大学实验动物中心SPF(Specific Pathogen Free)级实验室。该实验所用小鼠均为SPF级实验动物。野生型C57BL/6小鼠(Wild type,WT)购买自北京华阜康生物科技股份有限公司。
方法:成年C57小鼠,以100微升1.5%的戊巴比妥钠腹腔注射麻醉小鼠,固定于操作板,用宠物电推剪剃去腹部毛发,消毒皮肤,于腹正中做1cm长的切口,结扎盲肠,以26号注射器针头穿刺,如图5。最后缝合伤口,消毒皮肤。(具体参考:Daniel Rittirsch,Peter A Ward,et al.Immunodesign of experimental sepsis by cecal ligation and puncture.Nat Protoc.2009;4(1):31-36)。该建模方法是脓毒症动物模型的经典建模方法,且该建模方法是目前研究脓毒症的金标准动物模型。
动物脓毒症模型中IL-36α,IL-36β,IL-36γ检测实验
将小鼠建脓毒血症模型后,分别在6小时、12小时、24小时这三个时间点取肺组织,提取其RNA,逆转录为cDNA,进行定量PCR,测定IL-36α,IL-36β,IL-36γ的表达量,如图1-A;将小鼠建脓毒血症模型,24小时后取心脏血、肺、腹腔灌洗液(Peritoneal lavagefluid,PLF)等标本进行处理,用ELISA试剂盒(购于MyBioSourse公司)测量IL-36α,IL-36γ的表达量,如图1-B。从结果可以得出,IL-36α在脓毒血症的动物体内表达显著升高。
生存率实验:
将小鼠建脓毒症模型,盲肠大部结扎,做重症脓毒症模型,缝好皮肤后给实验组小鼠腹腔注射500ng重组小鼠IL-36α蛋白(购于美国的R&D公司),给对照组小鼠腹腔注射同等体积的无菌PBS,观察记录小鼠的生存情况,每天观察两次,连续观察2周,至小鼠不再死亡为止。结果如图2(A)所示,注射rIL-36α组的小鼠生存率为57.1%,注射PBS组的小鼠生存率为14.3%,可见rIL-36α组生存率明显高于PBS组,且能长期存活,说明IL-36α有利于小鼠在脓毒血症中的生存。
将小鼠做重症脓毒症模型,给实验组小鼠腹腔注射1μg的IL-36α抗体(购于美国的R&D公司),给对照组小鼠腹腔注射同等体积的IgG,观察记录小鼠的生存情况,每天观察两次,连续观察2周,至小鼠不再死亡为止。结果如图2(B)所示,注射抗体的实验组小鼠生存率明显下降,且明显低于对照组的生存率,反向说明了IL-36α有利于小鼠在脓毒血症中的生存。
细菌载量的测定:
在小鼠建模后实验组腹腔注射rIL-36α,对照组腹腔注射无菌PBS,24小时和48小时后分别取腹腔灌洗液、心脏血和脾脏,将腹腔灌洗液和血做10倍系列稀释后取100微升铺板,脾脏先匀浆,然后做10倍系列稀释后取100微升铺板,18-24小时后计数血琼脂平板上的菌落数。
结果如图3所示,与对照组相比,IL-36α组在建立脓毒血症模型后,其心脏血、脾脏和腹腔灌洗液中的细菌载量更低,机体清除细菌能力更高,说明IL-36α有利于细菌的清除。
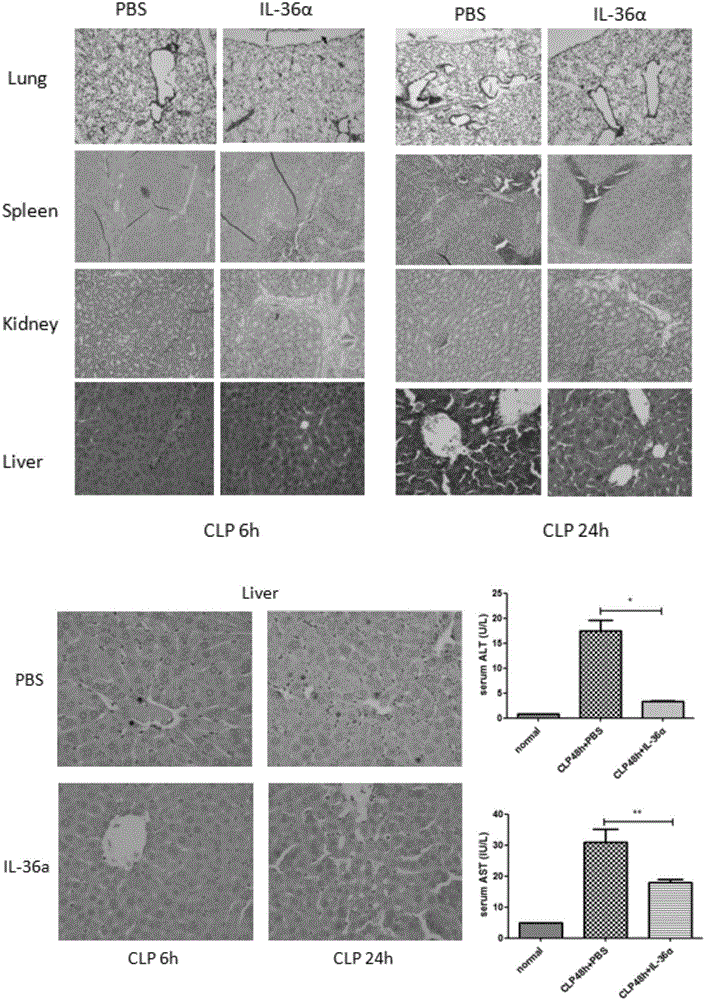
各器官损伤的病理学检测:
将小鼠建模后,实验组腹腔注射rIL-36α,对照组腹腔注射无菌PBS,在6小时及24小时后将小鼠麻醉后处死,取肺、肝、脾、肾,于4%多聚甲醛中固定24--48小时,分别进行脱水、浸蜡、包埋、切片,经HE染色后于显微镜下镜检。结果如图4所示,与IL-36α实验组相比,对照组小鼠各器官损伤明显较重,从病理切片可见明显的炎症加重,炎症细胞浸润,蛋白炎性渗出,组织充血水肿,细胞坏死等表现。生化指标ALT和AST可以反映肝损伤,ALT和AST的升高提示肝细胞损伤严重。
将小鼠建模后,实验组腹腔注射rIL-36α,对照组腹腔注射无菌PBS,在6小时及24小时后将小鼠麻醉后处死,取肺、肝、脾、肾,于4%多聚甲醛中固定24--48小时,分别进行脱水、浸蜡、包埋、切片,然后用TUNEL法(DAB显色)检测细胞凋亡。结果如图4所示,与IL-36α实验组相比,对照组小鼠肝细胞凋亡更加明显,且24小时比6小时凋亡程度更严重,说明IL-36α能够减轻脓毒血症对器官的损害。
IL-36α对小鼠巨噬细胞的吞噬杀菌功能的影响
给小鼠腹腔注射石蜡以诱导巨噬细胞,3-5天后取腹腔巨噬细胞来培养,待细胞全部贴壁后,处理组细胞加入了IL-36α重组蛋白,对照组用PBS做对照。37度、5%CO2培养24小时后,两组细胞均加入了同样数量的已用FITC荧光素标记已灭活的铜绿假单胞菌。再孵育30分钟后,弃去细胞上清,用PBS洗细胞,之后封片,用荧光显微镜观察并拍照。结果如图5(A)所示,被IL-36α重组蛋白处理过的巨噬细胞比对照组巨噬细胞吞噬了更多的细菌,说明IL-36α可以提高巨噬细胞的吞噬功能。以IL-36β,IL-36γ为实验对照组并未发现有提高巨噬细胞的吞噬功能和杀菌功能的效果,对脓毒症没有治疗效果。
给小鼠腹腔注射石蜡以诱导巨噬细胞,3-5天后取腹腔巨噬细胞来培养,分别铺两个板,待细胞全部贴壁后,处理组细胞加入了IL-36α重组蛋白,对照组用PBS做对照。37度、5%CO2培养24小时后,向两组细胞中加入同样数量的未灭活的铜绿假单胞菌,30分钟后弃去所有细胞上清。一批细胞被Triton裂解后做10倍梯度稀释,铺于血平板,另一批细胞继续培养90分钟后,用Triton裂解,10倍梯度稀释后铺于血平板。血平板在37度、5%CO2中培养过夜,第二天计数细菌菌落。此实验通过两批细胞内的细菌的数量之差来反映巨噬细胞吞噬细菌和杀死细菌的作用。如图5(B)所示,与对照组相比,IL-36α处理后的细胞能够吞噬和杀灭更多的细菌,说明IL-36α可以提高巨噬细胞的吞噬功能和杀菌功能。巨噬细胞杀菌能力增强的潜在机制是与MARCO有关,MARCO全称是macrophage receptor with collagenous structure,由MARCO基因编码,是清道夫受体家族的一个成员。IL-36a可能通过增强MARCO的表达,从而增强巨噬细胞的功能。
- 还没有人留言评论。精彩留言会获得点赞!