表没食子儿茶素没食子酸酯在制备预防或治疗膀胱肿瘤的药物中的用途的制作方法
本发明涉及肿瘤治疗技术领域,尤其涉及表没食子儿茶素没食子酸酯在制备预防或治疗膀胱肿瘤的药物中的用途。
背景技术:
绿茶是中国的常用饮品,天然健康,且具广泛保健功效。表没食子儿茶素没食子酸酯(EGCG)是绿茶中含量最高的茶多酚,也是绿茶中最主要的活性成分之一,有研究证明茶多酚EGCG在预防心血管疾病、抗肥胖、抗氧化、抗癌等方面有良好功效。在癌症的治疗和预防方面,茶多酚EGCG在临床测试和体内外细胞实验中,均表现出一定疗效。在临床试验中,60名前列腺癌前期病变患者均分为对照组和用药组(茶多酚EGCG胶囊),一年后服用EGCG组的患者成为前列腺癌的比例为对照组的十分之一[1]。动物实验表明,EGCG能抑制不同器官部位的肿瘤发生,例如皮肤、肺、肝、乳腺、前列腺、胃和乳腺等[2]。细胞实验表明,EGCG可通过诱导细胞周期阻滞、抑制端粒酶活性、抑制NF-κB活化、抑制肿瘤血管生成等,来诱导癌细胞凋亡并使癌细胞生长停滞[3]。有报道证明EGCG可在体内广泛分布并抑制癌症在皮肤、食管、胃、肠、肝脏、前列腺等组织及器官的发生发展,且无明显副作用[4]。茶多酚EGCG来源天然且无毒副作用,具有多种保健功效,是潜在的天然药物;而其在膀胱癌中的研究却少有报道,虽然有报道称EGCG抑制膀胱癌细胞NBT-2、T24的增殖和迁移[5],然而EGCG对膀胱癌SW780的分子机制研究和动物模型验证却没见报道。
技术实现要素:
本发明探索EGCG在膀胱癌的增殖、迁移和凋亡中的影响;并在动物模型中验证茶多酚EGCG的抗肿瘤作用并初步阐述其机制。这将为膀胱癌的治疗提供新的药物线索,也为相关保健品的研发提供基础性资料和科学指导。
因此,本发明提供表没食子儿茶素没食子酸酯在制备预防或治疗膀胱肿瘤的药物中的用途。
进一步地,上述表没食子儿茶素没食子酸酯通过诱导膀胱癌细胞凋亡来预防或治疗膀胱肿瘤。
进一步地,上述表没食子儿茶素没食子酸酯通过抑制膀胱癌细胞的迁移和/或侵染来预防或治疗膀胱肿瘤。
进一步地,上述表没食子儿茶素没食子酸酯通过抑制膀胱癌细胞的增殖来预防或治疗膀胱肿瘤。
进一步地,上述表没食子儿茶素没食子酸酯影响膀胱癌中PI3K/AKT通路相关蛋白的表达。
进一步地,上述表没食子儿茶素没食子酸酯影响凋亡相关蛋白Caspase-3、Caspase-8、Caspase-9、Bcl-2和PARP的表达。
进一步地,上述表没食子儿茶素没食子酸酯降低转移相关蛋白MMP-9的表达水平。
进一步地,上述表没食子儿茶素没食子酸酯降低AKT和PI3K的磷酸化水平。
进一步地,上述表没食子儿茶素没食子酸酯抑制PTEN的表达。
进一步地,上述表没食子儿茶素没食子酸酯与药学上可接受的载体组合成药物。
本发明证实了表没食子儿茶素没食子酸酯对于膀胱肿瘤具有一定疗效,因此可以用于预防或治疗膀胱肿瘤。
附图说明
图1显示EGCG对膀胱癌细胞SW780(A)、5637(B)和正常膀胱细胞SV-HUC-1(C)的增殖抑制作用。横坐标是EGCG浓度;纵坐标是细胞存活率。
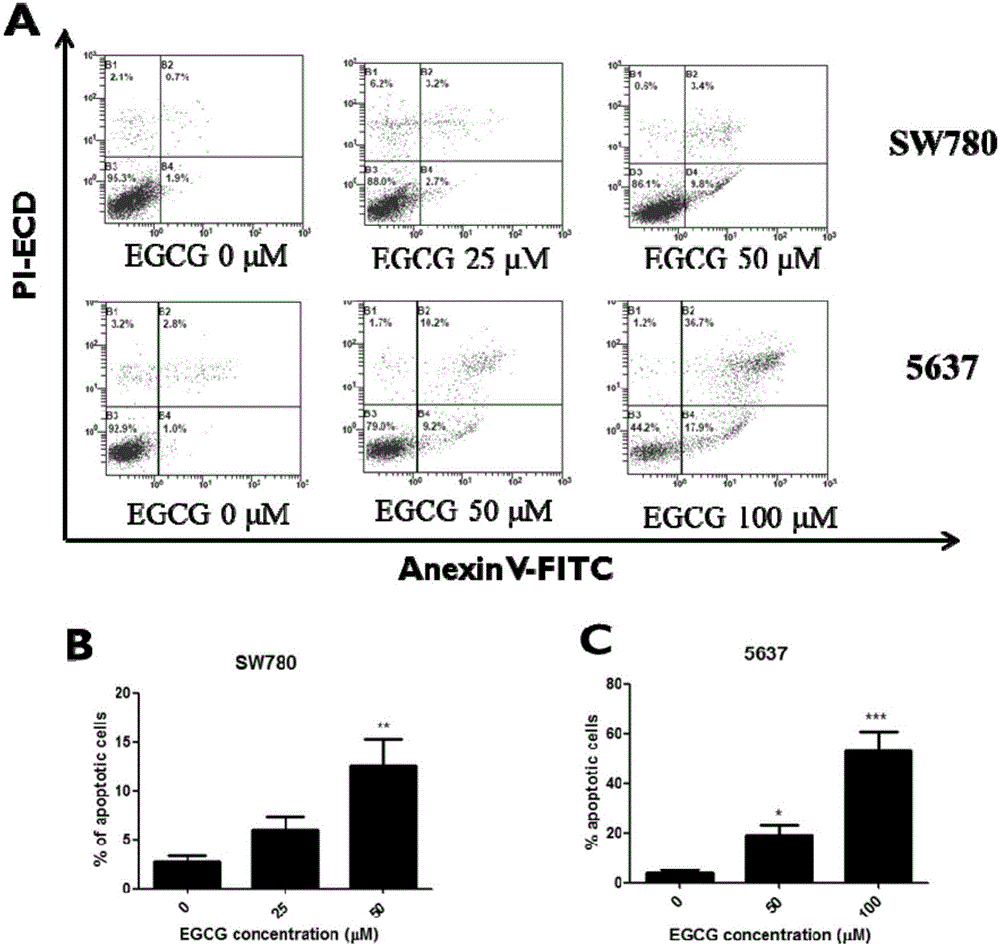
图2显示EGCG对膀胱癌细胞SW780和5637的凋亡诱导作用。
图3显示EGCG对膀胱癌细胞SW780的迁移抑制作用。A,划痕愈伤实验照片;B,EGCG作用于SW780细胞的划痕面积柱状图;C,侵染实验的染色照片;D,EGCG对SW780细胞侵染作用的实验结果。
图4显示EGCG对膀胱癌细胞5637的迁移抑制作用。A,划痕愈伤实验照片;B,EGCG作用于5637细胞后的划痕面积柱状图;C,侵染实验的染色照片;D,EGCG对5637细胞侵染作用的实验结果。
图5显示免疫印迹检测EGCG作用后,凋亡相关(A)及PI3K/AKT通路相关蛋白(B)在膀胱癌不同细胞系中的表达。
图6显示EGCG对小鼠的肿瘤抑制作用。A,小鼠体重变化图;B,EGCG作用后,血液生化指标检测中丙氨酸转氨酶、天冬氨酸转氨酶和肌酸激酶的变化;C,EGCG给药过程中,小鼠荷瘤照片图;D,小鼠肿瘤体积变化图;E,实验结束后,小鼠肿瘤照片图;F,小鼠肿瘤重量柱状图。
具体实施方式
本发明证实了表没食子儿茶素没食子酸酯对于膀胱肿瘤具有一定疗效,因此可以以其作为活性成分,制备成预防或治疗膀胱肿瘤的药物。
在本发明中,可以以表没食子儿茶素没食子酸酯单独作为药物。也可以与其它成分组成药物组合物,其它成分包括:药学上可接受的基质、载体、添加剂(例如赋形剂、粘合剂、崩解剂、润滑剂、溶剂、增甜剂、着色剂、矫味剂、气味掩蔽剂、表面活性剂、增湿剂、防腐剂、pH调节剂和增稠剂)等。
在本发明中,药学上可接受的载体,是指无毒的载体、佐剂或媒介物,其不会破坏与其一起配制的化合物的药理学活性。可用于本发明组合物中的药学上可接受的载体、佐剂或媒介物包括,但不限于:离子交换剂,氧化铝,硬脂酸铝,卵磷脂,血清蛋白例如人血清白蛋白,缓冲物质如磷酸盐类,甘氨酸,山梨酸,山梨酸钾,饱和植物脂肪酸的偏甘油酯混合物,水,盐类或电解质类例如硫酸鱼精蛋白、磷酸氢二钠、磷酸氢钾、氯化钠、锌盐,胶体二氧化硅,三硅酸镁,聚乙烯吡咯烷酮,基于纤维素的物质,聚乙二醇,环糊精类,羧甲基纤维素钠,聚丙烯酸酯类,蜡类,聚乙烯-聚氧丙烯-嵌段共聚物,聚乙二醇和羊毛脂。
在本发明中,药物的制剂形式,如片剂、包衣片剂、粉剂、颗粒剂、细粒剂、胶囊、丸剂、液体剂、混悬剂、乳剂、凝胶剂、咀嚼剂、软片剂等。
在本发明中,活性成分在药剂中的含量,没有特别限制,只要发挥对膀胱肿瘤疾病的治疗或预防效果即可,并且可以根据每天优选的活性成分摄入量适当确定,该量优选为0.0005至100质量%,更优选为0.005至90质量%,并且特别优选为0.05至80质量%。
在本发明中,受试者可以是患有膀胱肿瘤疾病的病人,或者高风险人群,比如遗传显示的高发生风险的人群,或者老年人(比如60岁以上),受试者还可以是动物(如狗、猫、牛、马、猪、绵羊、山羊、猴、兔、小鼠、大鼠、仓鼠等)。
在本发明中,给药剂量和给药时间,没有特别限制,可以是根据患者年龄、患者症状的严重性、其他条件等适当选择。
下面通过具体实施例结合附图对本发明作进一步详细说明。应当理解,实施例仅是示例性的,并不构成对本发明保护范围的限制。
I.技术与方法:
1.细胞培养
膀胱癌细胞系SW780、5637和正常膀胱上皮细胞SV-HUC-1购自美国模式培养物保藏中心(American Type Culture Collection,ATCC,Manassas,USA),细胞培养基由90%的DMEM(Life technology,USA),10%的胎牛血清(Life technology,USA),1%-2%的谷氨酰胺和0.5%-1%的双抗配成。
2.细胞增殖检测
使用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),检测细胞增殖。用含10%胎小牛血清的培养基配成单个细胞悬液,以每孔7000个细胞接种到96孔板,设置6个复孔,置于37℃培养箱中培养24h;然后吸去96孔板中培养液,加入含有不同浓度EGCG的培养液,置于37℃培养箱中培养24、48h。到达预定时间后,直接在96孔板中加入30μl 5mg/ml的MTT,继续孵育4h,终止培养,小心吸弃孔内上清,每孔加入二甲基亚砜(DMSO)150μl,震动摇匀;10min后,选择540nm波长,在酶联免疫检测仪上测定各孔的吸光度值,记录结果,以时间为横坐标,吸光值为纵坐标绘制细胞生长曲线。
3.细胞凋亡检测
经EGCG处理细胞24h后,收集膀胱癌细胞并用预冷的PBS洗涤2次,1000rpm,4℃离心5min;然后将细胞重悬于500μl缓冲液,加入5μlAnnexin-V-FITC和5μl PI(50μg/ml),轻轻混匀,避光,室温放置5min再转至流式检测管,利用流式细胞仪(EPICS,XL-4,Beckman,CA,USA)分析细胞凋亡率。每份标本收集10000个细胞。
4.细胞迁移检测
细胞迁移运动能力由细胞划痕实验检测。取对数生长期的膀胱癌细胞(1×105/ml)接种于24孔板,并在37℃培养箱培养24h。在无血清的培养基中饥饿培养24h后,用200μl的黄色枪头划痕,每孔一条横线两条竖直线,然后吸去无血清培养基,并换上含不同浓度EGCG(0、25、50、100、200μM)的新鲜培养基,置于37℃培养箱中培养。按0、20h取样,光学显微镜拍照,然后用TScratch软件分析愈伤面积的百分比。
5.细胞侵染检测
细胞迁移运动能力由细胞transwell实验检测。收集处于对数生长期的膀胱癌细胞,用含1%胎牛血清的培养基制备5×105/ml的细胞悬液,取100μl即5×104细胞接种至transwell上面的小室内,同时加入100μl含有不同浓度EGCG(1%FBS培养基配置)的培养液,在下室内加入含10%FBS的完全培养基500μl。孵化培养20-24h后,细胞用100%的甲醇固定并用苏木精染色,晾干,普通光学显微镜下观察并拍照,随机选取4个视野,用Image J计数穿膜的细胞数。
6.免疫印迹检测
用免疫印迹法检测蛋白表达。经不同浓度EGCG处理细胞24小时后,收集细胞蛋白;利用4×上样缓冲液,100℃煮10min;将煮好的样品加入到10%SDS-PAGE胶中,进行免疫印迹实验;转膜的PVDF膜用10%脱脂奶粉室温封闭1小时;蛋白抗体4℃过夜孵育,去除一抗,振摇洗膜10min×3次,加入适当浓度带HRP标记的二抗,室温孵育1小时;去除二抗,振摇洗膜10min×3次,加入化学发光的HRP底物显色液,利用BD的CCD镜头拍照。
7.裸鼠成瘤实验
取6-8周龄BALB/c裸鼠,4组×7只,共28只,在每只裸鼠背部皮下接种注射200μl(2×106)细胞悬液,于SPF级动物实验中心饲养。待肿瘤体积达到80mm3后,荷瘤小鼠随机分成4组,阴性对照组(腹腔注射0.2ml生理盐水/天),EGCG高剂量组(腹腔注射0.2ml 100mg/kg EGCG/天),EGCG中剂量组(腹腔注射0.2ml 50mg/kg EGCG/天),EGCG低剂量组(腹腔注射0.2ml 25mg/kg EGCG/天)。每周用游标卡尺测量肿瘤大小2次,以肿瘤体积=1/2*长*(宽)2来计算。3周后以脱胫处死裸鼠,取出肿瘤,称量瘤重,然后再利用肿瘤提取总蛋白和总RNA,进行瘤内基因、蛋白表达分析。
8.统计学分析
数据分析使用one way ANOVA统计,正态分布的数据采用mean±SD/SEM表示。检验水准以P<0.05表示差别具有统计学意义。
II.实验结果:
1.茶多酚EGCG抑制膀胱癌细胞SW780和5637的增殖
经EGCG培养24或48小时后,检测SW780、5637和SV-HUC-1细胞的增殖活力。EGCG可明显抑制膀胱癌细胞SW780和5637的增殖,且抑制呈浓度和时间依赖关系(图1)。在EGCG浓度为200μM时,SW780和5637细胞的存活率均低于20%(48h);而在正常膀胱细胞SV-HUC-1细胞中,其细胞存活率达90%,说明EGCG选择性杀伤膀胱癌细胞,而同等浓度下对正常细胞并无明显毒副作用。
2.EGCG诱导膀胱癌细胞SW780和5637凋亡
为了证实EGCG抑制膀胱细胞生长是通过促进细胞凋亡实现的,将经EGCG处理48小时后的细胞用流式细胞仪检测细胞的凋亡率:相比于阴性对照组(EGCG浓度为0),EGCG处理后的SW780和5637的细胞凋亡率明显增加,且呈浓度梯度依赖关系(图2),说明EGCG可以有效诱导癌细胞的凋亡。
3.EGCG抑制膀胱癌细胞的迁移和侵染
为检测EGCG是否有效抑制膀胱癌的迁移和侵染,选择细胞存活率>80%时的EGCG浓度,细胞培养24小时后用划痕实验和transwell实验来检测细胞的迁移和侵染:相比于阴性对照组(EGCG浓度为0),EGCG用药组的细胞迁移和侵染过程明显受到抑制(图3和图4),且呈现浓度梯度依赖关系,说明EGCG可在低浓度时有效抑制膀胱癌细胞的迁移和侵染。
4.EGCG影响膀胱癌中PI3K/AKT通路相关蛋白的表达
经不同浓度EGCG处理细胞24小时后,收集细胞蛋白,用免疫印迹法检测蛋白表达:相比于阴性对照组(EGCG浓度为0),EGCG用药组可明显影响凋亡相关蛋白Caspase-3/8/9、Bcl-2、PARP的表达,并降低转移相关蛋白MMP-9的表达水平。此外,EGCG可明显降低AKT和PI3K的磷酸化水平,并抑制PTEN的表达(图5);说明EGCG可能通过影响PI3K/AKT通路在膀胱癌中发挥作用。
5.EGCG在小鼠中显著抑制膀胱肿瘤的生长
为检测EGCG的抗肿瘤功效,采用裸鼠成瘤实验:经EGCG腹腔注射3周后,发现小鼠体重与阴性对照组(control)没有明显差别,且血液生化指标检测显示阴性对照组与EGCG用药组相比,丙氨酸转氨酶、天冬氨酸转氨酶和肌酸激酶没有显著差别(图6A-B);EGCG用药组可有效阻止肿瘤的生长,肿瘤体积明显减小,且肿瘤重量减轻,其中EGCG高剂量组效果最佳(图6C-F)。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
参考文献:
1.Bettuzzi S,Brausi M,Rizzi F,Castagnetti G,Peracchia G,Corti A.Chemoprevention of human prostate cancer by oral administration of green tea catechins in volunteerswithhigh-grade prostate intraepithelial neoplasia:a preliminary report from a one-year proof-of-principle study.Cancer Res 2006.66(2):1234-40.
2.Mukhtar H,Ahmad N.Tea polyphenols:prevention of cancer and optimizing health.Am J ClinNutr 2000.71:S1698-702.
3.Gupta S,Hastak K,Afaq F,Ahmad N,Mukhtar H.Essential role of caspases in epigallocatechin-3-gallate-mediated inhibition of nuclear factor kappa B and induction of apoptosis.Oncogene 2004.23:2507-22.
4.Singh BN,Shankar S,Srivastava RK.Green tea catechin,epigallocatechin-3-gallate(EGCG):mechanisms,perspectives and clinical applications.BiochemPharmacol 2011.82(12):1807-21.
5.Rieger-Christ KM,Hanley R,Lodowsky C,Bernier T,Vemulapalli P,Roth M,Kim J,Yee AS,Le SM,Marie PJ,Libertino JA,Summerhayes IC.The green tea compound,(-)-epigallocatechin-3-gallate downregulates N-cadherin and suppresses migration of bladder carcinoma cells.J Cell Biochem 2007.102(2):377-88.
- 还没有人留言评论。精彩留言会获得点赞!