CpG‑ODN在MUC1融合蛋白抗肿瘤中的应用的制作方法
技术领域:
本发明提供一种cpg-odn在muc1融合蛋白抗肿瘤中的应用,涉及cpg-odn2006序列作为免疫佐剂在重组muc1-mbp抗肿瘤中的医用用途,属于免疫学治疗领域。
背景技术:
:
cpg-odn是人工合成的含有非甲基化胞嘧啶鸟嘌呤二核苷酸(cpg)的寡脱氧核苷酸(odn),可模拟细菌dna刺激b细胞、树突状细胞活化,间接激活nk和t细胞等多种免疫效应细胞,增强抗原提呈细胞的加工和提呈,诱导th1型免疫应答,产生较强的体液免疫和细胞免疫应答,可用于肿瘤治疗、过敏性疾病、感染性疾病、免疫功能低下者。目前公认的对人免疫刺激活性最强是cpg-odn2006。国外已经对cpg-odn2006进行了多项临床试验,包括对黑色素瘤、肺小细胞癌、皮肤t细胞淋巴瘤,证实是高效低毒的新型免疫佐剂。国内沃森生物将cpg-odn作为乙型肝炎疫苗佐剂,目前正在进行临床iii期实验,而国内目前尚未发现用于肿瘤疫苗佐剂的报道。
muc1是mucins粘蛋白家族的重要成员,存在于正常腺管上皮细胞及其来源的肿瘤细胞表面,由多肽核芯(核芯肽)和侧枝糖链构成。由于正常组织muc1与肿瘤组织不同,使其成为免疫细胞攻击的靶点。经反复动物实验以及部分人体实验研究证实,muc1是肿瘤疫苗研制的有效靶点。目前以muc1为靶点研制的肿瘤疫苗,49个处于临床试验阶段,其中,tg4010和tecemotide也已经完成iii期临床并取得良好的结果。本研究组长期以来以muc1为靶点,首次通过基因工程技术将muc1基因与大肠杆菌麦芽糖结合蛋白偶联制成重组muc1-mbp融合蛋白。研究发现重组muc1-mbp融合蛋白单独免疫小鼠,很难产生强烈的细胞免疫应答,而与cpg-odn2006联合免疫,既能产生特异性体液免疫应答,又能产生较强的细胞免疫应答,发挥良好的抗肿瘤效果。
技术实现要素:
:
本发明提供一种cpg-odn在muc1融合蛋白抗肿瘤中的应用,用于人类治疗或预防肿瘤。
本发明公开的cpg-odn在muc1融合蛋白抗肿瘤中的应用,其中,
所述的cpg-odn2006序列是:5'-tcgtcgttttgtcgttttgtcgtt-3',也称cpg-odn7909,是一种非甲基化胞嘧啶鸟嘌呤二核苷酸为核心的序列;cpg-odn2006序列不仅能促进重组muc1-mbp融合蛋白诱导特异性体液免疫应答,而且能促进诱导特异性细胞免疫应答,具有良好的抗肿瘤作用,二者联合可作为疫苗用于表达muc1的肿瘤包括腺癌、血液肿瘤等治疗或预防的用途。
本发明cpg-odn2006与重组muc1-mbp联合适用于下述医疗用途:
1.cpg-odn2006作为佐剂与重组muc1-mbp联合,作为治疗性疫苗治疗癌症包括表达muc1的腺癌、肝癌、血液肿瘤等。
2.cpg-odn2006作为佐剂与重组muc1-mbp联合,作为预防性癌症疫苗预防各种癌症,包括表达muc1的腺癌、肝癌、血液肿瘤等。
本发明所述的cpg-odn2006作为佐剂与重组muc1-mbp联合的制备工艺,包括以下步骤:
1、重组muc1-mbp融合蛋白的制备,参见重组人muc1-mbp融合蛋白抗肿瘤疫苗及生产工艺,(专利号zl03111045.2);
2、重组muc1-mbp融合蛋白以40-160μg/ml溶于生理盐水中;
3、将cpg-odn2006以40-160μg/ml浓度溶于生里盐水中;
4、将上述cpg-odn2006与重组muc1-mbp融合蛋白按照等比例进行混合,经0.22μm滤膜过滤除菌。
本发明的积极效果在于:利用cpg-odn2006与muc1-mbp协同促进产生muc1特异性th1应答特性,提示cpg-odn2006具有诱导muc1-mbp产生特异性细胞免疫应答的作用,cpg-odn2006序列促进重组muc1-mbp诱导t细胞免疫应答,具有显著的抗肿瘤疗效。cpg-odn2006序列可作为重组muc1-mbp疫苗的佐剂,可作为癌症疫苗开发利用,用于人类治疗或预防肿瘤。
附图说明
图1为本发明重组muc-mbp的sds-page分析电泳图;
图2为本发明重组muc1-mbp单独免疫诱导的抗肿瘤作用图;
图3为本发明cpgodn2006与muc1-mbp对小鼠生存期影响图。
具体实施方式
通过以下实施例进一步举例描述本发明,并不以任何方式限制本发明,在不背离本发明的技术解决方案的前提下,对本发明所作的本领域普通技术人员容易实现的任何改动或改变都将落入本发明的权利要求范围之内。
实施例1
cpg-odn2006作为佐剂与重组muc1-mbp联合的制备工艺,包括以下步骤:
1、重组muc1-mbp融合蛋白的制备,参见重组人muc1-mbp融合蛋白抗肿瘤疫苗及生产工艺,(专利号zl03111045.2);
2、重组muc1-mbp融合蛋白以40-160μg/ml溶于生理盐水中;
3、将cpg-odn2006以40-160μg/ml浓度溶于生里盐水中;
4、将上述cpg-odn2006与重组muc1-mbp融合蛋白按照等比例进行混合,经0.22μm滤膜过滤除菌。
实验例1
1.材料
重组muc1-mbp融合蛋白(纯度98%,内度素小于5eu/mg)参见重组人muc1-mbp融合蛋白抗肿瘤疫苗及生产工艺,(专利号zl03111045.2)制备,丙烯酰胺和tris购自sigma公司,亚甲丙烯酰胺购自上海生物工程公司,bsa购自碧云天生物科技有限公司。
2方法
2.1重组muc1-mbp纯度分析
将重组muc1-mbp融合蛋白10μl加入10%分离胶和4%浓缩胶sds-page凝胶上样孔中,并采用低分子量蛋白marker作为对照,在10-20ma下进行电泳,结束后采用考马斯亮蓝进行颜色分析。
2.2重组muc1-mbp含量分析
将重组muc1-mbp融合蛋白稀释成6个稀释度,按照bca试剂盒说明书进行操作,配制蛋白标准品,采用酶标仪检测吸光光度值a490nm。
3.结果
3.1重组muc1-mbp的鉴定
将本研究组制备的重组muc-mbp通过sds-page分析,如图1所示,在62kd处可见一条较纯的条带,通过分析结果表明,电泳纯度为100%。结果与预期一致,可用于后续的实验研究。
3.2重组muc1-mbp的含量分析
经bca试剂盒分析结果表明1.15mg/ml,与实际值1.2mg/ml相比较,结果基本一致,占实测值95.8%,在质量控制90-110%的范围内,可用于后续的实验。
实验例2
1.材料
cpg-odn2006由上海生工合成(lot:9405454467);30个氨基酸muc1多肽(纯度95%)由上海紫域生物,bcg购自成都生物制品所,抗igg1-hrp、抗igg2c-hrp和抗igg-hrp购自southernbiotech。
6~8周龄,18~20gc57bl/6小鼠购自北京华阜康生物科技有限公司。
2.方法
2.1小鼠免疫
将小鼠称重,随机分为7组,每组10只鼠,雌雄各半,分别为生理盐水组,cpg-odn2006(0.2mg/kg)组,cpg-odn2006(0.4mg/kg)组,cpg-odn2006(0.8mg/kg)组,muc1-mbp(0.2mg/kg)+cpg-odn2006(0.2mg/kg)组,muc1-mbp(0.2mg/kg)+cpg-odn2006(0.4mg/kg),muc1-mbp(0.2mg/kg)+cpg-odn2006(0.8mg/kg)组。皮下多点注射,每2周免疫一次,共免疫2-4次。
2.2elisa检测muc1特异抗体及亚类
如上所述,小鼠第2次免疫后4-7天安乐死处死小鼠,眼球采血,常温静置4小时后,4℃离心,3000rpm,10min,分离小鼠血清,通过间接elisa分析抗muc1抗体的效价。简而言之,采用0.5μg/wellmuc1多肽包被96孔板,4℃过夜,次日,通过3%bsa封闭液封闭1h,采用0.5‰tween-20的pbs(pbs-t)液洗涤后,加入小鼠不同稀释度的血清。均设双复孔,37℃孵育0.5-1.5h,弃去孔内液体,pbs-t洗液5-7次后,加入hrp标记山羊抗小鼠igg或igg2c或igg1(按说明书稀释),37℃孵育0.5-1.5h,弃去孔内液体,pbs-t洗液5-7次后加入底物opd显色5-10min,加2mol/l硫酸溶液终止反应,采用酶标仪检测a490吸光光度值。
3.结果
为研究muc-mbp疫苗诱导小鼠产生特异性体液免疫应答情况,在小鼠第2次免疫后眼球采血,分离血清,采用间接elisa检测muc1特异性抗体及亚类。如表1结果所示,muc1-mbp联合不同剂量cpg-odn2006产生的抗体效价不同,随着佐剂剂量的增加muc1特异抗体igg,igg2c,igg1效价也逐渐增加;而单独应用佐剂并未见muc1特异抗体产生。提示cpg-odn2006促进muc1-mbp疫苗产生特异性体液免疫应答,通过igg2c,igg1亚类增高,间接提示cpg-odn2006不仅促进muc1-mbp疫苗产生th2应答,同时也产生th1应答。
表1cpg-odn2006促进muc1-mbp产生muc1特异性抗体igg、igg2c和igg1
4.结论
cpg-odn2006与muc1-mbp协同促进产生muc1特异性免疫应答。
实验例3
1.材料
小鼠淋巴细胞分层液购自索莱宝公司,il-2购自protech30个氨基酸muc1多肽(纯度95%)由上海紫域生物,胎牛血清购自biobio、imdm购自gibco,wst试剂购自promega,il-4以及ifn-γelesa试剂盒均购自于ebioscience公司。
2.方法
2.1muc1特异性淋巴细胞增殖分析
如上所述,在第2次免疫后4-10天杀鼠,无菌取脾、研磨、细胞记数,制备脾细胞悬液,采用小鼠淋巴细胞分层液分离小鼠脾脏单个核细胞,用imdm调整细胞浓度至1×107/ml,以100μl/well加入96孔板中。实验设3组,每组设3复孔,分别为阴性对照组、il-2单独刺激组(终浓度100u/ml)、muc1多肽刺激组(muc1多肽10μg/ml+il-2100u/ml)。37℃的co2培养箱3天,半量换液,继续培养5天后,吸取每孔细胞培养上清100μl用于细胞因子的检测,然后加入wst-1检测试剂10μl/孔,继续反应1小时,通过酶标仪检测吸光值450nm值,计算刺激指数(si)。si=实验孔a值/对照孔a值。
2.2muc1特异性淋巴细胞分泌细胞因子分析
如上2,1所述,将体外muc1特异性刺激的淋巴细胞培养上清,通过夹心elisa检测ifn-γ和il-4的分泌水平。按照ebioscience公司的elisa检测试剂盒说明书进行操作。简而言之,首先将包被抗体(抗ifn-γ和il-4的抗体)包被96孔酶标板,每个样本设双复孔,4℃过夜。采用pbs-0.05%tween-20洗板5次,加入封闭液封闭1h后,洗涤2次,加入标准品(ifn-γ:2000、1000、500、250、125、62.5、32.5、15.625pg/ml;il-4标准品配制:500、250、125、62.5、32.5、15.6、7.8、3.9pg/ml)和样品,100μl/孔,4℃过夜。洗涤5次后,加入检测抗体室温孵育1h,洗涤5次,加入酶标抗体avindin-hrp,室温孵育30min。洗7次,加tmb,室温15min。加硫酸终止后,采用酶标仪450nm波长测定吸光度值波长450nm。
3.结果
3.1cpg-odn促进muc1-mbp诱导的muc1特异性淋巴细胞增殖
为研究muc1-mbp疫苗诱导小鼠产生特异性细胞免疫应答情况,在小鼠第2次免疫后取脾,分离淋巴细胞,采用muc1多肽特异性刺激淋巴细胞5天后,采用wst1检测淋巴细胞的增殖情况。如表2所示,高剂量cpg-odn2006能促进muc1-mbp诱导的muc1特异性细胞增殖,单独高剂量cpg-odn2006组也可见到淋巴细胞刺激指数增加,但没有联合抗原组增加明显。提示cpg-odn2006能促进muc1-mbp产生特异性细胞免疫应答。
表2cpg-odn促进muc1-mbp诱导的muc1特异性淋巴细胞增殖(n=10)
3.2cpg-odn2006促进muc1-mbp诱导的muc1特异性淋巴细胞分泌ifn-γ水平
为研究muc1-mbp疫苗诱导小鼠产生特异性细胞免疫应答情况,在小鼠第2次免疫后取脾,分离淋巴细胞,采用muc1多肽特异性刺激淋巴细胞5天后,取细胞培养上清,通过双抗体夹心elisa检测ifn-γ和il-4分泌水平。将体外muc1多肽联合il-2刺激所得的数值减去il-2单独刺激的数值即得到muc1特异性th1释放的细胞因子。如表3结果所示,muc1-mbp联合不同剂量随着cpg-odn2006剂量的增加,muc1特异性t细胞释放ifn-γ水平也逐渐增加;而il-4变化不明显。单独cpg-odn2006组并未见明显ifn-γ水平的变化。提示muc1-mbp联合cpg-odn2006能协同诱导th1应答。
表3各组小鼠免疫后muc1特异性淋巴细胞分泌细胞因子(n=10,
其中,a:p<0.01,与对照组比较;b:p<0.01,与cpg(0.8mg/kg)组比较;b1:p<0.01,与muc1-mbp组比较;c:p<0.05,与对照组比较;d:p<0.05,与cpg(0.4mg/kg)组比较;f:p<0.05,与单独muc1-mbp组比较。
4.结论
cpg-odn2006与muc1-mbp协同促进产生muc1特异性th1应答,提示cpg-odn2006具有诱导muc1-mbp产生特异性细胞免疫应答的作用,可作为癌症疫苗开发利用。
实验例4
1.材料
g418,胎牛血清购自biobio、imdm购自gibco。
动物c57bl/6小鼠,18-20克购自北京华阜康生物公司
细胞b16-muc1细胞系是稳定转染人全长muc1的小鼠b16黑色素瘤细胞。用含g418(终浓度为600μg/ml),青、链霉素(100u/ml)及10%新生牛血清的imdm培养液培养b16-muc1细胞,用流式细胞仪鉴定muc1蛋白的表达,结果显示b16-muc1细胞muc1的表达率在97.8%以上可用于肿瘤模型的构建。
2.方法
2.1小鼠分组及免疫
c57bl/6小鼠,18-20g49只,随机分7组,分别为生理盐水组(ns);muc1多肽(143氨基酸)0.15mg/kg组;mbp0.35mg/kg组;muc1-mbp0.2mg/kg组;muc1-mbp0.3mg/kg组;muc1-mbp0.4mg/kg组;muc1-mbp0.5mg/kg组。共7组,每组7只小鼠。颈背部皮下多点注射,每2周免疫一次,共免疫2次。
2.2c57bl/6小鼠皮下b16-muc1黑色素瘤模型的建立
给小鼠背胁部皮下注射b16-muc1细胞1×106个/只,每两天观察一次肿瘤的生长情况。注射肿瘤细胞后一周之内肿瘤生长缓慢,7天左右可以触摸到米粒大小的肿瘤,此后肿瘤生长速度加快,九天左右就可看到背部明显肿块。
3.结果
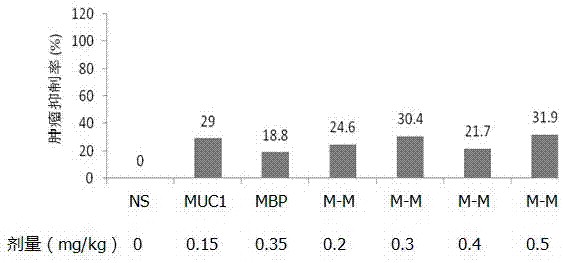
3.1重组muc1-mbp融合蛋白的抗肿瘤作用
为研究muc1-mbp融合蛋白抗肿瘤作用,以不同剂量蛋白给小鼠进行免疫,每周一次,共免疫三次后,皮下注射b16-muc1黑色素瘤细胞,然后观察肿瘤生长。结果发现随着muc1-mbp剂量的增加,肿瘤抑制作用有所增加,最高可达31.9%。(参见图2重组muc1-mbp单独免疫诱导的抗肿瘤作用:m-m,muc1-mbp;ns,生理盐水;肿瘤抑制率=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重)
4.结论
重组muc1-mbp单独免疫诱导的抗肿瘤作用较低,应该进一步探索不同的佐剂,以提高抗肿瘤的效果。
实验例5
1.材料
g418,胎牛血清购自biobio、imdm购自gibco,muc1-mbp本研究组制备,cpg-odn2006购置广州锐博科技股份公司。
动物:c57bl/6小鼠,18-20克购自北京华阜康生物公司
细胞:b16-muc1细胞系是稳定转染人全长muc1的小鼠b16黑色素瘤细胞。用含g418(终浓度为600μg/ml),青、链霉素(100u/ml)及10%新生牛血清的imdm培养液培养b16-muc1细胞,用流式细胞仪鉴定muc1蛋白的表达,结果显示b16-muc1细胞muc1的表达率在97.8%以上可用于肿瘤模型的构建。
2.方法
2.1小鼠分组及免疫
c57bl/6小鼠,18-20克60只,随机分6组,每组10只,分别为生理盐水组(ns)、muc1-mbp+cpg-odn20060.1mg/kg组、muc1-mbp+cpg-odn20060.2mg/kg、muc1-mbp+cpg-odn20060.4mg/kg、muc1-mbp+cpg-odn20060.8mg/kg组、muc1-mbp+cpg-odn20061.6mg/kg。将muc1-mbp和cpg-odn2006按照一定比例进行混合,颈背部皮下多点注射,每2周免疫一次,共免疫2次。
2.2c57bl/6小鼠皮下b16-muc1黑色素瘤模型的建立
给小鼠背胁部皮下注射b16-muc1细胞1×106个/只,每两天观察一次肿瘤的生长情况。注射肿瘤细胞后一周之内肿瘤生长缓慢,7天左右可以触摸到米粒大小的肿瘤,此后肿瘤生长速度加快,九天左右就可看到背部明显肿块。
3.结果
3.1cpg-odn2006增强重组muc1-mbp融合蛋白的抗肿瘤作用
为研究cpg-odn2006在muc1-mbp融合蛋白抗肿瘤中的作用,将二者进行混合,以不同剂量给予小鼠进行免疫,每周一次,共免疫二次后,皮下注射b16-muc1黑色素瘤细胞,然后观察肿瘤生长。如表4所示,随着cpg-odn2006剂量的增加,肿瘤抑制作用有所增加,最高可达78.1%,显著高于实验4显示的muc1-mbp蛋白单独作用31.9%(图2)。结果提示cpg-odn2006作为佐剂显著增强muc1-mbp蛋白的抗肿瘤作用,可作为该疫苗的良好候选佐剂。
表4muc1-mbp与cpg-odn2006联合免疫诱导的抗肿瘤作用
4.结论
cpg-odn2006与muc1-mbp联合具有显著的协同抗肿瘤作用,cpg-odn2006是muc1-mbp融合蛋白抗肿瘤疫苗的良好佐剂。
实验例6
1.材料
g418,胎牛血清购自biobio、imdm购自gibco,muc1-mbp本研究组制备,cpg-odn2006购置广州锐博科技股份公司。
c57bl/6小鼠(20-22g)40只,雌雄各半,购自北京华阜康生物技术有限公司。
细胞:b16-muc1细胞系是稳定转染人全长muc1的小鼠b16黑色素瘤细胞。用含g418(终浓度为600μg/ml),青、链霉素(100u/ml)及10%胎生牛血清的imdm培养液培养b16-muc1细胞,用流式细胞仪鉴定muc1蛋白的表达,结果显示b16-muc1细胞muc1的表达率在97.8%以上可用于肿瘤模型的构建。
2.方法
为观察小鼠的生存期,本发明首先给小鼠免疫,然后注射肿瘤,观察小鼠的生存期。将c57bl/6小鼠随机分组,共分成四组,包括生理盐水(ns)对照组,cpgodn2006(0.4mg/kg)单独用药组,muc1-mbp(0.2mg/kg)联合cpgodn2006(0.4mg/kg)组,muc1-mbp(0.2mg/kg)联合bcg(15mg/kg)组,每组雌雄各半。简而言之,小鼠皮下多点免疫,2周一次,共免疫2次.于末次免疫4-10天,在背部注射b16-muc1黑色素瘤细胞1×106个/只,观察小鼠生存期。
3.结果
免疫小鼠注射肿瘤后,观察至70天,结果如图3显示,生理盐水对照组小鼠全部死亡,cpgodn2006单独实验组和muc1-mbp联合bcg组存活率只有10%,而cpgodn2006与muc1-mbp联合免疫组存活率50%。结果提示cpgodn2006与muc1-mbp协同延长荷瘤小鼠的生存期,具有显著地抗肿瘤作用。(参见图3cpgodn2006与muc1-mbp对小鼠生存期影响)。
4.结论
cpgodn2006与muc1-mbp协同延长荷瘤小鼠的生存期,具有显著地抗肿瘤作用。
本发明的积极效果在于:cpg-odn2006联合muc1-mbp融合蛋白不仅能协同诱导体液免疫应答产生,而且能协同促进细胞免疫应答的产生,并具有明显的协同抗肿瘤作用。可作为癌症疫苗开发应用于临床免疫治疗领域。
- 还没有人留言评论。精彩留言会获得点赞!