丙肝聚合酶抑制剂的制作方法与工艺
本发明涉及抗病毒化合物,更具体地,涉及一种抑制由丙型肝炎病毒(HCV)编码的NS5A聚合酶(本文中,也称为丝氨酸蛋白酶)的化合物,以及含所述化合物的组合物,及抑制NS5A聚合酶的方法。
背景技术:
丙型肝炎是由丙型肝炎病毒(hepatitisCvirus,HCV)引起的经血液传播的一类肝脏疾病,患者具有易疲劳、恶心、呕吐等症状。HCV感染者约有60%-80%发展为慢性肝炎,其中约20%发展为肝硬化,并有约2%-5%的患者死于HCV感染导致的肝硬化和肝癌(ModiAA,LiangTJ.HepatitisC:aclinicalreview.OralDis[J].2008,14(1):10-4.)。全球范围内,HCV感染人数约占总人口数的2.2-3.0%,约为1.3-1.7亿(LavanchyD.TheglobalburdenofhepatitisC[J].LiverInt2009;29Suppls1:74–81.)。我国HCV的感染率约为3.2%,HCV感染正成为危害人类健康的问题(中华肝脏病杂志,2004,12(4):194—198.)。目前,由于缺少特异性有效的药物和疫苗,临床上标准的治疗方案是采用α干扰素(interferonalfa,INF-α)或聚乙二醇化干扰素(pegylatedinterferon,peg-INF)和利巴韦林(ribavirin,RBV)联合用药治疗丙型肝炎,然而,即使凭借包含聚乙二醇修饰的(pegylated)α-干扰素和利巴韦林的结合的实验性治疗方案,绝大部分病人没有持续减少病毒负载量。存在治疗周期长、选择性差、不良反应大等缺点;干扰素和利巴韦林会致患者出现流感样症状、疲乏、认知功能障碍、抑郁、皮疹、胃肠道症状、甲状腺功能不全、视网膜病变、溶血性贫血及血细胞减少等不良反应,使部分患者不能耐受而提前终止治疗(MannsMP,WedemeyerH,CornbergM.TreatingviralhepatitisC:efficacy,sideeffects,andcomplications[J].Gut.2006;55(9):1350-9)。因而,存在着明确的且未得到满足的开发有限的用于治疗HCV传染的方法的需要。能够直接抑制HCV复制的蛋白酶抑制剂或者聚合酶抑制剂成为抗丙型肝炎病毒的新型物质。其中以HCVNS3/4A丝氨酸蛋白酶(NS3/4Aserineprotease,NS3/4ASP)、NA5A聚合酶和NS5BRNA依赖的RNA聚合酶(NS5BRNA-dependentRNApolymerase,NS5BRdRp)等为靶标,寻找HCV特定靶点抗病毒治疗(specificallytargetedantiviraltherapyforHCV,STAT-C)药物是抗HCV研究的重要方向。HCV是一种正链RNA病毒。基于推断的氨基酸序列和5’非翻译区中广发的相似性的比较,已经讲HCV分类为黄病毒科中单独的种。全部黄病毒科的成员都已封装了病毒体,这些病毒体包含正链RNA基因组,其通过单个连续的可译框架的翻译编码了全部已知的病毒特定的蛋白质。在HCV基因组中,在核苷酸和所编码的氨基酸序列内存在着显著的异质性。已经表征六种主要的基因型,并且描述了50种以上的亚型。在全世界,HCV的主要基因型在其分布方面不同,并且尽管大量研究了基因型对发病机理和治疗方法的可能的作用,但是HCV的遗传异质性的临床意义仍然难以捉摸。単链HCVRNA基因组在长度上约为9500个核苷酸,并且具有编码约3000个氨基酸的单个大型多蛋白的单个可译框架(ORF)。在受感染细胞中,这种多蛋白在多个位点被细胞蛋白酶和病毒蛋白酶裂解从而产生结构性和非结构性(NS)蛋白质。就HCV来说,成熟的非结构性蛋白质(NS2、NS3、NS4A、NS4B、NS5A和NS5B)的产生受到两种病毒蛋白酶的影响。第一种蛋白酶在NS2-NS3连接点处裂解;第二种蛋白酶是含于NS3的N-末端范围内的丝氨酸蛋白酶,并且介导NS3下游的全部随后裂解,在NS3-NS4A裂解位点处为顺式,对于其余的NS4A-NS4B、NS4B-NS5A、NS5A-NS5B位点,为反式。NS4A蛋白质似乎起到多种功能,作为NS3蛋白酶的辅助因子并且可能有助于NS3和其它病毒复制酶组分的膜定位。NS3蛋白质与NS4A的络合型对于有效的多蛋白加工来说是必需的,强化了在所有位点处的溶蛋白性裂解。NS3蛋白质还显示出核苷三磷酸酶和RNA解旋酶活性。NS5B是一种依赖于RNA的RNA聚合酶,其涉及HCV的复制。目前STAT-C药物是抗HCV研究的重要方向,国外许多医药公司正积极研究该类药物,部分药物进入到临床试验阶段,美国Vertex公司的NS3/4A丝氨酸蛋白酶抑制剂Telaprevir(VX-950)和先灵葆雅公司(ScheringPlough)研发的NS3/4A丝氨酸蛋白酶抑制剂boceprevir(SCH503034)已于2011年被FDA批准上市。NS5A蛋白和NS5B聚合酶抑制剂药物正在进行临床试验研究。此外,还有一些试验药物以其它的病毒酶,如解螺旋酶、NS5A和HCV5'非编码区的内部核糖体进入位点(IRES)作为靶位,部分研究显示出有效的抗病毒效果。PPI-461是由Presidio药物公司与Stanford和Rutgers大学合作研发的一种用于治疗HCV感染的小分子NS5A/NS4B抑制剂,目前进入II期临床试验。它模仿一种抑制性肽类阻断病毒NS5A锚定到丙型肝炎病毒核蛋白与细胞膜的结合体上(6thAnnBioPartnerNAmerica(Vancouver),2008;CompanyWebPage,Presidio,31Jul&13Nov2008;Pressreleases,Presidio,7Jul2009&27Apr2010;BioWorldToday,13Jul2009)。BMS-790052是由Bristol-MyersSquibb(BMS)公司研发的用于治疗HCV感染的丙肝病毒NS5A抑制剂。目前正在进行临床II期试验(StudyofBMS-790052Add-OntoStandardofCareinTreatmentNaiveSubjects(HEPCAT)[EB/OL].(2010-9-9)http://clinicaltrials.gov/ct2/show/NCT01125189)。
技术实现要素:
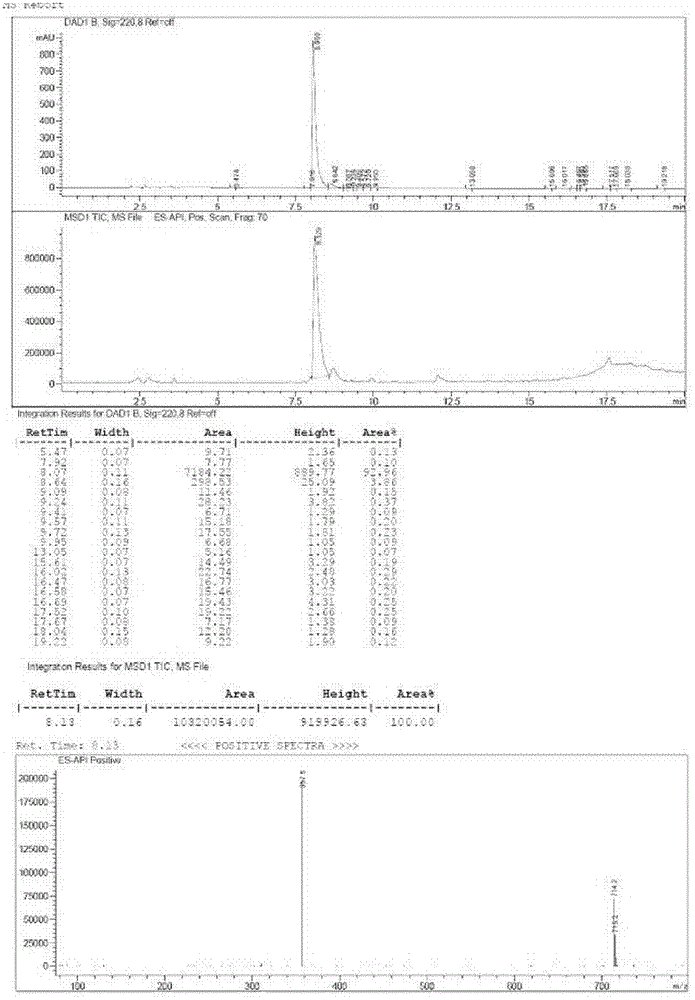
一方面,本发明目的在于提供一种具有通式(I)结构的化合物或其可药用盐,其中:R1和R3各自独立地选自氢、烷氧基、烷基、芳基烷氧基羰基、羧基、卤代烷基、卤素、羟基和-NRaRb羰基和三烷基甲硅烷基烷氧基烷基;R2选自C1-C5低级烷基、烷基羰基烷基、芳基、芳基烯基、芳基烷氧基、芳基烷基、芳基氧基烷基、环烷基、环烷基氧基烷基、卤代烷基和杂环基。在一优选的实施例中,其中R1和R3各自独立地选自氢。在另一优选的方案中,其中R2选自C1-C5的烷基、环烷基、芳基、芳基烷基、环烷基烷基、杂环基和杂环基烷基。本发明包括所述化合物的所有可药用盐形式,可药用盐为哪些盐盐形式,其中的抗衡离子对对所述化合物的生理活性或毒性没有显著贡献,因而起药理学等价物的作用。这些盐可以采用市售试剂根据普通邮寄技术制备,一些阴离子盐形式包括乙酸盐、acistrate、苯磺酸盐、溴化物、氯化物、柠檬酸盐、富马酸眼、葡萄糖醛酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、碘化物、乳酸盐、马来酸盐、甲磺酸盐、硝酸盐、双羟萘酸盐、磷酸盐、琥珀酸盐、硫酸盐、就是酸盐、甲苯磺酸盐和xinofoate,优选地为二盐酸盐。一些阳离子盐形式包括铵、铝、N,N’-双苄基乙撑二胺、铋、钙、胆碱、二乙基胺、锂、镁、甲葡胺、4-苯基环己基胺、哌嗪、钾、钠、氨基丁三醇和锌的盐。通式化合物可以通过本领域已知方法制备,包括下文描述的那些在内。一些试剂盒中间体在本领域是已知的,其它试剂盒中间体可以使用易于获得的原料通过本领域已知的方法制备。用于描述通式化合物合成的变量(例如数字化的“R”取代基)仅仅用于举例说明如何制备,而不应与在说明书权利要求或其它部分中使用变量混淆,在方案中使用的缩写一般说来依照本领域使用的惯例。在具体的实施例中,本发明涉及下列结构式的化合物:或其可药用盐。在方案中使用的缩写一般来说依照本领域使用的管理,一些实例如下:THF意指四氢呋喃;DMF意指N,N-二甲基甲酰胺;RCM意指闭环methasis;Boc意指叔丁氧基羰基;TFA意指三氟乙酸;DMA意指N,N-二甲基乙酰胺;PPh3意指三苯基膦;OAc意指乙酸酯;Me意指甲基;COD(或cod)意指1,5-环辛二烯;DCM意指二氯甲烷;DIPEA意指N,N-二异丙基乙胺;dtbpy意指4,4’-二-叔丁基-2,2’-二吡啶;dba意指二亚苄基丙酮;EDCI意指1-乙基-3-(3-二甲胺丙基)碳二胺盐酸盐;aq意指水溶液;tBUty或t-Bu表示叔丁基,SEM表示-(三甲基甲硅烷基)乙氧基甲基;TFA表示三氟乙酸;Ph意指苯基;OAc意指乙酸根;Cbz意指苄氧羰基;Bn意指苄基;EtOH意指乙醇;MeOH意指甲醇;TBTU意指2-(1H-苯并三唑-1-基)-1,1,3,3-四甲基脲阳离子四氟硼酸盐;DMSO意指二甲基亚砜;HATU意指O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲阳离子六氟磷酸盐;TEA意指三乙胺;HOBt意指1-羟基苯并三唑,CH3CN意指乙腈;Pd(dppf)Cl2意指1,1'-双(二苯基磷)二茂铁]二氯化钯。本发明的再一目的在于提供一种组合物,所述组合物为含有治疗有效量的本发明所述通式(I)化合物或其可药用盐,以及药用载体、稀释剂或赋形剂。治疗有效量,是指足以表现出患者益处的各活性成分的总量,如减少病毒负荷。当单独给予应用于单个活性成分时,治疗有效量指单一成分,当联合用药时,指产生治疗效果的活性成分和冰凉,而不管是否是依次或是同时的联合给予。本文所用术语“药学上可接受”,实质这样的化合物、原料、组合物和/或剂型,他们在正确的医学判断范畴内,适用于与患者组织接触,而无过度毒性、刺激性、过敏性反应或其它问题或并发症,此与合理的利益/风险比想成,且对他们的预定用途有效。药物制剂可以以单位剂型存在,其每单位剂量含有预定量的活性成分,在用于预防和治疗HCV接到的疾病的单一疗法中,约0.01-200毫克每千克体重每天,优选为0.05-100mg/kg体重每天的本发明所公开化合物剂量水平。典型地,本公开的药用组合物将以每日约1-约5此给予,或者作为连续输注的方式给予。这样的给药可用作慢性或剂型疗法,可以与载体原料组合以生产单一剂型的活性成分的量将根据所治疗的疾病、病情的严重性、给药次数、给药途径、所用化合物的排泄速率、疗程,以及患者的年龄、性别、体重和身体状况而变化。优选的单位剂量制剂为含有日剂量或如本文上述的亚剂量,或其合适的分剂量的活性成分。治疗可以以明显小于所述化合物的最适剂量的小剂量开始,此后,剂量按照小的增量增加,直至达到该情况下的最佳效果,一般来说,所述化合物的最理想的给予是在通常将所提供病毒有效的结果,而不引起任何有害的或有毒的副作用的浓度水平。当本公开的组合物包含本公开的化合物和至少一种另外的治疗或预防剂的组合时,化合物和两癌的治疗或预防剂连着通常以约10%至150%之间的剂量水平存在,通常更优选在单一疗法方案中以约10%至80%之间的剂量给予。可适于以任何适当的途径给予药用制剂,例如通过口服(包括口颊或舌下含服)、直肠、经鼻、局部(包括口颊、舌下或透皮)、阴道或胃肠外(包括皮下、皮内、肌肉内、关节内、滑膜腔内、胸骨内、鞘内、病灶内、静脉内或皮内注射或输注)途径。可通过制药领域已知的人非方法,例如通过将活性成分与载体或赋形剂混合制备这样的制剂。优选口服或注射给予。适用于口服给予的药物制剂可作为分立的单位存在,如胶囊或片剂;散剂或颗粒剂;在含水或非水液体中的溶液或混悬剂;可食用泡沫剂或whips;或水包油液体乳剂或油包水乳剂。例如对于以片剂或胶囊形式的口服给药,活性药物成分可与口服的、非毒性的药学上可接受的惰性载体如乙醇、甘油、水等混合。散剂通过将化合物粉碎成合适的细粉大小并与类似地粉碎的药用载体(如食用碳水化合物、淀粉或甘露醇)混合来制备。调味剂、防腐剂、分散剂和着色剂也可存在。而且,当想要或需要时,也可将适宜的粘合剂、润滑剂、崩解剂和着色剂掺入混合物中,适宜的粘合剂包括淀粉、明胶、天然糖诸如葡萄糖或β-乳糖、玉米甜味剂、天然和合成树胶诸如阿拉伯树胶、黄蓍胶或藻酸钠、羧甲基纤维素、聚乙二醇等。用于这些机型的润滑剂包括油酸钠、氯化钠等,崩解剂包括,但不限定于淀粉、甲基纤维素、琼脂、黄原胶等,例如通过制备粉末混合物,造粒或造小块,添加润滑剂和崩解剂并且压制成片,配置片剂。功过将回荡粉碎的化合物与稀释剂或如上描述的基质混合,并且任选与粘合剂诸如羧甲基纤维素、藻酸盐、明胶或与乙烯吡咯烷酮、缓凝剂诸如石蜡、再吸收加速剂诸如季铵盐,或吸收剂诸如膨润土、高岭土或磷酸二钙混合,制备粉末混合物。可通过用粘合剂诸如糖浆、淀粉糊、阿卡迪亚粘液或纤维素或聚合物原料的溶液湿润粉末混合,并且挤压通过筛网造粒。作为造粒的另一种选择,可将粉末混合物通过压片机,并将不完整形成的块破碎成粒。可采用添加硬脂酸、硬脂酸盐、滑石粉或植物油的方法是颗粒润滑以防片剂粘附在片剂成形冲模上,然后将润滑的混合物压制成片剂。可提供由虫胶的密封层组成的透明或不透明的保护层、糖或聚合原料的包衣或蜡抛光包衣。可制备为剂量单位形式的口服液体诸如溶液剂、提昂降级和酏剂,这样,所给的量含预定量的化合物。通过将化合物溶解于适宜的经过矫味处理的水溶液中,可制备糖浆剂、而通过使用无毒性的溶媒,可制备酏剂,也可加入增溶剂和乳化剂诸如乙氧基化的异硬脂醇和聚氧乙烯山梨醇醚,防腐剂、矫味添加诸如薄荷油或天然甜味剂或糖精或其它的人造矫味剂等。在一实施例中,该组合物还可进一步包括至少一种具有抗HCV活性的化合物,该活性化合物可以是干扰素、利巴韦林、HCV金属蛋白酶抑制剂、HCV丝氨酸蛋白酶抑制剂、HCV聚合酶抑制剂、HCV解旋酶抑制剂、HCVNS4B蛋白酶抑制剂或HCVNS5A蛋白酶抑制剂等。比如,所述的干扰素,可以是选自干扰素α2b、干扰素α2a、干扰素λ、干扰素β、干扰素γ、聚乙二醇干扰素α、长效干扰素、复合干扰素、淋巴酵母细胞样干扰素τ等。本发明的又一目的,在于提供一种治疗患者HCV感染的方法,包括对患者给予治疗有效量的通式(I)的化合物、或其可药用盐。在治疗HCV感染患者的方法中,还进一步包括给予通式(I)所述化合物、或其可药用盐之前、之后或同时给药至少一种另外的具有抗HCV活性的化合物。下表1列出了一些可与本公开化合物一起给予的示例性化合物的实例,在联合治疗中,本发明公开化合物可与其他的抗-HCV活性化合物或者和在一起或者分开或者通过将各化合物混合在组合物中一起给予。表1附图说明图1为化合物KW811的1H-NMR图谱。图2为化合物KW811的LC-MS图谱。图3化合物KW811的抗病毒活性图。图4为化合物KW811和KW819的细胞毒性图。实施例所述实方案并不是限制本发明公开的范围,相反,本公开涵盖所有的如可包括在权利要求书范围内的备选方案、修正和等价物。因而,一下的包括具体实施方案的实施例将阐明本公开的一种实践,应该理解,这些实施例是为了阐明某些实施方案的目的,并且呈现出来以提供相信对其方法和概念的描述是最有用的和易于理解的。实施例1(S)-2-(甲氧基碳酰氨基)-2-苯乙酸的合成将ClCO2Me(41.4mmol)滴加到冷却(冰/水)的(S)-2-氨基苯基乙酸叔丁酯/HCl(40.52mmol)和二异丙基乙胺(81.52mmol)与THF(410ml)的半溶液中,并在同样的温度下搅拌5.5小时,真空除去挥发性成分后,使残余物在水(100ml)和乙酸乙酯(200ml)之间分配,有几层用1NHCl(25ml)和饱和NaHCO3(30ml)洗涤,无水Na2SO4干燥,过滤后真空浓缩,所得无色油状物用己烷研磨,过滤后用己烷(100ml)洗涤,得到(R)-2-(甲氧羰基氨基)-2-苯基乙酸叔丁酯(7.7g,白色固体)。将TFA(16ml)滴加到上述产物的冷却(冰/水)的CH2Cl2(160ml)溶液中,移开冷却浴后,搅拌反应混合物20小时,由于脱保护反应仍为完成,因此在加入TFA(1.0ml),并再继续搅拌2小时,真空除去挥发性成分后,所得油性残余物用乙醚(15ml)和己烷(12ml)处理,得到沉淀物,沉淀物经过滤后,用乙醚/己烷(约1:3,30ml)洗涤后,真空干燥,得到(S)-2-(甲氧基碳酰氨基)-2-苯乙酸。旋光性:-176.9°[c=3.7mg/ml,H2O中;λ=589nm]。HNMR(DMSO-d6,δ=2.5ppm,400MHz):δ12.84(brs,1H),7.96(d,J=8.3,1H),7.41-7.29(m,5H),5.14(d,J=8.3,1H),3.55(s,3H)。LC/MS:对于[M+H]+C10H12NO4测定值为210.1。实施例2甲基(S)-2-((S)-2-(4-(4’-(2-((S)-1-(3-甲基氧杂环丁烷-3-羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)-2-氧代-1-苯基乙基氨基甲酸苄酯。合成步骤步骤a:2-溴-1-(4-溴苯)-乙酮将1-(4-溴苯)-乙酮(50g,0.253mmol)溶解于二氯甲烷(300mL)中,加入溴液(40.81g,0.225mol),在充N2条件下,混合物在室温下搅拌4小时,然后将反应物浓缩,得到产物2-溴-1-(4-溴苯)-乙酮,所得粗产物(50g,70%)用于下一步合成,粗产物无需进一步纯化。步骤b:(S)-1-苄基-2-(2-(4-溴苯)-2-氧代乙基)吡咯烷-1,2-二甲酸酯将2-溴-1-(4-溴苯)-乙酮(9.5g,36mmol)、以及(S)-1-(苄氧羰基)吡咯烷-2-甲酸(9g,38mmol)混合物的乙腈溶液于20℃下加入到DIPEA(4.6g,38mmol)中,混合液搅拌过夜,所得反应物用浓盐水洗涤,有机相用无水硫酸钠干燥,并浓缩得到产物(15.3g,93.6%)。所得产品用于下一步合成,无需进一步纯化。步骤c:(S)-苄基-2-(4-(4-溴苯)-1H-咪唑-2-基)吡咯烷-1-甲酸酯于(S)-1-苄基-2-(2-(4-溴苯)-2-氧代乙基)吡咯烷-1,2-二甲酸酯(15g,33.7mmol)的甲苯溶液中,加入醋酸铵,混合物加热至100℃保持5小时,所得混合物浓缩,残留物用硅胶柱色谱纯化,得到产物(S)-苄基-2-(4-(4-溴苯)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(5g,35%)。步骤d:(R)-2-(4’-2-((R)-1-((R)-2-(甲氧基碳酰氨基)-3-甲基丁酰基)吡咯烷-2-碳酰氧)联苯-4-基)-2氧代乙基在(S)-苄基-2-(4-(4-溴苯)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(6g,14mmol)的1,4-二噁唑(60ml)溶液中加入醋酸钾(4.15g,42mmol)和联硼酸频那醇酯(4.15g,42mmol)。混合物脱气并用N2置换3次,然后加入Pb(dppf)Cl2。混合物在80℃下搅拌3h,所得反应混合物用水洗涤并用EA萃取,混合有机相用无水Na2SO4干燥、浓缩,残留物经硅胶柱色谱纯化后得到(R)-2-(4’-2-((R)-1-((R)-2-(甲氧基碳酰氨基)-3-甲基丁酰基)吡咯烷-2-碳酰氧)联苯-4-基)-2氧代乙基(6g,90%)。步骤e:(S)-2-(2-(4-溴苯)-2-氧代乙基)1-叔丁基吡咯烷-1,2-二甲酸酯步骤d中所得产物(9.5g,36mmol)、以及(S)-1-(叔丁氧羰基)吡咯烷-2-羧酸(9g,38mmol)的乙腈溶液中,于20℃下加入DIPEA(4.6g,38mmol),所得混合物搅拌过夜,反应混合物用浓盐水洗涤,有机相用无水Na2SO4干燥、浓缩后得到粗产物(S)-2-(2-(4-溴苯)-2-氧代乙基)1-叔丁基吡咯烷-1,2-二甲酸酯(15.3g,93.6%)。所得产品用于下一步合成,无需进一步纯化。步骤f:(S)-叔丁基2-(4-(4-溴苯)-1H-咪唑-2基)吡咯烷-1-甲酸酯步骤e中所得产品(15g,33.7mmol)的甲苯溶液中,加入醋酸铵(15g,33.7mmol)。混合物加热至100℃并保持5h,所得反应混合物浓缩,残留物用硅胶柱色谱纯化后得到产物(S)-叔丁基2-(4-(4-溴苯)-1H-咪唑-2基)吡咯烷-1-甲酸酯(5.6g,35%)。步骤g:(S)-苄基2-(4-(4’-(2-((S)-1-(叔丁氧羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯步骤f中所得产品(2.08g,5.285mmol),以及(R)-2-(4’-(2-((R)-1((R)-(甲氧碳酰氨基)-3-甲基定酰基)吡咯烷-2-碳酰氧基)乙酰基)联苯-4-基)-2-氧代乙基(3g,6.34mmol)的DME溶液中,加入Na2CO3溶液(2M,5ml)。所得溶液脱气并用N2置换三次,加入Pb(PPH3)2Cl2,所得反应液在87℃搅拌16小时,反应液冷却至环境温度并用乙酸乙酯稀释,所得有机相用无水Na2SO4干燥、浓缩,残留物经硅胶柱色谱纯化后得到产物(S)-苄基2-(4-(4’-(2-((S)-1-(叔丁氧羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(2.5g,72%)。步骤h:(S)-叔丁基2-(4-(4’-(2((S)-吡咯烷-2-基)-1H-咪唑-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯。步骤f中所得产物(2.5g,3.8mmol)的甲醇溶液中,加入10%的Pd/C(1.5g)。混合物脱气,并用H2置换三次后,反应溶液在室温下搅拌2天,然后反应混合物过滤,滤液浓缩后得到产物(S)-叔丁基2-(4-(4’-(2((S)-吡咯烷-2-基)-1H-咪唑-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(1.5g,75%)。步骤i:(S)-叔丁基2-(4-(4’-(2-((S)-1-((S)-2-(甲氧碳酰氨基)-2-苯乙酰)吡咯烷-2-基)1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯步骤h中所得产品(1g,1.9mmol)、以及EDCI(0.4374g,2.28mmol)和HOBt(0.3092g,2.28mmol)的乙腈溶液中,加入(S)-2-(甲氧碳酰氨基)-2苯乙酸(476mg,2.28mmol)。混合液冷却至0℃,并在保持10℃下逐滴加入DIPEA(490mg,3.8mmol)。所得反应液在室温下搅拌过夜,反应混合物用水洗涤,并用CH2Cl2萃取,有机相用无水Na2SO4干燥,浓缩,残留物经硅胶柱色谱纯化,得到反应产物(S)-叔丁基2-(4-(4’-(2-((S)-1-((S)-2-(甲氧碳酰氨基)-2-苯乙酰)吡咯烷-2-基)1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(0.8g,60%),为黄色固体。步骤j:甲基(S)-2-氧代-1-苯基-2-((S)-2-(4-(4’-(2-((S)-吡咯烷-2-基)-1H-咪唑-4基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)乙基甲酸酯。步骤i中所得产品(0.5g,0.7mmol)的DCM溶液(5mL)中,逐滴加入TFA(3mL),所得混合物室温搅拌过夜,经TLC检测后,反应所得混合物用NaHCO3洗涤,并用DCM萃取,有机相干燥,浓缩得到黄色固体甲基(S)-2-氧代-1-苯基-2-((S)-2-(4-(4’-(2-((S)-吡咯烷-2-基)-1H-咪唑-4基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)乙基甲酸酯(0.4g,93%)。步骤k:甲基(S)-2-((S)-2-(4-(4’-(2-((S)-1-(3-甲基氧杂环丁烷-3-羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)-2-氧代-1-苯基乙基氨基甲酸苄酯。步骤j中所得产物(0.35g,1.9mmol)、EDCI(0.4374g,0.8mmol)、HOBt(0.3092g,0.8mmol)的乙腈液(5mL)中,加入3-甲基氧杂环丁烷-3-甲酸酯(0.093g,0.8mmol)。所得混合物冷却至0℃后,在保持温度低于10℃条件下逐滴加入DIPEA(0.172g,1.336mmol)。所得混合物室温搅拌过夜,所得反应物用水洗涤,并用CH2Cl2萃取,有机相用无水Na2SO4干燥,浓缩,残留物经p-TCL纯化,得到黄色固体产物:甲基(S)-2-((S)-2-(4-(4’-(2-((S)-1-(3-甲基氧杂环丁烷-3-羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)-2-氧代-1-苯基乙基氨基甲酸苄酯(100mg,15%),其HNMR图谱及LC-MS图谱见图1和2。实施例3化合物KW810的合成(S)-叔丁基2-(4-(4’-(2-((S)-1-((S)-2-(甲氧碳酰氨基)-3-甲基丁酰基)吡咯烷-2-基)1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯的合成将实施例2步骤h中所得产品(1g,1.9mmol)、以及EDCI(0.4374g,2.28mmol)和HOBt(0.3092g,2.28mmol)的乙腈溶液中,加入(S)-2-(甲氧碳酰氨基)-3甲基丁酸(2.28mmol)。混合液冷却至0℃,并在保持10℃下逐滴加入DIPEA(490mg,3.8mmol)。所得反应液在室温下搅拌过夜,反应混合物用水洗涤,并用CH2Cl2萃取,有机相用无水Na2SO4干燥,浓缩,残留物经硅胶柱色谱纯化,得到反应产物(S)-叔丁基2-(4-(4’-(2-((S)-1-((S)-2-(甲氧碳酰氨基)-3-甲基丁酰基)吡咯烷-2-基)1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(0.8g,60%),为黄色固体。其余步骤同实施例2中步骤j以及k,得到反应产物KW810:甲基(S)-2-((S)-2-(4-(4’-(2-((S)-1-(3-甲基氧杂环丁烷-3-羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)-2-氧代-3-甲基丁酰基氨基甲酸甲酯(0.05g,纯度大于95%),ES-API图谱测定其值为679.81。实施例4化合物KW812的合成(S)-叔丁基2-(4-(4’-(2-((S)-1-((S)-2-(甲氧碳酰氨基)-4-甲基戊酰基)吡咯烷-2-基)1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯的合成将实施例2步骤h中所得产品(1g,1.9mmol)、以及EDCI(0.4374g,2.28mmol)和HOBt(0.3092g,2.28mmol)的乙腈溶液中,加入(S)-2-(甲氧碳酰氨基)-4-甲基戊酸(2.28mmol)。混合液冷却至0℃,并在保持10℃下逐滴加入DIPEA(490mg,3.8mmol)。所得反应液在室温下搅拌过夜,反应混合物用水洗涤,并用CH2Cl2萃取,有机相用无水Na2SO4干燥,浓缩,残留物经硅胶柱色谱纯化,得到反应产物(S)-叔丁基2-(4-(4’-(2-((S)-1-((S)-2-(甲氧碳酰氨基)-4-甲基戊酰基)吡咯烷-2-基)1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-甲酸酯(0.8g,60%),为黄色固体。其余步骤同实施例2中步骤j以及k,得到反应产物KW812:甲基(S)-2-((S)-2-(4-(4’-(2-((S)-1-(3-甲基氧杂环丁烷-3-羰基)吡咯烷-2-基)-1H-咪唑-4-基)联苯-4-基)-1H-咪唑-2-基)吡咯烷-1-基)-2-氧代-4-甲基戊酰基氨基甲酸甲酯(0.05g,纯度大于95%),ES-API图谱测定其值为693.84。实施例5化合物KW813的合成以(S)-2-(甲氧碳酰氨基)-丁酸为原料,其合成步骤同实施例4,得到反应产物KW813,ES-API图谱测定其值为665.78。实施例6化合物KW814的合成以(S)-2-(甲氧碳酰氨基)-丙酸为原料,其合成步骤同实施例4,得到反应产物KW813,ES-API图谱测定其值为651.76。实施例6化合物体外抗HCV活性的检测按照Blight等报道的方法(J.Virol.2003;77:3181-3190)分别构建含有HCV基因亚型1a(H77)与1b(Con1)的HCV基因组全长体外复制子系统和实时荧光定量逆转录聚合酶链式反应(qRT-PCR)检测方法。在上述病毒复制系统中分别加入不同浓度的化合物和相同体积的二甲基亚砜(DMSO,阴性对照),继续培养48小时后,进行qRT-PCR病毒核酸定量检测。各化合物(KW810-KW814)均溶于DMSO中,配制成10mM的储备液备用,在进行抗病毒实验中,各化合物的起始浓度设定在100nM,终浓度为0.01pM。对上述化合物分别进行10倍系列稀释,每个处理分别进行3次独立重复实验,每次重复设5个复孔,实验数据进行统计分析。在同等条件下,根据BMS(百美施贵宝公司)的临床药物(BMS790052)公开的方案进行合成化合物BMS790052,以该化合物为体外活性的阳性对照。经检测,化合物对于H77和Con1两种亚型的HCV复制效率的抑制效果十分接近,以Con1亚型为例,化合物KW-811对HCV复制的IC50约为0.1pM(结果见图3),活性最强,其它化合物的抗HCV活性的IC50值结果见表2。表2化合物抗病毒活性实施例7化合物体外细胞毒性实验为获得化合物的体外细胞毒性数据,我们采用美国Promega公司生产的CytoTox-GloCytotoxicityAssay试剂盒,按照其说明书记载的方法,对肝细胞来源的HepG2、宫颈癌细胞来源HeLa、造血细胞来源K562、肺来源的A549以及肾细胞来源的293T等细胞系对两张化合物的细胞毒性进行了体外分析,结果显示在最高处理浓度为10μM的处理条件下,未见任何细胞毒性作用(结果见图4)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1