一株解淀粉芽孢杆菌及其产生的蛋白酶在制革脱毛方面的应用的制作方法
本发明属于微生物学技术领域,具体涉及一株解淀粉芽孢杆菌,本发明还涉及一种解淀粉芽孢杆菌的制备方法,本发明还涉及一种解淀粉芽孢杆菌产生的蛋白酶,本发明还涉及一种解淀粉芽孢杆菌在制革脱毛方面的应用。
背景技术:
皮革行业被列为仅次于造纸行业的污染行业。传统的脱毛工序中使用了硫化钠、硫氢化钠,采取毁毛法脱毛,不仅产生S2-污染,而且使废水中的COD、BOD值升高,废水呈强碱性且带有明显的恶臭味,对环境造成严重的污染。随着近年来一些中小型制革厂陆续被勒令停产或限产,制革行业的生存与发展面临严峻的考验。制革行业必须实现清洁化生产,而且必须真正地在制革企业实施,才能扭转当前制革行业所面临的尴尬局面,实现制革行业的可持续发展。
用生物制剂酶取代硫化钠进行脱毛是实现制革清洁化生产的有效途径之一。角蛋白酶因为能够较好的水解皮肤中的角质组织,将角蛋白降解为多肽和氨基酸,因此可以作为制革脱毛剂或助剂。
1999年Hublin等人将角蛋白酶用于牛皮脱毛研究发现具有明显的脱毛能力,2003-2005年间J.Friedrich等人将角蛋白酶用于猪皮、牛皮、羊皮、人的毛发降解研究,同时用胶原为作用底物,发现角蛋白酶不分解胶原,解决了酶脱毛不破坏胶原的难题。国外的一些研究报告表明,在没有硫化物的环境中,角蛋白酶的脱毛能力非常强。使用含角蛋白酶的脱毛助剂,可以减少脱毛废液中TDS和BOD含量,并且能够大量降低硫化物的用量以至达到零用量,这对制革工业的可持续发展和环境友好性有着重要意义。因此角蛋白酶在制革脱毛中的应用前景看好。
技术实现要素:
本发明的目的是提供一种株解淀粉芽孢杆菌。
本发明的另一目的是提供一种解淀粉芽孢杆菌的制备方法。
本发明的另一目的是提供一种解淀粉芽孢杆菌产生的蛋白酶。
本发明的另一目的是提供一种解淀粉芽孢杆菌在制革脱毛方面的应用。
本发明所采用的第一技术方案是,一株解淀粉芽孢杆菌(Bacillus amyloliquefaciens),该菌株于2015年7月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.11067。
本发明所采用的第二技术方案是,一种解淀粉芽孢杆菌的制备方法,包括以下步骤:
步骤1、样品采集:制革厂下水道出口处带有腐烂动物毛的泥土;
步骤2、富集:将所取样接入富集培养基中培养48h,转入液体种子培养基;
步骤3、菌株的初筛:在液体种子培养基培养12h后,将菌悬液在酪素选择培养基上划线培养24h,挑取有水解圈的单菌落均匀点种于酪素选择培养基,37℃恒温培养48小时,观察菌落生长状况与酪素水解情况;
步骤4、菌株的复筛:挑取水解圈明显的菌落均匀点种在固体羊毛培养基上,37℃恒温培养24小时以上,观察菌落生长状况与酪素水解情况,然后挑取水解圈在1厘米以上的单菌落,在种子培养基中活化12小时,按6%的接种量取菌液于发酵培养基中,37℃摇床发酵36小时,将发酵液离心;
步骤5、16sDNA序列测序:对筛选出的K20菌进行16SrDNA序列测序,其序列如SEQ ID NO.1所示,制备得到解淀粉芽孢杆菌。
进一步地,富集培养基的组分和含量如下:蛋白胨:1.0%,牛肉膏:1.0%,NaCl:0.5%,K2HPO4:0.07%,酪素:1.0%。
进一步地,初筛培养基为液体种子培养基,其组分和含量如下:葡萄糖:1.5%,K2HPO4:0.07%,天冬酰胺:0.09%,牛肉膏:0.07%。
进一步地,酪素选择培养基的组分和含量如下:葡萄糖:1.5%,K2HPO4:0.07%,天冬酰胺:0.09%,牛肉膏:0.07%,干酪素:2.0%,琼脂:5.0%。
进一步地,固体羊毛培养基的组分和含量如下:葡萄糖1.5%,牛肉膏0.1%,天冬酰胺0.11%,K2HPO40.12%,羊毛0.2%,琼脂:5%,pH6.4。
进一步地,发酵培养基的组分和含量如下:淀粉:3.0%,K2HPO4:0.12%,天冬酰胺:0.11%,牛肉膏:0.05%,羊毛:0.2%,pH6.4。
本发明所采用的第三技术方案是,一种上述的解淀粉芽孢杆菌产生的蛋白酶,通过以下方法制备得到:解淀粉芽孢杆菌用发酵培养基经过72小时发酵,得到的含蛋白酶发酵液。
进一步地,发酵培养基的组分和含量如下:淀粉:3.0%,K2HPO4:0.12%,天冬酰胺:0.11%,牛肉膏:0.05%,羊毛:0.2%,pH6.4。
本发明所采用的第四技术方案是,一种由上述的解淀粉芽孢杆菌产生的蛋白酶在制革脱毛方面的应用。
本发明的有益效果是:
(1)初筛得到37株菌,挑选出十五株具有水解圈的菌,经过酪素选择性平板和发酵液酶活力测定复筛,得到了一株角蛋白酶活力较高的菌株,命名为K20。
(2)通过菌种形态观察发现:该菌株为圆形、平坦、直径约为2mm,呈乳白色,表面干燥光滑,菌落边缘呈荷叶状。该菌呈杆状,经反复证明革兰氏染色为阳性。在有氧条件下生长良好,为好氧菌。
(3)K20菌的好氧生长,明胶水解,接触酶,酪氨酸水解,淀粉水解,硝酸盐还原,V-P反应均为阳性;苯丙氨酸脱氢酶,柠檬酸盐利用为阴性;可利用D-葡萄糖,D-甘露糖和麦芽糖。在30℃pH6-7,2%NaCl下生长,温度5℃和50℃不生长。5%NaCl不生长。结合菌株的形态特征及染色结果,可以基本判断K20菌为芽孢杆菌或类芽孢杆菌属。
(4)经l6s rDNA序列分析判断该菌株为芽孢杆菌属(Bacillus)。经碱基序列的NCBI对比,可初步认定该菌株为解淀粉芽孢杆菌。
(5)K20菌产生的蛋白酶对制革常用的羊皮、猪皮和牛皮都具有较好的脱毛活性。其中用于牛皮和羊皮的脱毛效果最好,脱毛后的裸皮柔软,有软化效果,且粒面平滑,毛孔清晰。
附图说明
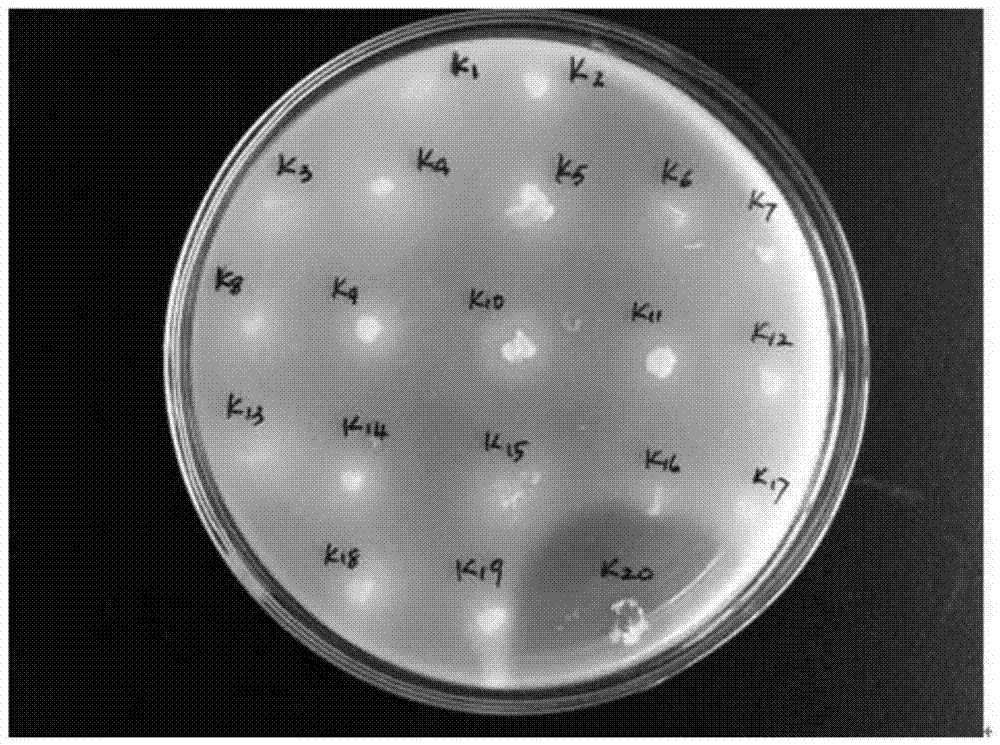
图1是本发明初筛时K1~K20菌落生长状况;
图2是本发明初筛时K21~K37菌落生长状况;
图3是本发明菌落在固体培养基上的生长(K5、K10、K15、K20、K21、K22菌株);
图4是本发明K20号菌株菌落形态特征图;
图5是本发明革兰氏染色显微照片X100;
图6是本发明PCR扩增16s rDNA结果;
图7是本发明制备得到的菌株产生的蛋白酶对四川本地山羊毛进行脱毛处理的结果;
图8是本发明制备得到的菌株产生的蛋白酶对法国奶牛皮进行脱毛处理的结果;
图9本发明制备得到的菌株产生的蛋白酶对澳洲公牛皮进行脱毛处理的结果。
具体实施方式
下面结合具体实施方式对本发明进行详细说明。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
1.材料与方法
1.1.材料
1.1.1实验仪器
1.1.2实验试剂
1.1.3富集培养基
富集培养基(%)
蛋白胨:1.0,牛肉膏:1.0,NaCl:0.5,K2HPO4:0.07,酪素:1.0;
1.1.4初筛培养基
①液体种子培养基(%)
葡萄糖:1.5,K2HPO4:0.07,天冬酰胺:0.09,牛肉膏:0.07;
②酪素选择培养基(%)
葡萄糖:1.5,K2HPO4:0.07,天冬酰胺:0.09,牛肉膏:0.07,干酪素:2.0,琼脂:5.0;
1.1.5复筛培养基:
①固体羊毛培养基(%)
葡萄糖1.5,牛肉膏0.1,天冬酰胺0.11,K2HPO40.12,羊毛0.2琼脂:5pH6.4;
②发酵培养基(%)
淀粉:3.0,K2HPO4:0.12,天冬酰胺:0.11,牛肉膏:0.05,羊毛:0.2pH6.4。
实施例1菌的分离与鉴定
1.1.样品采集:制革厂下水道出口处带有腐烂动物毛的泥土。
1.2.富集:将所取样接入富集培养基中培养48h,转入液体种子培养基。
1.3.菌株的初筛
在液体种子培养基培养12h后,将菌悬液在酪素选择培养基上划线培养24h,挑取有水解圈的单菌落均匀点种于酪素选择培养基。菌落编号为№1-37,37℃恒温培养48小时,观察菌落生长状况与酪素水解情况。
1.4.菌株的复筛
挑取水解圈明显的菌落均匀点种在固体羊毛培养基上,37℃恒温培养24小时以上,观察菌落生长状况与酪素水解情况。然后挑取水解圈在1厘米以上的单菌落,在种子培养基中活化12小时,按6%的接种量取菌液于发酵培养基中,37℃摇床发酵36小时。将发酵液离心,取清夜分别用福林法与羊毛法测定发酵液酶活力。
1.5.福林法
取2mL2%酪素底物(用磷酸二氢钾硼砂缓冲溶液配制,pH值为8.0)溶液(空白试管中加入三氯乙酸溶液),置于(40±0.2)℃水浴预热,分别加入1mL酶液摇匀。从开始加酶液起计时,10分钟后加入三氯乙酸溶液终止反应(空白试管中加干酪素溶液),离心,取上清液显色,在560nm处测定吸光度值。
酶活力定义:在上述反应体系中1min催化分解出1μg酪氨酸所需的酶量定义为一个酶活力单位(U/m L)。
酶活力U/ml=OD值*K*6*n/10
OD值:吸光度值
K:根据酪氨酸标准曲线计算出的斜率。
n:酶液的稀释倍数
1.6.羊毛法
在pH9.0和40℃条件下,取1ml适当稀释的酶液,加入2ml 1%可溶性角蛋白,对照只添加1ml的酶液,55℃水浴15min。反应结束后,加入1ml TCA(三氯乙酸)终止反应,对照组再添加2ml 1%可溶性角蛋白,颠倒混匀,静置5min,在10000rpm离心5min。取离心后的上清液1ml加入1ml碳酸钠,1ml福林酚Folin试剂(每组三个平行实验)混匀,在40℃水浴显色20min。在波长为680nm测定OD值,
角蛋白酶能将角蛋白水解成短肽甚至游离的氨基酸,酶活力越高,生成的氨基酸越多。在750nm测定反应液的OD值。
酶活力定义:在上述反应体系中,波长680nm下吸光度值每增加0.01为一个酶活单位(U/mL)。如果换算成比酶活(U/g或U/mg),需除以酶液浓度。
酶活力U/ml=OD值*K*6*n/10
OD值:吸光度值
K:根据酪氨酸标准曲线计算出的斜率。
n:酶液的稀释倍数
1.7.菌落形态观察
常规方法制作菌悬液涂片,在显微镜下观察菌落形态。
对筛选出的K20菌进行革兰氏染色。
1.8. 16sDNA序列测序
对筛选出的K20菌进行16SrDNA序列测序。
1.9.K20菌产生的角蛋白酶脱毛性能初探
K20菌发酵液经离心取上清液,按200U/g羊皮和250U/g牛皮的用量,将酶液涂抹到皮的肉面层在35℃下进行堆置酶脱毛。定时检查脱毛情况。结果见下表。
1.10实验结果:
1.10.1初筛结果
1.10.1.1平板初筛
如图1、图2和图3所示,经观察,K5、K10、K15、K20、K21、K22、K23、K24、K25、K26、K28、K29、K30、K31、K33十五株菌有水解圈,将这十五株菌重新点种到酪素选择性培养基上培养,发现水解圈在1厘米以上的有六株菌,见图3所示。其中K20菌的水解圈最大。对这六株菌进行发酵复筛。
1.10.1.2复筛结果
经过对筛选出的六株菌发酵液角蛋白酶活力测定,所得结果见表1。
表1菌株产生的角蛋白酶活力和蛋白酶活力
菌株发酵液的蛋白水解酶活力和角蛋白酶活力测定显示,K20菌株兼有蛋白酶活性和角蛋白酶活性,其蛋白酶活力比其他菌株高,测出的酶活力与平板培养时所观察到的较大的水解圈(见图3中所示)相吻合。因此选出K20菌作进一步研究。
实施例2 K20菌株生理生化性能研究
2.1.形态特征及染色结果
K20菌株菌落形态特征:形状:圆形,平坦。直径约2mm。乳白色,表面干燥光滑,菌落边缘呈荷叶状。见图4。
K20菌株在显微镜下观察呈杆状,经反复证明革兰氏染色为阳性(见图5)。在有氧条件下生长良好,为好氧菌。产芽孢,芽孢为椭圆形,有运动性。
2.2生理生化特征检测结果
K20菌的明胶水解,好氧生长,接触酶,酪氨酸水解,淀粉水解,硝酸盐还原,V-P反应均为阳性;苯丙氨酸脱氢酶,柠檬酸盐利用为阴性;可利用D-葡萄糖,D-甘露糖和麦芽糖。在30℃,pH6-7,2%NaCl下生长,温度5℃和50℃不生长。5%NaCl不生长。结合菌株的形态特征及染色结果,可以基本判断K20菌为芽孢杆菌或类芽孢杆菌属。
表2 K20菌的生理生化特征
2.3 16s rDNA序列分析
利用扩增细菌16s rDNA基因的通用引物(上游引物5’-AGAGTTTGATCCTGGCTCAG-3’,下游引物5’-CGGTTACCTTGTTACGACTT-3’),从菌株总DNA中扩增得到长约1.5kb的16S rDNA(rRNA)基因片段(见图6),进行了核苷酸序列测定,测得的序列如SEQ ID NO.1所示,将该序列与GenBank数据库的16S rDNA序列进行比较(图4),发现与该菌株16S rDNA同源性最高的均为芽孢杆菌属(Bacillus)的16S rDNA序列,与多个序列具有100%同源性。因此,可将该菌株初步菌株鉴定为芽孢杆菌。
上述碱基序列的NCBI对比结果可知:K20菌株的遗传进化距离与芽孢杆菌属最近,它与解淀粉芽孢杆菌同属于最小一个分支。结合K20菌株的形态特征和16S rDNA序列分析,鉴定K20菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
实施例3 K20菌产生的蛋白酶脱毛性能实验结果
K20菌用②发酵培养基(%)经过72小时发酵,得到的含蛋白酶发酵液用来做脱毛试验。其中,②发酵培养基(%)的组分和含量如下:淀粉:3.0,K2HPO4:0.12,天冬酰胺:0.11,牛肉膏:0.05,羊毛:0.2pH6.4。
实验结果表明:K20菌产生的蛋白酶对制革常用的羊皮、猪皮和牛皮都具有较好的脱毛活性(表3):其中用于牛皮和羊皮的脱毛效果最好。脱毛后的裸皮柔软,有软化效果,且粒面平滑,毛孔清晰。
表3菌株产生的蛋白酶脱毛活性
+脱毛效果评价,+越多,脱毛效果越好
采用本发明制备得到的菌株产生的蛋白酶对四川本地山羊毛、法国奶牛皮以及澳洲公牛皮进行脱毛处理,脱毛后的裸皮柔软,有软化效果,且粒面平滑,毛孔清晰(如图7-图9所示)。
- 还没有人留言评论。精彩留言会获得点赞!