一种新型EGFR和ALK激酶的双重抑制剂的制作方法
本发明涉及一种新型的酪氨酸激酶抑制剂,特别是突变型的EGFR和ALK的双重抑制剂。
背景技术:
肺癌是临床常见的肺部恶性肿瘤,一般分为小细胞肺癌(Small Cell Lung Cancer,SCLC)和非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)两大类。非小细胞肺癌在全世界的发病率逐年上升,严重威胁着人类健康。非小细胞肺癌是美国、日本和西欧国家癌症致死的主要原因。对于晚期患者而言,化学疗法虽然在一定程度上改善生存率,但化疗药物对人体也有显著的毒性,因而非常需要能特异性地靶向与肿瘤生长有关的关键基因的治疗剂(Schiller JH等,N.Engl.J.Med.,346:92-98,2002)。
ALK是间变性淋巴瘤激酶(Anaplastic Lymphoma kinase,ALK),2007年发现在肺癌患者中由于染色体倒位引起棘皮动物微管相关类蛋白4(EML4)基因与ALK基因的重排。EML4-ALK基因重排(又叫ALK阳性)的肺癌是新近发现的一种亚型,主要发生在NSCLC,约占肺癌3%-5%。重排的EML4-ALK融合基因编码的融合蛋白形成非配体依赖性二聚体引起组成性的ALK激活。ALK信号可通过激活RAS-MEK-ERK、JAK3-STAT3和PI3K-AKT信号通路导致细胞增殖和生成,从而促使肺癌发生和进展。在NSCLC中ALK易位与腺癌组织学、印戒细胞形态学、年轻患者及非吸烟史相关。对于ALK抑制剂克唑替尼(Xalkori,crizotinib)的大型I期研究证实在包含ALK易位的癌症患者中整体反应率为57%,疾病控制率为90%,由此获得了FDA的批准。更有效的ALK抑制剂和靶向获得性耐药的策略目前还正在研发当中。尽管ALK阳性的NSCLC在肺癌的比例很低,但在我国每年新发病例数仍然接近35000例。因此,准确鉴定出ALK阳性的NSCLC,并给予相应的治疗是需要的。
EGFR(Epidermal Rrowth Factor Receptor)是一种广泛分布于人体各种组织细胞膜上的具有酪氨酸激酶活性的跨膜糖蛋白。活化EGFR突变位于酪氨酸激酶域,可导致组成性的EGFR信号。EGFR突变激活的PI3K-AKT和RAS-MEK-ERK信号对癌细胞的生长、生存和迁移起至关重要的作用。最常见的激活突变是19号外显子的框内缺失(in-frame deletion)突变和858密码子的一个错义突变(导致精氨酸被亮氨酸取代,L858R)。带有EGFR突变的肺癌对EGFR酪氨酸激酶抑制剂(TKIs)高度敏感。当前,EGFR突变的基因型筛查常被用于筛选患有IV期NSCLC、一线治疗方案为接受EGFR TKIs治疗的患者。目前的研究重点集中在延长反应持续时间,找到有效的途径靶向在疾病进程中形成的耐药机制。最常见的耐药机制就是EGFR/T790M突变,存在约50%的耐药肿瘤中。此外还有一些其他的例如MET扩增,PIK3CA突变以及向SCLC转化也曾得到描述。
通过开发靶向癌症特异基因突变的药物,近年来非小细胞肺癌(NSCLC)的诊断和治疗发生了重大的变革。对肺癌活检组织的体细胞突变常规基因测试正成为提供最佳患者医疗护理的标准。确定特异的突变例如EGFR和ALK为使用FDA批准的靶向治疗提供指导,有可能使临床获益。发现其他的基因突变也可以引导患者和医生朝新靶向药物的临床试验做出努力。
目前,以EGFR为靶点的酪氨酸激酶抑制剂(TKI)(例如易瑞沙(Gefitinib,吉非替尼)和特罗凯(Erlotinib,埃罗替尼))等药物已在非小细胞肺癌的临床治疗中获得巨大成功。然而,接受TKI抑制剂治疗的患者往往由于形成TKI耐药性而面临复发的困境。第二代EGFR不可逆抑制剂如卡奈替尼(Canertinib)、阿法替尼(Afatinib)、来那替尼(Neratinib)、培利替尼(Pelitinib)等已进入临床试验,但这些分子对EGFR突变体的选择性差,导致药物的临床耐受剂量较低。结果,在最大耐受剂量下,药物无法在体内达到有效浓度,因而对多数耐药病人无效。
另外,据研究,在使用吉非替尼或埃罗替尼治疗EGFR-TKI敏感型的非小细胞肺癌时,患者往往在6~12个月后出现继发性耐药,其中约50%包含由外显子20编码的T790M突变。研究认为,T790M突变 阻碍EGFR与EGFR小分子抑制剂(如吉非替尼和埃罗替尼)的结合或者增加EGFR与ATP的亲和力,因而导致耐药(Yun CH et al.,Proc Natl Acad Sci U S A.2008Feb 12;105(6):2070-5)。
美国制药巨头辉瑞(Pfizer)近日宣布,欧盟委员会(EC)已批准口服靶向抗癌药克唑替尼扩大使用的产品标签更新,用于一线治疗间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌成人患者。克唑替尼是一种靶向间变淋巴瘤激酶(ALK)、ROS1和MET的小分子酪氨酸激酶抑制剂(TKI),于2011年获FDA批准用于ALK阳性局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗。克唑替尼是全球上市的首个ALK抑制剂,目前已获80多个国家批准。在临床上,克唑替尼被公认为ALK阳性晚期NSCLC的标准护理疗法。该药的上市,极大地改变了ALK阳性晚期NSCLC患者的临床护理。迄今为止,在全球范围内,已有超过2万例患者接受了克唑替尼治疗。
本申请所描述的化合物是突变型的EGFR和ALK的双重抑制剂,其可以通过单独使用或者与其它治疗剂联合使用的方式用于治疗非小细胞肺癌。目前,还未见关于使用本申请化合物用于治疗携带EGFR T790M突变和/或EGFR L858R突变和/或EGFR delE746_A750突变的耐药性非小细胞肺癌以及用于一线治疗间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌相关报道。
技术实现要素:
一种式(I)的化合物或其药学可接受的盐、溶剂化物、酯、酸、代谢物或前体药物:
其中:
R1选自H、-X-C3-6环烷基、或-X-C1-6 亚烷基-杂芳基,其中X选自-O-、-NH-、或-N(C1-6烷基)-,n=1、2或3;
R2选自卤素、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、硝基、氨基、氰基、或羟基;
R3选自H、C1-6烷氧基、C1-6卤代烷氧基、或C1-6硫代烷氧基;
R4选自-NH-(CO)-C1-6烷基、或-NH-(CO)-C2-6烯基(例如);
R5选自杂芳基(例如)、-O-杂芳基(例如)、-O-C1-6亚烷基-C1-6烷基氨基(例如)、或-O-C1-6亚烷基-杂环基(例如),其中Y选自CH或N,m=1或2;
R6选自H、-(SO2)-C1-6烷基、或-(SO2)-C1-6烷基氨基(例如);
R7各自独立地选自H、卤素、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、硝基、氨基、氰基、羟基、或-NH-氨基保护基;
R8选自H、C1-6烷基、卤素、C1-6卤代烷基、C1-6烷氧基、硝基、氨基、氰基、或羟基;
R9选自H、C1-6烷基、C1-6卤代烷基(例如氟代乙基)、氨基保护基、C1-6烷氧基C1-6烷基(例如甲氧基乙基)、C3-8环烷基(例如环己基)、C1-6烷基氨基(例如二甲基氨基)、C4-8环烷基烷基(例如环丙基甲基)、芳基C1-6烷基(例如苄基)、杂原子任选被C1-6烷基取代的杂环基(例如1-甲基哌嗪-4-基)、或C1-6烷基磺酰基(例如甲磺酰基);
氨基保护基各自独立地选自新戊酰基(Piv)、叔丁氧羰基(Boc)、 苄氧羰基(Cbz)、9-芴甲氧羰基(FMOC)、苄基(Bn)和对甲氧苯基(PMP)。
本发明所涉及带有手性的化合物,其构型可以是任意构型或者混合的外消旋体。
本发明还涉及包括以上化合物的药物组合物,以及该化合物预防或治疗由酪氨酸激酶活性调节的或者受其影响的或者其中涉及酪氨酸激酶活性的疾病、障碍或病症的方法和用途。
附图说明
图1a-1e示出化合物1在A549、H1975、H3255、PC-9及H3122细胞株中对细胞信号通路的影响;
图2a-2f示出化合物1在A549、H1975、PC-9、H3255及H3122细胞株中对细胞周期的影响;
图3a-3e示出化合物1在A549、H1975、H3255、H3122及PC-9细胞株中对细胞凋亡的影响;
图4a-4d示出化合物1在非小细胞肺癌细胞PC-9中对肿瘤的影响;
图5a-5d示出化合物1在非小细胞肺癌细胞H1975中对肿瘤的影响。
具体实施方式
术语
除非另外定义,所有本文使用的科技术语都具有与要求保护的主题所属领域的技术人员一般理解相同的含义。
除非另有说明,本发明采用本领域技术范围内的质谱、NMR、HPLC、蛋白质化学、生物化学、重组DNA技术和药理学等常规方法。除非提供具体的定义,否则与本文描述的分析化学、合成有机化学、以及医学和药物化学等化学上相关的命名和实验室操作和技术,是本领域技术人员已知的。一般而言,前述技术和步骤可以通过本领域众所周知的和在各种一般文献和更具体文献中描述的常规方法来实施,这些文献在本说明书中被引用和讨论。
“烷基”是指脂肪族烃基团,可以是支链或直链的烷基。根据结构, 烷基可以是单价基团或双价基团(即亚烷基)。在本发明中,烷基优选是具有1-8个碳原子的“低级烷基”。典型的烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基等。
“烷氧基”是指-O-烷基,其中烷基如本文中定义。典型的烷氧基包括但不限于甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基等。
术语“氨基”是指基团-NH2。
术语“烷基氨基”是指进一步被一个或两个烷基取代的氨基取代基,具体是指基团-NRR’,其中R和R’各自独立地选自氢或低级烷基,条件是-NRR’不是-NH2。本文的术语“芳烷基氨基”是指其中R是低级芳烷基且R’是氢、低级烷基、芳基或低级芳烷基的基团-NRR’。术语“氨基烷基”是指进一步被一个或多个氨基取代的烷基取代基。术语“羟烷基”或“羟基烷基”是指进一步被一个或多个羟基取代的烷基取代基。术语“氰基烷基”是指进一步被一个或多个氰基取代的烷基取代基。术语“烷基羰基”是指进一步被一个烷基取代的羰基。术语“烷基羰基烷基”是指进一步被一个烷基羰基取代的烷基。术语“烷氧基羰基”是指进一步被一个烷氧基取代的羰基。烷基氨基、氨基烷基、羟基烷基、氰基烷基、烷基羰基、烷基羰基烷基、以及烷氧基羰基中的烷基或芳基部分可以任选地被一个或多个取代基取代。
术语“芳香基”是指平面环具有离域的π电子系统并且含有4n+2个π电子,其中n是整数。芳香基环可以由五、六、七、八、九或多于九个原子构成。芳香基可以是任选取代的。术语“芳香基”包括碳环芳基(例如苯基)和杂环芳基(或“杂芳基”或“杂芳香基”)基团(例如吡啶)。该术语包括单环或稠环多环(即共用相邻的碳原子对的环)基团。
本文使用的术语“芳基”是指芳香基环中每一个构成环的原子都是碳原子。芳基环可以由五、六、七、八、九或多于九个原子构成。芳基可以是任选取代的。芳基的实例包括但不限于苯基、萘基、菲基、蒽基、芴基和茚基。根据结构,芳基可以是单价基团或双价基团(即亚芳基)。
本文使用的术语“杂烷基”是指本文定义的的烷基中的一个或多个骨架链原子是杂原子,例如氧、氮、硫、硅、磷或它们的组合。所述杂原子(一个或多个)可以位于杂烷基内部的任意位置或在杂烷基与分 子的其余部分相连的位置。
术语“杂芳基”是指芳基中包括一个或多个选自氮、氧和硫的环杂原子。含N“杂芳基”部分是指芳香基中环上至少有一个骨架原子是氮原子。根据结构,杂芳基可以是单价基团或双价基团(即亚杂芳基)。杂芳基的实例包括但不限于吡啶基、咪唑基、嘧啶基、吡唑基、三唑基、吡嗪基、四唑基、呋喃基、噻吩基、异噁唑基、噻唑基、噁唑基、异噻唑基、吡咯基、喹啉基、异喹啉基、吲哚基、苯并咪唑基、苯并呋喃基、吲唑基、吲嗪基、酞嗪基、哒嗪基、异吲哚基、蝶啶基、嘌呤基、噁二唑基、噻二唑基、呋喃基、苯并呋喃基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、萘啶基和呋喃并吡啶基等。
本文使用的术语“杂环烷基”是指非芳香基环中一个或多个构成环的原子是选自氮、氧和硫的杂原子。杂环烷基环可以由三、四、五、六、七、八、九或多于九个原子构成。杂环烷基环可以是任选取代的。杂环烷基的实例包括但不限于内酰胺、内酯、环亚胶、环硫代亚胺、环氨基甲酸酯、四氢噻喃、4H-吡喃、四氢吡喃、哌啶、1,3-二噁英、1,3-二噁烷、1,4-二噁英、1,4-二噁烷、哌嗪、1,3-氧硫杂环己烷、1,4-氧硫杂环己二烯、1,4-氧硫杂环己烷、四氢-1,4-噻嗪、2H-1,2-噁嗪、马来酰亚胺、琥珀酰亚胺、巴比妥酸、硫代巴比妥酸、二氧代哌嗪、乙内酰脲、二氢尿嘧啶、吗啉、三噁烷、六氢-1,3,5-三嗪、四氢噻吩、四氢呋喃、吡咯啉、吡咯烷、咪唑烷,吡咯烷酮、吡唑啉、吡唑烷、咪唑啉、咪唑烷、1,3-二氧杂环戊烯、1,3-二氧杂环戊烷、1,3-二硫杂环戊烯、1,3-二硫杂环戊烷、异噁唑啉、异噁唑烷、噁唑啉、噁唑烷、噁唑烷酮、噻唑啉、噻唑烷和1,3-氧硫杂环戊烷。根据结构,杂环烷基可以是单价基团或双价基团(即亚杂环烷基)。
术语“烷基(杂芳基)”是指本文定义的烷基被本文定义的杂芳基取代。
术语“烷基(杂环烷基)”是指本文定义的烷基被本文定义的杂环烷基取代。
术语“卤”或“卤素”是指氟、氯、溴和碘。
术语“卤代烷基”、“卤代烷氧基”和“卤代杂烷基”包括烷基、烷氧基或杂烷基的结构,其中至少一个氢被卤原子置换。在某些实施方式中, 如果两个或更多氢原子被卤原子置换,所述卤原子彼此相同或不同。
本文使用的术语“氰基”是指式-CN基团。
术语“酯基”是指具有式-COOR的化学部分,其中R选自烷基、环烷基、芳基、杂芳基(通过环碳连接)和杂脂环基(通过环碳连接)。
术语“任选取代的”或“取代的”是指所提及的基团可以被一个或多个额外的基团取代,所述额外的基团各自并且独立地选自烷基、环烷基、芳基、杂芳基、羟基、烷氧基、氰基、卤素、酰胺基、硝基、卤代烷基、氨基等。
本文使用的术语激酶的“抑制”、“抑制的”或“抑制剂”,是指磷酸转移酶活性被抑制。
本文公开的化合物的“代谢物”是当该化合物被代谢时形成的化合物的衍生物。术语“活性代谢物”是指当该化合物被代谢时形成的化合物的生物活性衍生物。本文使用的术语“被代谢”,是指特定物质被生物体改变的过程总和(包括但不限于水解反应和由酶催化的反应,例如氧化反应)。因此,酶可以引起特定的结构转变。例如,细胞色素P450催化各种氧化和还原反应,同时二磷酸葡萄糖甘酸基转移酶催化活化的葡萄糖醛酸分子至芳香醇、脂肪族醇、羧酸、胺和游离的巯基的转化。新陈代谢的进一步的信息可以从《The Pharmacological Basis of Therapeutics》,第九版,McGraw-Hill(1996)获得。本文公开的化合物的代谢物可以通过将化合物给予宿主并分析来自该宿主的组织样品、或通过将化合物与肝细胞在体外孵育并且分析所得化合物来鉴别。这两种方法都是本领域已知的。在一些实施方式中,化合物的代谢物是通过氧化过程形成并与相应的含羟基化合物对应。在一些实施方式中,化合物被代谢为药物活性代谢物。本文使用的术语“调节”,是指直接或间接与靶标相互作用,以改变靶标的活性,仅仅举例来说,包括增强靶标的活性、抑制靶标的活性、限制靶标的活性或者延长靶标的活性。
本文使用的术语“靶蛋白”是指能被选择性结合化合物所结合的蛋白质分子或部分蛋白质。在某些实施方式中,靶蛋白是酪氨酸激酶EGFR(野生型或各种突变或其组合)、ALK(野生型或各种突变或其组合)、KIT(野生型或各种突变或其组合)、ABL(野生型或各种突变 或其组合)、FLT3(野生型或各种突变或其组合)、BLK(野生型或各种突变或其组合)、VEGFR(野生型或各种突变或其组合)、RET(野生型或各种突变或其组合)、PDGFR(野生型或各种突变或其组合)、MEK(野生型或各种突变或其组合)、BCR/ABL(野生型或各种突变或其组合)、JAK(野生型或各种突变或其组合)、BRAF(野生型或各种突变或其组合)。
本文使用的GI50是指细胞50%生长抑制所需的药物浓度,即药物使50%癌细胞的生长得到抑制或控制,此时的药物浓度。
本文使用的IC50是指在测量这样的效应的分析中获得最大效应的50%抑制的特定测试化合物的量、浓度或剂量。
本文使用的EC50是指测定化合物的剂量、浓度或量,其引起特定测定化合物诱导、刺激或加强的特定反应的50%的最大表达的剂量依赖反应。
本发明新型的激酶抑制剂
本发明提供一种新型激酶抑制剂,包括式(I)的化合物或其药学可接受的盐、溶剂化物、酯、酸、代谢物或前药:
其中:
R1选自H、-X-C3-6环烷基、或-X-C1-6亚烷基-杂芳基,其中X选自-O-、-NH-、或-N(C1-6烷基)-,n=1、2或3;
R2选自卤素、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、硝基、氨基、氰基、或羟基;
R3选自H、C1-6烷氧基、C1-6卤代烷氧基、或C1-6硫代烷氧基;
R4选自-NH-(CO)-C1-6烷基、或-NH-(CO)-C2-6烯基(例如);
R5选自杂芳基(例如)、-O-杂芳基(例如)、-O-C1-6亚烷基-C1-6烷基氨基(例如)、或-O-C1-6亚烷基-杂环基(例如),其中Y选自CH或N,m=1或2;
R6选自-(SO2)-C1-6烷基、或-(SO2)-C1-6烷基氨基(例如);
R7各自独立地选自H、卤素、C1-6烷基、C1-6卤代烷基、C1-6烷氧基、硝基、氨基、氰基、羟基、或-NH-氨基保护基;
R8选自H、H、C1-6烷基、卤素、C1-6卤代烷基、C1-6烷氧基、硝基、氨基、氰基、或羟基;
R9选自H、C1-6烷基、C1-6卤代烷基(例如氟代乙基)、氨基保护基、C1-6烷氧基C1-6烷基(例如甲氧基乙基)、C3-8环烷基(例如环己基)、C1-6烷基氨基(例如二甲基氨基)、C4-8环烷基烷基(例如环丙基甲基)、芳基C1-6烷基(例如苄基)、杂原子任选被C1-6烷基取代的杂环基(例如1-甲基哌嗪-4-基)、或C1-6烷基磺酰基(例如甲磺酰基);
氨基保护基各自独立地选自新戊酰基(Piv)、叔丁氧羰基(Boc)、苄氧羰基(Cbz)、9-芴甲氧羰基(FMOC)、苄基(Bn)和对甲氧苯基(PMP)。
本文描述的是新型的激酶抑制剂。本文也描述了此化合物的药学可接受的盐、溶剂化物、酯、酸、药物活性代谢物和前药。
在另外的或进一步的实施方式中,将本文描述的化合物给予有需要的生物体后在其体内代谢产生代谢物,所产生的代谢物然后用于产 生期望的效果,包括期望的治疗效果。
本文描述的化合物可以被制成和/或被用作药学可接受的盐。药学可接受的盐的类型包括但不限于:(1)酸加成盐、通过将化合物的游离碱形式与药学可接受的无机酸反应形成,所述无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸、偏磷酸等;或与有机酸反应形成,所述有机酸如乙酸、丙酸、己酸、环戊烷丙酸、羟基乙酸、丙酮酸、乳酸、丙二酸、苹果酸、柠檬酸、琥珀酸、马来酸、酒石酸、反丁烯二酸、三氟乙酸、苯甲酸、3-(4-羟基苯甲酰基)苯甲酸、肉桂酸、扁桃酸、甲烷磺酸、乙烷磺酸、1,2-乙二磺酸、2-羟基乙磺酸、苯磺酸、甲苯磺酸、4-甲基双环-[2.2.2]辛-2-烯-1-甲酸、2-萘磺酸、叔丁基乙酸、葡庚糖酸、4,4'-亚甲基双-(3-羟基-2-烯-1-甲酸)、3-苯基丙酸、三甲基乙酸、十二烷基硫酸、葡糖酸、谷氨酸、水杨酸、羟基萘酸、硬脂酸、粘康酸等;(2)碱加成盐,其在母体化合物中的酸性质子被金属离子置换时形成,例如碱金属离子(例如锂、钠、钾)、碱土金属离子(例如镁或钙)或铝离子;或与有机碱配位。可接受的有机碱包括乙醇胺、二乙醇胺、三乙醇胺、三甲胺、N-甲基葡萄糖胺,等等。可接受的无机碱包括氢氧化铝、氢氧化钙、氢氧化钾、碳酸钠、氢氧化钠等。
药学可接受的盐的相应的平衡离子可以使用各种方法分析和鉴定,所述方法包括但不限于离子交换色谱、离子色谱、毛细管电泳、电感耦合等离子体、原子吸收光谱、质谱或它们的任何组合。
使用以下技术的至少一种回收所述盐:过滤、用非溶剂沉淀接着过滤、溶剂蒸发,或水溶液的情况下使用冻干法。
筛选和表征药学可接受的盐、多晶型和/或溶剂化物可以使用多种技术完成,所述技术包括但不限于热分析、X射线衍射、光谱、显微镜方法、元素分析。使用的各种光谱技术包括但不限于Raman、FTIR、UVIS和NMR(液体和固体状态)。各种显微镜技术包括但不限于IR显微镜检术和拉曼(Raman)显微镜检术。
本发明的药物组合物
本申请还提供药物组合物,其包含至少一种式(I)的化合物或所述化合物的药学可接受的盐、溶剂化物、酯、酸、药物活性代谢物或前药,以及药学可接受的载体或赋形剂,以及者任选的其它治疗剂。
在治疗过程中,可以根据情况单独或与一种或多种其它的治疗剂组合使用。可以通过注射、口服、吸入、直肠和经皮施用中的至少一种将包含本发明化合物的药物施用给患者。
在本发明的实施方式中,在根据本发明对患者进行治疗时,给定药物的量取决于诸多因素,如具体的给药方案、疾病或病症类型及其严重性、需要治疗的受治疗者或宿主的独特性(例如体重),但是,根据特定的周围情况,包括例如已采用的具体药物、给药途径、治疗的病症、以及治疗的受治疗者或宿主,施用剂量可由本领域已知的方法常规决定。通常,就成人治疗使用的剂量而言,施用剂量典型地在0.02-5000mg/天,例如约1-1500mg/天的范围。该所需剂量可以方便地被表现为一剂、或同时给药的(或在短时间内)或在适当的间隔的分剂量,例如每天二、三、四剂或更多分剂。本领域技术人员可以理解的是,尽管给出了上述剂量范围,但具体的有效量可根据患者的情况并结合医师诊断而适当调节。
本发明的药物的用途
式(I)的化合物或其其药学可接受的盐、溶剂化物、酯、酸、代谢物或前药、或药物组合物可以用于抑制酪氨酸激酶EGFR(野生型或各种突变或其组合)、ALK(野生型或各种突变或其组合)、KIT(野生型或各种突变或其组合)、ABL(野生型或各种突变或其组合)、FLT3(野生型或各种突变或其组合)、BLK(野生型或各种突变或其组合)、VEGFR(野生型或各种突变或其组合)、RET(野生型或各种突变或其组合)、PDGFR(野生型或各种突变或其组合)、MEK(野生型或各种突变或其组合)、BCR/ABL(野生型或各种突变或其组合)、JAK(野生型或各种突变或其组合)、BRAF(野生型或各种突变或其组合)活性。式(I)所述化合物或其药学可接受的盐、溶剂化物、酯、酸、代谢物或前药可用于治疗或者制备可用于治疗一种或多种选自下组的疾病:非小细胞肺癌、小细胞肺癌、肺腺癌、肺鳞癌、胰腺癌、前列腺癌、膀胱癌、肝癌、皮肤癌、神经胶质瘤、乳腺癌、黑色素瘤、恶性胶质瘤、横纹肌肉瘤、卵巢癌、星形细胞瘤、尤因氏肉瘤、成视网膜细胞瘤、上皮细胞癌、结肠癌、肾癌、胃肠间质瘤、白血病、组织细胞性淋巴癌、和鼻咽癌。
更优选地,本申请所描述的式(I)化合物或其其药学可接受的盐、溶剂化物、酯、酸、代谢物或前药、或药物组合物是突变型的EGFR和ALK的双重抑制剂,其可以通过单独使用或者与其它治疗剂联合使用的方式用于治疗非小细胞肺癌。特别地,本申请的化合物可用于治疗携带EGFR T790M突变和/或EGFR L858R突变和/或EGFR delE746_A750突变的耐药性非小细胞肺癌,以及用于一线治疗间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌。
化合物的制备
使用本领域技术人员已知的标准合成技术或使用本领域已知的方法与本文描述的方法组合,可以合成式(I)的化合物。另外,本文给出的溶剂、温度和其它反应条件可以根据本领域技术而改变。作为进一步的指导,也可以利用以下的合成方法。
所述反应可以按顺序使用,以提供本文描述的化合物;或它们可以用于合成片段,所述片段通过本文描述的方法和/或本领域已知的方法随后加入。
在某些实施方式中,本文提供的是本文描述的酪氨酸激酶抑制剂化合物的制备方法及其使用方法。在某些实施方式中,本文描述的化合物可以使用以下合成的方案合成。可以使用与下述类似的方法,通过使用适当的可选择的起始原料,合成化合物。
用于合成本文描述的化合物的起始原料可以被合成或可以从商业来源获得。本文描述的化合物和其它相关具有不同取代基的化合物可以使用本领域技术人员已知的技术和原料合成。制备本文公开的化合物的一般方法可以来自本领域已知的反应,并且该反应可以通过由本领域技术人员所认为适当的试剂和条件修改,以引入本文提供的分子中的各种部分。
如果需要,反应产物可以使用常规技术分离和纯化,包括但不限于过滤、蒸馏、结晶、色谱等方法。这些产物可以使用常规方法表征,包括物理常数和图谱数据。
制备式(I)的化合物的合成方案的非限制性实施例参见方案I。
方案I
使用本文描述的合成方法,以及本领域已知的那些方法,以好的 收率和纯度获得本文公开的酪氨酸激酶抑制剂。按照本文公开的方法制备的化合物通过本领域已知的常规方法纯化,例如过滤、重结晶、色谱、蒸馏及其组合。
在式(I)的化合物的芳香环部分上的位点,可以易于发生各种代谢反应,因此适当的取代基被引入至芳香环结构上,例如,仅仅举例说明,卤素能还原、减小或消除这种代谢途径。
实施例
以下具体的非限制性实施例将被解释为仅仅是说明性的,并不以任何方式限制本公开。虽然无需进一步详细描述,但是可以相信本领域技术人员能基于本文的描述,完全利用本公开。
本发明化合物中间体的合成
步骤1:2,5-二氯-N-(2-(异丙基磺酰基)苯基)嘧啶-4-胺中间体1-1的制备
称取2-(异丙基磺酰基)苯胺(9.96g,50mmol)溶于N,N-二甲基甲酰胺(DMF,100mL)中,在冰浴条件下慢慢加入氢化钠(NaH,2.4g,100mmol),搅拌0.5小时。在冰浴条件下慢慢滴加溶于20mL DMF的2,4,5-三氯嘧啶(11.0g,60mmol)的溶液,滴加完毕后室温下过夜反应,然后水洗,乙酸乙酯萃取,干燥浓缩后经柱层析分离得到白色固体1-1(6.9g,40%)。MS(ESI):m/z 346.0(M+H)+。1H NMR(400MHz,CDCl3)δ10.07(s,1H),8.63(d,J=8.0Hz,1H),8.30(s,1H),7.92(d,J=7.4Hz,1H),7.73(t,J=7.4Hz,1H),7.33(t,J=7.0Hz,1H),3.22(heptet,J=6.0Hz,1H),1.32(d,J=6.0Hz,6H).13C NMR(100MHz,CDCl3)δ157.8,156.3,155.6,137.3,135.2,131.4,124.5,124.2,122.7,115.2,56.1,15.3.
步骤2:5-氯-N2-(4-氟-2-甲氧基-5-硝基苯基)-N4-(2-(异丙基磺酰基)苯基)嘧啶-2,4-二胺中间体1-2的制备
将中间体1-1(138mg,0.4mmol)、4-氟-2-甲氧基-5-硝基苯胺(74.4mg,0.3mmol)、对甲基苯磺酸(PTSA,68.8mg,0.3mmol)溶于4mL仲丁醇中,115℃条件下反应5小时。将所得产物浓缩后柱层析提纯得到固体1-2(100.9mg,51%)。MS(ESI):m/z 496.1(M+H)+。1H NMR(400MHz,CDCl3)δ9.80(s,1H),8.46-8.44(m,1H),8.41(s,1H),8.30(br,1H),7.85(d,J=7.0Hz,1H),7.62-7.35(m,3H),7.14(s,1H),3.95(s,3H),3.46(heptet,J=6.0Hz,1H),1.32(d,J=6.0Hz,6H).
步骤3:5-氯-N2-(4-(4-乙基-1-哌嗪基)-2-甲氧基-5-硝基苯基)-N4-(2-(异丙基磺酰基)苯基)嘧啶-2,4-二胺中间体1-3的制备
将中间体1-2(99mg,0.2mmol)、N-乙基哌嗪(45.6mg,0.4mmol)、碳酸钾(55.2mg,0.4mmol)溶于2ml DMF中,100℃条件下反应2小时,水洗,乙酸乙酯萃取干燥,柱层析得到目标固体1-3(94.2mg,80%)。MS(ESI):m/z 590.2(M+H)+。
步骤4:N2-(5-氨基-4-(4-乙基-1-哌嗪基)-2-甲氧基苯基)-5-氯-N4-(2-(异丙基磺酰基)苯基)嘧啶-2,4-二胺中间体1-4的制备
将中间体1-3(94.2mg,0.16mmol)、还原铁粉(Fe,89.6mg,1.6mmol)、氯化铵(53.4mg,0.96mmol)溶于6ml乙醇和2ml水中,100℃条件下反应1小时,浓缩后柱层析得到固体1-4(37.6mg,0.067mmol)。MS(ESI):m/z 560.3(M+H)+。
实施例1:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-乙基-1-哌嗪基)-4-甲氧基苯基)丙烯酰胺化合物1的制备
将中间体1-4(37.6mg,0.067mmol)、N,N-二异丙基乙胺(DIPEA,17.5mg,0.13mmol)溶于1mL DMF中,冰浴下滴加丙烯酰氯(9mg,0.1mmol),室温下反应半小时。水洗,萃取,提纯得到化合物1(30mg,0.049mmol)。MS(ESI):m/z 614.2(M+H)+。1H NMR(400MHz,DMSO-d6)δ9.54(s,1H),9.02(s,1H),8.51(br,2H),8.23(s,1H),8.16(br,1H),7.78(d,J=7.6Hz,1H),7.56-7.54(m,1H),7.26(t,J=7.6Hz,1H),6.86(s,1H),6.65-6.63(m,1H),6.16(d,J=14.6Hz,1H),5.72(d,J=10.0Hz,1H),3.79(s,3H),3.46(heptet,J=6.0Hz,1H),3.34(s,2H),3.18-2.60(m,8H),1.24-1.17(m,9H)。
实施例2:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物2的制备
采用制备化合物1相类似的方法,用N-甲基哌嗪替代N-乙基哌嗪可得化合物2(23.5mg)。MS(ESI):m/z 600.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.53(s,1H),8.97(s,1H),8.53-8.47(m,2H),8.23(s,1H),8.11(s,1H),7.77(d,J=7.6Hz,1H),7.56-7.54(m,1H),7.26(t,J=7.6Hz,1H),6.86(s,1H),6.63-6.58(m,1H),6.16(d,J=14.6Hz,1H),5.72(d,J=10.0Hz,1H),3.79(s,3H),3.46(heptet,J=6.0Hz,1H),2.90(s,3H),3.18-2.60(m,8H),1.24-1.17(d,J=6.0Hz,6H)。
实施例3:4-(2-丙烯酰胺基-4-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-5-甲氧苯基)哌嗪-1-碳酸叔丁酯化合物3的制备
采用制备化合物1相类似的方法,用N-Boc哌嗪替代N-乙基哌嗪可得化合物3(35.2mg)。MS(ESI):m/z 686.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.52(s,1H),9.03(s,1H),8.50(br,2H),8.22(s,1H),8.19(s,1H),7.76(d,J=7.6Hz,1H),7.54-7.52(m,1H),7.25(t,J=7.6Hz,1H),6.89(s,1H),6.64(dd,J=16.6Hz,J=10.0Hz,1H),6.15(d,J= 16.6Hz,1H),5.70(d,J=10.0Hz,1H),3.77(s,3H),3.54(br,4H),3.42(heptet,J=6.0Hz,1H),2.81(br,4H),1.43(s,9H),1.16(d,J=6.0Hz,6H)。
实施例4:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(1-哌嗪基)苯基)丙烯酰胺化合物4的制备
将化合物3溶于2mL二氯甲烷,然后加入0.5mL三氟乙酸,室温下搅拌过夜得到化合物4(19.8mg).MS(ESI):m/z 586.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.51(s,1H),9.07(s,1H),8.53-8.50(m,2H),8.21(s,1H),8.11(s,1H),7.76(d,J=7.6Hz,1H),7.52-7.50(m,1H),7.26-7.23(m,1H),6.80(s,1H),6.73-6.66(m,1H),6.15(d,J=16.2Hz,1H),5.71(d,J=10.0Hz,1H),3.78(s,3H),3.42(heptet,J=6.0Hz,1H),3.35(br,4H),3.05(br,4H),1.15(d,J=6.0Hz,6H)。
实施例5:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-(甲基磺酰基)-1-哌嗪基)苯基)丙烯酰胺化合物5的制备
采用制备化合物1相类似的方法,用N-甲磺酰基哌嗪替代N-乙基哌嗪可得化合物5(28.3mg)。MS(ESI):m/z 664.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.52(s,1H),9.02(s,1H),8.50(br,2H),8.22(s,1H),8.19(s,1H),7.77(d,J=8.0Hz,1H),7.54-7.52(m,1H),7.25(t,J=7.6Hz,1H),6.92(s,1H),6.65(dd,J=16.8Hz,J=10.0Hz,1H),6.15(d,J=16.8Hz,1H),5.72(d,J=10.0Hz,1H),3.77(s,3H),3.46(heptet,J=6.0Hz,1H),3.36(br,4H),2.96(br,4H),1.16(d,J=6.0Hz,6H)。
实施例6:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(1-哌啶基)苯基)丙烯酰胺化合物6的制备
采用制备化合物1相类似的方法,用哌啶替代N-乙基哌嗪可得化 合物6(25.4mg)。MS(ESI):m/z 585.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.52(s,1H),8.95(s,1H),8.53(br,1H),8.48(s,1H),8.21(s,1H),8.12(s,1H),7.77(d,J=7.6Hz,1H),7.55-7.51(m,1H),7.25(t,J=7.6Hz,1H),6.83(s,1H),6.61(dd,J=16.6Hz,J=9.8Hz,1H),6.14(d,J=16.6Hz,1H),5.69(d,J=9.8Hz,1H),3.76(s,3H),3.42(heptet,J=6.0Hz,1H),2.80(br,4H),1.72(br,4H),1.55(br,2H),1.16(d,J=6.0Hz,6H)。
实施例7:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-吗啉苯基)丙烯酰胺化合物7的制备
采用制备化合物1相类似的方法,用吗啉替代N-乙基哌嗪可得化合物7(24.1mg)。MS(ESI):m/z 587.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.53(s,1H),9.08(s,1H),8.53-8.50(m,2H),8.23(s,1H),8.15(s,1H),7.77(d,J=8.0Hz,1H),7.55-7.53(m,1H),7.26(t,J=7.6Hz,1H),6.89(s,1H),6.64(dd,J=16.8Hz,J=10.2Hz,1H),6.16(d,J=16.8Hz,1H),5.71(d,J=10.2Hz,1H),3.81(s,4H),3.80(s,3H),3.42(heptet,J=6.0Hz,1H),2.88(br,4H),1.17(d,J=6.0Hz,6H)。
实施例8:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物8的制备
采用制备化合物1相类似的方法,用1-甲基-4-(4-哌啶基)哌嗪替代N-乙基哌嗪可得化合物8(30.5mg)。MS(ESI):m/z 683.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.52(s,1H),8.96(s,1H),8.51(br,1H),8.48(s,1H),8.21(s,1H),8.12(s,1H),7.76(d,J=8.0Hz,1H),7.53-7.51(m,1H),7.25(t,J=7.6Hz,1H),6.83(s,1H),6.65(dd,J=17.0Hz,J=9.8Hz,1H),6.15(d,J=17.0Hz,1H),5.70(d,J=9.8Hz,1H),3.76(s,3H),3.42(heptet,J=6.0Hz,1H),3.07-1.74(m,20H),1.16(d,J=6.0Hz,6H)。
实施例9:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-(2-氟乙基)-1-哌嗪基)-4-甲氧基苯基)丙烯酰胺化合物9的制备
采用制备化合物1相类似的方法,用1-(2-氟乙基)-哌嗪替代N-乙基哌嗪可得化合物9(21.3mg)。MS(ESI):m/z 632.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.53(s,1H),8.99(s,1H),8.54-8.47(m,2H),8.23(s,1H),8.12(s,1H),7.77(d,J=7.6Hz,1H),7.57-7.53(m,1H),7.26(t,J=7.6Hz,1H),6.89(s,1H),6.61(dd,J=17.4Hz,J=9.8Hz,1H),6.15(d,J=17.4Hz,1H),5.71(d,J=10.0Hz,1H),4.66-4.50(m,2H),3.79(s,3H),3.44(heptet,J=6.0Hz,1H),2.90(br,4H),2.76-2.69(m,6H),1.17(d,J=6.0Hz,6H)。
实施例10:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1,4-高哌嗪基)苯基)丙烯酰胺化合物10的制备
采用制备化合物1相类似的方法,用N-甲基高哌嗪替代N-乙基哌嗪可得化合物10(21.3mg)。MS(ESI):m/z 614.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.64(s,1H),9.53(s,1H),8.50(s,1H),8.38(s,1H),8.23(s,1H),8.05(s,1H),7.79-7.77(s,1H),7.64(s,1H),7.27(s,1H),7.10-7.04(m,1H),6.90(s,1H),6.18-6.14(m,1H),5.70-5.67(m,1H),3.80(s,3H),3.50-1.98(m,14H),1.17(d,J=6.0Hz,6H)。
实施例11:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-异丙基-1-哌嗪基)-4-甲氧基苯基)丙烯酰胺化合物11的制备
采用制备化合物1相类似的方法,用N-异丙基哌嗪替代N-乙基哌嗪可得化合物11(25.6mg)。MS(ESI):m/z 628.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.54(s,1H),9.30(s,1H),8.55-8.51(m,2H),8.23(s,2H),7.78-7.27(m,3H),6.94-6.87(m,1H),6.80(s,1H),6.63-6.58(m,1H),6.16(d,J=16.0Hz,1H),5.70(d,J=10.0Hz,1H),3.79(s,3 H),3.43-2.74(m,10H),1.36-1.17(m,12H)。
实施例12:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-(二甲氨基)-1哌嗪基)-4-甲氧基苯基)丙烯酰胺化合物12的制备
采用制备化合物1相类似的方法,用4-(二甲氨基)哌啶替代N-乙基哌嗪可得化合物12(28.4mg)。MS(ESI):m/z 628.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.53(s,1H),9.01(s,1H),8.54-8.48(m,2H),8.23(s,1H),8.16(s,1H),7.78(d,J=7.6Hz,1H),7.56-7.53(m,1H),7.26(t,J=7.6Hz,1H),6.85(s,1H),6.66(dd,J=16.4Hz,J=10.0Hz,1H),6.17(d,J=16.4Hz,1H),5.73(d,J=10.0Hz,1H),3.78(s,3H),3.43(heptet,J=6.0Hz,1H),3.14-1.88(m,15H),1.17(d,J=6.0Hz,6H)。
实施例13:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-(2-甲氧乙基)-1-哌嗪基)苯基)丙烯酰胺化合物13的制备
采用制备化合物1相类似的方法,用1-(2-甲氧基乙基)哌嗪替代N-乙基哌嗪可得化合物13(29.1mg)。MS(ESI):m/z 644.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.54(s,1H),8.98(s,1H),8.52-8.47(m,2H),8.23(s,1H),8.11(s,1H),7.77(d,J=7.6Hz,1H),7.56-7.54(m,1H),7.29-7.25(m,1H),6.88(s,1H),6.60(dd,J=16.0Hz,J=9.6Hz,1H),6.15(d,J=16.0Hz,1H),5.71(d,J=9.6Hz,1H),3.78(s,3H),3.49-2.57(m,13H),1.24-1.17(d,J=6.0Hz,6H)。
实施例14:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-(环丙甲基)-1-哌嗪基)-4-甲氧基苯基)丙烯酰胺化合物14的制备
采用制备化合物1相类似的方法,用1-环丙甲基哌嗪替代N-乙基哌嗪可得化合物14(25.4mg)。MS(ESI):m/z 640.3(M+H)+.1H NMR (400MHz,DMSO-d6)δ9.54(s,1H),8.99(s,1H),8.53-8.47(m,2H),8.23(s,1H),8.12(s,1H),7.77(d,J=7.6Hz,1H),7.56-7.54(m,1H),7.26(t,J=7.6Hz,1H),6.87(s,1H),6.59(dd,J=16.6Hz,J=9.6Hz,1H),6.15(d,J=16.6Hz,1H),5.71(d,J=9.6Hz,1H),3.79(s,3H),3.44-2.27(m,11H),1.17(d,J=6.0Hz,6H),0.88-0.13(m,5H)。
实施例15:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-环己基-1-哌嗪基)-4-甲氧基苯基)丙烯酰胺化合物15的制备
采用制备化合物1相类似的方法,用1-环己基哌嗪替代N-乙基哌嗪可得化合物15(28.7mg)。MS(ESI):m/z 668.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.53(s,1H),9.02(s,1H),8.50(br,2H),8.23(s,1H),8.14(s,1H),7.77(d,J=7.6Hz,1H),7.56-7.54(m,1H),7.26(t,J=7.6Hz,1H),6.85(s,1H),6.66-6.60(m,1H),6.15(d,J=16.0Hz,1H),5.71(d,J=9.6Hz,1H),3.79(s,3H),3.44-1.17(m,26H)。
实施例16:N-(2-(4-苄基-1-哌嗪基)-5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基苯基)丙烯酰胺化合物16的制备
采用制备化合物1相类似的方法,用1-苄基哌嗪替代N-乙基哌嗪可得化合物16(31.2mg)。MS(ESI):m/z 676.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.53(s,1H),9.00(s,1H),8.53-8.47(m,2H),8.23(s,1H),8.12(s,1H),7.77(d,J=7.6Hz,1H),7.56-7.54(m,1H),7.36-7.26(m,6H),6.89(s,1H),6.60(dd,J=16.8Hz,J=9.6Hz,1H),6.15(d,J=16.6Hz,1H),5.71(d,J=9.6Hz,1H),3.78(s,3H),3.57(s,2H),3.43(heptet,J=6.0Hz,1H),2.89(br,4H),2.61(br,4H),1.17(d,J=6.0Hz,6H)。
实施例17:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(吡啶-4-氧基)苯基)丙烯酰胺化合物17的制备
采用制备化合物1相类似的方法,用4-羟基吡啶替代N-乙基哌嗪可得化合物17(19.2mg)。MS(ESI):m/z 595.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.71(s,1H),9.56(s,1H),8.53(br,1H),8.48(s,1H),8.34(s,1H),8.00(s,1H),7.82(d,J=4.6Hz,1H),7.67(t,J=7.2Hz,1H),7.57(t,J=7.4Hz,2H),7.32(t,J=7.0Hz,1H),7.22(s,1H),6.34-6.14(m,4H),5.71(d,J=9.6Hz,1H),3.91(s,3H),3.43(heptet,J=6.0Hz,1H),1.17(d,J=6.0Hz,6H)。
实施例18:N-(5-(5-氯-4-(3-(三氟甲基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物18的制备
采用制备化合物1相类似的方法,用3-三氟甲基苯胺替代2-(异丙基磺酰基)苯胺可得化合物18(21.3mg)。MS(ESI):m/z 562.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.00(s,2H),8.21-8.13(m,4H),7.90(s,1H),7.37-7.23(m,2H),6.80(s,1H),7.67-6.61(m,1H),6.15(d,J=17.0Hz,1H),5.71(d,J=10.0Hz,1H),3.77(s,3H),3.25-2.72(m,8H)。
实施例19:N-(5-(5-氯-4-(甲基(3-(三氟甲基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物19的制备
采用制备化合物18相类似的方法,其中将第一步所得的中间体化合物甲基化后再进行后面的反应,可得化合物19(22.6mg)。MS(ESI):m/z 575.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.00(s,1H),8.60(s,1H),8.10(s,2H),7.60-7.49(m,4H),6.86(s,1H),7.65-6.58(m,1H),6.20(d,J=17.5Hz,1H),5.71(d,J=10.0Hz,1H),3.88(s,3H),3.71(s,3H),2.93-2.51(m,8H)。
实施例20:N-(5-(5-氯-4-(2-(三氟甲基)苯氧基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物20的制备
采用制备化合物2相类似的方法,用2-三氟甲基苯酚替代2-(异丙基磺酰基)苯胺可得化合物20(21.3mg)。MS(ESI):m/z 562.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ8.92(s,1H),8.53(s,1H),8.42(s,1H),7.86-7.45(m,5H),7.71-6.65(m,1H),6.24(d,J=17.5Hz,1H),5.76(d,J=9.2Hz,1H),3.73(s,3H),3.74-2.50(m,11H)。
实施例21:N-(5-(5-氯-4-(3-氯-4-氟苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物21的制备
采用制备化合物2相类似的方法,用3-氯-4-氟苯胺替代2-(异丙基磺酰基)苯胺可得化合物21(25.1mg)。MS(ESI):m/z 546.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.02(s,1H),8.86(s,1H),8.23-7.19(m,7H),6.83-6.71(m,2H),6.17(d,J=16.8Hz,1H),5.71(d,J=10.0Hz,1H),3.81(s,3H),3.33-2.81(m,11H)。
实施例22:N-(5-(5-氯-4-(2,6-二氟苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物22的制备
采用制备化合物2相类似的方法,用2,6-二氟苯胺替代2-(异丙基磺酰基)苯胺可得化合物22(27.5mg)。MS(ESI):m/z 530.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ8.86(s,1H),8.78(s,1H),8.10(s,1H),7.90(s,1H),7.67(s,1H),7.32-7.08(m,3H),6.71(s,1H),6.62(dd,J=16.8Hz,J=10.2Hz,1H),6.22(d,J=16.8Hz,1H),5.75(d,J=10.2Hz,1H),3.77(s,3H),2.94-2.30(m,11H)。
实施例23:N-(5-(5-氯-4-(2-特戊酰胺苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物23的制备
采用制备化合物2相类似的方法,用2-氨基苯基特戊酰胺替代2-(异丙基磺酰基)苯胺可得化合物23(29.0mg)。MS(ESI):m/z 593.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.36(s,1H),8.97(s,1H),8.24(s,1H),8.11-8.09(m,2H),7.98(s,1H),5.74(d,J=7.4Hz,1H),7.24-7.12(m,3H),6.79(s,1H),6.64(dd,J=16.0Hz,J=10.0Hz,1H),6.16(d,J=16.0Hz,1H),5.74(d,J=10.0Hz,1H),3.78(s,3H),2.89-2.36(m,11H),1.21(s,9H)。
实施例24:N-(5-(4-(2-(异丙基磺酰基)苯氨基)-5-甲基-嘧啶-2-氨基)-4-甲氧基-2-(4-(4-甲基-1-哌嗪基)-1-哌啶基)苯基)丙烯酰胺化合物24的制备
采用制备化合物1类似的方法,其中第一步反应中用2,4-二氯-5-甲基嘧啶替代2,4,5-三氯嘧啶,第三步中用1-甲基-4-(4-哌啶基)哌嗪替代N-乙基哌嗪可得化合物24(28.1mg)。MS(ESI):m/z 663.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.02(s,1H),8.95(s,1H),8.61(d,J=8.0Hz,1H),8.31(s,1H),7.98(s,1H),7.88(s,1H),7.74(d,J=7.8Hz,1H),7.53(t,J=7.8Hz,1H),7.20-7.16(m,1H),6.80(s,1H),6.64(dd,J=17.0Hz,J=10.6Hz,1H),6.13(d,J=17.0Hz,1H),5.69(d,J=10.6Hz,1H),3.78(s,3H),3.42(heptet,J=6.0Hz,1H),3.07-1.74(m,23H),1.16(d,J=6.0Hz,6H)。
实施例25:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)-嘧啶-2-氨基)-2-(4-(4-甲基-1-哌嗪基)-1-哌啶基)苯基)丙烯酰胺化合物25的制备
采用制备化合物1类似的方法,其中第二步反应中用4-氟-3-硝基苯胺替代4-氟-2-甲氧基-5-硝基苯胺,第三步中用1-甲基-4-(4-哌啶基) 哌嗪替代N-乙基哌嗪得化合物25(33.5mg)。MS(ESI):m/z 653.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ10.04(s,1H),9.57(s,1H),8.54(d,J=8.2Hz,1H),8.32(br,1H),8.20(s,1H),7.81(d,J=8.0Hz,1H,),7.54-7.51(m,1H),7.7.35-7.28(m,2H),7.10(d,J=8.4Hz,1H),6.42(dd,J=16.2Hz,J=9.0Hz,1H),6.18(d,J=16.2Hz,1H),5.71(d,J=9.0Hz,1H),3.42(heptet,J=6.0Hz,1H),3.01-1.50(m,20H),1.16(d,J=6.0Hz,6H)。
实施例26:N-(5-(4-(2-(异丙基磺酰基)苯氨基)-5-甲基-嘧啶-2-氨基)-2-(4-(4-甲基-1-哌嗪基)-1-哌啶基)苯基)丙烯酰胺化合物26的制备
采用制备化合物1类似的方法,其中第一步反应中用2,4-二氯-5-甲基嘧啶替代2,4,5-三氯嘧啶,第二步反应中用4-氟-3-硝基苯胺替代4-氟-2-甲氧基-5-硝基苯胺,第三步中用1-甲基-4-(4-哌啶基)哌嗪替代N-乙基哌嗪)可得化合物26(34.6mg)。MS(ESI):m/z 633.4(M+H)+.1H NMR(400MHz,DMSO-d6)δ10.05(s,1H),9.09(s,1H),8.68(d,J=8.6Hz,1H),8.36(s,1H),8.08(s,1H),7.98(s,1H),7.80(d,J=7.8Hz,1H),7.59-7.56(m,1H),7.34-7.07(m,3H),6.45(dd,J=17.0Hz,J=10.0Hz,1H),6.18(d,J=17.0Hz,1H),5.69(d,J=10.0Hz,1H),3.42(heptet,J=6.0Hz,1H),3.07-1.74(m,23H),1.18(d,J=6.0Hz,6H)。
实施例27:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)-嘧啶-2-氨基)-2-(2-(二甲氨基)乙氧基)-4-甲氧苯基)丙烯酰胺化合物27的制备
采用制备化合物1相类似的方法,用2-(二甲氨基)乙醇替代N-乙基哌嗪)可得化合物27(28.9mg)。MS(ESI):m/z 589.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.96(s,1H),9.53(s,1H),8.53(s,1H),8.20-8.18(m,2H),7.77-7.10(m,5H),6.87(s,1H),6.14(d,J=17.0Hz,1H),5.65(d,J=10.6Hz,1H),4.43(br,2H),3.81(s,3H),3.60(br,2H),3.43(heptet,J=6.0Hz,1H),2.84(s,6H),1.17(d,J=6.0Hz,6H)。
实施例28:(R)-N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)-嘧啶-2-氨基)-4-甲氧基-2(3-甲基-1-哌嗪基)苯基)丙烯酰胺化合物28的制备
采用制备化合物4类似的方法,用(R)-2-甲基N-Boc哌嗪替代N-Boc哌嗪得到化合物28(15.3mg)。MS(ESI):m/z 600.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.51(s,1H),9.06(s,1H),8.54-8.50(m,2H),8.24-8.21(m,1H),7.80-5.68(m,7H),3.80(s,3H),3.42-1.16(m,19H)。
实施例29:(S)-N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)-嘧啶-2-氨基)-4-甲氧基-2(3-甲基-1-哌嗪基)苯基)丙烯酰胺化合物29的制备
采用制备化合物4类似的方法,用(S)-2-甲基N-Boc哌嗪替代N-Boc哌嗪得到化合物29(12.0mg)。MS(ESI):m/z 600.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.54(s,1H),9.08(s,1H),8.60-8.52(m,2H),8.23(s,1H),7.80-6.83(m,4H),6.68(dd,J=17.0Hz,J=9.2Hz,1H),6.17(d,J=17.0Hz,1H),5.73(d,J=9.2Hz,1H),3.80(s,3H),3.54-1.17(m,19H)。
实施例30:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙酰胺化合物30的制备
采用制备化合物8类似的方法,用丙酰氯替代丙烯酰氯可得化合物30(29.4mg)。MS(ESI):m/z 685.4(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.55(s,1H),8.69(s,1H),8.53(br,1H),8.50(s,1H),8.22(s,1H),8.05(s,1H),7.80-7.27(m,3H),6.82(s,1H),3.76(s,3H),3.45-1.01(m,32H)。
实施例31:N-(5-(4-(2-(异丙基磺酰基)苯氨基)-5-甲基-嘧啶-2-氨基)-4-甲氧基-2-(4-(4-甲基-1-哌嗪基)-1-哌啶基)苯基)丙酰胺化合物31的制备
采用制备化合物24类似的方法,用丙酰氯替代丙烯酰氯可得化合物31(29.0mg)。MS(ESI):m/z 665.3(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.03(s,1H),8.65(s,1H),8.62(s,1H),8.23(s,1H),7.98(s,1H),7.87(s,1H),7.76-7.19(m,3H),6.78(s,1H),3.76(s,3H),3.44-1.01(m,35H)。
实施例32:N-(5-(5-氯-4-(2-(异丙基磺酰胺基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基-1-哌嗪基)苯基)丙烯酰胺化合物32的制备
采用制备化合物2类似的方法,用2-(N,N二甲基磺酰基)苯胺替换原料2-(异丙基磺酰基)苯胺可得化合物32(35.2mg)。MS(ESI):m/z 601.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ9.38(s,1H),8.96(s,1H),8.50-8.44(m,2H),8.20(s,1H),8.12(s,1H),7.75-6.57(m,5H),6.15(d,J=16.6Hz,1H),5.71(d,J=9.6Hz,1H),3.79(s,3H),2.89(br,4H),2.66(s,6H),2.61(br,4H),2.31(s,3H)。
实施例33:N-(5-(5-氯-4-(2-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(1H-咪唑-1-基)-4-甲氧基苯基)丙烯酰胺化合物33的制备
采用制备化合物1类似的方法,用咪唑替代N-乙基哌嗪可得化合物33(3.8mg)。MS(ESI):m/z 568.1(M+H)+.
实施例34:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(1-甲基哌嗪-2-基)甲氧)苯基)丙烯酰胺化合物34的制备
采用制备化合物1类似的方法,用N-甲基-2哌啶甲醇替代N-乙基 哌嗪可得化合物34(4.5mg)。MS(ESI):m/z 629.2(M+H)+.
实施例35:N-(5-(5-氯-4-(噻吩-2-甲氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基哌嗪-1-基)苯基)丙烯酰胺化合物35的制备
采用制备化合物2类似的方法,第一步用噻吩-2-甲胺替代2-(异丙基磺酰基)苯胺在乙醇溶剂中,添加2当量的N,N-二异丙基乙胺得到中间体,然后类似方法可得化合物35(30.2mg)。MS(ESI):m/z 514.2(M+H)+.1H NMR(400MHz,DMSO-d6)δ8.97(s,1H),8.73(s,1H),7.94(s,1H),7.80(s,1H),7.64(s,1H),7.29(s,1H),6.89-6.83(m,3H),6.58(dd,J=17.0Hz,J=10.4Hz,1H),6.19(d,J=17.0Hz,1H),5.70(d,J=10.4Hz,1H),4.80(s,2H),3.85(s,3H),2.87-2.32(m,11H)。
实施例36:N-(5-(5-氯-4-(环丙胺基)嘧啶-2-氨基)-4-甲氧基-2-(4-甲基哌嗪-1-基)苯基)丙烯酰胺化合物36的制备
采用制备化合物35类似的方法,用环丙胺替代噻吩-2-甲胺可得化合物36(5.3mg)。MS(ESI):m/z 458.2(M+H)+.
实施例37:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-2-(4-乙基-1-哌嗪基)-4-异丙氧基苯基)丙烯酰化合物37的制备
采用制备化合物1类似的方法,用4-N-乙基哌啶基-2-异丙氧基-5-硝基苯胺代替4-氟-2-甲氧基-5-硝基苯胺。MS(ESI):m/z 642.26(M+H)+.
实施例38:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(4-丙基-1-哌嗪基)苯基)丙烯酰胺化合物38的制备
采用制备化合物1类似的方法。MS(ESI):m/z 629.2(M+H)+。
实施例39:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-乙氧基-2-(4-丙基-1-哌嗪基)苯基)丙烯酰胺化合物39的制备
采用制备化合物1类似的方法。MS(ESI):m/z 629.2(M+H)+。
实施例40:N-(5-(5-氯-4-((2-(异丙基磺酰基)苯基)氨基)嘧啶-2-氨基)-2-(4-异丁基-1-哌嗪基)-4-甲氧苯基)丙烯酰胺化合物40的制备
采用制备化合物1类似的方法。MS(ESI):m/z 643.2(M+H)+。
实施例41:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-三氟甲氧基-2-(4-乙基-1-哌啶基)苯基)丙烯酰胺化合物41的制备
采用制备化合物1类似的方法。MS(ESI):m/z 669.1(M+H)+。
实施例42:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-甲氧基-2-(1-乙基哌啶-4-基)苯基)丙烯酰胺化合物42的制备
采用制备化合物1类似的方法。MS(ESI):m/z 614.2(M+H)+。
实施例43:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-异丙氧基-2-(1-乙基哌啶-4-基)苯基)丙烯酰胺化合物43的制备
采用制备化合物1类似的方法。MS(ESI):m/z 640.2599(M+H)+。
实施例44:N-(5-(5-氯-4-(2-(异丙基磺酰基)苯氨基)嘧啶-2-氨基)-4-异丙氧基-2-(1-甲基哌啶-4-基)苯基)丙烯酰胺化合物44的制备
采用制备化合物1类似的方法。MS(ESI):m/z 626.2442(M+H)+。
实施例45:N-2-(1-乙基哌啶-4-基)-4-异丙氧基-5-((4((2-(异丙基磺酰基)苯基)氨基)-5-甲基嘧啶-2-基)氨基)苯基)丙烯酰胺化合物45的制备
采用制备化合物1类似的方法。MS(ESI):m/z 620.3145(M+H)+。
实施例46:N-4-异丙氧基-5-((4-((2-(异丙基磺酰基)苯基)胺基)-5-甲基嘧啶-2-基)氨基)-2-(1-甲基哌啶-4-基)苯基)丙烯酰胺化合物46的制备
采用制备化合物1类似的方法。MS(ESI):m/z606.2988(M+H)+。
实施例47:新型激酶抑制剂对癌细胞生长的影响
通过测试新型激酶抑制剂对癌细胞的增殖的影响,进一步评估了本发明化合物抑制癌细胞增殖的选择性。实施例中选用了人非小细胞肺癌细胞NCI-H1975(表达EGFR L858R/T790M双突变型基因)、人皮肤鳞癌细胞A431(表达野生型EGFR基因)、非小细胞肺癌NCI-H3255(表达EGFR L858R突变型基因)、非小细胞肺癌细胞NCI-H3122(表达ALK基因)、人非小细胞肺癌细胞A549(表达野生 型EGFR基因)、人非小细胞肺癌细胞NCI-H2122(表达野生型EGFR基因)、人非小细胞肺癌细胞NCI-H460(表达野生型EGFR基因)、人源非小细胞肺癌细胞PC-9(表达EGFR delE746_A750突变型基因)、中国仓鼠卵巢细胞CHO(Cricetulus griseus,hamster,Chinese,ovary)、中国仓鼠肺细胞CHL、人B细胞慢性淋巴细胞白血病细胞株MEG-01(表达BCR-ABL基因)、人白血病细胞K562(表达BCR-ABL基因)、中国仓鼠肺细胞CHL细胞、人源非小细胞肺癌细胞HCC827(表达突变型EGFR del19基因)、人肺腺癌细胞HCC4006(表达突变型EGFR del19基因)、人源非小细胞肺癌细胞NCI-H2228(表达野生型ALK基因)、人慢性髓性白血病Ku812(表达BCR-ABL基因)、小鼠原B细胞BaF3,上述细胞均购自ATCC(美国)。此外,本实施例还选用了小鼠BaF3-TEL-ALK(稳定表达ALK激酶)、小鼠BaF3-ALK-F1174L(稳定表达突变型ALKF1174L激酶)、小鼠BaF3-NPM-ALK(稳定表达ALK激酶)、小鼠BaF3-TPR-MET(稳定表达MET激酶)、小鼠BaF3-FLT3-ITD(稳定表达FLT3/ITD突变的激酶)、小鼠BaF3-TEL-C-kit(稳定表达cKIT激酶)、小鼠BaF3-TEL-ABL(稳定表达ABL激酶)、小鼠BaF3/P210(稳定表达bcr/abl~(P210)突变型激酶)、小鼠BaF3-TEL-ABL-T315I(稳定表达ABLT315I突变型激酶)、小鼠BaF3-P210-ABL-T315I(稳定表达bcr/abl~(P210)及ABLT315I突变型激酶)、小鼠BaF3-TEL-EGFR(稳定表达EGFR激酶)、小鼠BaF3-TEL-EGFR-T790M(稳定表达EGFRT790M突变型激酶)、小鼠BaF3-TEL-EGFR-T790M-C797S(稳定表达EGFRT790M/C797S突变型激酶)、小鼠BaF3-FL-EGFR-Del19(稳定表达EGFR delE746_A750突变型激酶)、小鼠BaF3-EGFR-DEl19-T790M-C797S(稳定表达EGFRT790M/C797S/delE746_A750突变型激酶)、小鼠BaF3-TEL-EGFR-L858R(稳定表达EGFRL858R突变型激酶)、小鼠BaF3-FL-EGFR-T790M-L858R(稳定表达EGFRT790M/L858R突变型激酶)、小鼠BaF3-FL-EGFR-T790M-L858R-C797S(稳定表达EGFRT790M/L858R/C797S突变型激酶)、小鼠BaF3-TEL-Jak2(稳定表达JAK2激酶)。上述细胞株均由本实验室构建,构建方法为:PCR分别扩增人类ALK、ALK F1174L、MET、FLT3/ITD、cKIT、ABL、 bcr/abl~(P210)、ABL T315I、bcr/abl~(P210)/ABL T315I、EGFR、EGFR T790M、EGFR T790M/C797S、EGFR delE746_A750、EGFR T790M/C797S/delE746_A750、EGFR L858、EGFR T790M/L858R、EGFR T790M/L858R/C797S、JAK2激酶区序列,并分别插入到带有N端TEL片段和/或者NPM片段和/或者TPR片段的MSCV-Puro载体(Clontech),通过逆转录病毒方法,稳定转入小鼠BaF3细胞,并且撤除IL-3生长因子,最终得到依赖ALK、ALK F1174L、MET、FLT3/ITD、cKIT、ABL、bcr/abl~(P210)、ABL T315I、bcr/abl~(P210)/ABL T315I、EGFR、EGFR T790M、EGFR T790M/C797S、EGFR delE746_A750、EGFR T790M/C797S/delE746_A750、EGFR L858、EGFR T790M/L858R、EGFR T790M/L858R/C797S、JAK2转入蛋白的细胞系。
在实施例中将不同浓度(0.000508μM、0.00152μM、0.00457μM、0.0137μM、0.0411μM、0.123μM、0.370μM、1.11μM、3.33μM、10μM)的本发明化合物以及TAE-684、WZ4002和克唑替尼(后三种化合物购自上海皓元)分别加入到上述细胞中,并孵育72小时,用Cell (Promega,美国)化学自发光法细胞活力检测试剂盒,用酶标仪读数来进行定量测定来检测活细胞数目。其中,TAE-684和克唑替尼是现有的ALK抑制剂药物,WZ4002是已报道的抑制EGFR/T790M突变的药物。测试结果如表1所示。
表1.新型激酶抑制剂对癌细胞生长的影响(结果表示为GI50值,单位为μM)
续表1.新型激酶抑制剂对癌细胞生长的影响(结果表示为GI50值,单位为μM)
续表1.新型激酶抑制剂对癌细胞生长的影响(结果表示为GI50值,单位为μM)
续表1.新型激酶抑制剂对癌细胞生长的影响(结果表示为GI50值,单位为μM)
续表1.新型激酶抑制剂对癌细胞生长的影响(结果表示为GI50值,单位为μM)
续表1.新型激酶抑制剂对癌细胞生长的影响(结果表示为GI50值,单位为μM)
实施例48:新型激酶抑制剂对细胞信号通路的影响
在非小细胞肺癌A549(表达野生型EGFR基因)细胞株、非小细胞肺癌H1975(表达EGFRL858R/T790M双重突变基因)细胞株、非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株及非小细胞肺癌H3255(表达EGFRL858R突变基因)细胞株四株细胞(均购自ATCC)上,通过测定许多细胞生物化学终点和功能性终点,评估了化合物1对细胞中EGFR及与其信号通路相关的其他蛋白激酶,如Stat3、AKT、ErK、eIF4E、4EBP1、P70S6K等的影响。用不同浓度0μM、0.03μM、0.1μM、0.3μM、1μM、3μM的化合物1(于DMSO中)、1μM的WZ4002(于DMSO中)以及空白对照(DMSO)分别处理这些细胞株4小时后,收集样品。测定化合物1对这些细胞株中的Stat3Y705、AKT T308、AKT S473、Erk T202/204、EGFR Y1068、P70S6K Thr389、eIF4E Ser209、Erk T202/204、4EBP1(Thr37/46)磷酸化的影响(图1)。
在非小细胞肺癌细胞H3122(表达ALK基因)细胞株上,通过测定许多细胞生物化学终点和功能性终点,评估了化合物1对细胞中与ALK密切相关的其他蛋白激酶,如Stat3、Ras、MEK1/2、ErK、mTOR、PI3K、JAK3、AKT等的影响。用不同浓度0μM、0.03μM、0.1μM、0.3μM、1μM、3μM的化合物1(于DMSO中),1μM的TAE-684(于DMSO中)以及空白对照(DMSO)处理肺癌细胞H3122(表达ALK 基因)细胞株4小时后,收集样品。测定化合物1对这个细胞株中的Stat3Y705、Ras、MEK1/2S217/221、Erk T202/204、mTOR、PI3K、JAK3Tyr980/981、AKT T308、AKT S473磷酸化的影响(图1)。
实验结果如图1所示:在非小细胞肺癌细胞A549(表达野生型EGFR基因)中,化合物1不仅对EGFR蛋白磷酸化几乎没有影响,而且对相关信号通路的STAT3、S6K、AKT、ERK、eIF4E蛋白磷酸化也几乎没有影响,对照WZ4002在浓度为1μM表现相同。在非小细胞肺癌H1975(表达EGFRL858R/T790M双重突变基因)细胞株中,化合物1在浓度为0.03μM就能够完全抑制EGFR蛋白的磷酸化,也能够影响EGFR下游AKT、ERK蛋白的磷酸化,这与已报导的抑制EGFR/T790M突变的药物WZ4002表现相同。在非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株以及非小细胞肺癌细胞H3255(表达EGFRL858R突变基因)细胞株中,化合物1在浓度分别为0.1μM、0.3μM就能够明显抑制EGFR蛋白的磷酸化,也能够影响EGFR下游AKT、ERK蛋白的磷酸化,这与已报导的抑制EGFR/T790M突变的药物WZ4002表现相同。在非小细胞肺癌细胞H3122(表达ALK基因)细胞株上,与ALK密切相关的其他蛋白激酶,如Stat3、Ras、MEK1/2、ErK、JAK3、AKT等都有一定的影响,这与已知药物ALK抑制剂TAE684表现相同。
实施例49:新型激酶抑制剂对细胞周期的影响
为了研究用药后细胞被阻止在哪个生长周期,在非小细胞肺癌A549(表达野生型EGFR基因)细胞株、非小细胞肺癌H1975(表达EGFRL858R/T790M双重突变基因)细胞株、非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株、非小细胞肺癌H3255(表达EGFRL858R突变基因)细胞株及非小细胞肺癌细胞NCI-H3122(表达ALK基因)五株细胞,测试了化合物1对这些细胞株的细胞周期分布的影响。用不同浓度的0μM、0.03μM、0.1μM、0.3μM、1μM(于DMSO中)的化合物1,1μM(于DMSO中)的EGFR/T790M激酶抑制剂WZ4002,1μM(于DMSO中)的ALK激酶抑制剂TAE684,1μM(于DMSO中)的ALK/MET/ROS1激酶抑制剂克唑替尼以及空白对 照(DMSO)分别作用于上述细胞株。在非小细胞肺癌A549(表达野生型EGFR基因)细胞株中分别作用24小时、48小时后,在非小细胞肺癌H1975(表达EGFRL858R/T790M双重突变基因)细胞株、非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株、非小细胞肺癌H3255(表达EGFR L858R突变基因)细胞株及非小细胞肺癌细胞NCI-H3122(表达ALK基因)细胞株中作用24小时后,收集细胞,1XPBS缓冲液洗涤两次,75%的乙醇于-20℃固定24小时,1XPBS缓冲液再洗涤两次,加0.5mL 1XPBS缓冲液和0.5mL的PI染色液(购自美国BD Bioscience)到细胞中并将细胞放置于黑暗避光37℃染色15分钟,用流式细胞仪(BD FACS Calibur)检测细胞周期分布。结果参见图2。
实验结果如图2所示:在非小细胞肺癌A549(表达野生型EGFR基因)细胞株中分别作用24小时、48小时后,化合物1对非小细胞肺癌A549(表达野生型EGFR基因)细胞株的细胞周期影响较小。而在携带EGFRL858R/T790M双重突变型基因的非小细胞肺癌H1975细胞株、携带EGFR delE746_A750突变型基因的非小细胞肺癌PC-9细胞株、携带EGFR L858R突变型基因的非小细胞肺癌H3255以及携带ALK基因的非小细胞肺癌NCI-H3122四株细胞中,化合物1不仅能将细胞阻止在G0-G1期,而且能够明显看到死亡的细胞随着药物浓度的增加而增多。
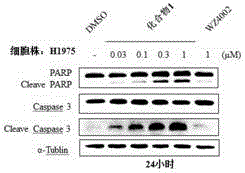
实施例50:新型激酶抑制剂对细胞凋亡的影响
为了证明用药以后细胞的死亡是通过凋亡还是坏死,在非小细胞肺癌细胞A549(表达野生型EGFR基因)、非小细胞肺癌H1975(表达EGFR L858R/T790M双重突变基因)细胞株、非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株及非小细胞肺癌H3255(表达EGFR L858R突变基因)细胞株以及非小细胞肺癌细胞H3122(表达ALK基因)细胞株中,检测了化合物1在细胞中对与细胞凋亡密切相关的DNA修复酶聚腺苷二磷酸-核糖聚合酶PARP、含半胱氨酸的天冬氨酸蛋白水解酶Caspase 3蛋白剪切的影响。用不同浓度0μM、0.03μM、0.1μM、0.3μM、1μM的化合物1(于DMSO中),1μM的WZ4002(于DMSO中),1μM(于DMSO中)的TAE684,1μM(于DMSO中)的克唑替尼以及空白对照(DMSO)处理不同的非小细胞肺癌细 胞,然后在24小时后收集细胞。用Western Blot检测不同浓度的药在不同时间段对DNA修复酶聚腺苷二磷酸-核糖聚合酶PARP和含半胱氨酸的天冬氨酸蛋白水解酶Caspase 3的剪切蛋白的影响。
实验结果如图3所示:在非小细胞肺癌细胞A549(表达野生型EGFR基因)中,作用24小时后,并没有看到有部分DNA修复酶聚腺苷二磷酸-核糖聚合酶PARP或者PARP的下游Caspase 3的剪切。这证明了化合物1在非小细胞肺癌细胞A549(表达野生型EGFR基因)中不能够引起细胞的凋亡。然而在非小细胞肺癌H3255(表达EGFRL858R突变基因)细胞株及非小细胞肺癌H3122(表达ALK基因)细胞株中,在化合物1的用药浓度为0.03μM时就能够看到很明显的DNA修复酶聚腺苷二磷酸-核糖聚合酶PARP的剪切,同时能够看到明显的PARP的下游Caspase 3的剪切。同样的实验中,在非小细胞肺癌H1975(表达EGFR L858R/T790M双重突变基因)细胞株及非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株中,在化合物1的用药浓度为0.3μM时也能够看到很明显的DNA修复酶聚腺苷二磷酸-核糖聚合酶PARP的剪切及PARP的下游Caspase 3的剪切。这证明了化合物1能够引起非小细胞肺癌H1975(表达EGFR L858R/T790M双重突变基因)细胞株、非小细胞肺癌PC-9(表达EGFR delE746_A750突变型基因)细胞株、非小细胞肺癌H3255(表达EGFR L858R突变基因)细胞株及非小细胞肺癌H3122(表达ALK基因)细胞株的凋亡。
实施例51:化合物1在人的非小细胞肺癌细胞PC-9以及人非小细胞肺癌细胞H1975小鼠模型中的实验结果。
从上海斯莱克实验动物有限责任公司购买24只4-6周龄的Bal b/c雌性小鼠,饲养于SPF级实验室中,饮水及垫料均经高压消毒无菌处理,有关小鼠的所有操作均在无菌条件下进行。第0天分别在所有小鼠左侧背部皮下注入5×106个PC9非小细胞肺癌细胞(购自ATCC)。第15天开始,将所有小鼠分成四组(每组6只小鼠),每天向第一组小鼠口服给药甲基纤维素(HKI)溶剂;向第二组小鼠口服给药剂量为25mg/kg鼠重的化合物1;向第三组小鼠口服给药剂量为50mg/kg鼠重的化合物1;并向第四组小鼠口服给药剂量为100mg/kg鼠重的化合 物1。从给药开始,每天用游标卡尺测量皮下肿瘤的长/宽,并每天记录小鼠体重,观察化合物1对小鼠体重的影响。第36天处死小鼠,取出皮下肿瘤,对肿瘤称重比较,之后用肿瘤样品组织制备出蛋白裂解液样品待用。统计16-36天内皮下肿瘤生长趋势,其中肿瘤体积计算方法:长×宽×宽/2mm3。
实验结果如图所示,结果表明:本发明公开的抑制剂化合物1,高剂量组(100mg/kg)会影响Bal b/c小鼠体重,但低剂量组(25mg/kg)明显就已经明显降低了皮下肿瘤的重量而且对小鼠的体重几乎没有影响;抑瘤率可以达到89.8%。说明化合物1能有效抑制皮下肿瘤的生长(图4)。
实验表明,如图4所示,在非小细胞肺癌细胞PC-9(表达EGFR delE746_A750突变型基因)小鼠肿瘤模型上化合物1用药剂量在25mg/kg时,用药四天效果非常显著,八天后肿瘤完全得到抑制,并且体重没有下降,抑瘤率高达89.9%;用药剂量在50mg/kg时,用药四天效果非常显著,八天后肿瘤完全得到抑制,并且体重没有下降,抑瘤率高达91.1%;用药剂量在100mg/kg时,用药第二天效果非常显著,八天后肿瘤完全得到抑制,并且体重没有明显下降,抑瘤率高达98.7%。
类似地,从上海斯莱克实验动物有限责任公司购买27只4-6周龄的Bal b/c雌性小鼠,饲养于SPF级实验室中,饮水及垫料均经高压消毒无菌处理,有关小鼠的所有操作均在无菌条件下进行。第0天分别在所有小鼠左侧背部皮下注入5×106个H1975非小细胞肺癌细胞(购自ATCC)。第15天开始,将所有小鼠分成三组(每组9只小鼠),每天向第一组小鼠口服给药甲基纤维素(HKI)溶剂;向第二组小鼠口服给药剂量为25mg/kg鼠重的化合物1;并向第三组小鼠口服给药剂量为50mg/kg鼠重的化合物1。从给药开始,每天用游标卡尺测量皮下肿瘤的长/宽,并每天记录小鼠体重,观察化合物1对小鼠体重的影响。第36天处死小鼠,取出皮下肿瘤,对肿瘤称重比较,之后用肿瘤样品组织制备出蛋白裂解液样品待用。统计16-36天内皮下肿瘤生长趋势,其中肿瘤体积计算方法:长×宽×宽/2mm3。
实验表明,如图5所示,在非小细胞肺癌细胞H1975(表达EGFRL858R/T790M双重突变基因)小鼠肿瘤模型上化合物1用药剂量 在25mg/kg时,用药第二天效果非常显著,并且体重没有下降,抑瘤率高达70%;用药剂量在50mg/kg时,用药四天效果非常显著,八天后肿瘤完全得到抑制,并且体重没有下降,抑瘤率高达81.7%。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 酪氨酸激酶抑制剂的制造方法与工艺
- 芳香族酰胺类衍生物、其制备方法及其在医药上的应用与制造工艺
- 包含5α‑还原酶抑制剂的药物组合物的制造方法与工艺
- 作为脾酪氨酸激酶抑制剂的二氮杂螺烷酮取代的噁唑衍生物的制造方法与工艺
- 包含热弹性感觉剂和TRPA1受体抑制剂的皮肤接合剃刮助剂的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 5‑溴‑7‑氮杂吲哚啉‑2‑酮类化合物及其制备方法与制造工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种抗癌药物的晶体化合物及其制备方法与制造工艺