激动活性降低的抗死亡受体3(DR3)拮抗性抗体的制作方法
本发明涉及一种激动活性降低的抗死亡受体3(dr3)拮抗性抗体。
背景技术:
死亡受体3(dr3)是肿瘤坏死因子受体超家族(tnfrsf)的成员,并且它已被称为肿瘤坏死因子受体超家族25(tnfrsf25)、淋巴细胞相关的死亡受体(lard)、apo-3、tramp和wsl-1。dr3主要在t细胞和一些其它细胞上表达,所述一些其它细胞包括内皮细胞、上皮细胞、成骨细胞、b细胞、自然杀伤t(nkt)细胞和2型先天性淋巴样细胞(ilc2)(npl1)。dr3活化由在内皮细胞以及淋巴细胞、浆细胞、树突细胞、巨噬细胞和单核细胞中表达的tnf样配体tl1a(tnf超家族15;tnfsf15)介导(npl2)。tl1a配体结合dr3会引发t细胞的增殖、活化,并且增加炎性细胞因子如干扰素-γ(ifn-γ)、白介素(il)-2、il-13、肿瘤坏死因子α(tnf-α)和粒细胞-巨噬细胞集落刺激因子(gm-csf)从t细胞分泌。也已显示dr3在体内调节nkt细胞(npl3)和ilc2细胞因子产生,最显著是il-13产生。因此,转基因介导的tl1a过表达促进小鼠的il-13依赖性肠病变(npl4)。
tl1a和dr3的结合已与若干炎性疾病,如诸如炎性肠病(ibd)、溃疡性结肠炎、克罗恩氏病(crohn’sdisease)、类风湿性关节炎、哮喘和多发性硬化症的炎性疾病相关。
就抗dr3抗体而言,wen等(npl5)公开了对dr3具有激动活性的抗dr3小鼠单克隆抗体f05,novusbiologicals正供应可应用于elisa的抗dr3小鼠单克隆抗体1h2(npl6),yu等(ptl1)和tittle等(ptl2)公开了抑制t细胞增殖的抗tr3抗体。在另一方面,migone等(ptl3、4)公开了小鼠单克隆抗体11h08结合dr3并活化dr3受体,产生了11h08的抗dr3fab片段,以获得可抑制tl1a的通过dr3受体实现的活性的单体抗dr3片段。此外,andersen等(ptl5)公开了拮抗性dr3配体,诸如针对dr3的阻断tl1a与dr3的结合的单价fab片段。
引用列表
专利文献
ptl1:美国专利号7,357,927
ptl2:美国专利号6,994,976
ptl3:wo2011/106707
ptl4:us2012/0014950
ptl5:wo2012/117067
非专利文献
npl1:meylan等,mucosalimmunol.,2013;doi:10.1038/mi.2013.1141-11
npl2:fang等,jexpmed.,2008;205:1037-1048
npl3:migone等,immunity,2002;16:479-492
npl4:meylan等,mucosalimmunol.,2010;4;172-185
npl5:wen等,thejournalofbiologicalchemistry,2003;278:39251-39258
npl6:1h2小鼠单克隆抗体的数据表(datasheetof1h2mousemonoclonalantibody),目录号h00008718-m08
技术实现要素:
技术问题
dr3拮抗作用可降低炎性应答。然而,先前已知的二价抗dr3拮抗性抗体全都被报道具有激动活性,其可促进有害的炎性应答诸如t细胞增殖和t细胞产生细胞因子。因此,所有先前已知的dr3拮抗性抗体都已被提议只以单价fab形式供抗炎使用。
问题的解决方案
因为igg抗体及其抗体片段通常显示出可预测的组成并易于使用标准化方法纯化,所以开发和产生供治疗使用的包含fc区的igg形式或抗体片段是相当简单的,从而提供超过已知单价形式的一定优势。我们已发现了激动活性减小/不显示出显著的激动活性的针对dr3的强力拮抗性igg抗体及其拮抗性抗体片段。
本发明涉及以下(1)至(14)。
(1)一种结合死亡受体3(dr3)并拮抗tl1a诱导的dr3活化的免疫球蛋白g(在下文中描述为igg)抗体或其抗体片段,其中所述抗体针对dr3具有减小的或不具有通过它们的结合实现的激动活性。
(2)以上条目(1)中所述的抗体或其抗体片段,所述抗体或其抗体片段结合dr3的富含半胱氨酸结构域(在下文中描述为crd)中存在的表位。
(3)以上条目(1)中所述的抗体或其抗体片段,所述抗体或其抗体片段结合包含dr3的crd1或crd4中存在的至少一个氨基酸残基的表位。
(4)以上条目(1)中所述的抗体或其抗体片段,所述抗体或其抗体片段是选自以下的一种:igg2抗体、包含igg2的铰链结构域的igg2抗体变体以及在igg2与igg4之间交换结构域的抗体,其中在eu编号位置409处的氨基酸残基是lys。
(5)以上条目(1)中所述的抗体或其抗体片段,所述抗体或其抗体片段中和和/或拮抗通过tl1a配体结合诱导的dr3活性。
(6)以上条目(1)至(5)中的任一个中所述的抗体或其抗体片段,其中所述激动活性是选自以下的至少一种:使nf-κb的p65亚基磷酸化、从表达dr3的细胞释放细胞因子、使表达dr3的细胞增殖、使表达dr3的细胞凋亡。
(7)以上条目(1)至(6)中的任一个中所述的抗体或其抗体片段,所述抗体或其抗体片段是至少一种选自如以下所述的(i)至(iii)的抗体;
(i)与抗dr3单克隆抗体142a2或142s38b竞争性结合dr3的抗体,
(ii)结合由所述抗dr3单克隆抗体142a2或142s38b识别的表位中存在的表位的抗体,和
(iii)结合由所述抗dr3单克隆抗体142a2或142s38b识别的相同表位的抗体。
(8)以上条目(1)中所述的抗体或其抗体片段,所述抗体或其抗体片段包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21、vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:21、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:77、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:78、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:79、vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:79、或vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33。
(9)以上条目(1)中所述的抗体或其抗体片段,所述抗体或其抗体片段包含分别为seqidno:16至18的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22至24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22-24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、81、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、82、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16-18的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、81、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16-18的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、82、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、83、24的vl的cdr1至cdr3的氨基酸序列;或分别为seqidno:28至30的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:34至36的vl的cdr1至cdr3的氨基酸序列。
(10)以上条目(1)中所述的抗体或抗体片段,其中所述抗体片段选自fab、fab’、f(ab’)2、单链fv(scfv)、微型双功能抗体(diabody)、二硫键稳定化fv(dsfv)、包含所述抗体的6个cdr的肽以及fc融合蛋白。
(11)以上条目(10)中所述的抗体或其抗体片段,其中所述fc融合蛋白是选自如下的与fc区融合的fab或scfv;
(i)二价抗体,其中两个fab或scfv与igg类别的fc区融合,
(ii)单价抗体,其中一个fab或scfv与fc区融合,和
(iii)包含h链和fc融合的l链(在下文中描述为fl)的单价抗体。
(12)以上条目(11)中所述的抗体或其抗体片段,其中所述fc区选自igg1、igg2、igg4及其变体。
(13)以上条目(10)中所述的抗体或其抗体片段,所述抗体或其抗体片段包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21、vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:21、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:77、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:78、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:79、vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:79、或vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33。
(14)以上条目(10)中所述的抗体或其抗体片段,所述抗体或其抗体片段包含分别为seqidno:16至18的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22至24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22-24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、81、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、82、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16-18的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、81、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16-18的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、82、24的vl的cdr1至cdr3的氨基酸序列;分别为seqidno:16、17、80的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:22、83、24的vl的cdr1至cdr3的氨基酸序列;或分别为seqidno:28至30的vh的cdr1至cdr3的氨基酸序列和分别为seqidno:34至36的vl的cdr1至cdr3的氨基酸序列。
发明的有利效果
因为本发明的抗体和抗体片段表现出减小的激动活性或不表现出激动活性,所以它们可用于治疗、预防或改善炎性疾病、自体免疫疾病、癌病和与它们的疾病相关的症状。
附图说明
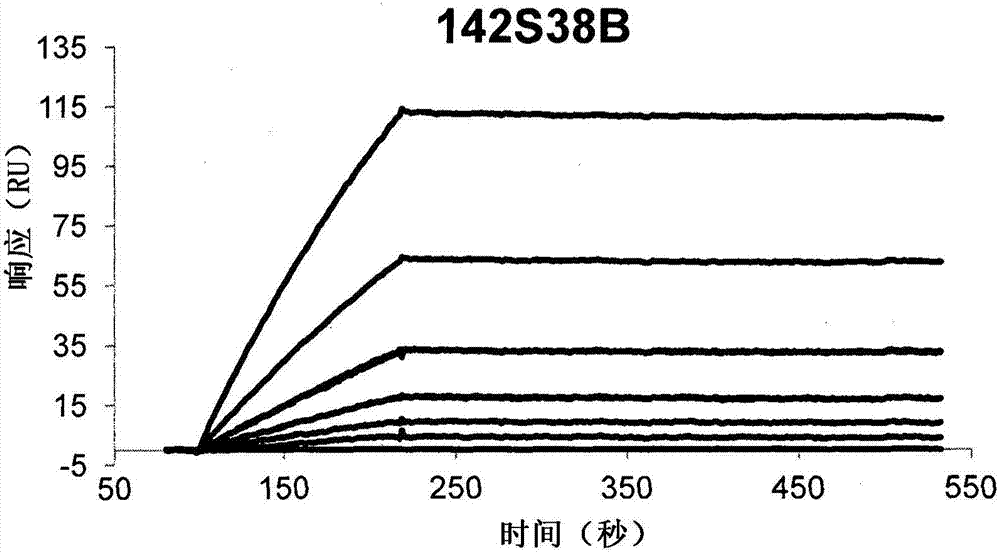
图1a和图1b分别指示抗dr3单克隆抗体142a2和142s38b的典型biacore传感图。传感图的各线分别指示抗dr3抗体fab片段从0.375至12nm的各浓度。纵向轴指示fab结合(共振单位),并且水平轴指示在fab片段注射之后的时间。
图2a和图2b分别指示同种型对抗dr3抗体激动剂和拮抗剂活性的影响的比较。确定指示的142a2igg1、igg2和igg4v形式对pbmcnf-kb活化的影响。纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示添加的抗体。在40nm浓度下添加tl1a,并且在6.67nm浓度下添加各抗体。
图3a和图3b指示抗dr3单克隆抗体142a2和142s38b对p65磷酸化水平的激动作用(图3a)和拮抗作用(图3b)。在图3a中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(μg/ml)。在图3b中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(μg/ml)。在单独tl1a处理之后,55%的细胞是磷酸化p65阳性的。
图4a和图4b指示抗dr3单克隆抗体142a2和142s38b对il-13产生的激动作用(图4a)和拮抗作用(图4b)。在图4a中,纵向轴指示相较于由作为阳性对照的tl1a-flag实现的分泌水平的分泌的il-13浓度(pg/ml),并且水平轴指示抗体浓度(nm)。在图4b中,纵向轴指示在抗体+tl1a-flag(1ug/ml)存在下的分泌的il-13浓度(pg/ml),并且水平轴指示抗体浓度(nm)。在存在或不存在1μg/mltl1a下,il-13产生水平分别是1300pg/ml和750pg/ml。
图5a和图5b指示抗dr3单价抗体mv142a2对p65磷酸化水平的激动作用(图5a)和拮抗作用(图5b)。在图5a中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(nm)。在图5b中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(μg/ml)。在单独tl1a或单独培养基处理之后,69.5%和2.3%的细胞是磷酸化p65阳性的。
图6a和图6b指示抗dr3单价抗体mv142s38b对p65磷酸化水平的激动作用(图6a)和拮抗作用(图6b)。在图6a中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(nm)。在图6b中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(μg/ml)。在单独tl1a或单独培养基处理之后,45%和3%的细胞是磷酸化p65阳性的。
图7a和图7b指示抗dr3抗体igg2、igg4变体、igg4244变体和igg2422变体对p65磷酸化水平的激动作用(图7a)和拮抗作用(图7b)。在图7a中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(nm)。在图7b中,纵向轴指示pbmc中的p65磷酸化阳性细胞(%),并且水平轴指示抗体浓度(μg/ml)。在单独tl1a或单独培养基处理之后,55%和1.8%的细胞是磷酸化p65阳性的。
图8指示抗dr3单克隆抗体fab142a2和142a2-eqr对il-13产生的拮抗作用。纵向轴指示在抗体+tl1a-flag(1μg/ml)存在下的分泌的il-13浓度(pg/ml),并且水平轴指示抗体浓度(nm)。所有样品都用板结合的抗cd3抗体(10μg/ml)和可溶性抗cd28抗体(1μg/ml)共刺激。在存在或不存在1μg/mltl1a下,il-13产生水平分别是1846pg/ml和974pg/ml。
具体实施方式
定义
如本文所用的术语“抗体”包括任何抗体诸如单克隆抗体、寡克隆抗体和多克隆抗体。
如本文所用的术语“单克隆抗体”是指由均一的氨基酸序列构成的抗体,换句话说,一级结构是相同的。此外,单克隆抗体仅识别单一表位(它也被称为抗原决定簇)。
如本文所用的术语“寡克隆抗体”和“多克隆抗体”意指包含超过两种单克隆抗体的多种抗体的抗体组合物。
如本文所用的术语“抗体”也被称为免疫球蛋白(在下文中称为ig),并且人抗体基于其在分子结构方面的差异被分类成iga1、iga2、igd、ige、igg1、igg2、igg3、igg4和igm同种型。在氨基酸序列方面具有相对较高同源性的igg1、igg2、igg3和igg4通常被称为igg。此外,本发明的抗体包括包含与天然抗体的氨基酸序列不同的氨基酸序列的任何抗体变体。本发明的抗体优选是igg抗体和它的变体,更优选是igg2、包含至少一个源于igg2的结构域的igg2变体、包含来自igg2的铰链结构域的igg2变体、包含igg2的铰链结构域的igg4抗体变体和包含igg2的铰链结构域并且在eu编号位置409中存在lys的igg4抗体变体。
如本文所用的术语“天然抗体”是指天然存在于动物中并且具有被定义为同种异型的若干氨基酸序列的抗体。
抗体分子由被称为重链(在下文中称为h链)和轻链(在下文中称为l链)的多肽组成。
此外,h链从它的n末端开始由h链可变区(也被称为vh)和h链恒定区(也被称为ch)的区域构成,并且l链从它的n末端开始由l链可变区(也被称为vl)和l链恒定区(也被称为cl)的区域构成。关于ch,已知各子类的α、δ、ε、γ和μ链。关于cl,已知λ和κ。igg抗体具有两条重链和两条轻链,并且形成两个由vh和vl构成的抗原结合位点。因此,igg抗体是二价抗体。
结构域是指构成抗体分子的各多肽的功能性结构单元。此外,本发明的fc和fc区是指h链恒定区的由铰链结构域、ch2结构域和ch3结构域组成的部分序列和部分结构。
此外,ch从n末端开始由ch1结构域、铰链结构域、ch2结构域和ch3结构域组成。本发明中的ch1结构域、铰链结构域、ch2结构域、ch3结构域和fc区可根据eu索引,通过从n末端开始的氨基酸残基的编号来鉴定[kabat等,免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991)]。通过kabat等人的eu索引来获得氨基酸残基的编号,并且在本发明中,编号前氨基酸残基指示多肽的原始或亲本残基,并且编号后氨基酸残基指示所述多肽的替换或取代氨基酸残基。
具体来说,分别地,ch1通过eu索引的第118至215位氨基酸序列来鉴定,铰链通过eu索引的第216至230位氨基酸序列来鉴定,ch2通过eu索引的第231至340位氨基酸序列来鉴定,并且ch3通过eu索引的第341至447位氨基酸序列来鉴定。
如本文所用的术语“重组抗体”是指通过重组技术产生的重组抗体以及从杂交瘤获得的单克隆抗体。重组抗体包括通过使人抗体恒定区结合于非人抗体可变区而制备的嵌合抗体、通过将非人抗体可变区的h链和l链互补决定区(在下文中缩写成cdr)移植至人抗体可变区的框架区(在下文中缩写成fr)中而制备的人源化抗体(或cdr移植抗体)、以及通过使用人抗体产生性动物制备的人抗体等。
如本文所用的术语“嵌合抗体”是指其中将非人动物抗体的vh和vl的氨基酸序列移植至人抗体的相应vh和vl中的抗体。嵌合抗体可通过以下方式产生:从源于非人动物的单克隆抗体产生性杂交瘤获得编码vh和vl的cdna,将它们插入用于动物细胞的具有编码人抗体的ch和cl的dna的表达载体中以便构建人嵌合抗体表达载体,接着将所述载体引入动物细胞中以便表达抗体。
术语“人源化抗体”是指其中将非人动物抗体的vh和vl的cdr的氨基酸序列移植至人抗体的vh和vl的相应cdr中的抗体。vh和vl的除cdr以外的区域被称为框架区(在下文中称为fr)。
人源化抗体可按以下方式产生:构建编码由非人抗体的vh的cdr的氨基酸序列和任何人抗体的vh的fr的氨基酸序列组成的vh的氨基酸序列的cdna,和编码由非人动物抗体的vl的cdr的氨基酸序列和任何人抗体的vl的fr的氨基酸序列组成的vl的氨基酸序列的cdna,将这些cdna分别插入用于动物细胞的具有编码人抗体的ch和cl的dna的表达载体中以便构建人源化抗体表达载体,并且将这个载体引入动物细胞中以便表达抗体。
如本文所用的术语“人抗体”最初是指天然存在于人体中的抗体。然而,人抗体也包括从人抗体噬菌体文库,克隆永生化人外周血淋巴细胞,或根据近年来在遗传工程学、细胞工程学和发育工程学方面的技术进步制备的人抗体产生性转基因动物获得的抗体。
人抗体可通过用所需抗原免疫接种具有人免疫球蛋白基因的小鼠来获得(tomizukak.等,procnatlacadsciusa.97,722-7,2000)。此外,通过使用由从人b细胞扩增抗体基因而形成的噬菌体展示文库来选择具有所需结合活性的人抗体,有可能在不进行免疫接种下获得人抗体(winterg.等,annurevimmunol.12:433-55.1994)。
此外,通过使用eb病毒使人b细胞永生化以制备具有所需结合活性的人抗体产生性细胞,有可能获得人抗体(rosena.等,nature267,52-54.1977)。
存在于人体中的抗体可例如按以下方式纯化;通过用eb病毒等感染使从人外周血分离的淋巴细胞永生化,随后进行克隆,由此可培养产生抗体的淋巴细胞,并且可从培养物纯化抗体。
人抗体噬菌体文库是通过将从人b细胞制备的抗体基因插入噬菌体的基因中来使噬菌体在其表面上表达抗体片段诸如fab和scfv的噬菌体文库。从这个文库,通过使用固定有抗原的基材的结合活性作为指标,有可能回收表达具有所需抗原结合活性的抗体片段的噬菌体。也可通过遗传工程改造技术将抗体片段转化成由两条完整h链和两条完整l链组成的人抗体分子。
人抗体产生性转基因动物是指通过使人抗体基因整合至宿主动物的染色体中获得的动物。具体来说,将人抗体基因引入小鼠es细胞中,将es细胞移植至另一小鼠的早期胚胎中,接着使胚胎发育,由此可制备人抗体产生性转基因动物。
作为一种从人抗体产生性转基因动物制备人抗体的方法,通过使用除人类以外的哺乳动物实施的标准杂交瘤制备方法获得人抗体产生性杂交瘤,随后进行培养,由此人抗体可被产生和积累在培养物中。
具体来说,它可包括由杂交瘤或抗体产生性细胞产生的非人动物抗体、人源化抗体和人抗体的vh和vl的氨基酸序列。
本发明的抗体中的cl的氨基酸序列可为人抗体的氨基酸序列或非人动物抗体的氨基酸序列中的任一个。人抗体的cκ或cλ的氨基酸序列是优选的。
本发明的抗体中的ch可为属于免疫球蛋白的任一个。优选地,γ1(igg1)、γ2(igg2)和γ4(igg4)以及它们的变体中的任一个属于人igg类别,更优选地,可使用γ2(igg2)和它的变体。
如本文所用的术语“抗体片段”是指可结合特定抗原dr3的任何抗体片段。例如,它包括fab、fab’、f(ab’)2、单链fv(scfv)、微型双功能抗体、二硫键稳定化fv(dsfv)、包含多个cdr的肽和包含抗体的6个cdr的肽,此外还包括任何fc融合蛋白,诸如与fc区融合的fab(cater等,naturemed.,2006;6;343-357)、与fc区融合的scfv(carter等,naturemed.,2006;6;343-357)、其中一个fab与fc区融合的单价抗体、由抗体的h链和与fc区融合的l链(在下文中描述为fl融合多肽)组成的单价抗体(us2007/0105199)等(labrjin等,curr.opininimmunol.,2008;20;479-485)。
fab是指具有通过二硫键(s-s键)彼此结合的n末端的约一半h链和完整l链、约50000的分子量和抗原结合活性的抗体片段,其是一种通过用木瓜蛋白酶处理igg抗体获得的片段(在h链的氨基酸残基的第224位处裂解)。
f(ab’)2是指略微长于通过铰链区的s-s键彼此结合的fab并且具有约100,000的分子量和抗原结合活性的抗体片段,其是一种通过用胃蛋白酶处理igg获得的片段(在h链的氨基酸残基的第234位处裂解)。
fab’是通过裂解f(ab’)2的铰链区的s-s键获得的并且具有约50,000的分子量和抗原结合活性的抗体片段。
scfv是通过使用适当肽连接物(p)诸如通过连接任意数目的由4个gly残基和1个ser残基组成的连接物(g4s)制备的连接物肽使一个vh连接于一个vl所获得的具有抗原结合活性的抗体片段,其是vh-p-vl或vl-p-vh多肽。
微型双功能抗体是由显示出相同或不同抗原结合特异性的scfv形成的作为二聚体的抗体片段,并且该抗体片段对于相同抗原来说具有二价抗原结合活性,或者对于不同类型的抗原来说具有2种类型的特异性抗原结合活性。
dsfv是其中vh和vl各自中的1个氨基酸残基被胱氨酸残基取代的片段,并且该多肽通过这些半胱氨酸残基之间的s-s键连接。
包含cdr的肽由vh或vl的至少一个或多个cdr区构成。在包含多个cdr的肽中,cdr可直接彼此结合或通过适当肽连接物彼此结合。
它可通过以下方式制备:构建编码本发明的抗体的vh和vl的cdr的dna,将这些dna插入用于原核生物或真核生物的表达载体中,以及将这个表达载体引入原核生物或真核生物中以进行表达。包含cdr的肽也可通过化学合成方法诸如fmoc方法或tboc方法制备。
可以通过制备与fc区融合的源于抗体的所需片段的氨基酸序列,将编码fc融合蛋白的cdna构建至表达载体中以及在适当宿主细胞中表达fc融合蛋白来产生fc融合蛋白,诸如fab-fc、scfv-fc、(fab)2-fc、其中一个fab与fc区融合的单价抗体以及由抗体的h链和fl融合多肽组成的单价抗体。
如本文所用的术语“变体”是指保留与dr3多肽、其dr3多肽片段、抗体或其抗体片段类似或相同的活性,然而与亲本抗体或其抗体片段(或原始抗体或其抗体片段)相比具有类似氨基酸序列或不同氨基酸序列的多肽。具有类似氨基酸序列的抗体变体是指包含与抗dr3抗体或其抗体片段的可变区诸如vh或vl或cdr的氨基酸序列具有至少50%、至少60%、至少70%、至少75%、优选至少80%、至少85%、更优选至少90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同一性的氨基酸序列的多肽。此外,本发明的变体包括在抗体的恒定区中包含至少一个氨基酸取代的任何变体。抗体变体也包括在抗体的恒定区的各结构域诸如ch1、铰链、ch2和ch3结构域中进行结构域交换(或结构域调换)的任何抗体,其包括或不包括至少一个氨基酸取代。更优选地,抗体变体包括igg2、包含至少一个源于igg2的结构域的igg2变体、包含源于igg2和igg4抗体的结构域的igg2变体、包含来自igg2的铰链结构域以及来自igg4的ch1、ch2和ch3结构域的igg2变体、和包含来自igg2的铰链结构域以及来自igg4的ch1、ch2和ch3结构域并且其中在ch3结构域中eu编号位置409处的氨基酸残基是lys的igg2变体。
如本文所用的术语“表位”是指定位在抗原的表面上、被抗体识别和/或结合的任何氨基酸序列和任何三维结构。例如,包括的是被单克隆抗体识别和结合的单一氨基酸序列;所述氨基酸序列的构象;结合有修饰残基诸如糖链、氨基、羧基、磷酸、硫酸等的氨基酸序列;和结合有修饰残基的氨基酸序列的构象。构象是蛋白质的天然存在的三维结构,并且它是指在细胞内或在细胞的质膜上表达的蛋白质的构象。
本发明的表位可为dr3多肽的由连续氨基酸序列构成的线性表位、非连续氨基酸序列或构象结构。在一个实施方式中,本发明的表位是包含dr3多肽的细胞外区域中存在的一个或多个氨基酸残基的表位。在其它实施方式中,表位是与tl1a配体结合的dr3分子表面中存在的表位。
如本文所用的术语“死亡受体3”、“dr3”、“dr3肽”、“dr3蛋白”或“dr3多肽”是指包含seqidno:4的氨基酸序列的多肽;包含uniplot编号q93038的氨基酸序列的多肽;包含其中在由seqidno:2或uniplot编号q93038表示的氨基酸序列中缺失、取代或添加一个或多个氨基酸残基的氨基酸序列并且具有dr3的活性的多肽;包含与由seqidno:3或uniplot编号q93038表示的氨基酸序列具有至少60%同源性、优选至少80%同源性、更优选至少90%同源性以及最优选至少95%、96%、97%、98%或99%同源性的氨基酸序列并且具有dr3的活性的多肽;以及包括snp变体等的相关多肽。所述相关多肽包括优选保留dr3活性/功能的snp变体、剪接变体、片段、取代、缺失和插入。肿瘤坏死因子受体超家族25(tnfrsf25)、淋巴细胞相关的死亡受体(lard)、apo-3、tramp和wsl-1也称为dr3的同义词,这些当然与dr3相同。
此外,多肽由seqidno:3或nm_003790.2的核苷酸序列编码。作为编码dr3的基因,本发明的编码dr3的基因也包括:含有包含在seqidno:3或nm_003790.2的核苷酸序列中具有一个或多个核苷酸的缺失、取代或添加的核苷酸序列的dna并且也编码具有dr3的功能的多肽的基因;含有由与seqidno:3或nm_003790.2的核苷酸序列具有至少60%或更高同源性、优选80%或更高同源性以及更优选95%、96%、97%、98%或99%、更高同源性的核苷酸序列组成的dna并且也编码具有dr3的功能的多肽的基因;由在严格条件下与具有seqidno:3或nm_003790.2的核苷酸序列的dna杂交的dna组成并且也含有编码具有dr3的功能的多肽的dna的基因;等。
包含其中在seqidno:4或uniplot编号q93038的氨基酸序列中缺失、取代和/或添加一个或多个氨基酸残基的氨基酸序列的多肽可例如通过位点特异性诱变[《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlaboratorypress(1989);《现代分子生物学实验方法》(currentprotocolsinmolecularbiology),johnwiley&sons(1987-1997);nucleicacidsresearch,10,6487(1982);proc.natl.acad.sci.usa,79,6409(1982);gene,34,315(1985);nucleicacidsresearch,13,4431(1985);或proc.natl.acad.sci.usa,82,488(1985)]等将位点特异性突变引入编码包含seqidno:4的氨基酸序列的多肽的dna中来获得。对缺失、取代或添加的氨基酸残基的数目没有具有限制,并且数目优选是1至几十个,诸如1至20个,并且更优选是1至几个,诸如1至5个。
如本文所用的术语“在严格条件下杂交的dna”是指使用具有seqidno:3或nm_003790.2的核苷酸序列的dna作为探针,通过菌落杂交、噬菌斑杂交、southern印迹杂交、dna微阵列等获得的dna。这种dna的具体实例是杂交的菌落或噬菌斑来源的dna,其可通过使用pcr产物或寡dna已固定于其上的过滤器或玻璃载片在65℃下在0.7至1.0mol/l氯化钠存在下进行杂交,接着在65℃下用0.1至2倍浓度ssc溶液(1倍浓度ssc溶液:150mmol/l氯化钠和15mmol/l柠檬酸钠)洗涤所述过滤器或玻璃载片来鉴定。杂交可根据各种方法[《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlab.press(1989);《现代分子生物学实验方法》(currentprotocolsinmolecularbiology),johnwiley&sons(1987-1997);《dna克隆1:核心技术实用方法》(dnacloning1:coretechniques,apracticalapproach),第2版,oxforduniversity(1995)]等来进行。具体来说,能够杂交的dna包括与核苷酸序列seqidno:3或nm_003790.2具有至少60%或更大同源性、优选80%或更大同源性、更优选90%或更大同源性以及最优选95%、96%、97%、98%或99%或更大同源性的dna。
在编码真核生物的蛋白质的基因的核苷酸序列中,常常识别到遗传多态性。本发明中使用的dr3基因也包括其中由于所述多态性而在核苷酸序列中产生小修饰的基因作为本发明中使用的基因。
除非另外指示,否则本发明中的同源性的数值可为通过使用由技术人员所知的同源性检索程序计算的数值。关于核苷酸序列,数值可通过以缺省参数使用blast[j.mol.biol.,215,403(1990)]等来计算,并且关于氨基酸序列,数值可通过使用blast2[nucleicacidsres.,25,3389(1997);genomeres.,7,649(1997),以缺省参数;http://www.ncbi.nlm.nih.gov/education/blastinfo/information3.html]等来计算。
作为缺省参数,g(开放空位罚分(costtoopengap))是5(对于核苷酸序列来说)和11(对于氨基酸序列来说);-e(空位延伸罚分(costtoextendgap))是2(对于核苷酸序列来说)和1(对于氨基酸序列来说);-q(核苷酸错配罚分(penaltyfornucleotidemismatch))是-3;-r(核苷酸匹配奖分(rewardfornucleotidematch))是1;-e(预期值)是10;-w(字长)是11个残基(对于核苷酸序列来说)和3个残基(对于氨基酸序列来说);-y[以位数表示的非空位延伸下降值(x)(dropoff(x)forblastextensionsinbits)]是20(对于blastn来说)和7(对于除blastn以外的程序来说);-x(以位数表示的空位比对下降值x(xdropoffvalueforgappedalignmentinbits))是15;并且-z(以位数表示的最终空位比对下降值x(finalxdropoffvalueforgappedalignmentinbits))是50(对于blastn来说)和25(对于除blastn以外的程序来说)(http://www.ncbi.nlm.nih.gov/blast/html/blastcgihelp.html)。
可根据由技术人员所知的方法制备包含seqidno:4或uniplot编号q93038的氨基酸序列的部分序列的多肽。例如,它可通过使编码seqidno:2的氨基酸序列的dna的一部分缺失,以及对其中引入了含有dna的表达载体的转化体进行培养来制备。此外,基于通过使用以上方法制备的多肽或dna,可以以与上述相同的方式制备包含其中在seqidno:4或uniplot编号q93038的氨基酸序列的部分序列中缺失、取代或添加一个或多个氨基酸的氨基酸序列的多肽。此外,可通过化学合成方法诸如芴基甲氧基羰基(fmoc)方法或叔丁基氧基羰基(tboc)方法来产生包含seqidno:4或uniplot编号q93038的氨基酸序列的部分序列的多肽;或包含其中在seqidno:4或uniplot编号q93038的氨基酸序列的部分序列中缺失、取代或添加一个或多个氨基酸的氨基酸序列的多肽。
在本发明中,dr3的细胞外区域包括例如通过使用常规已知的跨膜区域推导程序sosui(http://bp.nuap.nagoya-u.ac.jp/sosui/sosui_submit.)、第2版tmhmm(http://www.cbs.dtu.dk/services/tmhmm-2.0/)、expasyproteomicsserver(http://ca.expasy.org/)等从由seqidno:3表示的多肽的氨基酸序列预测的区域。
本发明中的dr3的细胞外区域的实例包括对应于细胞外结构域中的第25至201位的区域。dr3包含细胞外结构域中的四个富含半胱氨酸结构域(crd)crd1至crd4,然后是跨膜结构域、拓扑结构域和细胞内结构域中的死亡结构域。各crd通常含有在结构域的界面处形成3个二硫键的6个半胱氨酸残基。
dr3的活性/功能是指dr3通过结合tl1a配体来诱导t细胞的活化和增殖。dr3活化也通过nf-κb磷酸化来诱导从t细胞释放细胞因子,包括白介素(il)-13、il-17、gm-csf和ifn-γ。此外,dr3活化表现出使一些细胞类型凋亡。
术语针对dr3的“激动作用”、“激动活性”、“激动剂效能”或“激动功能”是指由结合的配体或抗体活化或刺激dr3。因此,这些结合剂可诱导nf-κb磷酸化、t细胞的活化和增殖、dr3阳性细胞的凋亡以及从t细胞释放细胞因子诸如白介素(il)-13、il-17、gm-csf和ifn-γ。
术语针对dr3的“拮抗作用”、“拮抗活性”、“拮抗剂效能”或“拮抗功能”是指抑制或防止dr3的由结合的tl1a配体引起的活性。因此,具有所述性质的拮抗剂可抑制由结合的tl1a配体引起的dr3和nf-κb的磷酸化,t细胞的活化、增殖、浸润,dr3阳性细胞的凋亡以及从t细胞释放细胞因子诸如白介素(il)-13、il-17、gm-csf和ifn-γ。
本发明的术语“对dr3具有减小、减低、降低/缺失、消除的激动活性、无激动活性”是指本发明的抗体显示出由它们自身结合所诱导的最小激动作用,本发明的抗体基本上不通过它们自身结合来活化、刺激或激动dr3,或本发明的抗体不通过它们自身结合来活化、刺激或激动dr3。在本发明的一个特定实施方式中,它是指抗体基本上不诱导外周血单核细胞(pbmc)中nf-κb和/或nf-κb的p65亚基的磷酸化,抗体基本上不诱导表达dr3的细胞或pbmc中的细胞因子释放,以及抗体基本上不诱导t细胞增殖。在一个特定和优选实施方式中,它是指与pbmc中的总细胞相比,抗体诱导小于20%、优选10%细胞的nf-κbp65亚基磷酸化。
抗死亡受体3(dr3)抗体
本发明提供了具有减小的激动活性或不具有激动活性的抗dr3拮抗性igg抗体及其变体;用于产生其抗体的方法;其抗体的氨基酸序列;编码抗体的核苷酸序列;包含编码抗体的核苷酸序列的载体;减小拮抗性igg抗体的激动活性的方法和包括施用抗体的治疗疾病的方法。此外,本发明提供了源于上面所述的抗体的抗体片段;产生其抗体片段的方法;其抗体片段的氨基酸序列;编码抗体片段的核苷酸序列;包含编码抗体片段的核苷酸序列的载体;减小拮抗性igg抗体片段的激动活性的方法和包括施用抗体片段的治疗疾病的方法。
本发明的抗dr3抗体可结合dr3多肽的细胞外区域,并且阻断/中和dr3多肽的活性,抑制t细胞增殖,因为所述抗体自身几乎不活化dr3或不活化dr3。因此,本发明的抗体几乎不通过自身结合来活化dr3或不通过自身结合来活化dr3,换句话说,本发明的抗体对dr3具有减小的激动活性/不具有激动活性。在一个实施方式中,本发明的抗体包括具有对dr3的中和/阻断活性并且具有减小的激动活性或不具有激动活性的抗体,可结合dr3的细胞外区域、中和dr3的活性并且具有减小的激动活性或不具有激动活性的抗体。将dr3的细胞外区域分成从多肽的n末端开始的四个富含半胱氨酸结构域(crd),并且包含crd1结构域的n末端区域已被称为前配体装配结构域(称为“plad”),plad结构域起到用于形成由三个dr3单体组成的三聚体的作用。因此,本发明的抗dr3抗体结合至少一个dr3单体、多个dr3单体和/或三聚dr3(三聚体)。
在一个实施方式中,本发明提供结合dr3的细胞外区域中包含的至少一个表位,抑制dr3三聚体的形成,并且中和通过tl1a结合实现的dr3活化的抗体,其中所述抗体对dr3表现出减小的激动活性/不表现出激动活性。在一个实施方式中,本发明提供结合dr3的细胞外区域中包含的至少一个表位,阻断结合于dr3的tl1a,并且中和通过tl1a结合实现的dr3活化的抗体,其中所述抗体对dr3具有减小的激动活性/不具有激动活性。在本发明的优选实施方式中,抗体结合plad结构域、crd1结构域、crd2结构域、crd3结构域、crd4结构域或crd3与crd4间结构域,抑制dr3三聚体的形成,并且中和通过tl1a结合实现的dr3活化,其中所述抗体对dr3表现出减小的激动活性/不表现出激动活性。
在本发明的优选实施方式中,抗体或抗体片段结合包含至少一个选自plad结构域、crd1结构域、crd2结构域、crd3结构域、crd4结构域和crd3与crd4间结构域的结构域中存在的氨基酸残基的表位,中和通过tl1a结合实现的dr3活化,其中所述抗体对dr3具有减小的激动活性/不具有激动活性,抗体结合至少一个选自plad结构域、crd1结构域、crd2结构域、crd3结构域、crd4结构域和crd3与crd4间结构域的结构域中存在的表位,抑制dr3三聚体的形成,并且中和通过tl1a结合实现的dr3活化,其中所述抗体对dr3具有减小的激动活性/不具有激动活性。
在本发明的其它实施方式中,抗体结合与tl1a结合的dr3表面,或dr3的三聚化中涉及的dr3表面,并且中和通过tl1a结合实现的dr3活化,其中所述抗体对dr3表现出减小的激动活性/不表现出激动活性。在一个优选实施方式中,本发明的抗体或抗体片段包括结合于plad结构域或crd1结构域,阻断tl1a结合,并且中和通过tl1a结合实现的dr3活化的抗体,其中所述抗体对dr3具有减小的激动活性/不具有激动活性。在另一优选实施方式中,本发明的抗体包括结合于crd4结构域,阻断tl1a结合,并且中和通过tl1a结合实现的dr3活化的抗体,其中所述抗体对dr3具有减小的激动活性/不具有激动活性。
在更优选实施方式中,本发明的抗体或抗体片段包括结合于包含crd1结构域即seqidno:4的第47至71位氨基酸序列中存在的至少一个氨基酸残基的表位、或包含seqidno:4的第117至123位和第140至170位氨基酸序列中存在的至少一个氨基酸残基的表位的抗体,其中抗体中和通过tl1a结合实现的dr3活化,并且对dr3表现出减小的激动活性或不表现出激动活性。此外,本发明的抗体或抗体片段包括与上面所述的另一特定抗体竞争性结合于dr3的抗体、结合于由上面所述的另一特定抗体识别的表位中包含的表位的抗体、和结合于上面所述的另一特定抗体结合的相同表位的抗体。
在本发明的一个优选实施方式中,抗体或抗体片段中和dr3的活性,并且具有减小的激动活性或不具有激动活性,其中所述抗体包含源于igg2类别及其变体的ch1结构域和/或铰链结构域的氨基酸序列的至少一部分。本发明中的源于igg2子类的ch1结构域和/或铰链结构域的氨基酸序列的所述部分可包括它们的区域的任何部分,只要其中包含源于igg2子类的ch1结构域和/或铰链结构域的氨基酸序列的所述部分的抗体对dr3具有减小的激动活性或不具有激动活性即可。氨基酸序列的所述部分可包括任何氨基酸序列诸如连续序列、分散或不连续序列。本发明的其中ch1结构域和/或铰链结构域源于igg2的抗体对dr3具有减小的激动活性或不具有激动活性,即使所述抗体可中和通过tl1a结合实现的dr3活性。因此,本发明的其中ch1结构域和/或铰链结构域源于igg2的抗体特异性拮抗、阻断或中和dr3活性,其中对dr3的激动作用减小或缺失。
在本发明的一个优选实施方式中,抗体或抗体片段中和dr3的活性,并且具有减小的激动活性或不具有激动活性,其中所述抗体是igg2类别及其变体。本发明的igg2类别抗体对dr3具有减小的激动活性或不具有激动活性,即使所述抗体可中和通过tl1a结合实现的dr3活性。因此,本发明的抗体特异性拮抗、阻断或中和dr3活性,其中对dr3的激动作用减小或缺失,但所有已知igg抗体都已中和dr3活性,并且通过自身结合而具有激动活性。即,因为本发明的抗体的激动作用被减小或消除,所以抗体单纯或仅仅具有对dr3的拮抗作用。抗体的所述性质具有极大价值以便通过施用抗dr3抗体来治疗患有dr3相关疾病的患者,因为可认为不利事件或降低的治疗作用是由抗体的激动作用引起的。在另一实施方式中,本发明的抗体包括人igg2的任何gm同种异型诸如g2(n+或n-)和g2m(23)等,它们全部都是天然存在的(hougs等,immunogenetics,2001:52,242-248;brusco等,imunogenetics,1995;42:414-417)。
在本发明的另一优选实施方式中,抗体或抗体片段中和dr3的活性,并且具有减小的激动活性或不具有激动活性,其中所述抗体是包含至少一个选自抗体的fc区中的第234、235、237、250、300、309、339、331和428位的氨基酸取代的igg2变体。在更优选实施方式中,抗体中和dr3的活性,并且具有减小的激动活性或不具有激动活性,其中抗体选自1)包含至少一个选自人igg2抗体的fc区中的v234a、l235e、g237a、t250q、f300y、v309l、t339a、p331s和m428l的氨基酸取代的抗体,2)包含人igg2抗体的fc区中的氨基酸取代t250q和m428l的抗体,3)包含人igg2抗体的fc区中的氨基酸取代v234a、g237a和p331s的抗体,4)包含人igg2抗体的fc区中的氨基酸取代f300y、v309l和t339a的抗体,和5)包含人igg2抗体的fc区中的氨基酸取代v234a、l235e、g237a、t250q、f300y、v309l、t339a、p331s和m428l的抗体等。
在本发明的另一优选实施方式中,抗体或抗体片段包含igg2类别抗体的铰链结构域,抗体或抗体片段包含igg2类别抗体的铰链结构域以及igg4抗体的ch1、ch2和ch3结构域,并且抗体或抗体片段包含igg2类别抗体的铰链结构域以及igg4抗体的ch1、ch2和ch3结构域,其中在ch3结构域中eu编号位置409处的氨基酸残基是lys。
在本发明的另一优选实施方式中,抗体或抗体片段包括包含igg2的铰链结构域的igg4抗体变体以及包含igg2的铰链结构域并且lys存在于eu编号位置409中的igg4抗体变体。
在特定实施方式中,本发明的抗体包括抗dr3单克隆抗体142a2、142s38b和它们的抗体变体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16、17、80和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16、17、80和vl的cdr1至cdr3的氨基酸序列seqidno:22、81、24的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16、17、80和vl的cdr1至cdr3的氨基酸序列seqidno:22、82、24的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22、81、24的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22、82、24的抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16、17、80和vl的cdr1至cdr3的氨基酸序列seqidno:22、83、24的抗体、包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21的抗体、包含vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:21的抗体、包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:77的抗体、包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:78的抗体、包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:79的抗体、包含vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:79的抗体、包含vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33的抗体。
在其它实施方式中,本发明的抗体包括与以下各氨基酸序列具有至少90%、优选至少91%、92%、93%、94%、更优选至少95%、96%、97%、98%或99%同一性的抗体:vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21、vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:21、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:77、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:78、vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:79、vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:79、或vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33;以及与以下各氨基酸序列具有至少95%、96%、97%、98%或99%同一性的igg2抗体:vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22-24;vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22-24;vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、81、24;vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、82、24;vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、83、24;vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、81、24;vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、82、24;vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、83、24;或vh的cdr的氨基酸序列seqidno:28-30和vl的cdr的氨基酸序列seqidno:34-36。此外,本发明的抗体也包括由任何种类的筛选方法获得的任何亲和性成熟抗体克隆。
在其它实施方式中,本发明的抗体包括结合于由抗dr3单克隆抗体142a2、142s38b或它们的抗体变体识别的表位的抗体,包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22-24、vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、81、24的抗体,包含vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、82、24的抗体,包含vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、83、24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、81、24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、82、24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、83、24的抗体,包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21的抗体,包含vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:21的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:77的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:78的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:79的抗体,包含vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:79的抗体或包含vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33的抗体。此外,本发明的抗体包括与上面所述的另一特定抗体竞争性结合于dr3的抗体。
在更具体的实施方式中,本发明的抗体包括抗dr3单克隆抗体142a2、142s38b及其被重排成igg2子类的抗体变体、包含igg2的铰链结构域的igg2变体、包含igg2的铰链结构域以及igg4的ch1、ch2和ch3结构域的igg2变体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的igg2抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的抗体、包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21的igg2抗体、包含vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33的igg2抗体。在其它实施方式中,本发明的抗体包括与以下各氨基酸序列具有至少90%、优选至少91%、92%、93%、94%、更优选至少95%、96%、97%、98%或99%同一性的igg2抗体:vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21、或vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33;以及与以下各氨基酸序列具有至少95%、96%、97%、98%或99%同一性的igg2抗体:vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22-24、或vh的cdr的氨基酸序列seqidno:28-30和vl的cdr的氨基酸序列seqidno:34-36。此外,本发明的抗体也包括由任何种类的筛选方法获得的任何亲和性成熟抗体克隆。例如,本发明中包括包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22-24、vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、81、24的抗体,包含vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、82、24的抗体,包含vh的cdr的氨基酸序列seqidno:16-18和vl的cdr的氨基酸序列seqidno:22、83、24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、81、24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、82、24的抗体,包含vh的cdr的氨基酸序列seqidno:16、80、18和vl的cdr的氨基酸序列seqidno:22、83、24的抗体,包含vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:21的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:77的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:78的抗体,包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:79的抗体,以及包含vh的氨基酸序列seqidno:76和vl的氨基酸序列seqidno:79的抗体。
在其它实施方式中,本发明的抗体包括结合于由抗dr3单克隆抗体142a2、142s38b识别的表位的igg2抗体和igg2变体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的igg2抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的igg2抗体、包含vh的氨基酸序列seqidno:15和vl的氨基酸序列seqidno:21的igg2抗体、或包含vh的氨基酸序列seqidno:27和vl的氨基酸序列seqidno:33的igg2抗体。此外,本发明的抗体包括与上面所述的另一特定抗体竞争性结合于dr3的igg2抗体。
在一个实施方式中,本发明的抗体片段包括fab、fab’、f(ab’)2、单链fv(scfv)、微型双功能抗体、二硫键稳定化fv(dsfv)、包含多个cdr的肽和包含抗体的6个cdr的肽和fc融合蛋白,诸如其中一个fab与fc区融合的单价抗体(fab-fc)、其中两个fab与fc区融合的二价抗体[(fab)2-fc]、其中一个scfv与fc区融合的单价抗体(scfv-fc)、其中两个scfv与fc区融合的二价抗体[(scfv)2-fc]、由抗体的h链和fc融合的l链(在下文中描述为“fl”)组成的单价抗体等。本发明的抗体片段可拮抗tl1a诱导的dr3活性,其中抗体片段具有减小的激动活性或不具有激动活性。
在本发明的一个优选实施方式中,抗体片段包括具有一个或两个由vh和vl组成的抗原结合结构域诸如fab或scfv的单价抗体和二价抗体。在本发明的一个更优选实施方式中,单价抗体包括其中一个fab与fc区融合的单价抗体(fab-fc)、由一条h链、一条轻链和一个fc区组成的单价抗体、其中一个scfv与fc区融合的单价抗体(scfv-fc)、由一个scfv-fc和一个fc区组成的单价抗体、由抗体的h链和fl融合多肽组成的单价抗体,其中所述单价抗体可拮抗tl1a诱导的dr3活性,其中激动活性减小或不具有激动活性。
在本发明的另一更优选实施方式中,抗体片段包括其中两个fab与igg2-fc区融合的二价抗体[(fab)2-igg2fc]、其中两个scfv与igg2fc区融合的二价抗体[(scfv)2-igg2fc],其中二价抗体可拮抗tl1a诱导的dr3活性,其中激动活性减小或不具有激动活性。
在一个优选实施方式中,本发明的单价抗体包括包含抗dr3单克隆抗体142a2或142s38b的6个cdr序列的单价抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的单价抗体、和包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的单价抗体。在另一优选实施方式中,本发明的二价igg2抗体包括包含抗dr3单克隆抗体142a2或142s38b的6个cdr序列的二价igg2抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的二价igg2抗体、和包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的二价igg2抗体。
在本发明的一个优选实施方式中,单价抗体包括包含抗dr3单克隆抗体142a2或142s38b的6个cdr序列的单价抗体、包含vh的cdr1至cdr3的氨基酸序列seqidno:16-18和vl的cdr1至cdr3的氨基酸序列seqidno:22-24的单价抗体、和包含vh的cdr1至cdr3的氨基酸序列seqidno:28-30和vl的cdr1至cdr3的氨基酸序列seqidno:34-36的单价抗体。
在本发明的另一优选实施方式中,单价抗体也包括包含下述各6个cdr序列的单价抗体;vh的cdrseqidno:16、80、18和vl的cdrseqidno:22-24;vh的cdrseqidno:16-18和vl的cdrseqidno:22、81、24;vh的cdrseqidno:16-18和vl的cdrseqidno:22、82、24;vh的cdrseqidno:16-18和vl的cdrseqidno:22、83、24;vh的cdrseqidno:16、80、18和vl的cdrseqidno:22、81、24;vh的cdrseqidno:16、80、18和vl的cdrseqidno:22、82、24;或vh的cdrseqidno:16、80、18和vl的cdrseqidno:22、83、24。
在一个实施方式中,本发明的抗体或抗体片段包括其中包括任何翻译后修饰的氨基酸残基的抗体。呈翻译后修饰形式的抗体是熟知的,如在重链的c末端缺乏赖氨酸残基(在下文中,因此称为“赖氨酸剪裁”),并且在多肽的n末端处的谷氨酰胺残基被修饰成焦谷氨酰胺(pyroglu)(beck等,analyticalchemistry,2013;85:715-736)。因此,在本发明的一个特定实施方式中,抗体在各多肽的n/c末端处包含pyroglu和/或lys剪裁。这些修饰基本上不影响抗体的活性,并且本发明的抗体与无这些修饰的抗体具有等效活性。
本发明也提供了一种包含上面所述的抗体或抗体片段的抗体组合物或抗体片段组合物。在一个实施方式中,本发明的抗体组合物包括包含中和dr3的活性并且具有减小的激动活性或不具有激动活性的抗体的抗体组合物,包含阻断tl1a结合、中和dr3的活性并且具有减小的激动活性或不具有激动活性的抗体的抗体组合物,包含抑制dr3三聚体的形成并且中和通过tl1a结合实现的dr3活化的抗体的抗体组合物,其中抗体对dr3具有减小的激动活性/不具有激动活性。在本发明的一个实施方式中,抗体组合物可包含可变抗体分子,诸如在各多肽的n/c末端处包括pyroglu和/或lys剪裁的上述翻译后修饰的抗体分子、糖形式变体等。
抗体性质的调节
在本发明中,具有fc区的抗体可通过fc受体结合或补体结合来表现出若干效应物活性。
效应物活性是指由抗体的fc区介导的抗体依赖性活性。作为效应物活性,抗体依赖性细胞细胞毒性活性(adcc活性)、补体依赖性细胞毒性活性(cdc活性)和由诸如巨噬细胞、树突细胞等的吞噬细胞引起的抗体依赖性吞噬作用(adp活性)是已知的。在本发明中,可使用已知测量方法测量adcc和cdc活性[cancerimmunol.immunother.,36,373(1933)]。
adcc活性是指其中与靶细胞上的抗原结合的抗体通过抗体的fc区结合免疫细胞的fc受体,由此活化所述免疫细胞(自然杀伤细胞等)以及损害所述靶细胞的活性。
fc受体(在下文中在一些情况下称为fcr)是指与抗体的fc区结合的受体,并且由于结合抗体而诱导各种类型的效应物活性。
fcr对应于抗体子类,并且igg、ige、iga和igm分别特异性结合fcγr、fcεr、fcαr和fcμr。fcγr具有包括fcγri(cd64)、fcγrii(cd32)和fcγriii(cd16)的亚型,并且所述亚型分别具有包括fcγria、fcγrib、fcγric、fcγriia、fcγriib、fcγriic、fcγriiia、fcγriiib的同工型。这些不同类型的fcγr存在于不同细胞上[annurev.immunol.9:457-492(1991)]。在人类中,fcγriiib在嗜中性白细胞中特异性表达,并且fcγriiia在单核细胞、自然杀伤细胞(nk细胞)和一部分t细胞中表达。通过fcγriiia引起的抗体结合诱导nk细胞依赖性adcc活性。
cdc活性是指其中与靶细胞上的抗原结合的抗体活化一系列由血液中一组补体相关蛋白质组成的级联(补体活化路径),由此损害所述靶细胞的活性。通过由于补体活化而产生的蛋白质片段,有可能诱导免疫细胞的迁移和活化。当具有针对抗体的fc区的结合结构域的c1q结合fc区,并且作为两种丝氨酸蛋白酶的c1r和c1s与其结合时,形成c1复合物,由此开始cdc活性的级联。
用于控制本发明的抗体的效应物活性的方法可如下示例。控制抗体的效应物活性的方法的实例可包括:控制形成α1,6结合的n-乙酰基葡萄糖胺(glcnac)的海藻糖(也被称为核心海藻糖)的量的方法,所述n-乙酰基葡萄糖胺存在于复合型n连接的糖链(在下文中在一些情况下仅缩写成复合糖链)的还原端,所述糖链与在eu索引的第297位处的asn结合(使用igg1子类的fc的氨基酸序列作为本发明的抗体的fc)(wo2005/035586、wo2002/31140、wo00/61739);或通过取代抗体的fc区的氨基酸残基来控制活性的方法。
1)通过修饰糖链来调节
抗体的效应物活性可通过控制添加至与抗体的fc区结合的复合糖链的还原端中的n-乙酰基葡萄糖胺中的海藻糖的含量来增加或减小。
用于减小结合于与抗体的fc区结合的复合型n连接的糖链的海藻糖的含量的方法在于通过使用其中已缺失α1,6-海藻糖基转移酶基因(fut8)的cho细胞表达抗体来获得不具有与其结合的海藻糖的抗体。不具有与其结合的海藻糖的抗体具有高adcc活性。
在另一方面,用于增加结合于与抗体的fc区结合的复合型n连接的糖链的海藻糖的含量的方法在于通过使用其中已引入α1,6-海藻糖基转移酶基因的宿主细胞表达抗体来获得具有与其结合的海藻糖的抗体。具有与其结合的海藻糖的抗体与不具有与其结合的海藻糖的抗体相比具有较低adcc活性。
在本发明的抗体的fc区中,n连接的糖链结合于在eu索引的位置297处的asn残基,但不存在糖链结合于其它fc区的asn残基的报道。因此,两个n-糖苷连接的糖链通常结合于一个抗体分子。
已知n连接的糖链是高甘露糖型、复合型和杂合型糖链。只要n连接的糖链不具有与其结合的海藻糖,它与具有与其结合的海藻糖的糖链相比就具有较高adcc活性。
与本发明的抗体的fc区结合的复合型糖链可包括其中一个或多个n-乙酰基葡萄糖胺(glcnac)或半乳糖-n-乙酰基葡萄糖胺(在下文中称为glcnac或gal-glcnac)α1-2或α1-4连接于核心结构(三甘露糖基核心结构)的非还原端的甘露糖(man)的糖链。它也可包括在gal-glcnac的非还原端具有唾液酸、平分型n-乙酰基葡萄糖胺(在下文中称为平分型glcnac)等的复合型糖链。
在本发明中,核心海藻糖或α1,6-海藻糖是指其中海藻糖(在下文中在一些情况下称为fuc)的1位通过复合型n-糖苷连接的糖链的α键结合于还原端中的n-乙酰基葡萄糖胺(在下文中在一些情况下称为glcnac)的6位的糖链结构。此外,不具有与复合型n-糖苷连接的糖链的还原端中的n-乙酰基葡萄糖胺连接的核心海藻糖的那些糖链简称为不具有海藻糖或不具有核心海藻糖的糖链。
在本发明中,核心结构或三甘露糖基核心结构是指manα1-6(manα1-3)manβ1-4glcnacβ1-4glcnac结构。
作为与本发明的抗体结合的糖链,双触角n-糖苷连接的复合糖链(也称为双触角复合糖链)由以下化学式表示。
[化学式1]
本发明的抗体组合物是具有其中复合型糖链与在抗体分子的第297位处的asn结合的fc区的抗体分子,并且只要它具有以上糖结构,它即可由具有单一或多个不同糖链的抗体分子组成。
换句话说,本发明的抗体组合物意指由具有单一或多个不同糖链的抗体分子组成,并且具体来说由其中在抗体中包括的与fc区结合的总n-糖苷连接的糖链之中,50%或更多的糖链不具有与糖链的还原端处的n-乙酰基葡萄糖胺结合的海藻糖的抗体组成的组合物。在抗体组合物的另一实施方式中,80%或更多的抗体组合物由在fc区中具有海藻糖基化糖链的抗体分子组成。
抗体组合物中不具有核心海藻糖的糖链的比率可为任何比率,只要抗体的adcc活性增加或减小即可。对于增加的adcc来说,所述比率可优选是50%或更大,更优选是51%至100%,更优选得多的是80%至100%,特别优选是90%、91%、92%、93%、94%、95%、96%、97%、98%、99%,并且最优选是100%。对于减小的adcc来说,所述比率可优选是20%或更小。
不具有核心海藻糖的糖链的比率是50%的抗体组合物可为以下抗体组合物中的任一种:100%的分子在与抗体分子的第一多肽和第二多肽结合的n-糖苷连接的糖链中的一个糖链处不具有海藻糖的抗体组合物,以及50%的分子在与抗体分子的第一多肽和第二多肽结合的n-糖苷连接的糖链中的两个糖链处均不具有海藻糖并且50%的分子在与抗体分子的第一多肽和第二多肽结合的n-糖苷连接的糖链中的两个糖链处均具有海藻糖的抗体组合物。
在本发明中,不具有海藻糖的糖链在非还原端处可具有任何糖链结构,只要海藻糖不与上述化学式中的还原端处的n-乙酰基葡萄糖胺结合即可。
在本发明中,不具有与糖链的还原端处的n-乙酰基葡萄糖胺结合的海藻糖(无核心海藻糖)意指海藻糖基本上未被结合。其中“海藻糖基本上未被结合”的抗体组合物意指其中在下述糖链分析中基本上不能检测到海藻糖的抗体组合物。“基本上不能检测到海藻糖”意指它低于检测限。在所有糖链中都不具有核心海藻糖的抗体组合物具有最高adcc活性。
由具有与复合型n-糖苷连接的糖链结合的fc区的抗体分子组成的组合物中含有的具有无海藻糖的糖链的抗体分子的比率可通过以下方式来测定:使用已知方法诸如肼解或酶消化[生物化学实验方法23-用于研究糖蛋白糖链的方法(日本学会出版社)(biochemicalexperimentationmethods23-methodforstudyingglycoproteinsugarchain(japanscientificsocietiespress)),reikotakahashi编(1989)]使糖链从抗体分子释放,对释放的糖链进行荧光标记或放射性同位素标记,接着通过色谱法来分离标记的糖链。
此外,由具有与复合型糖链结合的fc区的抗体分子组成的组合物中含有的与不具有海藻糖的糖链结合的抗体分子的比率可通过用hpaed-pad方法[j.liq.chromatogr.,6,1577(1983)]分析释放的糖链来测定。
2)通过取代氨基酸残基来调节
可通过改变构成抗体的fc的抗体子类或通过取代fc区的氨基酸残基来增加或减小本发明的抗体或抗体片段的adcc、adcp和cdc活性。
例如,可通过使用美国专利申请公布号2007/0148165中所述的fc区的氨基酸序列来增加抗体的cdc活性。此外,可通过进行美国专利号6,737,056、7,297,775和7,317,091中所述的氨基酸残基取代来增加或减小抗体的adcc活性或cdc活性。
用于增加adcc活性的特定取代可包括s239d、p247i、f243l、r292p、s298a、y300l、a330l、i332e、e333a、k334a、a339d、t393a、p396l、h433p等。同时,用于降低adcc活性的特定取代可包括l235e、p238a、n297a、k322a、p331s等。
可以两个或更多个氨基酸残基取代的组合来增加cdc活性,并且视目的而定,可增加待取代的氨基酸残基。优选地,用于增加cdc活性的氨基酸残基取代可包括至少一个选自n276k、a339t、t394f和t394y的取代、氨基酸残基取代n276k和a339t、以及氨基酸残基取代k274q、n276k、y296f、y300f、a339t、d356e、l358m、n384s、v397m和v422i等。同时,用于降低cdc活性的特定氨基酸残基取代可包括至少一个选自l235e、n297a、k322a、p329a和p331s等的取代。
也可通过向人igg子类的fc中添加至少一个选自t250q、m428l、m252y、s254t、t256e等的取代来延长血液半衰期。也可通过使用其中n连接的糖链通过在位置n297处引入氨基酸突变而移除的fc、人igg2或igg4子类的fc、igg2和igg4的嵌合fc等来降低细胞细胞毒性诸如adcc活性、adcp活性、cdc活性。
在本发明的一个实施方式中,可通过向人igg抗体中至少添加选自f300y、v309l和t339a的取代来使抗体或抗体片段在低ph条件下稳定。
在一优选实施方式中,本发明的抗体或抗体片段包含至少一个选自igg抗体的fc区中的第234、235、237、250、300、309、331、339、409和428位的氨基酸取代。在更优选实施方式中,本发明的抗体包括包含至少一个选自人igg2抗体的fc区中的v234a、l235e、g237a、t250q、f300y、v309l、p331s、t339a和m428l的氨基酸取代的抗体、包含人igg2抗体的fc区中的氨基酸取代t250q和m428l的抗体、包含人igg2抗体的fc区中的氨基酸取代v234a、g237a和p331s的抗体、包含人igg2抗体的fc区中的氨基酸取代f300y、v309l和t339a的抗体,和包含人igg2抗体的fc区中的氨基酸取代v234a、l235e、g237a、t250q、f300y、v309l、t339a、p331s和m428l的抗体等。
在一个实施方式中,本发明的抗体片段包含如下;
(i)至少一个选自igg1抗体的fc区中的第214、220、435和436位的氨基酸取代。
(ii)至少一个选自igg2抗体的fc区中的第234、235、237、250、300、309、339、331、409、428、435和436位的氨基酸取代,或
(iii)至少一个选自igg4抗体的fc区中的第131、133、228、235、409、435和436位的氨基酸取代
在一个优选实施方式中,本发明的抗体片段包括包含如下的抗体片段;
(i)至少一个选自igg1抗体的fc区中的c214s、c220s、h435r和y436f的氨基酸取代。
(ii)至少一个选自igg2抗体的fc区中的c220s、v234a、l235e、g237a、t250q、f300y、v309l、p331s,t339a、m428l、h435y和y436f位置的氨基酸取代,或
(iii)至少一个选自igg4抗体的fc区中的c131s、r133k、c214s、s228p、l235e、r409k、h435r和y436f的氨基酸取代
在最优选实施方式中,本发明的单价抗体包括如下;
(i)包含igg1的h链中的c220s取代以及fl链中的c214s、h435r和y436f取代的单价抗体,
(ii)包含igg1的h链中的c220s取代、fl链中的c214s、h435r和y436f取代以及216-220epksc缺失的单价抗体,
(iii)包含igg1的h链中的c220s、l235e、g237a和p331s取代以及fl链中的c214s、c220s、l235e、g237a、p331s、h435r和y436f取代的单价抗体,
(iv)包含igg1的h链中的c220s、l235e、g237a和p331s取代、fl链中的c214s、l235e、g237a、p331s、h435r和y436f取代以及216-220epksc缺失的单价抗体,
(v)包含igg2的h链中的c220s和f300y取代、fl链中的c214s、f300y、h435r和y436f的单价抗体,
(vi)包含igg2的h链中的c220s、t250q和m428l取代、fl链中的c214s、t250q、m428l、h435r和y436f的单价抗体,
(vii)包含igg2的h链中的c220s、v234a、l235e、g237a、t250q、f300y、v309l、p331s、t339a和m428l取代、fl链中的c214s、v234a、l235e、g237a、t250q、f300y、v309l、t339a、p331s、m428l、h435r和y436f的单价抗体,
(viii)包含igg2的h链中的c220s、v234a、l235e、g237a、t250q、f300y、v309l、p331s、t339a和m428l取代、fl链中的c214s、v234a、l235e、g237a、t250q、f300y、v309l、t339a、p331s、m428l、h435r和y436f的单价抗体,和
(ix)包含igg4的h链中的c131s和r409k取代以及fl链中的c214s、r409k、h435r和y436f取代的单价抗体。
(x)包含igg4的h链中的c131s、r133k、s228p、l235e和r409k取代以及fl链中的c214s、s228p、l235e、r409k、h435r和y436f取代的单价抗体。
本发明也包括一种产生本发明的抗体及其抗体片段的方法,所述方法包括步骤a)将包含编码抗体的氨基酸序列的核酸序列的载体引入宿主细胞中,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化抗体。
在本发明的优选实施方式中,方法包括:
一种产生抗体的方法,其包括步骤a)在抗体的恒定区中替换成源于igg2子类的ch1结构域和/或铰链结构域的一部分,b)将包含编码抗体的氨基酸序列的核酸序列的载体引入宿主细胞中,c)培养所述细胞并回收培养上清液,和d)从所述培养上清液纯化所述抗体,
一种产生抗体的方法,其包括步骤a)在抗体的fc区中替换成igg2子类,b)将包含编码抗体的氨基酸序列的核酸序列的载体引入宿主细胞中,c)培养所述细胞并回收培养上清液,和d)从所述培养上清液纯化所述抗体,
一种产生igg2抗体或igg2抗体变体的方法,其包括步骤a)将包含编码所述抗体的氨基酸序列的核酸序列的载体引入宿主细胞中,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化所述抗体,
一种产生igg2抗体或igg2抗体变体的方法,其包括步骤a)将包含编码所述抗体的氨基酸序列的核酸序列的载体引入宿主细胞中,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化所述抗体,和
一种产生igg2抗体或igg2抗体变体的方法,其包括步骤a)将包含编码所述抗体或igg2抗体变体的氨基酸序列的核酸序列的载体引入宿主细胞中,所述抗体包含至少一个选自igg抗体的fc区中的第234、235、237、250、300、309、331、339、409、428、435和436位的氨基酸取代,所述igg2抗体变体包含igg2抗体的铰链结构域以及igg4的ch1、ch2、ch3结构域,其中在ch3结构域中的第409位处的氨基酸残基是lys,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化所述抗体。
本发明也包括:
一种产生本发明的抗体片段的方法,其包括步骤a)将编码igg1、igg2或igg4抗体的抗体片段的氨基酸序列的载体引入宿主细胞中,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化抗体,
一种产生本发明的抗体片段的方法,其包括步骤a)将编码包含igg1、igg2或igg4抗体的fc区的抗体片段的氨基酸序列的载体引入宿主细胞中,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化抗体,和
一种产生本发明的抗体片段的方法,其包括步骤a)将编码包含igg1、igg2或igg4抗体的fc区的单价抗体的氨基酸序列的载体引入宿主细胞中,b)培养所述细胞并回收培养上清液,和c)从所述培养上清液纯化抗体。此外,上面所描述的产生抗体片段的任何方法都可被包括在本发明方法中。
在本发明的一个实施方式中,方法包括:
一种使抗体的激动作用减小或缺失的方法,其包括步骤a)在抗体的恒定区中替换成源于igg2子类的ch1结构域和/或铰链结构域的一部分,b)产生重组抗体和c)检测所述抗体的激动活性,和
一种使抗体的激动作用减小或缺失的方法,其包括步骤a)在抗体的fc区中替换成igg2子类或igg2抗体变体,b)产生重组抗体和c)检测所述抗体的激动活性。
在优选实施方式中,本发明方法包括一种使抗体的激动作用减小或缺失的方法,其包括步骤a)在抗体的fc区中替换成igg2子类或igg2抗体变体,b)产生重组抗体和c)在至少一个选自以下的测定中检测所述抗体的激动活性:(i)dr3的磷酸化,(ii)nf-κb的磷酸化,(iii)t细胞的增殖,(iv)dr3阳性细胞的凋亡和(v)从t细胞释放细胞因子诸如白介素(il)-13、il-17、gm-csf和ifn-γ。
在本发明的一个实施方式中,方法包括:
一种使抗体片段的激动作用减小或缺失的方法,其包括步骤a)构建编码igg1、igg2、igg4或各抗体变体的抗体片段的氨基酸序列的载体,b)产生重组抗体和c)检测所述抗体的激动活性,
一种使抗体片段的激动作用减小或缺失的方法,其包括a)构建编码包含igg1、igg2或igg4抗体的fc区的抗体片段的氨基酸序列的载体,b)产生重组抗体和c)检测所述抗体的激动活性,和
一种使抗体片段的激动作用减小或缺失的方法,其包括a)构建编码包含igg1、igg2、igg4或各抗体变体的fc区的单价抗体的氨基酸序列的载体,b)产生重组抗体和c)检测所述抗体的激动活性。
在优选实施方式中,本发明方法包括一种使抗体的激动作用减小或缺失的方法,其包括步骤a)重建包含igg1、igg2、igg4或各抗体变体的fc区的单价抗体,b)产生重组单价抗体和c)在至少一个选自以下的测定中检测所述单价抗体的激动活性:(i)dr3的磷酸化,(ii)nf-κb的磷酸化,(iii)t细胞的增殖,(iv)dr3阳性细胞的凋亡和(v)从t细胞释放细胞因子诸如白介素(il)-13、il-17、gm-csf和ifn-γ。
下面具体描述了一种用于产生本发明的抗体的方法、一种用于治疗疾病的方法和一种用于诊断疾病的方法。
1.单克隆抗体的制备方法
(1)抗原的制备
可通过将包含编码全长dr3或其部分长度的cdna的表达载体引入大肠杆菌(escherichiacoli)、酵母、昆虫细胞、动物细胞等中来获得dr3多肽或表达dr3蛋白的细胞作为抗原。此外,dr3可从表达大量dr3的各种人肿瘤细胞系、人组织等纯化。肿瘤细胞系和组织可被允许用作抗原。此外,具有dr3的部分序列的合成肽可通过化学合成方法诸如fmoc方法或tboc方法制备并用作抗原。此外,表达和制备诸如人、猴、大鼠、小鼠等的任何物种的dr3蛋白。
用于本发明中的dr3可例如根据以下方法,通过使用《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlaboratorypress(1989);《现代分子生物学实验方法》(currentprotocolsinmolecularbiology),johnwiley&sons(1987-1997)等中所述的方法在宿主细胞中表达编码dr3的dna来产生。
首先,通过将包含编码dr3或其片段的区域的全长cdna插入适当表达载体的启动子的下游中来制备重组载体。此时,如果必要,那么具有适当长度的dna片段含有编码基于全长cdna的多肽的区域,并且可使用所述dna片段代替上述全长cdna。接着,可通过将重组载体引入适于表达载体的宿主细胞中来获得产生dr3的转化体。
表达载体包括可在待使用的宿主细胞中自主复制的载体,或可在使得编码多肽的dna可被转录的位置处整合至包含适当启动子的染色体中的载体。
宿主细胞可为任一宿主细胞,只要它可表达目标基因即可。实例包括属于埃希氏菌属(escherichia)的微生物诸如大肠杆菌;酵母;昆虫细胞;动物细胞等。
当原核生物诸如大肠杆菌用作宿主细胞时,优选的是,本发明中使用的重组载体可在原核生物中自主复制,并且包含启动子、核糖体结合序列、包含编码dr3的部分的dna和转录终止序列。重组载体不一定具有转录终止序列,但转录终止序列优选设置于恰好在结构基因以下。重组载体可进一步包含调节启动子的基因。
此外,以上重组载体优选是质粒,其中将作为核糖体结合序列的shine-dalgarno序列(也被称为sd序列)与起始密码子之间的间隔调整成适当距离(例如6至18个核苷酸)。
此外,编码dr3的dna的核苷酸序列可被另一碱基取代以便成为适于在宿主细胞中表达的密码子,由此改进目标dr3的产率。
可使用任何表达载体,只要它可在待使用的宿主细胞中起作用即可。表达载体的实例包括pbtrp2、pbtac1、pbtac2(全都由rochediagnostics制造)、pkk233-2(由pharmacia制造)、pse280(由invitrogen制造)、pgemex-1(由promega制造)、pqe-8(由qiagen制造)、pkyp10(日本公开未审查专利申请号110600/83)、pkyp200[agriculturalbiologicalchemistry,48,669(1984)]、plsa1[agric.biol.chem.,53,277(1989)]、pgel1[proc.natl.acad.sci.usa,82,4306(1985)]、pbluescriptiisk(-)(由stratagene制造)、ptrs30[由大肠杆菌jm109/ptrs30(fermbp-5407)制备]、ptrs32[由大肠杆菌jm109/ptrs32(fermbp-5408)制备]、pgha2[由大肠杆菌igha2(fermbp-400)制备,日本公开未审查专利申请号221091/85]、pgka2[由大肠杆菌igka2(fermbp-6798)制备,日本公开未审查专利申请号221091/85]、pterm2(us4686191、us4939094、us5160735)、psupex、pub110、ptp5、pc194、peg400[j.bacteriol.,172,2392(1990)]、pgex(由pharmacia制造)、pet系统(由novagen制造)、pme18sfl等。
可使用任何启动子,只要它可在待使用的宿主细胞中起作用即可。实例包括源于大肠杆菌、噬菌体等的启动子,诸如trp启动子(ptrp)、lac启动子、pl启动子、pr启动子和t7启动子。此外,可使用人工设计和修饰的启动子,诸如其中两个ptrp串联连接的启动子、tac启动子、lact7启动子和leti启动子。
宿主细胞的实例包括大肠杆菌xl1-blue、大肠杆菌xl2-blue、大肠杆菌dh1、大肠杆菌mc1000、大肠杆菌ky3276、大肠杆菌w1485、大肠杆菌jm109、大肠杆菌hb101、49号大肠杆菌、大肠杆菌w3110、大肠杆菌ny49、大肠杆菌dh5α等。
可使用任何重组载体引入方法,只要它是用于将dna引入宿主细胞中的方法即可,并且实例包括使用钙离子的方法[proc.natl.acad.sci.usa,69,2110(1972);gene,17,107(1982)以及molecular&generalgenetics,168,111(1979)中描述的方法]。
当动物细胞用作宿主时,可使用任何表达载体,只要它在动物细胞中表现出它的功能即可,并且其实例可包括pcdnai、pcdm8(由funakoshico.制造)、page107[日本专利公布号h3-22979;cytotechnology,3,133(1990)]、pas3-3(日本专利公布号h2-227075)、pcdnai/amp(由invitrogen制造)、pcdna3.1(由invitrogen制造)、prep4(由invitrogen制造)、page103[j.biochemistry,101,1307(1987)]、page210、pme18sfl3、pkantex93(wo97/10354)、n5kg1val(美国专利号6,001,358)、tol2转座子载体(wo2010/143698、wo2013/005649)等。
可使用任何启动子,只要它可在动物细胞中起作用即可。实例包括巨细胞病毒(cmv)的立即早期(ie)基因的启动子、sv40早期启动子、逆转录病毒的启动子、金属硫蛋白启动子、热休克启动子、srα启动子、莫洛尼(molony)鼠类白血病病毒启动子或增强子等。此外,人cmv的ie基因的增强子可连同启动子一起使用。
宿主细胞的实例包括人白血病细胞namalwa、猴cos细胞、人白血病细胞per.c6、中国仓鼠卵巢细胞cho细胞(journalofexperimentalmedicine,108,945(1958);proc.natl.acad.sci.usa,60,1275(1968);genetics,55,513(1968);chromosoma,41,129(1973);methodsincellscience,18,115(1996);radiationresearch,148,260(1997);proc.natl.acad.sci.usa,77,4216(1980);proc.natl.acad.sci.,60,1275(1968);cell,6,121(1975);molecularcellgenetics,附录i,ii(第883-900页))、cho/dg44、cho-k1(atccccl-61)、dukxb11(atccccl-9096)、pro-5(atccccl-1781)、cho-s(lifetechnologies,目录号11619)、pro-3细胞、大鼠骨髓瘤yb2/3hl.p2.g11.16ag.20(也称为yb2/0)、小鼠骨髓瘤细胞nso、小鼠骨髓瘤细胞sp2/0-ag14、叙利亚仓鼠细胞bhk或hbt5637(日本公开未审查专利申请号000299/88)等。
可使用任何重组载体引入方法,只要它是用于将dna引入动物细胞中的方法即可,并且实例包括电穿孔[cytotechnology,3,133(1990)]、磷酸钙方法(日本公开未审查专利申请号227075/90)、脂质体转染方法[proc.natl.acad.sci.usa,84,7413(1987)]等。
可通过在培养基中培养源于微生物、动物细胞等的具有包含编码dr3的dna的重组载体的转化体以使dr3在培养物中形成和积累,以及从培养物回收dr3来产生dr3。根据宿主培养中使用的常用方法进行用于在培养基中培养转化体的方法。当dr3在源于真核生物的细胞中表达时,可获得结合于糖或糖链的dr3。当对用含有诱导型启动子的重组载体转化的微生物进行培养时,必要时可向培养基添加诱导剂。例如,当对用使用lac启动子的重组载体转化的微生物进行培养时,可向培养基添加异丙基-β-d-硫代半乳糖吡喃糖苷;或当对用使用trp启动子的重组载体转化的微生物进行培养时,可向培养基添加吲哚丙烯酸等。
当对使用动物细胞作为宿主细胞获得的转化体进行培养时,培养基包括通常使用的rpmi1640培养基[thejournaloftheamericanmedicalassociation,199,519(1967)]、依格氏mem培养基(eagle’smemmedium)[science,122,501(1952)]、杜贝卡氏改良mem培养基(dulbecco’smodifiedmemmedium)[virology,8,396(1959)]和199培养基[proceedingofthesocietyforthebiologicalmedicine,73,1(1950)]、伊思柯夫氏改良杜贝卡氏培养基(iscoove’smodifieddulbecco’smedium)(imdm)、其中已添加胎牛血清等的培养基等。培养通常在5%co2存在下在6至8的ph和30至40℃下进行1至7天。必要时,可在培养期间向培养基添加抗生素诸如卡那霉素、青霉素或庆大霉素。
关于编码dr3的基因的表达方法,除直接表达之外,也可根据[《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlaboratorypress(1989)中所述的方法进行分泌产生、融合蛋白表达等。在一个实施方式中,dr3融合蛋白包括dr3fc融合蛋白、dr3的细胞外区域fc融合蛋白、crd结构域fc融合蛋白、dr3组氨酸标签(缩写为his标签)融合蛋白、dr3flag融合蛋白等。在任何情况下,任何dr3、dr3变体及其片段都可融合于fc、his标签、flag标签、谷胱甘肽-s转移酶(gst)标签等,并且可以被产生。
用于产生dr3的方法包括在宿主细胞中进行细胞内表达的方法、从宿主细胞进行细胞外分泌的方法、在宿主细胞膜外部包膜上产生的方法等。可通过改变所用宿主细胞和产生的dr3的结构来选择适当方法。
当在宿主细胞中或在宿主细胞膜外部包膜上产生dr3时,可根据paulson等[j.biol.chem.,264,17619(1989)]的方法、lowe等[proc.natl.acad.sci.usa,86,8227(1989);genesdevelop.,4,1288(1990)]的方法、日本公开未审查专利申请号336963/93和wo94/23021中所述的方法等使dr3确定地分泌在细胞外。此外,可根据日本公开未审查专利申请号227075/90中所述的方法,利用使用二氢叶酸还原酶(dhfr)基因的基因扩增系统来提高dr3的产生量。
可例如如下分离和纯化所得dr3。当dr3以溶解状态在细胞内表达时,通过离心来回收培养之后的细胞,将所述细胞悬浮于水性缓冲液中,接着使用超声发生器、french压碎器、mantongaulin匀浆器、珠磨机(dynomill)等破坏以获得无细胞提取物。离心无细胞提取物以获得上清液,并且可通过使所述上清液经受可单独或组合使用的一般性酶分离和纯化技术来获得纯化的制备物,所述技术诸如溶剂提取;用硫酸铵等盐析;脱盐;用有机溶剂沉淀;使用树脂诸如二乙基氨基乙基(deae)-琼脂糖、diaionhpa-75(由mitsubishichemical制造)进行的阴离子交换色谱法;使用树脂诸如s-琼脂糖ff(由pharmacia制造)进行的阳离子交换色谱法;使用树脂诸如丁基-琼脂糖或苯基-琼脂糖进行的疏水性色谱法;使用分子筛进行的凝胶过滤;亲和色谱法;色谱聚焦;诸如等电聚焦的电泳等。
当dr3通过形成包涵体而在细胞内表达时,以相同方式回收、破坏和离心细胞,并且回收作为沉淀级分的dr3包涵体。将回收的蛋白质包涵体用蛋白质变性剂溶解。通过对溶解的溶液进行稀释或透析来使蛋白质成为正常三维结构,接着通过与上述相同的分离纯化方法来获得纯化的dr3制备物。
当dr3、它的变体或其片段诸如糖基化产物被分泌在细胞外时,可从培养上清液回收dr3或衍生物诸如糖基化产物。也就是说,通过诸如离心的方法以与上述相同的方式处理培养物以获得培养上清液,可通过与上述相同的分离纯化方法从所述培养上清液获得纯化的dr3制备物。
此外,本发明中使用的dr3可通过化学合成方法诸如fmoc方法或tboc方法来产生。此外,它可使用由advancedchemtech、perkin-elmer、pharmacia、proteintechnologyinstrument、synthecell-vega、perseptive、shimadzucorporation等制造的肽合成仪来化学合成。
(2)动物的免疫接种和供融合的抗体产生性细胞的制备
将3至20周龄的小鼠、大鼠或仓鼠用上面(1)中制备的抗原免疫接种,从动物的脾、淋巴结或外周血收集抗体产生性细胞。此外,当认定以上动物中的足够滴度的增加归因于低免疫原性时,dr3敲除小鼠可用作待免疫接种的动物。
通过皮下、静脉内、腹膜内或淋巴结节内注射,连同适当佐剂(例如完全弗氏佐剂(completefreund'sadjuvant)、氢氧化铝凝胶与百日咳疫苗的组合等)一起将抗原施用至动物中来进行免疫接种。当抗原是部分肽时,产生与载体蛋白诸如bsa(牛血清白蛋白)、klh(钥孔虫戚血蓝蛋白)等的结合物,其用作抗原。
在首次施用之后,每一周或每两周进行5至10次抗原施用。在各次施用之后的第3至第7天,从眼底或尾部静脉收集血液样品,例如通过酶免疫测定[《抗体实验手册》(antibodies-alaboratorymanual),coldspringharborlaboratory(1988)]等来测试血清与抗原的反应性。在其血清中显示出针对用于免疫接种的抗原的足够抗体滴度的动物被用作供融合的抗体产生性细胞的供应源。
在末次施用抗原之后3至7天,切除来自免疫接种的动物的含有抗体产生性细胞的组织诸如脾或淋巴结节以收集抗体产生性细胞。当使用脾细胞/淋巴结节细胞时,切除组织并将其打散,随后离心。接着,通过移除红细胞来获得供融合的抗体产生性细胞。
(3)骨髓瘤细胞的制备
从小鼠获得的已建立的细胞系被用作骨髓瘤细胞。实例包括8氮杂鸟嘌呤抗性小鼠(源于balb/c)骨髓瘤细胞系p3-x63ag8-u1(p3-u1)[currenttopicsinmicrobiologyandimmunology,18,1(1978)]、p3-ns1/1-ag41(ns-1)[europeanj.immunology,6,511(1976)]、sp2/0-ag14(sp-2)[nature,276,269(1978)]、p3-x63-ag8653(653)[j.immunology,123,1548(1979)]、p3-x63-ag8(x63)[nature,256,495(1975)]等。
在适当培养基中对这些细胞系进行传代培养,所述培养基诸如8-氮杂鸟嘌呤培养基[通过向补充有谷氨酰胺、2-巯基乙醇、庆大霉素和胎牛血清(在下文中称为“fcs”)的rpmi-1640培养基添加8-氮杂鸟嘌呤获得的培养基]、伊斯科夫氏改良杜贝卡氏培养基(在下文中称为“imdm”)或杜贝卡氏改良依格培养基(在下文中称为“dmem”)。在细胞融合之前将细胞在正常培养基(例如含有10%fcs的dmem)中传代培养3-4天以保证细胞在融合当天处于2×107或更多的数目下。
(4)细胞融合和用于产生单克隆抗体的杂交瘤的制备
将通过上面(2)获得的供融合的抗体产生性细胞和通过上面(3)获得的骨髓瘤细胞用最低必需培养基(mem)或pbs(1.83g磷酸氢二钠、0.21g磷酸二氢钾、7.65g氯化钠、1升蒸馏水,ph7.2)充分洗涤并混合以产生抗体产生性细胞:骨髓瘤细胞的比率=5至10:1,随后离心。接着,丢弃上清液。将沉淀的细胞群充分打散。在将沉淀的细胞打散之后,在37℃下在搅拌下向细胞添加聚乙二醇-1000(peg-1000)、mem和二甲亚砜的混合物。此外,每一或两分钟添加1至2mlmem培养基数次,并且添加mem以产生50ml的总量。在离心之后,丢弃上清液。在将细胞温和打散之后,将细胞温和悬浮于hat培养基[其中向正常培养基添加次黄嘌呤、胸苷和氨基蝶呤后得到的培养基]中。在5%co2培养箱中在37℃下培养悬浮液7至14天。
当上述骨髓瘤细胞是8-氮杂鸟嘌呤抗性细胞系,即次黄嘌呤/鸟嘌呤/磷酸核糖基转移酶(hgprt)缺陷细胞系时,未融合的骨髓瘤细胞和骨髓瘤细胞自身的融合细胞不能在含有hat的培养基中存活。在另一方面,抗体产生性细胞彼此的融合细胞以及抗体产生性细胞与骨髓瘤细胞的杂交瘤可存活,但抗体产生性细胞的融合细胞的寿命有限。因此,如果在含有hat的培养基中连续培养这些细胞,那么仅抗体产生性细胞与骨髓瘤细胞的杂交瘤可存活,并且因此,有可能选择杂交瘤。
用通过从hat培养基移除氨基蝶呤获得的培养基(在下文中称为“ht培养基”)替换以集落形状生长的杂交瘤的培养基。此后,收集一部分上清液,接着可使用后面描述的抗体滴度测量方法选择抗体产生性杂交瘤。
测量抗体滴度的方法的实例包括各种已知技术,诸如放射免疫测定法(在下文中称为“ria”)、酶联免疫吸附测定法(在下文中称为“elisa”)、荧光抗体方法诸如流式细胞计量术、和被动血凝。在这些技术之中,鉴于检测灵敏度、快速性、准确度、操作自动化的可能性等,ria或elisa是优选的。
将通过抗体滴度测量而确认产生特定抗体的杂交瘤转移至另一板中并克隆。克隆方法的实例包括有限稀释方法,其中通过稀释使得所述板的每个孔中含有一个杂交瘤来培养杂交瘤;软琼脂方法,其中在软琼脂培养基中培养杂交瘤以回收集落;通过使用显微操纵器逐一取出细胞并培养所述细胞的方法;和其中通过细胞分选器来分离单一细胞的“分选器克隆”等。有限稀释方法由于它的简单性而被广泛使用。
例如通过对其中抗体滴度得以确认的各孔进行有限稀释来重复克隆2至4次,并且其中抗体滴度得以稳定确认的杂交瘤被选作抗人dr3单克隆抗体产生性杂交瘤株系。
(5)纯化的单克隆抗体的制备
通过腹膜内注射将通过上面(4)获得的产生单克隆抗体的杂交瘤细胞施用至用0.5ml鲨肝油烷(pristane)处理的8至10周龄小鼠或裸鼠(腹膜内施用2,6,10,14-四甲基十五烷(鲨肝油烷),随后饲养2周)中。杂交瘤在10至21天内产生腹水肿瘤。从小鼠收集腹水,离心以移除固体,用40至50%硫酸铵进行盐析,接着通过辛酸进行沉淀,穿过deae-琼脂糖柱、蛋白a柱或凝胶过滤柱以收集作为纯化的单克隆抗体的igg或igm级分。
此外,在含有fbs等的rpmi1640培养基中培养通过上面(4)获得的单克隆抗体产生性杂交瘤,并且通过离心来移除上清液。将沉淀的细胞悬浮于含有5%digogf21的杂交瘤sfm培养基中,并且培养3至7天。可通过将获得的细胞悬浮液离心,随后用蛋白a柱或蛋白g柱纯化所得上清液以收集igg级分来获得纯化的单克隆抗体。
可使用子类分型试剂盒,通过酶免疫测定法来确定抗体的子类。可通过lowry方法或从280nm下的吸光度[1.4(od280)=1mg/ml免疫球蛋白]测定蛋白质的量。
(6)单克隆抗体的选择
可通过结合测定系统诸如ouchterlony方法、elisa、ria、流式细胞计量术(fcm)或表面等离子体共振(spr)方法来确认本发明的抗dr3单克隆抗体的结合活性。尽管简单,但ouchterlony方法在抗体浓度较低时需要浓缩操作。
当使用elisa或ria时,使培养上清液照原样与吸附有抗原的固相结合,并且对应于各种免疫球蛋白同种型和子类的抗体被用作第二抗体,由此可鉴定抗体的同种型和子类。
使纯化或部分纯化的重组人dr3吸附于用于elisa的96孔板等的固相表面上,并且将其上未吸附有抗原的固相表面用与抗原无关的蛋白质诸如牛血清白蛋白(在下文中描述为“bsa”)封闭。
将elisa板用含有0.05%吐温20(tween20)的磷酸盐缓冲盐水(在下文中描述为“pbs”)(在下文中缩写成吐温-pbs)等洗涤,接着与连续稀释的第一抗体(例如小鼠血清、培养上清液等)结合,由此使抗体与固定在板上的抗原结合。
此后,作为第二抗体,被生物素、酶(辣根过氧化物酶;hrp、碱性磷酸酶;alp等)、化学发光物质、放射性化合物等标记的抗免疫球蛋白抗体被分配至板中,由此使第二抗体与已结合于板的第一抗体反应。在用吐温-pbs充分洗涤板之后,进行由第二抗体的标记物质引起的反应,由此选择与免疫原特异性结合的单克隆抗体。
可通过fcm测量靶抗体对于抗原表达性细胞的结合活性[cancerimmunol.immunother.,36,373(1993)]。如果靶抗体结合于细胞膜上表达的膜蛋白,那么这可被提及为所述靶抗体是识别天然存在的抗原的三维结构的抗体。
spr的实例包括使用
可通过向上述结合测定系统添加主题抗体并使抗体结合来获得与本发明的抗dr3抗体竞争结合dr3的抗体。也就是说,通过筛选在添加主题抗体时其结合活性受抑制的抗体,有可能获得与获得的抗体竞争结合dr3的细胞外结构域的抗体。
(7)鉴定抗dr3单克隆抗体的表位
在本发明中,可按以下方式鉴定抗体的识别表位。例如,制备部分缺陷抗原、通过使用不同异质氨基酸残基进行氨基酸取代获得的氨基酸取代的抗原、或通过修饰结构域获得的修饰的抗原,并且当靶抗体对于缺陷抗原或氨基酸取代的抗原的反应性降低时,这明确表明缺陷位点和氨基酸取代的位点是被靶抗体识别的表位。部分缺陷抗原或氨基酸取代的抗原可以以从适当宿主细胞(大肠杆菌、酵母、植物细胞、诸如中国仓鼠卵巢细胞的哺乳动物细胞等)分泌的蛋白质形式获得。也有可能通过在宿主细胞表面上表达抗原来制备抗原表达性细胞。在膜型抗原的情况下,优选的是在宿主细胞表面上表达抗原以便表达抗原,同时保留抗原的构象结构(似乎是天然存在的构象)。也有可能通过制备模拟抗原的一级结构或三维结构的合成肽来确认靶抗体的反应性。制备合成肽的方法的实例包括通过使用已知的肽合成技术来制备具有各种分子的部分肽的方法。
关于本发明的抗dr3抗体,制备通过组合人dr3和小鼠dr3的细胞外结构域的相应plad结构域、crd结构域1至4获得的嵌合蛋白以便确认靶抗体的反应性,由此可鉴定抗体的表位。例如,使由来自小鼠dr3的crd1和来自人dr3的crd2至4组成的嵌合dr3蛋白在cho细胞上表达,并且嵌合dr3可以以可溶性fc融合蛋白形式产生。如果测试的抗体可结合人dr3蛋白/表达人dr3的细胞,但抗体不能结合crd1嵌合dr3蛋白/表达crd1嵌合dr3的细胞,那么发现所述抗体具有包含dr3的细胞外区域的crd1中存在的至少一个氨基酸残基的表位,并且所述氨基酸残基是在人crd1与小鼠crd1之间不同的氨基酸残基。
此后,通过使用本领域技术人员已知的寡肽合成技术来更详细地合成相应部分的各种寡肽、肽突变体等,并且确认靶抗体对肽的反应性以鉴定表位。作为一种获得各种寡肽的简单方法,有可能使用可商购获得的试剂盒[例如spots试剂盒(由genosysbiotechnologies制造)、使用多针合成方法的一系列多针/肽合成试剂盒(由chiron制造)等]。
可通过以下方式来获得结合于与本发明的结合dr3的细胞外结构域的抗体所识别的表位相同的表位的抗体:鉴定在上述结合测定系统中获得的抗体的表位;制备鉴定的表位的部分合成肽、具有模拟所述表位的三维结构的三维结构的合成肽、重组蛋白等;以及进行免疫接种。
例如,在膜蛋白的情况下,制备整个细胞外结构域或一部分细胞外结构域融合于适当标签(flag标签、his标签、gst蛋白、抗体的fc区等)的重组蛋白,用所述重组蛋白进行免疫接种,由此可更高效地制备表位特异性抗体。
2.重组抗体的制备
作为重组抗体的产生实例,下面示出了用于产生人嵌合抗体和人源化抗体的方法。
(1)用于表达重组抗体的载体的构建
用于表达重组抗体的载体是其中已插入编码人抗体的ch和cl/h和l链的dna的用于动物细胞的表达载体,并且通过将编码人抗体的ch和cl/h和l链的各dna克隆至用于动物细胞的表达载体中来构建。
人抗体的c区可为任何人抗体的ch和cl。实例包括属于γ1、γ2或γ4子类的ch、属于κ类别的cl等。作为编码人抗体的ch和cl的dna,通常可使用cdna,并且也可使用包含外显子和内含子的染色体dna。作为用于动物细胞的表达载体,可使用任何表达载体,只要编码人抗体的c区的基因可被插入其中并在其中表达即可。实例包括page107[cytotechnol.,3,133(1990)]、page103[j.biochem.,101,1307(1987)]、phsg274[gene,27,223(1984)]、pkcr[proc.natl.acad.sci.usa,78,1527(1981)]、psg1bd2-4[cytotechnol.,4,173(1990)]、pse1uk1sed1-3[cytotechnol.,13,79(1993)]等。用于动物细胞的表达载体的启动子和增强子的实例包括sv40早期启动子[j.biochem.,101,1307(1987)]、莫洛尼小鼠白血病病毒ltr[biochem.biophys.res.commun.,149,960(1987)]、免疫球蛋白h链启动子[cell,41,479(1985)]和增强子[cell,33,717(1983)]等。
用于表达重组抗体的载体可为以下中的任一个:其中编码抗体h链的基因和编码抗体l链的基因存在于分开的载体上的类型(分开类型)或其中两个基因存在于同一载体上的类型(串联类型)。用于表达重组抗体的串联类型的载体的实例包括pkantex93(wo97/10354)、pee18[hybridoma,17,559(1998)]、tol2转座子载体(wo2010/143698、wo2013/005649)等。此外,这些载体可用于通过将编码h或l链的各基因逐一插入载体中来分开表达h和l链。
(2)编码源于非人动物的抗体的v区的cdna的获得和氨基酸序列的分析
如下进行编码非人动物抗体的vh和vl的cdna的获得和氨基酸序列的分析。
从产生源于非人动物的抗体的杂交瘤细胞提取mrna以合成cdna。将合成的cdna克隆至载体诸如噬菌体或质粒中以制备cdna文库。使用编码小鼠抗体的c区或v区的一部分的dna作为探针,从文库分离含有编码vh或vl的cdna的各重组噬菌体或重组质粒。测定重组噬菌体或重组质粒上源于目标非人动物的小鼠抗体的vh和vl的全长核苷酸序列,并且分别从核苷酸序列推导vh和vl的全长氨基酸序列。
用于制备产生非人抗体的杂交瘤细胞的非人动物的实例包括小鼠、大鼠、仓鼠、兔等。可使用任何动物,只要可从中产生杂交瘤细胞即可。
用于从杂交瘤细胞制备总rna的方法的实例包括硫氰酸胍-三氟乙酸铯方法[methodsinenzymol.,154,3(1987)]、使用试剂盒诸如rnaeasy试剂盒(由qiagen制造)等。
用于从总rna制备mrna的方法的实例包括寡(dt)固定的纤维素柱方法[《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlaboratorypress(1989)]、使试剂盒用诸如oligo-dt30<super>mrna纯化试剂盒(由takarabio制造)的方法等。此外,用于从杂交瘤细胞制备mrna的试剂盒的实例包括fasttrackmrna分离试剂盒(由invitrogen制造)、quickprepmrna纯化试剂盒(由pharmacia制造)等。
用于合成cdna以及制备cdna文库的方法的实例包括已知方法[《分子克隆实验指南》(molecularcloning,alaboratorymanual),coldspringharborlab.press(1989);《现代分子生物学实验方法》(currentprotocolsinmolecularbiology),补编1,johnwiley&sons(1987-1997)];使用试剂盒诸如用于cdna合成和质粒克隆的superscript质粒系统(由gibcobrl制造)、zap-cdna试剂盒(由stratagene制造)等的方法;等等。
其中已插入使用从杂交瘤细胞提取的mrna作为模板合成的cdna以制备cdna文库的载体可为任何载体,只要cdna可被插入即可。实例包括zapexpress[strategies,5,58(1992)]、pbluescriptiisk(+)[nucleicacidsresearch,17,9494(1989)]、λzapii(由stratagene制造)、λgt10和λgt11[dna克隆实用方法(dnacloning:apracticalapproach),i,49(1985)]、lambdabluemid(由clontech制造)、λexcell和pt7t318u(由pharmacia制造)、pcd2[mol.cell.biol.,3,280(1983)]、puc18[gene,33,103(1985)]等。
可使用用于引入通过噬菌体或质粒载体构建的cdna文库的任何大肠杆菌,只要cdna文库可被引入、表达和维持即可。实例包括xl1-bluemrf'[strategies,5,81(1992)]、c600[genetics,39,440(1954)]、y1088和y1090[science,222:778(1983)]、nm522[j.mol.biol.,166,1(1983)]、k802[j.mol.biol.,16,118(1966)]、jm105[gene,38,275(1985)]等。
使用同位素或荧光标记的探针的菌落杂交或噬菌斑杂交方法可用于从cdna文库选择编码非人抗体的vh和vl等的cdna克隆[《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlaboratorypress(1989)]。
此外,可通过制备引物以及使用从mrna或cdna文库制备的cdna作为模板,通过聚合酶链反应(在下文中称为“pcr”;《分子克隆实验指南》(molecularcloning,alaboratorymanual),第2版,coldspringharborlaboratorypress(1989);《现代分子生物学实验方法》(currentprotocolsinmolecularbiology),补编1,johnwiley&sons(1987-1997))制备编码vh和vl的cdna。
可通过以下方式来测定cdna的核苷酸序列:用适当限制酶等消化所选cdna,将片段克隆至质粒诸如pbluescriptsk(-)(由stratagene制造)中,通过通常使用的核苷酸分析方法进行反应。例如,在诸如双脱氧方法[proc.natl.acad.sci.usa,74,5463(1977)]的反应之后,通过使用自动核苷酸序列分析器诸如abiprism3700(由pebiosystems制造)和a.l.f.dna测序仪(由pharmacia制造)进行核苷酸分析。
可通过以下方式确认获得的cdna是否编码抗体的vh和vl的含有分泌信号序列的完整氨基酸序列:从测定的核苷酸序列估计vh和vl的全长氨基酸序列,以及将它们与已知抗体的vh和vl的全长氨基酸序列进行比较[免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991)]。可通过将抗体的vh和vl的包含分泌信号序列的全长氨基酸序列与已知抗体的vh和vl的全长氨基酸序列进行比较来推导分泌信号序列和n末端氨基酸序列的长度[免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991)],并且也可获悉它们所属的子组。此外,可通过将获得的氨基酸序列与已知抗体的vh和vl的氨基酸序列进行比较来发现vh和vl的各cdr的氨基酸序列[免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991)]。
此外,可通过使用获得的vh和vl的全长氨基酸序列,例如根据blast方法[j.mol.biol.,215,403(1990)]等,与任何数据库例如swiss-prot、pir-protein等中的序列的进行同源性检索来考查vh和vl的全长氨基酸序列的新颖性。
(3)用于表达人嵌合抗体的载体的构建
将编码非人动物的抗体的各vh和vl的cdna克隆在上面(1)中提及的用于表达重组抗体的载体的编码人抗体的ch或cl的基因的上游,由此构建用于表达人嵌合抗体的载体。
例如,为连接包含非人动物的抗体的vh或vl的3'末端的核苷酸序列的cdna和人抗体的ch或cl的5'末端的核苷酸序列,制备编码非人动物的抗体的vh和vl的各cdna,以便编码由连接部分的核苷酸序列编码的适当氨基酸,并且被设计成具有限制酶的适当识别序列。分别克隆获得的编码抗体的vh和vl的cdna以使它们各自以适当形式在上面(1)中提及的用于表达人源化抗体的载体的编码人抗体的ch或cl的基因的上游表达以构建用于表达人嵌合抗体的载体。
此外,使用在两端具有适当限制酶的识别序列的合成dna,通过pcr来扩增编码非人动物抗体的vh或vl的cdna,并且将它们各自克隆至上面(1)中获得的用于表达重组抗体的载体中。此外,合成或通过pcr扩增编码重组抗体的h链或l链的cdna,并且将各cdna克隆至上面(1)中获得的用于表达重组抗体的载体中。
(4)编码人源化抗体的v区的cdna的构建
可如下获得编码人源化抗体的vh或vl的cdna。分别选择人抗体的vh或vl中的框架区(在下文中称为“fr”)的氨基酸序列,源于非人动物抗体的抗体的vh或vl中的cdr的氨基酸序列被移植至所述框架区。可使用人抗体的fr的任何氨基酸序列,只要它们源于人即可。实例包括数据库诸如蛋白质数据库(proteindatabank)等中登记的人抗体的fr的氨基酸序列,以及为人抗体的fr的子组所共有的氨基酸序列[免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991)]等。为抑制抗体的结合活性减小,选择与原始抗体的vh或vl中的fr的氨基酸序列具有高同源性(至少60%或更大)的氨基酸序列。
接着,将原始抗体的cdr的氨基酸序列分别移植至人抗体的vh或vl中的fr的所选氨基酸序列,以设计人源化抗体的vh或vl的各氨基酸序列。通过考虑抗体的基因的核苷酸序列中所见的密码子使用频率,将设计的氨基酸序列转换成dna序列[kabat等,免疫用途的蛋白质的序列(sequenceofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991)],并且设计编码人源化抗体的vh或vl的氨基酸序列的dna序列。基于设计的核苷酸序列,合成vh和vl的cdna,通过将适当限制酶的识别序列引入至合成dna的存在于两端上的5'末端,可容易地将编码人源化抗体的vh或vl的cdna克隆至(1)中构建的用于表达人源化抗体的载体中。另外,这可基于设计的dna序列,使用合成dna作为编码全长h链和全长l链中的每一种的单一dna来进行。
(5)人源化抗体的v区的氨基酸序列的修饰
已知当只是通过仅仅将源于非人动物的抗体的vh和vl中的cdr移植至人抗体的vh和vl的fr中来产生人源化抗体时,它的抗原结合活性低于源于非人动物的原始抗体的抗原结合活性[bio/technology,9,266(1991)]。在人源化抗体中,在人抗体的vh和vl中的fr的氨基酸序列之中,鉴定直接涉及与抗原的结合的氨基酸残基、与cdr中的氨基酸残基相互作用的氨基酸残基、和维持抗体的三维结构并间接涉及与抗原的结合的氨基酸残基,并且将它们改变成亲本抗体(原始抗体)中存在的氨基酸残基以由此使减小的抗原结合活性增加。
为鉴定fr中与抗原结合活性相关的氨基酸残基,构建抗体的三维结构,并且通过x射线晶体分析法[j.mol.biol.,112,535(1977)]、计算机建模[proteinengineering,7,1501(1994)]等来分析。此外,各种尝试在目前来说必须是必要的,例如产生各抗体的若干修饰的抗体,并且考查各修饰的抗体与它的抗体结合活性之间的关联性。可使用如(4)中所述的用于根据pcr进行修饰的各种合成dna来实现对人抗体的vh和vl中的fr的氨基酸序列的修饰。关于通过pcr获得的扩增产物,根据如(2)中所述的方法测定核苷酸序列以便确认是否已进行目标修饰。
(6)用于表达人源化抗体的载体的构建
可通过将编码构建的重组抗体的vh或vl的各cdna克隆至如(1)中所述的用于表达重组抗体的载体中的编码人抗体的ch或cl的各基因的上游来构建用于表达人源化抗体的载体。此外,它也通过将编码人源化抗体的h链和l链的cdna克隆至适当载体中来构建。例如,当将适当限制酶的识别序列引入至(4)和(5)中的用于构建人源化抗体的vh或vl的合成dna之中位于两端的合成dna的5'末端时,可进行克隆以使它们以适当形式在如(1)中所述的用于表达人源化抗体的载体中的编码人抗体的ch或cl的各基因的上游表达。
(7)重组抗体的瞬时表达
为高效评估产生的各种人源化抗体的抗原结合活性,可使用如(3)和(6)中所述的用于表达人源化抗体的载体或其修饰的表达载体瞬时表达重组抗体。任何细胞都可用作宿主细胞,只要所述宿主细胞可表达重组抗体即可。通常,cos-7细胞(atcccrl1651)、cho-k1(atccccl-61)、cho-s(lifetechnologies,目录号11619)由于具有高表达量而被使用[methodsinnucleicacidsres.,crcpress,283(1991)]。在引入表达载体之后,可通过elisa、ria、fcm等来测定培养上清液中重组抗体的表达量和抗原结合活性。
(8)获得稳定表达重组抗体的转化体以及重组抗体的制备
可通过将(3)和(6)中所述的用于表达重组抗体的载体引入适当宿主细胞中来获得稳定表达重组抗体的转化体。用于将表达载体引入宿主细胞中的方法的实例包括电穿孔[日本公开未审查专利申请号257891/90;cytotechnology,3,133(1990)]等。作为其中已引入用于表达重组抗体的载体的宿主细胞,可使用任何细胞,只要它是可产生重组抗体的宿主细胞即可。实例包括cho-k1(atccccl-61)、dukxb11(atccccl-9096)、pro-5(atccccl-1781)、cho-s(lifetechnologies,目录号11619)、大鼠骨髓瘤细胞yb2/3hl.p2.g11.16ag.20(也被称为yb2/0)、小鼠骨髓瘤细胞nso、小鼠骨髓瘤细胞sp2/0-ag14(atcc编号crl1581)、小鼠p3x63-ag8.653细胞(atcc编号crl1580)、其中二氢叶酸还原酶基因(在下文中称为“dhfr”)是缺陷型的cho细胞[proc.natl.acad.sci.u.s.a.,77,4216(1980)]、凝集素抗性获得性lec13[somaticcellandmoleculargenetics,12,55(1986)]、其中α1,6-海藻糖基转移酶基因是缺陷的cho细胞(wo02/31140、wo2005/35586)、大鼠yb2/3hl.p2.g11.16ag.20细胞(atcc编号crl1662)等。
其特定实例可包括per.c6、cho-k1(atccccl-61)、dukxb11(atccccl-9096)、pro-5(atccccl-1781)、cho-s(lifetechnologies,目录号11619)、lec13细胞、大鼠骨髓瘤细胞yb2/3hl.p2.g11.16ag.20(atcc编号crl1662,或也称为yb2/0)、小鼠骨髓瘤细胞ns0、小鼠骨髓瘤细胞sp2/0-ag14(atcc编号crl1581)、小鼠p3x63-ag8.653细胞(atcc编号crl1580)、二氢叶酸还原酶基因(在下文中称为dhfr)缺陷型cho细胞(cho/dg44)[proc.natl.acad.sci.usa,77,4216(1980)]、叙利亚仓鼠细胞bhk、hbt563细胞、以上细胞系的亚株系和通过使以上细胞系适应于无血清培养基或非粘附培养条件而制备的细胞等。
此外,也可使用其中诸如与细胞内糖核苷酸gdp-海藻糖的合成相关的酶的蛋白质、诸如与其中在复合型n-糖苷连接的糖链中海藻糖的1位通过α键结合于还原端中的n-乙酰基葡萄糖胺的6位的糖链的修饰相关的酶的蛋白质、或与细胞内糖核苷酸gdp-海藻糖转运至高尔基体(golgibody)相关的蛋白质的活性减小或缺失的宿主细胞,优选是如wo05/35586、wo02/31140等中所述的其中α1,6-海藻糖基转移酶基因缺陷的cho细胞。
在引入表达载体之后,通过在含有试剂诸如g418硫酸盐(在下文中称为“g418”)、环己酰亚胺(在下文中称为chx)等的用于动物细胞培养的培养基中培养来选择稳定表达重组抗体的转化体。
用于动物细胞培养的培养基的实例包括rpmi1640培养基(由invitrogen制造)、git培养基(由nihonpharmaceutical制造)、ex-cell301培养基、ex-302培养基、ex-325pf(由jrh制造)、imdm培养基(由invitrogen制造)、杂交瘤-sfm培养基(由invitrogen制造)、通过向这些培养基添加各种添加剂诸如胎牛血清(在下文中称为“fcs”)至获得的培养基等。可通过在培养基中培养所选转化体来使重组抗体产生和积累在培养上清液中。可通过elisa等测量培养上清液中重组抗体的表达量和抗原结合活性。此外,在转化体中,可根据日本公开未审查专利申请号257891/90中公开的方法,通过使用dhfr扩增系统等来增加重组抗体的表达量。
可通过使用蛋白a柱从转化体的培养上清液纯化重组抗体[《单克隆抗体:原理与实践》(monoclonalantibodies-principlesandpractice),第3版,academicpress(1996);《抗体实验手册》(antibodies-alaboratorymanual),coldspringharborlaboratory(1988)]。例如,可通过凝胶过滤、离子交换色谱法、超滤、蛋白g柱等的组合来纯化重组抗体。通过聚丙烯酰胺凝胶电泳(在下文中称为“sds-page”)[nature,227,680(1970)]、western印迹[《单克隆抗体:原理与实践》(monoclonalantibodies-principlesandpractice),第3版,academicpress(1996);《抗体实验手册》(antibodies-alaboratorymanual),coldspringharborlaboratory(1988)]等来测定纯化的重组抗体的h链或l链或整个抗体分子的分子量。
3.纯化的单克隆抗体或其抗体片段的活性的评估
可按以下方式评估本发明的纯化的单克隆抗体或其抗体片段的活性。可使用以上章节1(6)和(7)中所述的结合测定系统来测量针对dr3表达性细胞系的结合活性。可通过已知测量方法[cancerimmunol.immunother.,36,373(1993)]测量针对抗原阳性细胞系的cdc活性或adcc活性。
可按以下方式测量由本发明的抗体实现的特异性配体tl1a依赖性磷酸化、dr3或nf-κb信号活化和tl1a中和活性。在如rpmi1640(无fcs)的典型培养基中对dr3表达性细胞或人外周血单核细胞(pbmc)进行传代培养,并使其稳定化以进行dr3和nf-κb磷酸化测定。将细胞与数ng/ml至μg/ml的tl1a一起在存在或不存在抗dr3抗体下在37℃下在数十分钟之中孵育,接着将细胞裂解或进行可渗透化处理。在那之后,通过针对磷酸化dr3和nf-κb的western印迹来分析细胞的dr3和/或nf-κb的磷酸化水平。随后制备细胞的提取物,并且使用抗dr3特异性抗体、抗nf-κb特异性抗体和管家基因(肌动蛋白(actin)等)特异性抗体对相应蛋白质进行免疫沉淀。使沉淀的蛋白质经受使用sds-page进行的电泳,随后经受通过使用dr3特异性抗体和磷酸化酪氨酸特异性抗体进行的western印迹,由此有可能测量针对dr3的磷酸化的抑制活性。
或者,使已向其中添加抗体的培养的细胞经受通过使用甲醛和皂素进行的蛋白质固定化和细胞膜渗透化处理,并且使用dr3特异性抗体、磷酸化nf-kb特异性抗体或磷酸化酪氨酸特异性抗体进行fcm分析。也可以这个方式确认dr3的磷酸化。此外,关于dr3的三聚化,以与上述用于检测磷酸化的测试中相同的方式进行培养以及细胞裂解物的制备,接着使用抗dr3抗体对dr3蛋白进行免疫沉淀以便检测沉淀的蛋白质,由此有可能检测dr3的三聚化。
此外,也以相同方式分析tl1a依赖性t细胞增殖、炎性细胞因子如il-13、gm-csf和ifn-γ等的释放。
4.使用本发明的抗dr3单克隆抗体或抗体片段治疗疾病的方法
本发明的特异性识别dr3的天然构象结构(三维结构),并且结合细胞外区域的抗体或其抗体片段可用于治疗与dr3相关的疾病。
在一个实施方式中,本发明的抗体或抗体组合物可用于治疗、改善或预防本文所述的疾病、病症或症状。在优选实施方式中,本发明的抗体结合dr3的细胞外结构域,中和dr3的活性,并且不通过自身结合来活化dr3,用于治疗、预防或改善炎性疾病、自体免疫疾病、癌病以及与它们的疾病相关的症状。
在优选实施方式中,本发明的结合dr3的细胞外区域的抗体、其抗体变体或片段可用于治疗炎性疾病,包括克罗恩氏病(cd)、溃疡性结肠炎(uc)、炎性肠病(ibd)、过敏、急性或慢性反应性气道疾病、过敏性鼻炎、过敏性皮炎、特应性疾病、特应性哮喘、特应性皮炎、支气管哮喘、嗜酸性粒细胞侵袭性哮喘、慢性阻塞性肺病(copd)、关节炎、类风湿性关节炎、全身性红斑狼疮(sle)、银屑病、动脉粥样硬化、骨质疏松、多发性硬化症(ms)、癌症骨转移、血液癌症、实体癌症,诸如头颈部癌、脑癌、肺癌、食道癌、胃肠癌、胃癌、肠癌、结肠直肠癌、乳腺癌、卵巢癌、前列腺癌、子宫癌、泌尿器官癌、肝癌、胆囊癌、骨癌和癌转移。
可通过本发明的抗体或抗体组合物治疗的自体免疫疾病包括至少一种选自以下的疾病:多发性硬化症、类风湿性关节炎(ra)、自体免疫溶血性贫血、自体免疫新生儿血小板减少症、特发性血小板减少性紫癜(itp)、自体免疫血细胞减少症、溶血性贫血、抗磷脂综合征、皮炎、过敏性脑脊髓炎、心肌炎、复发性多软骨炎、风湿性心脏病、神经炎、葡萄膜炎眼炎、多内分泌病变、紫癜(例如亨诺克-舍恩莱因紫癜(henloch-scoenleinpurpura))、莱特尔氏病(reiter'sdisease)、僵人综合征(stiff-mansyndrome)、自体免疫性肺部炎症、自闭症、格林-巴利综合征(guillain-barresyndrome)、胰岛素依赖性糖尿病(iddm)和自体免疫炎性眼病症、自体免疫甲状腺炎、甲状腺功能不足(即桥本氏甲状腺炎(hashimoto'sthyroiditis))、全身性红斑狼疮(sle)、古德帕斯彻氏综合征(goodpasture'ssyndrome)、天疱疮、受体自体免疫性(诸如像(a)格雷福斯病(graves'disease)、(b)重症肌无力和(c)胰岛素抗性)、自身免疫血小板减少性紫癜、类风湿性关节炎、伴有抗胶原蛋白抗体的硬皮病、混合结缔组织疾病、多发性肌炎/皮肤肌炎、恶性贫血、特发性阿狄森氏病(idiopathicaddison'sdisease)、不育症、慢性肾衰竭(crf)、肾小球肾炎(gn)、肾病、iga肾病变、大疱性类天疱疮、休格连氏综合征(sjogren'ssyndrome)、肾上腺素能药物抗性(哮喘或囊性纤维化)、慢性活动性肝炎、原发性胆汁性肝硬化、其它内分泌腺衰竭、白癜风、血管炎、mi后疾病、心切开术综合征、荨麻疹、特应性皮炎、炎性肌病变和其它炎、肉芽肿性、退行性和萎缩性疾病。此外,与以上鉴定的疾病相关的任何并发症也都被包括在本发明的药物可治疗的症状中。
施用途径的实例包括口服施用和胃肠外施用,诸如经颊、经气管、经直肠、皮下、肌内或静脉内施用。在抗体或肽制剂的情况下,静脉内施用是优选的。剂型的实例包括喷雾剂、胶囊、片剂、粉剂、颗粒剂、糖浆、乳液、栓剂、注射液、软膏剂、胶带剂等。
适于口服施用的药物制剂包括乳液、糖浆、胶囊、片剂、粉剂、颗粒剂等。可使用以下各物作为添加剂来产生诸如乳液和糖浆的液体制剂:水;糖,诸如蔗糖、山梨糖醇和果糖;二醇,诸如聚乙二醇和丙二醇;油,诸如芝麻油、橄榄油和大豆油;防腐剂,诸如对羟基苯甲酸酯;调味剂,诸如草莓调味剂和胡椒薄荷;等。可使用以下各物作为添加剂来产生胶囊、片剂、粉剂、颗粒剂等:赋形剂,诸如乳糖、葡萄糖、蔗糖和甘露糖醇;崩解剂,诸如淀粉和海藻酸钠;润滑剂,诸如硬脂酸镁和滑石;粘合剂,诸如聚乙烯醇、羟丙基纤维素和明胶;表面活性剂,诸如脂肪酸酯;塑化剂,诸如甘油;等。适于胃肠外施用的药物制剂包括注射液、栓剂、喷雾剂等。可使用载体诸如盐溶液、葡萄糖溶液或两者的混合物来制备注射液。可使用载体诸如可可脂、氢化脂肪或羧酸来制备栓剂。可按原样使用抗体或抗体片段,或将它与载体一起使用来制备喷雾剂,所述载体不刺激患者的口腔或气道粘膜并且可通过将它以精细粒子形式分散来促进化合物的吸收。载体包括乳糖、甘油等。有可能产生诸如气雾剂和干燥粉剂的药物制剂。此外,被示例作为口服制剂的添加剂的组分也可添加至胃肠外制剂中。
5.使用本发明的抗dr3单克隆抗体或抗体片段诊断疾病的方法
可通过使用本发明的单克隆抗体或抗体片段检测或测定dr3或表达dr3的细胞来诊断与dr3相关的疾病。可通过例如如下检测或测量dr3来对作为一种与dr3相关的疾病的炎性疾病进行诊断。
可通过用免疫方法诸如流式细胞仪(fcm)检测在患者的身体中的细胞上表达的dr3来对炎性疾病进行诊断。免疫方法是其中使用标记的抗原或抗体检测或测定抗体量或抗原量的方法。免疫方法的实例包括放射性物质标记的免疫抗体方法、酶免疫测定法、荧光免疫测定法、发光免疫测定法、western印迹方法、物理化学手段等。
放射性物质标记的免疫抗体方法的实例包括以下方法:其中使本发明的抗体或抗体片段与抗原、表达抗原的细胞等反应,接着使经受放射性标记的抗免疫球蛋白抗体或其结合片段与此反应,随后使用闪烁计数器等进行测定。
酶免疫测定法的实例包括以下方法:其中使本发明的抗体或抗体片段与抗原、表达抗原的细胞等反应,接着使经受抗体标记的抗免疫球蛋白抗体或其结合片段与此反应并通过分光光度计测量有色色素,并且例如可使用夹心式elisa。作为酶免疫测定法中使用的标记物,可按已描述的使用任何已知酶标记物(enzymeimmunoassay,由igakushoin出版,1987)。实例包括碱性磷酸酶标记、过氧化物酶标记、荧光素酶标记、生物素标记等。
夹心式elisa是以下方法:其中使抗体结合于固相,捕集待检测或测量的抗原,并且使另一抗体与捕集的抗原反应。在elisa中,制备两种其中抗原识别位点不同的识别待检测或测量的抗原的抗体或其抗体片段,并使第一抗体或抗体片段先吸附在板(诸如96孔板)上,并且用荧光物质诸如fitc、酶诸如过氧化物酶、或生物素标记第二抗体或抗体片段。
使以上抗体所吸附的板与从活体分离的细胞或其分散的细胞悬浮液、其组织或离解溶液、培养的细胞、血清、胸腔积液、腹水、眼液等反应,接着使其与标记的单克隆抗体或抗体片段反应,并且进行对应于标记的物质的检测反应。待测试的样品中的抗原浓度可由通过逐步稀释已知浓度的抗原制定的校正曲线计算。作为用于夹心式elisa的抗体,可使用任何多克隆抗体和单克隆抗体,或可使用抗体片段诸如fab、fab'和f(ab)2。作为夹心式elisa中使用的2种抗体的组合,可使用识别不同表位的单克隆抗体或抗体片段的组合,或可使用多克隆抗体与单克隆抗体或抗体片段的组合。
荧光免疫测定法包括文献[《单克隆抗体:原理与实践》(monoclonalantibodies-principlesandpractice),第3版,academicpress(1996);《单克隆抗体实验手册》(manualformonoclonalantibodyexperiments),kodanshascientific(1987)]中描述的方法等。作为荧光免疫测定法中使用的标记物,可按已描述的使用任何已知荧光标记物[《荧光免疫测定法》(fluorescentimmunoassay),由akirakawao所著,softscience,(1983)]。标记物的实例包括fitc、ritc等。
可使用文献[《生物发光和化学发光》(bioluminescenceandchemicalluminescence),rinshokensa,42,hirokawashoten(1998)]中描述的方法等进行发光免疫测定法。作为发光免疫测定法中使用的标记物,可包括任何已知发光标记物。可使用的实例包括吖啶酯、洛酚碱(lophine)等。
western印迹是以下方法:其中抗原或表达抗原的细胞通过sds-聚丙烯酰胺凝胶电泳[《抗体实验手册》(antibodies-alaboratorymanual)(coldspringharborlaboratory,1988)]来分级分离,使凝胶印迹于pvdf膜或硝化纤维素膜上,使膜与抗原识别性抗体或抗体片段反应,进一步使其与用荧光物质诸如fitc、酶标记物诸如过氧化物酶、生物素标记等标记的抗小鼠igg抗体或抗体片段反应,并且使标记物可视化以确认反应。其实例如下所述。
将其中表达具有由seqidno:2表示的氨基酸序列的多肽的细胞或组织溶解于溶液中,并且在还原性条件下,通过sds-page方法使每个泳道0.1至30μg的蛋白质量进行电泳。将电泳的蛋白质转移至pvdf膜,并且使其与含有1至10%的bsa的pbs(在下文中称为“bsa-pbs”)在室温下反应30分钟以进行封闭。此时,使本发明的单克隆抗体与此反应,用含有0.05至0.1%吐温20的pbs(在下文中称为“吐温-pbs”)洗涤,并且使其与用过氧化物酶标记的山羊抗小鼠igg在室温下反应2小时。
将它用吐温-pbs洗涤,并且使用eclwestern印迹检测试剂(由amersham制造)等检测单克隆抗体所结合的条带,由此检测具有由seqidno:2表示的氨基酸序列的多肽。作为在western印迹中检测所使用的抗体,使用可结合于不具有天然类型的三维结构的多肽的抗体。
通过使作为抗原的dr3与本发明的抗体或抗体片段反应以形成聚集体,以及检测这个聚集体来特异性进行物理化学方法。物理化学方法的其它实例包括毛细管方法、一维免疫扩散方法、免疫比浊法、乳胶免疫比浊法[《临床测试方法手册》(handbookofclinicaltestmethods),kaneharashuppan,(1988)]等。例如,在乳胶免疫扩散方法中,可使用用抗体或抗原敏化的载体诸如具有约0.1至1μm的粒度的聚苯乙烯胶乳,并且当使用相应抗原或抗体进行抗原-抗体反应时,反应溶液中的散射光增加,而透射光降低。当以吸光度或积分球浊度形式检测所述变化时,现时有可能测量待测试的样品中的抗原浓度等。
对于表达dr3的细胞的检测来说,可使用已知免疫检测方法,并且优选使用免疫沉淀方法、免疫细胞染色方法、免疫组织染色方法、荧光抗体染色方法等。
免疫沉淀方法是以下方法:其中使表达dr3的细胞与本发明的单克隆抗体或抗体片段反应,接着添加对免疫球蛋白具有特异性结合能力的载体诸如蛋白g-琼脂糖以使抗原-抗体复合物得以沉淀。此外,可进行以下方法。
使本发明的上述抗体或抗体片段固相化于用于elisa的96孔板上,接着用bsa-pbs封闭。当抗体为非纯化状态诸如杂交瘤细胞的培养上清液时,使抗小鼠免疫球蛋白或大鼠免疫球蛋白或蛋白a或蛋白g等先吸附在用于elisa的96孔板上并用bsa-pbs封闭,并且向其中分配杂交瘤细胞的培养上清液以进行结合。在丢弃bsa-pbs并用pbs充分洗涤残余物之后,用表达dr3的细胞或组织的溶解溶液进行反应。用样品缓冲液从充分洗涤的板提取免疫沉淀物以进行sds-page,并且通过上述western印迹来检测。
免疫细胞染色方法或免疫组织染色方法是以下方法:其中必要时用表面活性剂、甲醇等处理其中表达抗原的细胞或组织以使得抗体易于渗透至细胞或组织中,接着使本发明的单克隆抗体与此反应,接着进一步使其与经受荧光标记诸如fitc、酶标记物诸如过氧化物酶、或生物素标记的抗免疫球蛋白抗体或其结合片段反应,并且使标记物可视化并在显微镜下观察。
此外,可通过免疫荧光染色方法来检测组织的细胞,其中使细胞与荧光标记的抗体反应并通过流式细胞仪来分析[《单克隆抗体:原理与实践》(monoclonalantibodies-principlesandpractice),第3版,academicpress(1996);《单克隆抗体实验手册》(manualforexperimentsofmonoclonalantibodies),kodanshascientific(1987)],其中使细胞与荧光标记的抗体反应并通过流式细胞仪来分析。具体来说,结合dr3的细胞外区域的本发明的单克隆抗体或抗体片段可检测表达维持天然类型三维结构的多肽的细胞。
此外,在荧光抗体染色方法之中在使用fmat8100hts系统(由appliedbiosystems制造)等的情况下,可在不分离所形成的抗体-抗原复合物与未涉及于抗体-抗原复合物的形成中的游离抗体或抗原的情况下测量抗原量或抗体量。
下面通过实施例来描述本发明;然而,本发明不限于以下实施例。
实施例
实施例1载体构建
在下文中,抗体或抗体片段中的氨基酸残基的编号由kabat等(免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991))的eu编号系统确定。
(1)用于可溶性人flag-tl1a(ec)的表达载体
如以下所述来产生由
从人淋巴瘤u-937细胞系(atcccrl-1593.2)分离编码人tl1a的cdna。为此,遵循制造商说明书,使用
为了从哺乳动物细胞分泌蛋白质,通过“重叠pcr”将紧连在flag序列之前的来自人血管细胞粘着分子1(vcam-1)的信号肽引入至htl1a的5’末端。用分别正向引物和反向引物vcam-flag-sali-f(seqidno:43)和vcam-flag_htl1a_r(seqidno:46)产生编码vcam-flag的pcr片段,其中sali限制位点被添加在5’末端,并且13个编码htl1a的核苷酸被添加在3’末端。用分别正向引物和反向引物
分离上述两种pcr产物,并且添加至用来自pcr反应1的正向引物(vcam-flag-sali-f(seqidno:43))和来自反应2的反向引物(htl1a-ec_bamhi-r(seqidno:44))进行的第三pcr反应中,从而产生编码vcam-flag-htl1a蛋白(seqidno:2)的全长cdna。根据制造商说明书,使用dna连接酶mightymix(takara,目录号6023)将这个pcr片段克隆在pktabex-tc26表达载体(wo2013/005649)的sali和bamhi限制位点处。通过sanger测序(genewiz,sandiegocalifornia)确认dna序列。构建了包含编码vcam-flag-htl1a蛋白的cdna的载体。
(2)可溶性人dr3(ec)-hg1fc的表达载体
产生由人dr3(tnfrsf25)(nm_003790.2)的氨基末端(n末端)细胞外(ec)结构域融合于人igg1的fc结构域组成的可溶性嵌合fc-融合蛋白。如上对于人tl1a所述,从u-937细胞分离编码人dr3的细胞外结构域的cdna,并且使用引物hdr3_f5’(seqidno:47)和hdr3-ec_r(seqidno:48),如上面实施例1.1中所述通过重叠pcr来产生编码dr3(ec)-hg1fc蛋白的cdna。
通过使用作为模板的cdna(上述)、正向引物hdr3-sali_f(seqidno:49)和反向引物hdr3_hg1fc_r(seqidno:60)进行pcr来扩增编码hdr3-ec的dna序列(seqidno:3的1至603,编码seqidno:4的氨基酸残基1至201)。将sali限制位点和人igg1fc的5’末端的一定数目的核苷酸分别引入至hdr3的5’末端和3’末端。使用引物hdr3_hg1fc_f(seqidno:51)和hg1fc_bamhi-r(seqidno:42),如上通过pcr来扩增人igg1fc的编码氨基酸残基216至447(eu编号,kabat等)的cdna(seqid5和6),其中分别添加与hdr3(ec)的3’末端同源的5’核苷酸和3’bamhi限制位点。使用作为模板的来自hdr3(ec)和人igg1fc的组合pcr产物以及正向引物hdr3-sali_f(seqidno:49)和hg1fc_bamhi-r(seqidno:52),在第三pcr反应中产生完整hdr3(ec)-hg1fccdna。将所得pcr片段克隆至pktabex-tc26的sali和bamhi限制位点中,并且产生包含编码dr3(ec)-hg1fc蛋白的cdna的载体。
(3)可溶性人dr3(crd1)-小鼠g1fc的表达载体
产生可溶性嵌合fc-融合蛋白,其由人dr3的含有人dr3的“富含半胱氨酸结构域(crd)1”的较短n末端区域(包括信号肽的完整全融合蛋白序列seqidno:8的氨基酸残基1至71)通过间插短多聚甘氨酸连接物肽(氨基酸序列asgggsgggsgggs)融合于小鼠igg1fc结构域构成(seqidno:8)。使用与上面类似的“重叠pcr”方法。
使用分别添加5’sali位点和侧接3’多聚甘氨酸cdna的正向引物hdr3-sali_f(seqidno:49)和反向引物hdr3-pg-nhei_r(seqidno:53),如上所述从分离自u-937细胞的cdnapcr扩增人dr3的信号肽和crd1(seqidno:7的核苷酸序列1至213,编码seqidno:8的氨基酸1-71)。用分别添加侧接5’多聚甘氨酸cdna和3’bamhi位点的正向引物mg1fc-pg-nhei_f(seqidno:54)和反向引物mg1fc_bamhi-r(seqidno:55)扩增小鼠igg1fc片段(seqidno:7的核苷酸序列256至936)。使用引物hdr3-sali_f(seqidno:49)和mg1fc_bamhi-r(seqidno:55),如上所述在第三pcr中融合hdr3(crd1)和mg1fccdna。如上所述,将pcr片段克隆在pktabex-tc26的sali和bamhi限制位点处,并且通过测序(genewiz,sandiegocalifornia)确认。
(4)用于表达表面结合的人或小鼠dr3δdd的载体
构建用于细胞表面表达缺乏大部分细胞质“死亡结构域”的人或小鼠dr3蛋白的载体。被不同地定义为人dr3的细胞质结构域的膜远端羧基末端(c末端)区域内从346至417(migone等,immunity,2002;16:479-492)或从332至412(wang等,immunogenetics,2001,3553:59-63)的氨基酸残基的“死亡结构域”是包括tnfr1、fas、dr4、dr5和dr6的tnfr超家族成员所共有的,已被显示在外源性过表达dr3时引起所观察到的这些蛋白质的细胞毒性。使用正向引物hdr3-sali_f(seqidno:49)和反向引物hdr3δdd_bamhi_r(seqidno:56)以及作为模板的先前制备的dr3(ec)的cdna,通过pcr来扩增这个死亡结构域缺失的人dr3,称为hdr3δdd(核苷酸序列seqidno:9,编码seqidno:10的从1至345的氨基酸残基)。将pcr片段插入其中环己酰亚胺(chx)抗性基因被新霉素抗性基因(neo)替换的pktabex-tc26载体中,并且产生包含编码hdr3-δdd蛋白的cdna的载体。
此外,对于缺乏dd的小鼠dr3蛋白,使用引物mdr3_fwd(seqidno:57)和mdr3_3’_r(seqidno:58)从c57/bl6小鼠的脾制备小鼠dr3的cdna,使用正向引物mdr3-sali_f(seqidno:59)、反向引物mdr3(1-324)_bamhi_r(seqidno:60)和作为模板的mdr3cdna,通过pcr制备编码mdr3-δdd蛋白的cdna。最后,以与先前方法相同的方法产生包含编码mdr3-δdd蛋白的cdna的载体。
实施例2稳定细胞系的产生
(1)表达表面人dr3δdd的稳定小鼠el4细胞系
通过将表达载体引入亲本淋巴瘤细胞系el4(atcc,目录号tib-39)中来产生表达表面重组人dr3的稳定小鼠细胞系。为此,将1×107个el4细胞用冰冷pbs洗涤并悬浮于400μl冰冷pbs中,接着向细胞悬浮液中混合10μghdr3-δdd的表达载体和25μgtol2转座酶表达载体(wo2013/005649)并转移至0.4cm间隙小池(bio-rad,目录号165-2088)中,并且使用genepulser装置(bio-rad,目录号165-2075)[设置:300v、960μf]进行电穿孔。在转染后24小时之后,将细胞置于1mg/ml遗传霉素(也描述为“g418”,lifetechnologies,目录号10131-035)下选择19天。使用facsaria(bdbiosciences)分选具有人dr3的高细胞表面表达的细胞;为此,依次用生物素抗人dr3(tramp)抗体(克隆jd3,biolegend,目录号307104)和抗链霉亲和素-藻红素抗体(jacksonimmunoresearch,目录号016-110-084)对细胞进行染色。通过流式细胞计量术,在随后时间点确认所得细胞系的稳定高表面hdr3表达。
(2)表达表面人或小鼠dr3δdd的稳定cho-k1细胞系
也按对于el4-dr3细胞系所描述的来产生表达重组表面人或小鼠dr3的悬浮cho-k1稳定细胞系。简单地说,使用350v和500μf进行上面实施例2(1)中的相同载体的电穿孔,并且在0.5至1mg/mlg418下进行17天的选择,然后使用有限稀释选择高表达性克隆。
(3)通过哺乳动物瞬时表达来产生可溶性重组蛋白和抗体
为产生最多的抗体和蛋白质,遵循制造商说明书,使用freestyletmmax转染试剂(lifetechnologies,目录号16447-100),并使用1.25μg载体dna/μl培养物,以dna与在opti-mem培养基(lifetechnologies,目录号31985-070)中稀释的freestyletmmax转染试剂的1:1(w/v)比率,用所需表达载体转染freestyletm293-f细胞(lifetechnologies,目录号r790-07)或freestyletmcho-s细胞(lifetechnologies,目录号r800-07)的悬浮培养物。随后在freestyletm293表达培养基(lifetechnologies,目录号12338-018)(如果使用293-f细胞的话)或freestyletmcho表达培养基(lifetechnologies,目录号1265-014)(如果使用cho-s细胞的话)中培养转染子(transfectant)6天。依次通过离心和0.22μm过滤(millipore,
(4)从稳定cho-k1细胞产生可溶性人dr3(ec)-hg1fc
产生稳定cho-k1细胞系,以更大规模地产生可溶性人dr3-hg1fc蛋白。将含1×107个cho-k1细胞的400μl冰冷pbs、10μg表达载体pktabextc26-hdr3-hg1fc和25μgtol2转座酶载体转移至0.4cm间隙小池中,并且使用genepulser装置[设置:350v、500μf]进行电穿孔。将细胞立刻转移至96孔板中,并且4天后开始用3μg/ml环己酰亚胺(chx)(sigma,目录号c4859)选择。在选择14至21天之后,通过夹心式elisa来筛选各孔的可溶性iggfc。扩增高滴度孔,并且使细胞经受进一步滴度测试直至选泽出最终的高表达性细胞系。
利用chocd高效进料a和进料b(分别是lifetechnologies目录号a10234-01和目录号a10240-01),使用分批进料产生方法从cho-k1稳定细胞系产生人dr3(ec)-hg1fc。将细胞按比例扩大至所需体积,并且用进料a和进料b的混合物进料。当细胞的活力下降至80%以下时收集培养上清液,并且依次通过离心和0.22μm过滤将所述上清液澄清化。
实施例3抗dr3单克隆抗体的建立
(1)小鼠免疫接种
在第0、14和21天,使用在sigma佐剂系统(sas)(目录号s6322)中的50μg人dr3-fc融合蛋白或dr3表达性el4细胞对kirin-medarex(km)小鼠(含有人ig基因座)(wo02/43478;wo02/092812;ishida,等,ibc第11次抗体工程会议(ibc's11.sup.thantibodyengineeringmeeting).摘要(2000);kataoka,s.ibc第13次抗体工程会议(ibc's13.sup.thantibodyengineeringmeeting).摘要(2002))进行免疫接种。通常通过流式细胞计量的与人dr3表达性cho细胞的结合来评估血清抗hdr3抗体滴度。对具有适当滴度(通常显示出1:10,000的终点稀释度)的小鼠最终用dr3-fc或dr3-el4细胞免疫接种1次。在最终加强免疫之后3天后处死小鼠。
(2)杂交瘤产生
切除来自免疫接种的小鼠的脾,并且制备单细胞脾细胞悬浮液。使脾细胞与sp2/0-ag14(atcccrl-1581)融合配偶体细胞以1:5混合,并且用20ml温热dmem(invitrogen)洗涤3次。从最终洗涤物抽吸培养基,并且在温和混合下在1分钟内向细胞逐滴添加1ml温热peg1500(boehringermannheim)。将所得peg1500细胞悬浮液再温和混合2分钟,随后逐滴添加一系列温热dmem(在1分钟内添加1ml,接着在3分钟内添加3ml,接着在1分钟内添加10ml),全都在温和涡旋下进行。
将融合混合物在37℃下孵育5分钟。通过离心使细胞沉淀,并且在106个细胞/毫升下再悬浮于补充有10%胎牛血清(fbs)、50pg/ml重组il-6(r&dsystems206-il-050)的dmem中。将融合混合物在100μl/孔下分布在96孔组织培养板中并培养过夜。次日,添加100μl含有2×hat补充物(sigmaaldrich)的dmem培养基(在下文中描述为dmem/hat),并且将板再培养3天。用1×dmem/hat替换75%的培养基,并且将杂交瘤细胞再培养2至4天。
(3)抗体选择
通过流式细胞计量的与人dr3表达性cho细胞(在下文中在有的情况下描述为cho/dr3)的结合来筛选多孔板的上清液。将细胞在10,000/孔下在96孔圆底测定板中在4℃下与杂交瘤的纯上清液一起孵育15分钟。通过离心使细胞沉淀,并且用200μlpbs/0.5%胎牛血清洗涤。在随后离心之后,将细胞再悬浮于200μl含有10μg/ml抗人igg-藻红素抗体(jacksonimmunoresearch,109-115-098)的pbs/0.5%胎牛血清中,并且在4℃下孵育15分钟。如上所述洗涤细胞,并且再悬浮于200μlpbs/0.5%胎牛血清中;在lsrfortessa流式细胞仪(becktondickinson)上获取了>5000个事件。使用flowjo(treestarinc.)分析结果。因此,建立了产生抗dr3单克隆抗体的杂交瘤克隆,包括142a2和142s38b。
扩增dr3结合抗体产生性杂交瘤株系,并且根据常规方法学纯化上清液的抗体。抗体蛋白质纯化:使用重组mabselectsure蛋白a亲和树脂(gehealthcarelifesciences,pittsburgh,pa)从培养基纯化人单克隆抗体。用0.22μm真空过滤装置(millipore,bedford,ma)过滤条件培养基,并且将其荷载到具有与培养基中人抗体的量匹配的适当容量的蛋白a柱(gehealthcarelifesciences,pittsburgh,pa)上。将柱用5柱体积的pbs彻底洗涤,用0.1mgly-hcl(ph3.6)洗脱抗体,并且用1mtris-hcl(ph8.0)中和。
通过sds-page来分析级分,并将阳性级分汇合并针对pbs(ph7.4)(gibco,lifetechnologies,grandisland,ny)进行透析。在透析之后,用离心浓缩机(vivaspin,50,000mwco:sartorius,gettingen,germany)浓缩抗体样品。最后,使用具有0.22μm孔直径的针筒过滤器对抗体进行灭菌过滤,并且通过lowry方法来测定抗体浓度。使用fda许可的endosafe-pts鲎阿米巴状细胞裂解物(limulusamebocytelysate,lal)测定法(charlesriverlaboratories)来测定热原含量。这个测定法的检测限是0.01eu/ml。如果测试是阴性的,那么样品被认为是无内毒素的。
如下所述评估纯化抗体的dr3激动作用/拮抗作用。通过若干融合,我们建立了包括142a2和142s38b的抗人dr3单克隆抗体,并且对这两种抗体进行基因克隆和进一步表征。
实施例4抗dr3单克隆抗体的基因克隆
(1)来自杂交瘤142a2和142s38b的vh和vl基因的基因克隆和测序
使用5’-smart-race-pcr(在rna模板的5’末端处的转换机理-cdna末端的快速扩增-聚合酶链反应)从所选杂交瘤细胞系142a2和142s38b提取编码信号肽和重排的免疫球蛋白重链可变(vh)结构域(vh在本文中是指来自人基因组的组合的可变基因(v)+多样性基因(d)+接合基因(j)区域)、以及信号肽和免疫球蛋白轻链可变(vl)结构域(vl在本文中是指来自人基因组的组合的可变基因(v)+接合基因(j)区域)的cdna并进行sanger测序。
为此,遵循制造商说明书,使用
这个cdna被用作下述pcr扩增的模板:使用在所有人γ同种型(引物igg1,seqidno:61)或人κ(引物hk-5,seqidno:62)的恒定结构域内退火的基因特异性反向引物与试剂盒提供的通用正向引物的组合,对重链或轻链的vh或vl区以及一小部分恒定区进行pcr扩增。kod热启动dna聚合酶(novagen/toyobo,目录号71086-3)用于以下热循环程序内:94℃4分钟;5个循环的94℃30秒、68℃2分钟;5个循环的94℃30秒、66℃30秒、68℃1分钟;25个循环的94℃30秒、64℃30秒、68℃1分钟;1个循环的68℃5分钟。从这个反应分离的142a2vhcdna不足,因此使用来自第一pcr反应的dna作为模板进行第二轮部分巢式pcr。使相同试剂盒提供的正向引物与在重恒定结构域内退火的巢式反向引物(引物igg2,seqidno:71)配对,并按前面所描述的重复pcr。所有其它抗体片段都不需要第二轮pcr。遵循制造商说明书,使用zeroblunttopopcr克隆试剂盒(invitrogen,目录号k2820)将扩增的vh和vlcdna片段克隆至pcrbluntii-topo质粒中。
通过sanger测序(由genewizinc.进行)对多个含有vh或vlcdna插入物的质粒测序,使用程序sequencher(由genecodescorp.制造)进行比对。使用imgt/v探索程序(brochet,lefranc等2008)、blast和igblast进行vh和vlcdna的共有序列比对和分析。使用kabat的定义(kabat等,免疫用途的蛋白质的序列(sequencesofproteinsofimmunologicalinterest),usdept.healthandhumanservices(1991))来鉴定抗体的互补决定区(cdr)。
鉴定的序列如下:142a2vh(核苷酸序列为seqidno:13,包括信号肽的vh区的氨基酸序列为seqidno:14,vh区的氨基酸序列为seqidno:15并且hcdr1至3的氨基酸序列为seqidno:16至18)、142a2vl(核苷酸序列为seqidno:19,包括信号肽的vl区的氨基酸序列为seqidno:20,vl的氨基酸序列为seqidno:21,并且lcdr1至3的氨基酸序列为seqidno:22至24);142s38bvh(核苷酸序列为seqidno:25,包括信号肽的vh区的氨基酸序列为seqidno:26,vh区的氨基酸序列为seqidno:27并且hcdr1至3的氨基酸序列为seqidno:28至30)、142s38bvl(核苷酸序列为seqidno:31,包括信号肽的vl区的氨基酸序列为seqidno:32,vl的氨基酸序列为seqidno:33,并且lcdr1至3的氨基酸序列为seqidno:34至36)。
(2)将vh和vl克隆至igg1、igg2和igg4表达载体中。
通过将鉴定的编码包括内源性信号肽的vh或vl结构域的cdna分别连接至含有各人γ恒定区(igg1、igg2或igg4变体)或人κ恒定结构域(seqidno:37)的表达载体中来构建用于表达142a2与142s38b两者的全长人igg1、igg2或igg4变体抗体形式的载体。在这个实施例的情况下,igg4变体是指在人igg4恒定区中包含氨基酸取代s228p、l235e和r409k(氨基酸位置的编号由eu索引确定)的
为此,使用添加5’侧接sali限制位点的正向引物[用于142a2的引物142a2-vh_sali_f(seqidno:67)和用于142s38b的引物142s38b_vhf_sali(seqidno:69)]和添加3’侧接nhei限制位点的反向引物[(用于142a2的引物142a2-vh_nhei_r(seqidno:68)和用于142s38b的引物f429_vh_r1(seqidno:70))]扩增信号肽和vh结构域。将pcr产物克隆至表达载体pktabex-tc26内的sali和nhei限制位点中,所述表达载体含有所需同种型的免疫球蛋白恒定结构域[氨基酸序列:人igg1(seqidno:38)、igg2(seqidno:39)或igg4-null(seqidno:40)]的cdna。类似地,扩增各抗体的vl结构域,并将其插入含有人κ的恒定结构域的cdna的相同载体或另一载体的bglii和bsiwi限制位点中。用于扩增信号肽和vl并添加5’和3’侧接bglii和bsiwi限制位点的pcr引物如下:对于142a2来说,正向引物142a2_bglii_f(seqidno:65)和反向引物142a2_bsiwi_r(seqidno:66);对于142s38b来说,正向引物142s38b_vlf_bglll(seqidno:63)和反向引物:142p20_vl1_bsiwi_r(seqidno:64)。如上面实施例2(3)中所述使用cho-s细胞进行瞬时抗体产生。
实施例5抗dr3抗体与重组人dr3-人igg1-fc(hudr3-hufc)的结合活性的基于biacore的评估
为了动力学分析抗dr3人抗体142a2和142s38b与重组人dr3蛋白的结合活性,通过表面等离子体共振方法(spr)测量抗体的结合活性。遵循piercefab制备试剂盒(thermoscientificpierce编号44985)来获得上面提及的抗体的fab抗体片段。所有以下操作都使用
具体来说,通过以下方式来进行动力学测定:在芯片上固定约2000个共振单位(ru)的重组蛋白以实现中等蛋白质固定水平。此后,使分5步从12nm浓度稀释的抗dr3抗体fab片段在30μl/min的流速下在芯片上流经120秒。解离时间是300秒,并且在25℃下测量结合曲线。
用甘氨酸盐酸盐(ph1.5)进行60秒再生。通过减去来自无捕集配体的参照流动槽和缓冲液空白的信号来对原始数据进行双重参照。获得对应于各浓度的传感图。使用附装于装置的分析软件
因此,在表1中给出由此获得的个别抗体的平衡解离常数kd(kd/ka)。各抗体的典型传感图被描绘在图1a和图1b中。根据分析,抗dr3单克隆抗体142a2和142s38b对人dr3蛋白具有显著较高亲和性,kd值的数量超过109级。此外,142a2抗体比142s38b抗体具有更高缔合速率常数(ka),在另一方面,142s38b抗体比142a2抗体具有更高的解离速率常数(kd)。
表1:抗dr3单克隆抗体的亲和性分析
实施例6抗dr3单克隆抗体的dr3激动作用和拮抗作用
为了评估本发明中建立的抗dr3单克隆抗体的激动作用和拮抗作用,通过fcm方法来分析人外周血单核细胞(pbmc)中的p65(rela)nf-κb亚基的磷酸化水平。通过使用ficoll进行差异性密度离心来从健康志愿者纯化pbmc。为使pbmc中的基础nf-κb活化水平稳定化,将pbmc在无血清rpmi1640培养基(invitrogen)(在下文中描述为rpmi)中在37℃下静息置30分钟。
比较同种型对抗dr3单克隆抗体的拮抗剂和激动剂活性的影响。如下面所述来确定指示的142a2igg1、igg2和igg4变体形式对pbmcnf-κb活化的影响。在激动剂测定中,在37℃下在rpmi中用单独的6.67nm抗dr3单克隆抗体142a2-igg1、142-a2-igg2或142a2-igg4v,或作为阳性对照的单独的40nmtl1a-flag处理细胞30分钟。在拮抗剂测定中,在37℃下在rpmi中在存在或不存在6.67nm抗dr3单克隆抗体142a2-igg1、142-a2-igg2或142a2-igg4v下预处理细胞30分钟,接着添加40nmtl1a-flag,并且将细胞在37℃下在rpmi中孵育10分钟。在各孵育之后,将细胞用抗磷酸p65抗体(becton,dickinson,目录号558423)进行染色,并且使用bectondickinsonlsrfortessa流式细胞仪进行分析。
对于关于抗体的剂量依赖性的拮抗剂测定来说,接着将细胞在37℃下在rpmi中在存在或不存在各浓度的抗dr3单克隆抗体下处理30分钟。在那之后,在抗体存在下向培养基添加1μg/ml(40nm)外源性tl1a-flag,持续10分钟,随后用bectondickinson(bd)cytofix固定并用bdphosflow可渗透化缓冲液iii(bectondickinson,目录号554714)进行可渗透化。
对于关于抗体的剂量依赖性的激动剂测定来说,用单独的抗体、单独的rpmi阴性对照、或40nm重组tl1a阳性对照处理细胞10分钟,随后如上所述进行固定和可渗透化。用抗磷酸p65抗体(becton,dickinson,558423)对细胞进行染色,并且使用bectondickinsonlsrfortessa流式细胞仪进行分析。
如图2a中所示,作为阳性对照的单独的tl1a使pbmc中的磷酸化p65阳性细胞增加至约45%,在另一方面,抗dr3单克隆抗体142a2-igg1和抗dr3单克隆抗体142a2-igg4v也使磷酸化p65阳性细胞增加直至对照的约80%或70%。然而,抗dr3单克隆抗体142a2-igg2仅使磷酸化p65阳性细胞增加少于对照的十分之一。因此,对于二价igg抗体形式来说,发现igg2类别的重排可减小或缺失通过抗dr3单克隆抗体结合实现的激动效能。因此,igg2类别的抗dr3单克隆抗体可用于在由异常dr3活化引起的疾病的治疗中纯粹拮抗dr3抗原。
此外,如图2b中所示,与tl1a使pbmc中的磷酸化p65阳性细胞增加约55%相比,igg1、igg2和igg4的所有抗dr3单克隆抗体都几乎完全抑制在tl1a结合时诱导的p65磷酸化。因此,显示igg2类别的抗dr3单克隆抗体具有显示出dr3拮抗作用,同时激动作用降低或无激动作用的出乎意料性质。这些实验结果清楚地表明,igg2类别的抗dr3单克隆抗体可被选作用于与异常dr3活化相关的疾病的纯粹拮抗剂的一种候选物。
在另一方面,如图3a中所示,抗dr3igg4抗体变体142a2和142s38b以抗体剂量依赖性方式使pbmc中的p65磷酸化增加,因此这些抗体对dr3显示出激动活性,并且a2-igg4v的激动活性是高于s38-igg4v的活性。另一方面,具有igg2的恒定区的a2-igg2和s38-igg2不使pbmc中的p65磷酸化增加,即使在最高抗体浓度下也是这样。因此,这些igg2抗体缺乏激动活性。
此外,如图3b中所示,具有igg2或igg4变体恒定区的所有抗dr3单克隆抗体142a2和142s38b都使tl1a诱导的p65磷酸化减小,并且由此对dr3显示出拮抗活性。与142s38b抗体的拮抗活性相比,142a2抗体的拮抗活性显示出较高拮抗活性。从igg4子类重排成igg2子类略微减小142a2抗体的拮抗剂效能,在另一方面,这略微增加142s38b抗体的拮抗剂效能。
与先前已知的二价抗dr3拮抗性抗体相比,igg2重排的抗dr3抗体保留dr3拮抗作用,但具有减小或缺乏的显著激动剂活性。因此,二价igg2可用于抑制dr3功能,而不显著刺激dr3。
实施例7对tl1a介导的il-13产生抑制的拮抗作用
为分析在存在或不存在抗dr3单克隆抗体下炎性细胞因子从t细胞的分泌,测定作为一种炎性细胞因子的il-13的分泌。使用miltenyi全t细胞分离试剂盒ii(miltenyibiotech130-095-130),通过磁性激活的细胞分选从人pbmc(如上所述通过ficoll分离)纯化t细胞。将分离的t细胞接种于具有1μg/ml抗cd28抗体(bectondickinson,目录号556620)和1μg/ml在上面实施例2(4)中制备的重组tl1a-flag的96孔抗cd3涂布的板(2x105个细胞/孔;ebioscience目录号16-0037-85)上。添加各种浓度的抗dr3抗体,并且在37℃下培养细胞72小时。通过elisa(r&dsystems,目录号d1300b)来评估上清液il-13水平。
如图4a中所示,抗dr3单克隆抗体142a2-igg2和142s38b-igg2不使il-13从pbmc的分泌增加,分泌量与单独培养基中的il-13分泌量相同。因此,根据p65磷酸化分析中的结果,显示igg2类别的抗dr3单克隆抗体对炎性细胞因子释放不具有任何激动效能。此外,如图4b中所示,抗dr3单克隆抗体142a2-igg2和142s38b-igg2以剂量依赖性方式抑制tl1a诱导的从pbmc分泌il-13。
因此,根据以上上面对igg2类别的抗dr3单克隆抗体的分析,igg2类别的重排完全消除了抗dr3单克隆抗体的激动效能。因此,igg2类别的抗dr3单克隆抗体可能是用于由异常dr3活化所致的与炎性细胞因子释放相关的疾病的一种纯粹拮抗剂。
实施例8抗dr3单克隆抗体片段的制备
(1)抗dr3单价抗体的构建
为产生包含抗体的fc区的抗体片段,设计由h链和与l链融合的fc(fl融合多肽)组成的单价抗体(在下文中在有的情况下描述为mvab)作为一种抗体片段。抗dr3单克隆抗体142a2和142s38b被用作用于构建抗dr3单价抗体的亲本抗体克隆,使抗体的vh的氨基酸序列连接于人igg4抗体的其中包括c131s、r133k、s228p、l235e和r409k取代的恒定区的氨基酸序列,并且由此构建mvab的h链。
接着,使抗体的vl的氨基酸序列连接于人κ轻链的恒定区的氨基酸序列,继之以人igg4抗体的包含铰链、ch2和ch3结构域的其中包括c214s、s228p、l235e、r409k、h435r和y436f取代的fc区,并且由此构建fl融合多肽。
使源于142a2抗体或142s38b抗体的vh和vl的各氨基酸序列(seqidno:15和21、或27和33)分别结合于包含c131s、r133k、s228p、l235e和r409k取代的igg4重链恒定区的氨基酸序列(142a2/mvg4_hc;seqidno:72和142s38b/mvg4_hc;seqidno:73)或人κ轻链的恒定区的氨基酸序列,继之以人igg4重链的由铰链、ch2和ch3结构域组成的包含c214s、s228p、l235e、r409k、h435r和y436f取代的fc区(142a2/mvg4_lc;seqidno:74和142s38b/mvg4_lc;seqidno:75)。各对h链和fl-融合多肽构成抗dr3单价抗体mv142a2和抗dr3单价抗体mv142s38ba。
将编码142a2/mvg4_hc(seqidno:72)或142s38b/mvg4_hc(seqidno:73)的氨基酸序列的其中被限制酶noti和bamhi识别的各序列被引入5’末端和3’末端的dna序列分别插入表达载体pkantex93(wo97/10354)上的noti和bamhi位点中。
此外,将编码142a2/mvg4_lc(seqidno:74)或142s38b/mvg4_lc(seqidno:75)的氨基酸序列的其中被限制酶ecori和kpni识别的各序列被引入5’末端和3’末端的dna序列分别插入包含fl链多肽的表达载体pkantex93处。因此,构建了抗dr3单价抗体的表达载体pkantex93/142a2/mvg4和pkantex93/142s38b/mvg4。
(2)抗dr3单价抗体的产生和纯化
为产生包含抗体的fc区的抗体片段,使用中国仓鼠卵巢cho/dg44细胞(somaticcellmol.genet.,12,555,1986)。在5%co2培养箱中在37℃下进行细胞培养。为表达多种单价抗体,按以下方式进行表达载体的引入。
向2.0×107个cho/dg44细胞添加8μg各种单价抗体表达载体,并且通过电穿孔方法[cytotechnology,3,133(1990)]来引入基因。将具有2mm间隙的小池在冰上保持5分钟,接着在350v、250μf的条件下进行电脉冲。在脉冲之后,用15ml含有10%透析胎牛血清(在下文中缩写成dfbs)的imdm培养基(由gibco制造)[在下文中缩写成imdm-(10)]回收细胞,并且在imdm-(10)中培养各细胞2天,接着用含有0.5mg/mlg418硫酸盐(nacalaitesque,inc.)的imdm-(10)[在下文中缩写成imdm-(10g)]替换培养基以继续培养,由此获得g418抗性细胞系。
将在先前培养下获得的g418抗性细胞系悬浮于imdm-(10g)中并在175cm2烧瓶中培养一段汇合时间,接着将细胞移至hyperflasktm(corning,目录号10020)中并在补充有0.5mg/mlg418和10μg/ml庆大霉素的excell302(由safcbiosciences制造)中培养7至11天,接着回收培养上清液。对于抗dr3单价抗体142s38b/mvg4来说,执行与实施例2的章节(3)中所描述的类似的瞬时蛋白质表达系统。作为培养转染细胞的结果,获得142a2mvg4和142s38bmvg4的培养上清液。
为了纯化mvab,使上述各种单价抗体的培养上清液在0.5至1.0ml/min的流速下穿过装填有mabselectsure(由millipore制造)载体的0.5ml体积柱。将柱用磷酸盐缓冲盐水(pbs)洗涤两次,并且分别使用0.1m柠檬酸盐缓冲液(ph4.0)(对于142a2/mvg4来说),0.1m柠檬酸盐缓冲液(ph3.9)(对于142s38b/mvg4来说)进行各次洗脱,并且将各洗脱级分立刻用2mtris-盐酸缓冲液(ph8.0)中和。
将显示出高蛋白质浓度的洗脱级分针对含有10mm柠檬酸(其中用氢氧化钠调整ph至6.0)和150mm氯化钠的缓冲液(在下文中缩写成柠檬酸盐缓冲液)透析两次。回收样品,并且通过超滤过滤器(由millipore制造)来浓缩低浓度样品,并使用0.22μm过滤器(由millipore制造)进行灭菌。
进一步通过凝胶过滤色谱法来纯化样品,并将其用于体外活性测试中。使superdex20010/300gl柱(gehealthcare)连接于高速液相色谱系统aktaexplore10s(gehealthcare),并且用柠檬酸盐缓冲液更换柱中的水溶液,并使用作为操作缓冲液的缓冲液。将550μl制备体积的抗体溶液手动施加于柱,并且使1.5柱体积的缓冲液在0.5ml/min的流速下穿过柱(耐受压力设置在1.5mpa下),接着回收0.5ml的各级分。
回收在约25至30分钟时被检测为主峰的级分,并将其用于分析。用0.22μm过滤器过滤纯化的样品并将其保存在4℃下。由在280nm下的吸光度(od280)计算蛋白质浓度。因此,获得了纯化的抗dr3单价抗体mv142a2和mv142s38b。
实施例9抗dr3单克隆抗体片段的dr3激动作用和拮抗作用
为了评估本发明中建立的作为包含抗体的fc区的抗体片段的抗dr3单价抗体mv142a2和mv142s38b的激动作用和拮抗作用,通过与上面实施例6中所述相同的fcm方法来分析人pbmc中的p65(rela)nf-κb亚基磷酸化水平。
因此,相较于pbmc中的磷酸化p65阳性细胞分别是69.5%和2.3%的单独tl1a(阳性对照)和单独培养基(阴性对照)值,抗dr3单克隆igg4抗体142a2igg4以抗体剂量依赖性方式使细胞群体明显增加,在另一方面,抗dr3单价抗体mv142a2在任何抗体剂量下都几乎决不增加细胞群体(图5a)。
因此,发现与抗dr3单克隆抗体142a2igg4相比,抗dr3单价抗体mv142a2明确显示出对dr3的激动活性降低或几乎无激动活性。在另一方面,与阳性对照和阴性对照相比,抗dr3单价抗体mv142a2和抗dr3单克隆抗体142a2igg4以抗体剂量依赖性方式减小pbmc中的由tl1a配体诱导的磷酸化p65阳性细胞群体,并且mv142a2的抑制作用略微弱于142a2igg4的抑制作用(图5b)。
因此,抗dr3单价抗体mv142a2对人pbmc中由tl1a诱导的dr3活化显示出拮抗活性,其中所述抗体对dr3活性具有减小的激动效能或不具有激动效能。mv142a2的拮抗活性略微小于142a2igg4抗体。
关于抗dr3单价抗体mv142s38b,与这个实验中的阳性(单独tl1a,45%)和阴性(单独培养基,3%)对照值相比,抗dr3单克隆igg4抗体142s38b-igg4以抗体剂量依赖性方式明显增加pbmc中的磷酸化p65阳性细胞,这与142a2-igg4相同,在另一方面,抗dr3单价抗体mv142s38b在任何抗体剂量下都不增加磷酸化p65阳性细胞群体(图6a)。
在另一方面,抗dr3单价抗体mvs38b和抗dr3单克隆抗体142s38bigg4等效地减小pbmc中的磷酸化p65阳性细胞群体,这与142a2抗体克隆相同(图6b)。因此,抗dr3单价抗体mv142s38b对人pbmc中由tl1a诱导的dr3活化显示出拮抗活性,其中抗体具有减小的激动效能或不具有激动效能。
因此,抗dr3单价抗体可拮抗tl1a诱导的dr3活化,而不显示出显著的激动剂效能。此外,与先前已知的抗dr3抗体片段诸如纯粹fab相比,包含抗体的fc区的抗体片段由于含有抗体的fc区而似乎在人血清中具有较长半衰期和较高稳定性。因此,包括本发明的由h链和fc融合的l链组成的单价抗体的抗体片段可被选作用于与异常dr3活化相关的疾病的纯粹拮抗剂的一个候选物。
实施例10铰链区调换的igg变体的产生
为了确定在激动活性消除中必需的源于igg2抗体的区域,产生在igg2子类与igg4子类之间调换铰链区的igg变体。关于igg4抗体,尽管已知在铰链区中的第228位(eu编号)处的ser残基与诸如半体的igg4分子的不稳定性相关,但使用先前所述的“nullbody”中包含的含有s228p取代的igg4铰链区。将包含源于igg4抗体的ch1、ch2和ch3结构域以及源于igg2抗体的铰链结构域的igg变体指定为“4244”变体,并且将包含源于igg2抗体的ch1、ch2和ch3结构域以及源于igg4抗体的铰链结构域的igg变体指定为“2422”变体。
产生用于产生142a2-igg4244变体重链恒定区的表达载体,其中igg4-null抗体的铰链被人igg2的铰链替换。编码人“igg4-null”恒定重区内的铰链结构域(eskygppcppcp)的cdna被编码人igg2恒定重区的铰链结构域(erkccvecppcp)的cdna替换,并且如先前所述将编码142a2-igg4244变体的cdna插入表达载体上的适当限制位点中。与igg4244变体相同,产生包括编码142a2-igg2422变体的cdna的表达载体。最后,以与上面实施例1和2中所述的程序相同的程序获得纯化的各抗体。
以与实施例6中所述相同的拮抗剂和激动剂测定法评估这些获得的142a2抗体变体。如图7中所示,尽管所有142a2抗体和它们的变体都对由tl1a配体诱导的p65磷酸化显示出稳健的拮抗剂活性,igg4244和igg2422变体与各亲本igg2或igg4抗体变体相比尤其显示出较高拮抗活性(图7b)。在另一方面,尽管igg4和igg2422抗体变体显示出显著的激动活性,但igg2抗体和igg4244抗体变体显示出明显降低的激动剂活性(图7a)。
这些结果明确显示,将igg恒定区重排成igg2子类会降低抗dr3抗体142a2的激动活性而不降低拮抗活性。此外,igg2类别抗体的铰链区含有为降低抗dr3抗体的激动活性所必需的重排部分。因此,发现具有源于igg2子类的铰链区的抗dr3抗体是表现出纯粹拮抗活性和显著降低的激动活性的非常有用的抗体。
实施例11142a2抗体变体的建立
为了建立具有增加的亲和性的抗体变体,使用标准简并寡核苷酸方法构建142a2变体单链fv(scfv)组合噬菌体展示文库。突变优先以142a2抗体的全部6个cdr区为目标。最初通过在上面实施方式中获得的固定化的重组dr3fc融合蛋白上进行淘选来鉴定具有dr3结合活性的噬菌体变体。
如procnatlacadsciusa.2006年3月14日;103(11):4005-4010中所述,通过竞争性结合alphascreen来评估筛选的scfv噬菌体克隆的解离常数(kd)。将与亲本142a2scfv相比具有增加的kd的突变体亚克隆至细菌表达载体中,并且使用标准分子生物学技术纯化scfv蛋白。使抗体变体中所有在cdr外部的突变都回复成亲本142a2氨基酸序列以维持源于亲本抗体克隆的氨基酸序列,同时保留cdr突变以供进一步测试。此外,对于vh,第112位处的gly被arg取代。
因此,建立了vh和vl的各氨基酸序列,诸如vh_g112r(seqidno:76)、vl_a51e(seqidno:77)、vl_l54q(seqidno:78)和vl_a51e/l54q(seqidno:79)。突变的cdr的各氨基酸序列被描绘成hcdr_g112r(seqidno:80)、lcdr2_a51e(seqidno:81)、lcdr2_l54q(seqidno:82)和lcdr2_a51e/l54q(seqidno:83)(表2)。
表2142a2抗体变体中的cdr的氨基酸序列。
*粗体和加下划线的氨基酸残基指示取代的氨基酸残基。“氨基酸编号范围”指示各可变区中cdr的氨基酸编号。
构建包含142a2vl_a51e、vl_l54q和/或vh_g112r或其组合的重组igg1形式,并且如上所述产生fab片段。通过与上面所述相同的表面等离子体共振(spr)测定法来测定这些142a2变体的dr3结合亲和性。所有产生的142a2抗体变体与亲本142a2相比都表现出对dr3蛋白的改进的结合亲和性(表3)。具体来说,在vh和vl中包含a51e、l54q和/或g112r取代的各抗体变体(a2-e、q、eq、er或eqr)与其它变体相比对dr3蛋白具有最高结合亲和性,并且它分别具有约1.8、1.2、1.9、2.0或2.2倍的增加。因此,它是极其有希望的用于dr3拮抗性疗法的候选物。
表3通过表面等离子体共振(spr)测量的142a2变体dr3结合亲和性
实验数目以“n”指示。“kd”指示解离速率常数(nm),并且“kd”指示解离常数(nm)。
此外,分析142a2变体a2-eqr的拮抗活性效能。以上面实验中的相同测定法测定fab抗体片段的这些拮抗活性。因此,这些抗体以剂量依赖性方式抑制il-13释放,并且在10nm下在抗cd3抗体和抗cd28抗体组合存在下完全抑制tl1a配体诱导的il-13分泌。此外,a2-eqr抗体变体与亲本a2抗体相比具有高得多的拮抗活性。因此,发现抗dr3拮抗性抗体变体a2-eqr对于阻断tl1a配体诱导的t细胞活化来说是非常有用的。
尽管本发明已详细地以及参照其特定实施方式进行描述,但对于本领域技术人员来说显而易见的是,可在不脱离本发明精神和范围下在其中进行各种变化和修改。本申请是基于美国临时申请号61/975,214(2014年4月4日提交),并且其内容以引用的方式并入本文。
序列表自由文本
seqidno:1-tl1a-flag的核苷酸序列
seqidno:2-合成构建体
seqidno:5-hdr3-fc的核苷酸序列
seqidno:6-合成构建体
seqidno:7-hdr3-mg1fc的核苷酸序列
seqidno:8-合成构建体
seqidno:9-hdr3-dd的核苷酸序列
seqidno:10-合成构建体
seqidno:11-mdr3-dd的核苷酸序列
seqidno:12-合成构建体
seqidno:13-142a2-vh完整的核苷酸序列
seqidno:14-合成构建体
seqidno:15-142a2-vh的氨基酸序列
seqidno:16-142a2-hcdr1的氨基酸序列
seqidno:17-142a2-hcdr2的氨基酸序列
seqidno:18-142a2-hcdr3的氨基酸序列
seqidno:19-142a2-vl完整的核苷酸序列
seqidno:20-合成构建体
seqidno:21-142a2-vl的氨基酸序列
seqidno:22-142a2-lcdr1的氨基酸序列
seqidno:23-142a2-lcdr2的氨基酸序列
seqidno:24-142a2-lcdr3的氨基酸序列
seqidno:25-142s38b-vh完整的核苷酸序列
seqidno:26-合成构建体
seqidno:27-142s38b-vh的氨基酸序列
seqidno:28-142s38b-hcdr1的氨基酸序列
seqidno:29-142s38b-hcdr2的氨基酸序列
seqidno:30-142s38b-hcdr3的氨基酸序列
seqidno:31-142s38b-vl完整的核苷酸序列
seqidno:32-合成构建体
seqidno:33-142s38b-vl的氨基酸序列
seqidno:34-142s38b-lcdr1的氨基酸序列
seqidno:35-142s38b-lcdr2的氨基酸序列
seqidno:36-142s38b-lcdr3的氨基酸序列
seqidno:37-hclκ的氨基酸序列
seqidno:38-higg1_ch的氨基酸序列
seqidno:39-higg2_ch的氨基酸序列
seqidno:40-higg4变体的氨基酸序列
seqidno:41-htl1a_f的核苷酸序列
seqidno:42-htl1a-3’_r的核苷酸序列
seqidno:43-vcam-flagr-sali_f的核苷酸序列
seqidno:44-htl1a-ec_bamhi-r的核苷酸序列
seqidno:45-vcam-flag_htl1a_f的核苷酸序列
seqidno:46-vcam-flag_htl1a_r的核苷酸序列
seqidno:47-hdr3_f5’的核苷酸序列
seqidno:48-hdr3-ec_r的核苷酸序列
seqidno:49-hdr3-sali_f的核苷酸序列
seqidno:50-hdr3_hg1fc_r的核苷酸序列
seqidno:51-hdr3_hg1fc_f的核苷酸序列
seqidno:52-hdr3_hg1fc_bamhi-r的核苷酸序列
seqidno:53-hdr3-pg-nhei_r的核苷酸序列
seqidno:54-mg1fc-pg-nhei_f的核苷酸序列
seqidno:55-mg1fc_bamhi-r的核苷酸序列
seqidno:56-hdr3δdd_bamhi_r的核苷酸序列
seqidno:57-mdr3_fwd的核苷酸序列
seqidno:58-mdr3_3’_r的核苷酸序列
seqidno:59-mdr3-sali_f的核苷酸序列
seqidno:60-mdr3(1-324)_bamhi的核苷酸序列
seqidno:61-igg1引物的核苷酸序列
seqidno:62-hk5引物的核苷酸序列
seqidno:63-142s38ba_vlf_bgll的核苷酸序列
seqidno:64-142p20_vl1_bsiwi的核苷酸序列
seqidno:65-142a2_bglii_f的核苷酸序列
seqidno:66-142a2_bsiwi_r的核苷酸序列
seqidno:67-142a2-vh_sali_f的核苷酸序列
seqidno:68-142a2-vh_nhei_r的核苷酸序列
seqidno:69-142s38ba_vhf_sali的核苷酸序列
seqidno:70-f429_vh_r1的核苷酸序列
seqidno:71-igg2引物的核苷酸序列
seqidno:72-142a2_mvg4_hc的氨基酸序列
seqidno:73-142a2_mvg4_lc的氨基酸序列
seqidno:74-142s38b_mvg4_hc的氨基酸序列
seqidno:75-142s38b_mvg4_lc的氨基酸序列
seqidno:76-142a2-vh_g112r的氨基酸序列
seqidno:77-142a2-vl_a51e的氨基酸序列
seqidno:78-142a2-vl_l54q的氨基酸序列
seqidno:79-142a2-vl_a51e/l54q的氨基酸序列
seqidno:80-142a2-hcdr_g112r的氨基酸序列
seqidno:81-142a2-lcdr2_a51e的氨基酸序列
seqidno:82-142a2-lcdr2_l54q的氨基酸序列
seqidno:83-142a2-lcdr2_a51e/l54q的氨基酸序列
序列表
- 还没有人留言评论。精彩留言会获得点赞!