一种重组蛋白质的纯化方法与流程
本发明公开了一种重组蛋白质的纯化方法,属于蛋白质工程技术领域。
背景技术:
透明质酸酶最早发现于1929年。根据来源、结构和作用机制的不同,透明质酸酶可分为三类(Karl Meyer,1971):来源于脊椎动物和动物毒液的内切-β-N-乙酰氨基葡糖苷酶(EC 3.2.1.35)、来源于水蛭唾液腺及十二指肠虫的内切-β-葡萄糖醛酸苷酶(EC 3.2.1.36)和来源于细菌的透明质酸裂解酶(EC 4.2.2.1)。人类基因组包含6种透明质酸酶,相似性在33.1%-41.7%之间。其中,基因HYAL-1(HYAL,Gene of Hyaluronoglucosaminidase)、HYAL-2和HYAL-3位于染色体3p21.3,基因HYAL-4、HYAL-P1和PH-20/SPAM1(Sperm adhesion molecular 1,SPAM 1)位于染色体7q31.3。PH20是其中唯一一种最适pH为中性的透明质酸酶。
透明质酸酶主要用来改善其他注射用药物的渗透和增加其他药物的组织渗透性。牛透明质酸酶Wydase(Wyeth Inc.)于1948年经美国FDA批准上市,是最早商业化的透明质酸酶产品。由于其生产困难、纯度低、稳定性差,已于2001年停产。之后,FDA于2004-2005年批准上市了牛透明质酸酶Amphadase(Amphastar Pharmaceuticals Inc.)和Hydase(Akorn Inc.,已停止上市)、绵羊透明质酸酶Vitrase(Bausch and Lomb Inc.)以及重组人透明质酸酶Hylenex(Halozyme Therapeutics Inc.)四种透明质酸酶产品。Wydase、Amphadase、Hydase和Vitrase均提取自动物睾丸组织,Hylenex是利用基因重组技术将人PH20蛋白在中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞中表达、纯化制成的基因工程产品。目前我国市场上只有动物来源的透明质酸酶产品。
动物源性透明质酸酶已在临床应用了60多年,其耐受性和有效性都得到了证实,但对于过敏和免疫反应的担心使其用途受到了限制。动物源性的透明质酸酶比活性低,免疫原性高,重复使用会引起IgE介导的过敏反应。Hylenex(rhPH20)是利用重组DNA技术制备的高纯度、最适pH为中性的人源透明质酸酶,比活性比动物源性透明质酸酶高100倍。近年来,Hylenex与多种生物药(如抗体、胰岛素和免疫球蛋白等)制成的复方注射剂已进入临床试验阶段。
rHuPH20有六个糖基化位点和五个二硫键,在大肠杆菌和酵母表达系统中难以形成正确的蛋白质天然构象,蛋白比活性较低。CHO细胞常用来制备这类结构复杂且具有糖基化的蛋白质,其表达的蛋白质具有接近于天然蛋白质的构象,拥有很好的生物学活性。
CN200980107850.9公开了一种对重组人透明质酸酶的纯化工艺中,其先后使用串珠状交联琼脂糖柱层析、串珠状交联苯基取代琼脂糖柱层析、氨基苯硼酸柱层析和羟基磷灰石柱层析纯化工艺对含有重组人透明质酸酶的细胞培养液进行了纯化,其对重组人透明质酸酶的纯化的效果显著,比活性约为1.0×105U/mg。但是该方法在应用中存在一定的问题,例如,氨基苯硼酸盐柱是一种用于纯化糖蛋白的亲和层析填料,该柱填料昂贵,难于商业化获得,难于线性比例放大。重组人透明质酸酶的纯度直接影响着临床疗效,以及工业化生产的成本,因此本领域存在着获得高纯度、高活性,经济性好、易于商业化获得和线性比例放大的重组人透明质酸酶的需求。
技术实现要素:
基于现有技术领域存在的技术问题,本发明首先提供了一种从细胞培养液中纯化重组蛋白质的方法,所述方法包括:
(1)收集含有目的蛋白质的细胞培养液;
(2)使所述细胞培养液流过离子交换层析柱,固定目的蛋白质,并使杂质蛋白质流过,之后采用等度洗脱方法,收集洗脱峰;
(3)使步骤(2)获得的含有目的蛋白质的培养液流过疏水作用层析柱,使杂质蛋白质流过,并固定目的蛋白,之后采用等度洗脱方法,收集洗脱峰;
(4)将步骤(3)获得的含有目的蛋白质的培养液流过羟基磷灰石层析柱,固定目的蛋白质,并使杂质蛋白质流过,之后采用等度洗脱方法,收集洗脱峰;
(5)使步骤(4)获得的含有目的蛋白质的培养液流过亲和层析柱,固定目的蛋白质,并使杂质蛋白质流过,之后采用等度洗脱方法,收集洗脱峰;
(6)收集洗脱峰,置换于缓冲液中保存。
在一个优选的技术方案中,所述蛋白质为重组人透明质酸酶。本申请的发明人在前期构建了能够表达重组人透明质酸酶的CHO细胞系,在生物反应器上的表达水平约为30mg/L。重组人透明质酸酶成熟蛋白包含447个氨基酸,分子量约为61kD,等电点5.6。
在一个优选的技术方案中,所述步骤(2)中的离子交换层析柱为高流速季铵琼脂糖凝胶阴离子层析柱(Q Sepharose FF)层析柱或高载量季铵琼脂糖凝胶阴离子层析柱(Q Sepharose XL)层析柱。
在一个优选的技术方案中,所述步骤(3)中的疏水作用层析柱为高效苯基交联琼脂糖凝胶层析柱(Phenyl HP层析柱)。
在一个优选的技术方案中,所述步骤(4)中的羟基磷灰石层析柱为陶瓷羟基磷灰石I型(CHT I型)层析柱。
在一个优选的技术方案中,所述步骤(5)中的亲和层析柱为高效磺酸基琼脂糖凝胶阳离子柱层析(SP Sepharose high performance层析柱)或者高流速磺酸基琼脂糖凝胶阳离子柱层析(SP FF层析柱)。
优选地,所述步骤(1)包括用中空纤维柱澄清细胞培养液,收集透过液,将透过液用超滤膜包浓缩换液的步骤。
优选地,所述步骤(2)中的洗脱液为10mM HEPES,210mM NaCl2,pH 7.0。
优选地,所述步骤(3)中洗脱液为10mM HEPES,700mM(NH4)2SO4,0.1mM CaCl2,pH 7.0。
优选地,所述步骤(4)中蛋白结合时的NaH2PO4浓度为5mM,蛋白洗脱时的NaH2PO4浓度为50mM。
优选地,所述步骤(5)中蛋白洗脱液为20mM NaAC,110mM NaCl,pH 5.2。
在一个优选的技术方案中,所述步骤(6)中缓冲液为10mM Histidine,140mM NaCl,pH6.5。
本发明所公开的高效纯化来源于CHO细胞表达系统的重组人透明质酸酶的方法,该纯化方法得到的重组人透明质酸酶纯度高(≥98%),蛋白比活性好(≥1.1×105U/mg),相对于目前现有技术纯化方法获得纯化蛋白的比活性提高了10%,对于未来的药物制备应用具有重要的意义;而且,所采用的层析方法容易线性比例放大至大规模生产条件下使用,满足工业生产的需要。该纯化工艺第一步采用阴离子结合模式,可有效去除绝大多数带有负电荷的宿主蛋白质和核酸,使其对后续的纯化步骤的影响降到最低。第二步疏水层析富集蛋白的同时去除了绝大多数色素类物质。接下来利用羟基磷灰石层析独特结合模式去除了与目的蛋白质电荷性质、疏水性相近的杂蛋白,使蛋白质纯度达到90%以上,最后经过阳离子精细纯化,去除痕量杂蛋白及相关物质,最终使产品纯度达到98%以上。
附图说明
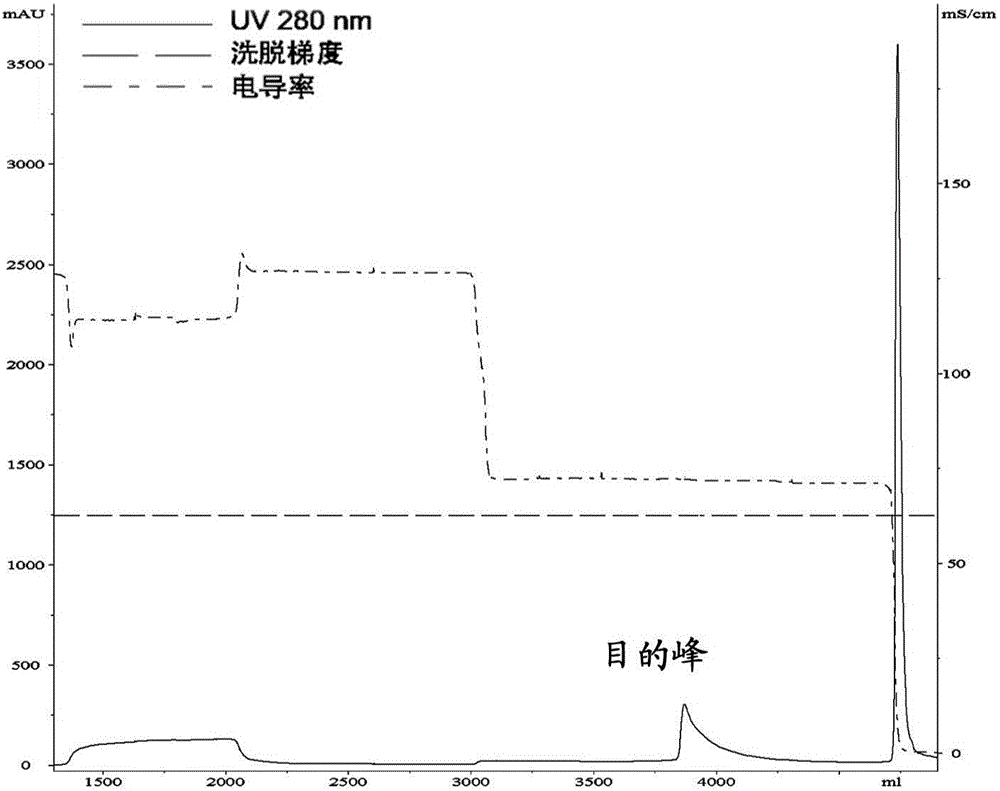
图1.Q separose FF层析图;
图2.Phenyl HP层析图;
图3.CHT I型层析图;
图4.SP Sepharose HP层析图;
图5.各步纯化结果SDS-PAGE电泳分析图谱;
图6.透明质酸酶(HAse)活性测定标准品曲线图;
图7.重组人透明质酸酶原液SDS-PAGE检测图谱;
图8.SEC-HPLC色谱图及面积分析图;
图9.HIC-HPLC色谱图和面积分析图;
图10.等点聚焦电泳测定重组人透明质酸酶等电点电泳图谱。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的保护范围构成任何限制。
实施例1
1.细胞培养液澄清
利用生物反应器培养能够表达重组人透明质酸酶的CHO细胞,表达了水平为30mg/L,终体积为20L。用中空纤维柱(0.45μm,Watersep公司)处理细胞培养液,蠕动泵转速65转/分(rpm),压力≤5psi,收集透过液,测定酶活性。再将透过液用超滤膜包(10kD,0.5m2,Millipore公司)浓缩,进口压≤10psi,浓缩6倍后,对浓缩液进行酶活性分析。然后用超滤膜包将浓缩的蛋白溶液和缓冲液(10mM HEPES,50mM NaCl,pH 7.0)按体积比1:1置换至少3次。测定酶活性。
2.Q sepharose FF柱层析
Q sepharose FF柱规格为柱高27cm×直径5cm,柱体积530ml(GE公司)。上样前,用至少5倍体积的缓冲液A(10mM HEPES,50mM NaCl,pH 7.0)平衡层析柱;上样后,先用预洗液B(10mM HEPES,140mM NaCl,pH 7.0)预洗2倍体积,再用洗脱液C(10mM HEPES,210mM NaCl,pH 7.0)等度洗脱,收集洗脱峰。用缓冲液D(10mM HEPES,1M NaCl,pH 7.0)清洗和再生层析柱。层析图见图1,SDS-PAGE图见图5;测定酶活性。
3、Phenyl HP柱层析
Phenyl HP柱规格为柱高22.8cm×直径5cm,柱体积447ml(GE公司)。用样品处理液[5M(NH4)2SO4,0.1M CaCl2]将Q sepharose FF柱层析收集的目的蛋白平衡至(NH4)2SO4终浓度1M,CaCl2终浓度0.1mM。上样前,用至少5倍体积的缓冲液A[10mM HEPES,1.1M(NH4)2SO4,0.1mM CaCl2,pH 7.0]平衡层析柱;上样后,用洗脱液B[10mM HEPES,700mM(NH4)2SO4,0.1mM CaCl2,pH 7.0]等度洗脱。用灭菌去离子水清洗和再生层析柱。层析图见图2,SDS-PAGE图见图5;测定酶活性。
4、CHT I型柱层析
CHT I型柱柱高15cm×直径5cm,柱体积294ml(Biorad公司)。用样品稀释液(10mM NaAC,5mM NaH2PO4,pH 7.0)将Phenyl HP柱层析收集的目的蛋白稀释至电导≤10mS/cm。比较稀释前后目的蛋白的总活性。上样前,用至少5CV缓冲液A(5mM NaH2PO4,10mM NaAC,50mM NaCl,0.1mM CaCl2,pH 7.0)平衡层析柱;上样后,用洗脱液B(50mM NaH2PO4,10mM NaAC,50mM NaCl,0.1mM CaCl2,pH 7.0)等度洗脱。用400mM PB清洗和再生层析柱。层析图见图3,SDS-PAGE图见图5;
5.SP sepharose HP柱层析
SP sepharose HP柱的规格为柱高15cm×直径2.6cm,柱体积79ml(GE公司)。用样品稀释液(20mM NaAC,pH 5.2)将CHT I型柱层析收集的目的蛋白缓慢稀释至电导≤8mS/cm。上样前,用至少5倍体积的缓冲液A(20mM NaAC,50mM NaCl,pH 5.2)平衡层析柱;上样后,用洗脱液B(20mM NaAC,110mM NaCl,pH 5.2)等度洗脱。用缓冲液C(20mM NaAC,1M NaCl,pH 5.2)清洗和再生层析柱。层析图见图4,SDS-PAGE图见图5;图5中:M为marker;Q FF泳道包括:1(柱前)、2(柱后)、3(预洗)、4(洗脱)和5(柱清洗);Phenyl HP泳道包括:6(柱前)、7(柱后)、8(预洗)、9(洗脱)和10(柱清洗);CHT Ⅰ型泳道包括:11(柱前)、12(柱后)、13(洗脱)和14-15(柱清洗);SP HP泳道包括:16(柱前)、17(柱后)、18-19(洗脱)和20(柱清洗);黑三角表示目的蛋白所在位置。从图5中可看出4步层析中目的蛋白的纯化情况,在第2步Phenyl HP层析后,目的蛋白已被富集,能够占到全部蛋白的75%左右。在第3步CHT I层析后,可获得纯度大于90%的目的蛋白。在第4步HP SP层析后,即可获得纯度大于98%的目的蛋白。
6.用缓冲液(10mM His,140mM NaCl,pH6.5)将上步收集的目的蛋白溶液超滤换液并浓缩至终浓度为1.0mg/ml,进行重组人透明质酸酶质量研究的各项分析。
7.透明质酸酶活性测定
实验方法参考《中国药典》(2015版)Ⅱ部,通则1207。
(1)将透明质酸酶标准品用酶稀释液(20mM NaH2PO4,77mM NaCl,0.01%BSA,pH7.0)稀释至6、5、4、3、2、1、0IU/ml;预估重组人透明质酸酶样品活性,用酶稀释液稀释2万倍至标准曲线范围区间;
(2)取标准品和样品各40μL,加入96孔板,每个稀释度2复孔;
(3)用底物稀释液(300mM NaH2PO4,pH 5.35)10倍稀释底物母液(0.3%透明质酸)制成底物工作液,将酶和底物工作液放置到37℃恒温孵育箱预热10min;
(4)取40μL底物工作液加入上述标准品和样品,混匀,放入37℃恒温孵育箱中反应45min,反应结束后立即加入140μL酸性牛血清白蛋白溶液(24mM醋酸钠,79mM醋酸,0.1%BSA,pH 3.75),室温反应10min后使用酶标仪测定吸光度A600;
(5)以酶活性单位的效价为横坐标,吸光度A600为纵坐标,绘制标准曲线,回归得线性方程;
(6)将样品吸光度代入方程计算即可得到样品中透明质酸酶的活性。
收获的细胞培养液经中空纤维柱和超滤浓缩后,依次经过Q FF柱、Phenyl HP柱、CHTⅠ型柱和SP HP柱四步层析,得到的目的蛋白SDS-PAGE纯度>99.9%(图5),总活性3×106IU。以目前国外上市的重组人透明质酸酶制剂规格150~200U/支计,一次22L细胞培养液可制备1万支制剂,能够满足产业化制备的需求。表1列出了各纯化步骤的目的蛋白回收情况。
表1、目的蛋白纯化分步效率及总收率
实施例2、重组人透明质酸酶的质量研究
对利用实施例1中的纯化方法得到的重组人透明质酸酶原液进行了以下质量研究。
1、重组人透明质酸酶的比活性
透明质酸酶标准品溶液活性与吸光度之间是线性回归关系,在0~6IU/mL浓度范围内,数据呈线性关系。重组人透明质酸酶的比活性为1.1×105IU/mg。图6为透明质酸酶活性参考品的标准曲线。
2.纯度
利用Image J软件分析,SDS-PAGE纯度为99.9%(见图7),图7中,M为marker;泳道1为重组人透明质酸酶(黑三角所示位置)。;利用Waters HPLC 2487分析仪检测了分子排阻纯度(SEC-HPLC),分析柱为TSK G3000,纯度为100%(见图8)检测了疏水分析纯度(HIC-HPLC)。分析柱为TSK phenyl 5PW,纯度为100%(见图9)。
3.等电点
采用水平等电聚焦电泳仪(GE公司)检测了重组人透明质酸酶的等电点为5.6,与理论预测值一致(见图10)。图10中,1:重组人透明质酸酶M:pI标准蛋白
4.N端及C端氨基酸序列及分子量
对重组人透明质酸酶样品进行酶解,利用RP-HPLC-ESI-MS对氨基酸序列进行确证,并与理论序列进行比较,考察蛋白的一级结构序列覆盖率,一级结构覆盖率为98%,N端15个氨基酸序列与理论序列完全匹配,C末端氨基酸序列缺失最后一个酪氨酸(Y)。质谱检测重组人透明质酸酶脱糖分子量为50937.0Da,也显示其C末端存在酪氨酸(Y)缺失,重组人透明质酸酶脱糖理论上的分子量为50937.8Da,分子量偏差小于1Da。
5.杂质分析
采用Cygus CHO宿主蛋白质检测试剂盒检测,宿主细胞蛋白残留为0.006%,低于0.01%的药典要求;采用定量PCR方法检测CHO宿主细胞残留DNA,外源DNA残留为20pg/剂,小于100pg/剂的标准药典要求。
- 还没有人留言评论。精彩留言会获得点赞!