一种酯酶EST112‑2及其编码基因和应用的制作方法
本发明属于生物化工和生物技术领域,具体涉及一种酯酶EST112-2及其编码基因和应用。
背景技术:
:
手性化合物虽然原子组成是一样的,但它们的立体结构却互为镜像,在生物学和药学性质上却相差甚远。比如L-薄荷醇具有清凉味,而D-薄荷醇则发霉味;S-天冬酰胺是甜的,R-天冬酰胺是苦的;R型的“反应停”是孕妇用镇痛药和止痛药,而S型的“反应停”对胎儿则有致畸作用,历史上曾出现使用反应停导致大规模新生儿畸形的事件。可见合成手性药物过程中,前体原料的光学纯度是重要环节。
手性化合物的合成主要有:(1)化学法,即利用对映体的物理和化学性质的差异进行分离。通常有盐析法、包结法、以及组合拆分。其缺点是要求对映体之间的性质差异要大,适用的化合物不多;(2)合成法,通过设计反应来进行手性化合物的化学合成。这种方法缺点在于反应过程通常比较剧烈,耗费能量,而且反应中使用大量有毒的有机溶剂。(3)色谱拆分,这种方法是利用填料对手性对映体吸附性质的差异来实现,其缺点是设备昂贵,普及性较差。
叔醇是非常重要的手性药物中间体,如抗HIV药物依法韦仑以及半合成紫杉醇的合成中都需要手性叔醇。手性叔醇的合成通常比较困难,需要使用大量的有机溶剂和有毒的催化剂,而且反应条件剧烈。而酶是一种环境友好的催化剂,反应条件相对温和近年来,通过脂肪酶、酯酶、蛋白酶、脱氢酶都成功地获得了手性叔醇。脂肪酶和酯酶不需要辅基进行的催化,而且来源广泛,通过简单水解反应就能获得手性醇,受到了研究人员的格外关注。
芳樟醇属链状萜烯醇类,羟基位于在γ位,也是一种重要的叔醇类化合物。芳樟醇因香气柔和、浓青带甜,还有抗菌、杀螨的作用而深受人们喜爱。芳樟醇是一种广泛使用的香料,常被添加在肥皂、洗衣粉和变性剂中。芳樟醇有两种α和β两种异构体,两者气味和生理功能有较大区别。左旋异构体偏甜润,右旋异构体偏清青;左旋芳樟醇有镇静作用,而右旋芳樟醇则起到兴奋神经作用。因此,获得高光学纯度的芳樟醇是提高其应用价值的重点。
酯酶的来源非常广泛,微生物、植物和动物中都有存在。酯酶作为生物催化剂多数可作用非天然底物,而且可拆分的底物多,立体选择性高,不需要辅助因子,是一种重要的手性催化剂。但是大多数酯酶不能够识别叔醇酯,这就为手性叔醇的制备带来的障碍。近期一些研究表明,在氧阴离子穴(oxyanion hole)附近含有GGG(A)X基序对于叔醇酯的结合至关重要,是脂肪酶/酯酶是否具有手性催化叔醇的重要特征。
技术实现要素:
:
本发明的目的是提供一种新的酯酶EST112-2及其编码基因和应用。
本发明是从一株筛选自深海样品的嗜冷杆菌(Psychrobacter sp.)112中开发得到一种新的酯酶EST112-2及其编码基因酯酶基因EST112-2,构建了含有酯酶基因EST112-2的重组表达载体和基因工程菌,培养基因工程菌后获得酯酶EST112-2,其可应用于催化酯类水解和制备(+)-芳樟醇。
本发明的第一个目的是提供一种酯酶EST112-2,其氨基酸序列如SEQ ID NO.2所示。
本发明的第二个目的是提供一种编码所述的酯酶EST112-2的酯酶基因EST112-2。
优选,所述的酯酶基因EST112-2的核苷酸序列如SEQ ID NO.1所示。
本发明还提供了一种含有所述的酯酶基因EST112-2的重组表达载体。
优选,所述的表达载体为pET-28a(+)载体。
本发明还提供了一种含有所述的酯酶基因EST112-2的基因工程菌。
优选,所述的基因工程菌为大肠杆菌BL21(DE3)。
本发明的第三个目的是提供所述的酯酶EST112-2在催化酯类水解中的应用。
优选,所述的酯酶EST112-2在催化拆分(±)-乙酸芳樟酯反应得到(+)-芳樟醇中的应用。
本发明的第四个目的是提供所述的酯酶EST112-2在耐受Co2+、Ca2+、Ba2+、Mg2+、Tween-20、Triton-100、EDTA、正己烷、环己烷、甲醇、二氯甲烷和/或DMSO环境下进行催化的应用。
本发明的酯酶EST112-2来自深海样品中筛选得到的一株嗜冷杆菌(Psychrobacter sp.)112,保存在中国科学院南海海洋研究所。本发明利用生物信息学分析方法,从基因组测序的嗜冷杆菌(Psychrobacter sp.)112中克隆得到酯酶基因EST112-2,全长为1401bp(从起始密码子到终止密码子),其编码的酯酶EST112-2的氨基酸序列如SEQ ID NO.2所示,含有466个氨基酸。将酯酶基因EST112-2与表达载体pET-28a(+)连接后转化大肠杆菌BL21(DE3)感受态细胞,培养并诱导表达后,得到了重组表达的酯酶EST112-2,实现了酯酶基因EST112-2在大肠杆菌BL21(DE3)中的异源可溶性表达。该酯酶EST112-2可用于制备(+)-芳樟醇,利用重组表达的酯酶EST112-2作为催化剂,得到了光学纯度70%以上的(+)-芳樟醇。本发明的酯酶EST112-2可用于生物医药、化妆品和精细化工等领域,具有非常大的应用价值。
附图说明:
图1是酯酶EST112-2的SDS-PAGE电泳图,其中,M为蛋白marker,CK为IPTG诱导前的含有pET-28a(+)-EST112-2质粒的大肠杆菌BL21(DE3)粗蛋白,泳道1为IPTG在22℃诱导后的含有pET-28a(+)-EST112-2的大肠杆菌BL21(DE3)粗蛋白,泳道2为IPTG在16℃诱导后的含有pET-28a(+)-EST112-2的大肠杆菌BL21(DE3)粗蛋白,泳道3为Ni柱纯化后的酯酶EST112-2。
图2是不同侧链长度的对硝基苯酚酯对酯酶EST112-2酶活性的影响。
图3是酯酶EST112-2和其它第IV家族脂水解酶构建的进化树。
图4是酯酶EST112-2氨基酸序列在pubmed上的比对结果。
图5是酯酶EST112-2氨基酸序列和其它第IV家族脂水解酶多序列比对,其中,黑色圆圈表示预测的活性中心。
图6是pH对酯酶EST112-2酶活力和稳定性的影响。
图7是温度对酯酶EST112-2酶活性的影响。
图8是温度对酯酶EST112-2稳定性的影响。
图9是金属离子对酯酶EST112-2酶活性的影响。
图10是温度对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响。
图11是离子强度对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响。
图12是底物浓度对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响。
图13是反应时间对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响。
图14是酯酶EST112-2拆分(±)-乙酸芳樟酯的GC图,A为等摩尔(-)-芳樟醇、(±)-芳樟醇和(±)-乙酸芳樟酯混合标准样品GC图;B为酯酶EST112-2催化(±)-乙酸芳樟酯的不对称水解GC图;其中1代表(-)-芳樟醇,2代表(+)-芳樟醇,3代表(±)-乙酸芳樟酯。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:酯酶基因EST112-2引物设计及开放阅读框边界确定
提取嗜冷杆菌(Psychrobacter sp.)112的基因组DNA,经16S rRNA验证无误后,交至上海美吉生物科技有限公司测序。利用生物信息学手段对基因组进行注释,分析其中的酯酶基因,确定了其中酯酶基因EST112-2的开放阅读框,其具有1401bp的碱基,其核苷酸序列如SEQ ID NO.1所示,其编码的酯酶EST112-2具有466个氨基酸,具体序列如SEQ ID NO.2所示,通过信号分析工具http://www.cbs.dtu.dk/services/SignalP/,分析发现其中没有信号肽,引物信息如下:正向引物:5’-CACGGATCCATGTCTCACTCAACCATATCGCTCAATACC-3’,下划线部分为BamH I酶切位点;反向引物:5’-CCGCTCGAGTTAGGCCGCTAACTGCCC-3’,下划线部分为Xho I酶切位点。
实施例2:酯酶基因EST112-2的克隆及载体构建
2.1PCR扩增
将实施例1设计的引物(正向引物:5’-CACGGATCCATGTCTCACTCAACCATATCGCTCAATACC-3’;反向引物:5’-CCGCTCGAGTTAGGCCGCTAACTGCCC-3’)送至上海生物工程有限公司合成引物,合成的引物使用TE稀释到10μM,提取嗜冷杆菌(Psychrobacter sp.)112的基因组DNA作为DNA模板,建立如表1所示的PCR反应体系:
表1 PCR反应体系
使用以下PCR扩增程序扩增酯酶基因EST112-2:a.95℃变性5min;b.95℃变性1min,55~65℃退火0.5min,72℃延伸3min 30s,进行30个循环;c.72℃延伸10min,冷却到10℃。
将PCR产物在1%琼脂糖凝胶中,120V电压下电泳20min,置于凝胶成像系统中观察。回收1400bp左右的条带。PCR产物按照胶回收试剂盒的方法进行回收,使用20μL无菌水洗脱,得到纯化回收的PCR产物。
2.2酶切
将纯化回收的PCR产物使用以下酶切体系进行双酶切,酶切时间1h。酶切体系为:BamH I 1μL,Xho I 1μL,PCR产物<0.3μg,灭菌ddH2O加至30μL。酶切后纯化回收得到的经过双酶切的PCR产物。
质粒pET-28a(+)的双酶切:挑取含有质粒pET-28a(+)的大肠杆菌DH5α单菌落,过夜培养。使用质粒提取试剂盒提取质粒,用BamH I和Xho I按以下酶切体系进行双酶切,酶切时间1h。酶切体系为:BamH I 1μL,Xho I 1μL,质粒pET-28a(+)<1μg,灭菌ddH2O加至20μL。酶切后纯化回收得到经过双酶切的pET-28a(+)载体。
上述双酶切使用的限制性内切酶为Thermo公司生产的快速内切酶。酶切后的纯化回收使用核酸纯化回收试剂盒(Magen,Hipure Gel Pure DNA Micro Kit),质粒提取试剂盒为上海捷瑞生物工程有限公司的质粒小量制备试剂盒,操作方法按其使用说明书。
2.3连接
将经过双酶切的PCR产物和pET-28a(+)载体按照3:1的摩尔比例进行连接。连接使用的T4连接酶购自北京全式金生物技术公司,连接使用的酶量为5U/5μL连接体系,连接温度为22℃,连接时间20min。由此得到连接产物。
2.4转化及筛选
取5μL连接产物加入到50μL大肠杆菌DH5a感受态细胞中,冰浴30min,于42℃水浴锅热激90s,冰浴2min后加入500μL LB液体培养基,37℃200rpm培养1h。培养物4000rpm离心1min后,弃400μL上清,余下的上清与菌体进行混匀后涂布于含50μL/mL卡那霉素的LB平板,培养20h后挑选单菌落。单菌落于5mL LB培养基中过夜培养后提取质粒,进行双酶切验证,酶切片段与基因大小相同的即为阳性克隆。
2.5基因核苷酸序列测定
将获得的阳性克隆送至上海美吉生物医药有限公司进行测序,测序结果与酯酶基因EST112-2的核苷酸序列(如SEQ ID NO.1所示)进行比对,结果完全正确,确认得到带有酯酶基因EST112-2的pET-28a(+)质粒(命名为pET-28a(+)-EST112-2),可用于进行下一步试验。
实施例3:酯酶EST112-2在大肠杆菌BL21(DE3)中的高效表达
3.1大肠杆菌BL21(DE3)感受态细胞制备
a、将大肠杆菌BL21(DE3)菌种接入5mL LB液体培养基中,37℃过夜摇培,250rpm;
b、按1%体积比的接种量将液培管中过夜摇培后的大肠杆菌BL21(DE3)菌液接种到LB摇瓶中,37℃摇培3h(≥300rpm),得到原培养物;
c、将培养好的摇瓶在冰水中迅速冷却至0℃,将原培养物分装至冰预冷的离心管(50mL),冰置数分钟;
d、4℃,4000rpm离心10min回收细胞,将残留液空干(迅速);
e、用冰预冷的10mL 0.1M的CaCl2重悬细胞,4℃,4000rpm离心10min回收细胞;
f、用10mL 0.1M的CaCl2重悬细胞,冰浴1h以上;
g、4℃,4000rpm离心10min回收细胞;
h、每50mL原培养物用2mL含体积分数15%甘油的CaCl2来重悬,分装于1.5mL离心管,200μL每管,-80℃保藏。由此得到大肠杆菌BL21(DE3)感受态细胞。
3.2转化
取实施例2得到的pET-28a(+)-EST112-2质粒0.5~1μL与50μL大肠杆菌BL21(DE3)感受态细胞混合,冰浴30min,于42℃水浴锅热激90s,冰浴2min后加入500μL LB液体培养基,37℃200rpm培养1h。培养物离心后涂布50μL/mL的卡那霉素LB平板,培养20h后挑选单菌。由此得到含有pET-28a(+)-EST112-2的大肠杆菌BL21(DE3)。
实施例4:酯酶EST112-2的表达和纯化
4.1蛋白诱导
含有pET-28a(+)-EST112-2的大肠杆菌BL21(DE3)在LB培养基中37℃培养至OD600为0.5左右,加IPTG至浓度0.5mM,22℃培养16h。300mL菌液4000rpm,4℃离心10min,收集菌体,用30mL(50mM,pH 7.2)NaH2PO4/Na2HPO4缓冲液重悬菌体,超声400w,超4s,停6s,破碎10min分钟,4℃,10000rpm离心10min,收集上清。上清于-80℃冷冻12h,取出后立即使用冷冻干燥机,冷冻干燥30h左右,即得冻干的酶粉,-20℃储存备用。
4.2酯酶EST112-2的纯化
用镍离子亲和层析柱对4.1中收集的上清进行纯化得纯化的酯酶EST112-2(见图1),酯酶EST112-2的理论分子量为55kDa,等电点pI为7.0。SDS-PAGE结果表明,酯酶EST112-2能使用Ni柱亲和层析进行纯化,纯化后的酯酶EST112-2分子量大小符合理论值。另外,结果还说明,酯酶EST112-2能够在E.coli BL21(DE3)中实现可溶性表达,但是22℃和16℃诱导的上清中的酯酶EST112-2表达量没有太大区别。经Ni柱纯化的蛋白纯度较高,脱盐后能够满足后续基本酶学性质测定的要求。
具体实施方案如下:使用5mM的咪唑洗脱5个柱体积,20~40mM咪唑洗脱10个柱体积,最后使用300mM咪唑洗脱5个柱体积,收集中间3.5mL。用脱盐柱Sephadex G25对上述酯酶EST112-2进行脱盐,具体操作方法参照GE公司的操作手册进行。
4.3酯酶EST112-2酶活测定
酯酶EST112-2酶活测定采用对硝基苯酚酯,具体方法如下:①配制10mM的对硝基苯酚酯;②在1mL反应体系中加入940μL Tris-HCl buffer(50mM,pH 8.0),40μL乙醇,10μL酯酶EST112-2纯酶液(约2μg)和10μL对硝基苯酚酯溶液(10mM)。③于35℃下,3~5min后,410nm测定吸光度。
酶活单位定义:1min内水解对硝基苯酚酯,释放1μmol对硝基苯酚所需的酶量定义为一个酶活单位。
实施例5:酯酶EST112-2的酶学性质
5.1酯酶EST112-2定性
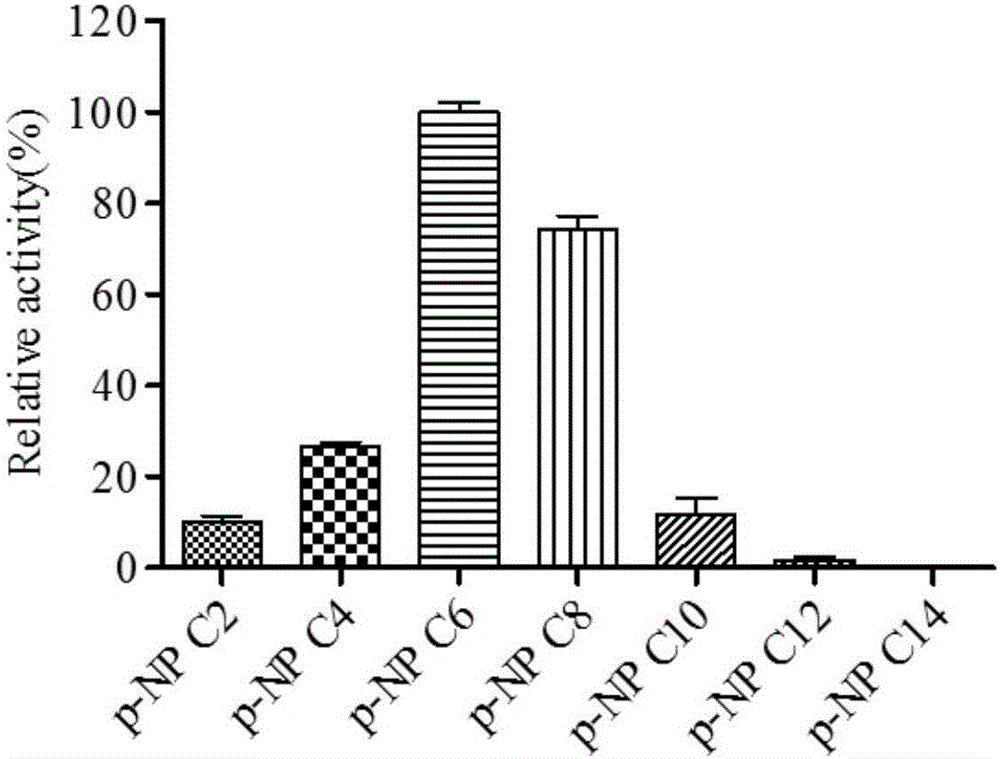
按照4.3的测定条件,比较酯酶EST112-2对不同侧链长度的对硝基苯酚酯的水解作用,结果见图2。可以发现,酯酶EST112-2对对硝基苯酚己酸酯(p-NP C6)的水解活性最大,而对对硝基苯酚乙酸酯(p-NP C2)和对硝基苯酚丁酸酯(p-NP C4)的水解活性则较弱。对于10个碳以上的对硝基苯酚酯的活力很微弱,其最适底物为对硝基苯酚己酸酯(p-NP C6)。而且酯酶EST112-2不能够水解橄榄油,因此根据酯水解的特点和定义,酯酶EST112-2为一种酯酶。
5.2多态性分析
将酯酶EST112-2(其序列如SEQ ID NO.2所示)和其它HSL家族酯水解酶构建进化树(图3),可以清晰的发现酯酶EST112-2和HSL家族酯水解酶亲缘关系较近,尤其是GDSAG亚家族酯水解酶,因此酯酶EST112-2应属于HSL家族GDSAG亚家族酯水解酶。通过Blast比对发现和其氨基酸序列相似性最大的3个蛋白分别是Ps.glacincola的一个脂肪酶(相似度,73%,NCBI序列号:WP_055125642),Ps.sp.酯酶/脂肪酶(相似度73%,NCBI序列号:GAF59704),Ps.sp.的一个脂肪酶(相似度73%,NCBI序列号:WP_060492094)(图4)。通过Swiss-Modle进行结构模拟,与其结构匹配度较高的是耐热菌Rhizomucor miehe中的一个酯酶(PDB:4wy5,相似度:27.83%)。
5.3活性中心分析
将酯酶EST112-2氨基酸序列与HSL家族酯水解酶进行多序列比对,结果发现,酯酶EST112-2氨基酸序列有HGGG和GDSAG基序存在,是符合HSL酯水解酶特征,这一结果和步骤5.2的进化树分析结果一致。另外通过同源建模可以推测其催化中心分别为:Ser282-Asp397-H472(图5)。
5.4pH对酯酶EST112-2酶活力和稳定性的影响
配制pH为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0的缓冲液,浓度均为50mM。将4.3的测定条件中的缓冲液(Tris-HCl buffer(50mM,pH 8.0))分别替换为上述的不同pH的缓冲液,然后以对硝基苯酚己酸酯作为底物,测定不同pH的缓冲液对酯酶EST112-2的酶活力和稳定性的影响(图6),在其它条件一致的情况下,酯酶EST112-2在pH7.5的50mMTris-HCl活力最高,当缓冲液pH低于7.0或者高于8.0时活力都比7.5低,尤其是在酸性条件下酯酶EST112-2的水解活性较低。酯酶EST112-2在不同缓冲液中分别处理12h后,按4.3中的测定方法(以对硝基苯酚己酸酯作为底物)测定酯酶EST112-2酶活,结果如图6。结果说明酯酶EST112-2对不同pH的缓冲液均有较好的耐受性,所有的处理的相对酶活均保持在60%以上,尤其是在pH 7.5的50mM Tris-HCl中酯酶EST112-2的稳定性最好。
5.5温度对酯酶EST112-2酶活力和稳定性的影响
以pH7.5的50mM Tris-HCl作为缓冲液,对硝基苯酚己酸酯作为底物,按照4.3中的反应体系,在不同温度(4~60℃)下测定酯酶EST112-2酶活,结果见图7。可见温度对酯酶EST112-2的水解活力有较大影响,在40℃时酯酶EST112-2相对酶活达到最大,4℃和60℃时酶活最低,分别为40℃时的4.3%和7.6%,因此酯酶EST112-2的最适温度为40℃。将酯酶EST112-2在不同温度(4~60℃)下预处理,间隔一定时间取出按4.3中的测定方法测酶活,结果见图8。可见酯酶EST112-2在4~40℃范围内保持较高活性,而在高于50℃时处理20min酶活仅为21.6%,60℃时处理30min基本测定不到酶活。
5.7金属离子对于酯酶EST112-2酶活的影响
以pH7.5的50mM Tris-HCl为溶剂配制不同金属离子溶液,每种金属离子浓度均为1mM,将酯酶EST112-2在各种金属离子溶液中4℃下处理12h;以不加金属离子的pH7.5的50mM Tris-HCl溶液为对照(Control)。再按照4.3中的测定方法(以对硝基苯酚己酸酯作为底物)测定酶活,实验比较了9种二价金属离子对酯酶EST112-2酶活的影响,结果见图9。Co2+、Ca2+、Ba2+、Mg2+对酯酶EST112-2酶活影响较小,而Cu2+、Zn2+对酯酶EST112-2酶活的抑制作用较大。
5.8表面活性剂和抑制剂对酯酶EST112-2酶活的影响
将酯酶EST112-2分别加入到表2中的表面活性剂和抑制剂溶液中处理12h(对照为将酯酶EST112-2加入到蒸馏水中处理12h,其他溶液的浓度为体积分数),然后按照4.3的测定方法(以pH7.5的50mM Tris-HCl作为缓冲液,对硝基苯酚己酸酯作为底物)测定酶活。实验比较了不同表面活性剂和抑制剂对酯酶EST112-2酶活的影响,结果见表2。酯酶EST112-2对非离子型表面活性剂Tween-20和Triton-100的耐受性较强,处理12h后酶活分别为对照的81%和96%,而变性剂SDS和盐酸胍对酶活抑制作用强烈,酶活基本上被完全抑制。EDTA对酶活影响不大,处理12h后酶活分别为对照的97%,说明酯酶EST112-2不是一个金属离子依赖的酶。
表2表面活性剂和抑制剂对酯酶EST112-2酶活的影响
5.9有机溶剂对酯酶EST112-2酶活的影响
将酯酶EST112-2分别加入到表3中的有机溶剂溶液中处理12h(对照为将酯酶EST112-2加入到蒸馏水中处理12h,其他溶液的浓度按体积分数计),然后按照4.3的测定方法(以pH7.5的50mM Tris-HCl作为缓冲液,对硝基苯酚己酸酯作为底物)测定酶活,结果见表3。不同溶剂对酯酶EST112-2酶活的影响较大,正己烷、环己烷、甲醇和DMSO对酯酶EST112-2酶活有促进作用,特别是DMSO,剩余酶活为对照的123%。而乙醇、异丙醇、正丙醇、正戊醇、1,4-二氧六环和苯对酶活抑制强烈,尤其是正丙醇,剩余酶活仅有0.2%。
表3有机溶剂对酯酶EST112-2酶活的影响
5.10酶的动力学参数
以pH7.5的50mM Tris-HCl作为缓冲液,对硝基苯酚己酸酯作为底物,反应温度为40℃,按照4.3的测定方法,测定酯酶EST112-2的特异性酶活为207±6U/mg·min,采用Lineweaver–Burk双倒数法测定Km和Vmax,得Y=0.7312X+0.3617,R2=0.9934;
Km=2.76±0.08mM,Vmax=2.02±0.02mM/mg·min。酯酶EST112-2理论分子量为55kDa,pI=7.0,因此Kcat=189.8±0.6S-1。
实施例6:酯酶EST112-2在拆分(±)-乙酸芳樟酯中的应用
本法采用在水相中的水解(±)-乙酸芳樟酯获得(+)-芳樟醇。酶法拆分(±)-乙酸芳樟酯受到溶液pH、反应温度、助有机溶剂种类、底物浓度和反应时间等诸多条件的影响。本发明对上述参数进行了优化,具体的条件为:500μL的反应体系包括10mg冻干的酯酶EST112-2酶粉,498μL缓冲液(pH 7.5 50mM Tris-HCl),2μL(±)-乙酸芳樟酯(约20mM)。以200rpm反应12h,反应结束后用500μL乙酸乙酯萃取12h,用GC检测(±)-乙酸芳樟酯的含量和立体选择性。实验采用单因素验证的方式进行优化,即每一步的最优条件立即用于下一步实验的优化,具体步骤包括:
6.1温度对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
温度对(+)-芳樟醇的产物对映体过量值(e.e.p)和得率(Yield)有较大影响,结果见图10。在15~30℃范围内,温度对(+)-芳樟醇的e.e.p值的影响不大,但是(+)-芳樟醇的得率在30℃时达到最大,为79%。而继续升高温度,转化率明显会下降,因此最佳的反应温度为30℃。
6.2pH对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
实验比较了不同50mM的pH的缓冲液对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响,由表4可见,e.e.p值和转化率在pH7.5时达到最高,尤其是在Tris-HCl缓冲液中,e.e.p最大可达55%,转化率达80%。
表4pH对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
注:a缓冲液为50mM NaAc-Hac,b缓冲液为50mM Na2HPO4-NaH2PO4,c缓冲液为50mM Tris–HCl
6.3离子强度对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
实验比较0.05~1.0M的pH 7.5的Tris-HCl对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响(图11),结果发现相对于转化率而言,e.e.p值对离子强度不敏感。在0.1~0.6M保持在较高水平,(+)-芳樟醇的得率最高在0.1M,为81%,e.e.p值为56%。
6.4有机共溶剂对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
实验比较了不同有机溶剂对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解反应的影响,结果见表5。在所有的溶剂中,二氯甲烷能够明显提高(+)-芳樟醇的e.e.p值。接着继续对二氯甲烷浓度进行优化,结果5%的浓度能够提高(+)-芳樟醇的得率(Yield),而(+)-芳樟醇的e.e.p值保持在68%。
表5有机共溶剂对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
6.5酶量对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
实验比较了20~80mg/mL的酶量对底物的拆分效果(表6),在保持转化率相对稳定的情况下,60mg/mL的酶量需要10h,继续增加酶量无益于缩短反应时间和(+)-芳樟醇的光学纯度,因此最适的酶量应选择在60mg/mL。
表6酶量对酯酶EST112-2拆分(±)-乙酸芳樟酯的影响
6.6底物浓度对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
实验比较酯酶EST112-2对不同浓度的(±)-乙酸芳樟酯的手性拆分效果,结果如图12。当底物浓度在5~30mM时,(±)-乙酸芳樟酯的转化率变化不大,但是当底物浓度超过30mM时,(±)-乙酸芳樟酯的转化率有一个明显下降的过程,从99%下降到81%,说明底物抑制了酯酶EST112-2水解(±)-乙酸芳樟酯的反应,因此,60mg/mL的冻干的酶粉的最适底物浓度为30mM。
6.7反应时间对酯酶EST112-2催化的(±)-乙酸芳樟酯不对称水解的影响
实验测定12h内酯酶EST112-2对(±)-乙酸芳樟酯手性拆分的效果,结果如图13。随着反应时间的进行,(±)-乙酸芳樟酯被不断水解,(+)-芳樟醇产率不断提高,但是光学纯度却不断下降,在4h内(+)-芳樟醇的光学纯度可以到达70%,(±)-乙酸芳樟酯转化率可以达到32%,反应12h后,(+)-芳樟醇的光学纯度可以到达54%,(±)-乙酸芳樟酯转化率达98%,可见要想获得光学纯度为>70%的(+)-芳樟醇,反应时间应控制在4h以内。
实施例7:(+)-芳樟醇和(±)-乙酸芳樟酯的检测
具体分析条件为:采用福利气相色谱仪,配有手性柱(30m×0.25mm Cyclosil B chirl column)和氢离子火焰检测器。仪器分析条件设置为:注射器温度220℃,检测器温度250℃,载气为N2,流速1.2mL/min,采用梯度升温进行分析:100℃保持1min,10℃/min到220℃,保持1min(图14)。
- 还没有人留言评论。精彩留言会获得点赞!