一种喹啉类衍生物及其制备方法和在制备抗肿瘤药物中的应用与流程
本发明属于药物化学领域,更具体地,涉及一种喹啉类衍生物及其制备方法和在制备抗肿瘤药物中应用。
背景技术:
癌症是威胁人类健康和生命安全的主要疾病之一。据统计,全世界每年新增癌症患者达600万人左右。抗癌药物的研究与开发一直是化学家和药物学家关注的热点,寻找高效、高选择性、毒副作用小的抗癌药物是药物研究开发的重要方向之一。
以DNA为靶点设计合成抗癌药物,特别是针对具有重要生理意义的癌基因c-myc启动子区中特殊核酸高级结构设计合成小分子抑制剂,是发展新型抗癌药物的重要方向。根据目前的报道,与c-myc基因中特殊核酸高级结构相互作用的小分子具有以下结构特点:有平面的芳环结构;一条或多条可以与G-四链体DNA的Loop结合的侧链。它的抗癌作用机制主要是通过与癌基因DNA G-四链体结构相互作用,抑制癌基因c-myc转录表达,从而抑制癌细胞的增殖。
吲哚喹啉类化合物是自然界中比较稀少的一种生物碱,具有四个平面芳环的结构,quindoline和cryptolepine是该类化合物的典型代表,这两种化合物分别于1977年和1929年从西非植物Cryptilepis sanguinolenta中首次分离出来。本研究小组先后报道了一系列11位氨基侧链取代的吲哚喹啉类衍生物(J.Med.Chem.2005,48,7315-7321;J.Med.Chem.2008,51,6381-6392)通过与端粒G-四链体DNA相互作用抑制端粒酶活性,对多种癌细胞株具有显著的抑制作用。
尽管吲哚喹啉类化合物的抗癌效果已经得到了证实,但是由于目前已有的多种吲哚喹啉类化合物对抗淋巴癌特定靶点(c-myc启动子中的G-四链体DNA)的选择能力仍有待提高,同时由于自然界中吲哚喹啉类化合物的资源有限,目前,吲哚喹啉类化合物在抗癌方面的应用仍存在较大的限制。
技术实现要素:
本发明的目的是针对现有技术的不足,提供一种毒性小,选择性高且抗癌效果好的喹啉类衍生物;
本发明的另一个目的在于提供上述衍生物的制备方法,以及该类衍生物在制备抗肿瘤药物中的应用。
本发明根据一些与c-myc G-四链体DNA相互作用的小分子化合物(白叶藤碱衍生物)的结构特征,在苯并呋喃喹啉为母体骨架的11位利用点击化学引入含三氮唑环侧链,得到与c-myc G-四链体DNA相互作用的喹啉类衍生物。
本发明的上述技术目的通过以下技术方案实现:
本发明提供了一种喹啉类衍生物,所述喹啉类衍生物的结构式如式(I)或式(II)所示,
其中,R代表羟基、苯基、取代苯基、环烷基、胺基、取代胺基、五元或六元杂环基、C1-8烷基或取代的C1-8烷基、卤基或糖基;
X为N、O或S;Y为C1-3烷基或氢,n为0~6中任意一个整数。
优选地,R代表羟基、苯基、取代苯基、C3-8环烷基、胺基、取代胺基、五元或六元杂环基、C1-8烷基或取代的C1-8烷基或糖基。
优选地,R代表羟基、苯基、取代苯基、C3-8环烷基、胺基、取代胺基、含氮的五元或六元杂环基、含氧的五元或六元杂环基、C1-5烷基或取代的C1-5烷基或糖基。
优选地,取代基选自卤基、羟基、氰基、C1-5烷基、C1-5烷氧基、硝基、胺基、C1-6单烷基氨基、C1-6二烷基氨基、C5-8单环烷基氨基、C5-6单杂环基氨基、C5-6单芳基氨基、C1-6烷基酰氨基、C5-6芳基酰氨基、C1-6烷基酰氧基、羧基、C5-6芳香基或C5-6杂环基。
优选地,取代基选自C1-5烷基、羟基或C1-3烷基酰氧基。
优选地,R代表N,N-二甲基胺基,N,N-二乙基胺基,氨基、吗啡啉基,哌啶基,甲基哌嗪基,吡咯烷基,羟基,苯基,C1-5直链或支链烷基,环戊烷基、环己烷基或糖基。
优选地,所述糖基为β-D-核糖基、β-D-吡喃葡萄糖基、2,3,5-三-O-乙酰基-β-D-核糖基或2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖。
优选地,X为N或O;Y为甲基或氢。
本发明另外提供所述喹啉类衍生物的制备方法,当所述喹啉类衍生物为式(I)所示结构,且当X为O,Y为氢时,包括如下步骤:
S1.苯氧乙酸经氯化亚砜酰化与邻氨基苯甲酸反应得到化合物
S2.在多聚磷酸催化下环合得到化合物
S3.在DMF催化下与氯化亚砜进行氯代反应得到化合物
S4.在一水合对甲苯磺酸的催化下与炔丙胺发生取代反应得到化合物
S5.将与叠氮类化合物N3-R发生点击反应得到所述喹啉类衍生物
当所述喹啉类衍生物为式(II)所示结构,且当X为O,Y为甲基时,包括如下步骤:
S1.与碘甲烷反应,得到
S2.化合物与炔丙胺发生取代反应得
SM6.将与叠氮类化合物N3-R发生点击反应得到喹啉类衍生物
当所述喹啉类衍生物为式(II)所示结构,且当X为N,Y为甲基时,包括如下步骤:
S1.与碘甲烷反应得到
S2.化合物与炔丙胺发生取代反应得
S3.将与叠氮类化合物N3-R发生点击反应得到喹啉类衍生物
当所述喹啉类衍生物为式(I)所示结构,且当X为N,Y为氢时,包括如下步骤:
S1.邻氨基苯甲酸与氯乙酰氯发生取代反应得到化合物
S2.化合物与苯胺发生取代反应得到化合物
S3.在多聚磷酸催化下关环得到化合物
S4.用氯化亚砜氯代得到化合物
S5.在一水合对甲苯磺酸的催化下与炔丙胺发生取代反应得到化合物
S6.与叠氮类化合物N3-R发生点击反应得到所述喹啉类衍生物
本发明根据一些与癌基因c-myc G-四链体DNA结构相互作用的小分子化合物的结构特征,以苯并呋喃喹啉为基本母核,在母核11位引入一条侧链,同时利用点击化学在侧链中引入三氮唑环和不同末端基团,增强化合物与c-myc G-四链体DNA的loop的相互作用,同时提高其选择能力,从而设计出一系列与c-myc G-四链体DNA相互作用的喹啉类衍生物,降低癌基因c-myc的转录表达水平,达到抗肿瘤作用的目的。
本发明的所提供的喹啉类衍生物与c-myc G-四链体DNA具有很强的相互作用,实验显示该类衍生物能选择性抑制癌基因c-myc的转录翻译,从而抑制癌细胞的增殖和迁移,因此可用于制备抗肿瘤药物。
进一步地,将本发明提供的喹啉类衍生物应用于抑制淋巴瘤细胞,采用MTT法进行体外细胞毒测定。对数生长期细胞加入所述喹啉类衍生物,结果表明本发明所述化合物在体外对人淋巴癌细胞株具有较强的抑制作用。因此,本发明所述的喹啉类衍生物极具有开发前景,可用于制备抗癌的药物。
与现有技术相比,本发明具有以下有益效果:
1.本发明所提供的喹啉类衍生物对多种癌细胞株,特别是淋巴瘤细胞株,有显著的增殖抑制作用,同时,可以特异性地抑制这些癌细胞株中癌基因c-myc的转录表达。
2.本发明的所提供的喹啉类衍生物对正常细胞毒性小,在制备抗癌药物的应用中安全性高。
3.本发明的所提供的喹啉类衍生物可以制备成各种剂型的抗癌药物,具有很高的医学价值和广阔的市场前景。
附图说明
图1为本发明所述化合物在Raji细胞内对c-myc基因的转录效果图。
图2为本发明所述化合物在Raji细胞内对c-myc基因的翻译和c-MYC蛋白的表达效果图。
具体实施方式
以下通过具体的实施例和附图进一步说明本发明的技术方案。
除非特别说明,本发明采用的试剂、设备和方法为本技术领域常规市购的试剂、设备和常规使用的方法。
本发明所述的喹啉类衍生物的制备方法,当X为O,Y为氢,n=0,1,2,3时为CK系列化合物,其合成方法包括以下步骤:
实施例1:化合物S4的合成
将0.1mol苯氧乙酸溶于150mL三氯甲烷中,加入17.5mL氯化亚砜60℃回流反应3小时后减压旋蒸除去溶剂得到棕色液体,再加入乙腈作为溶剂后与0.1mol邻氨基苯甲酸进行缩合反应,得到S1.将而后将PPA预热至130℃加入S1进行环合反应,得到S2。将S2与氯化亚砜在DMF催化下80℃反应得到化合物S3。而后于耐压管中将2.2g一水合对甲苯磺酸加热至120℃后加入5mmol S3,搅拌10分钟,冷却至室温。加入10mmol炔丙胺,120℃反应6小时。反应完成后冷却,用30mL氯仿:甲醇=2:1溶解固体,1N NaOH溶液调节pH至12,再用50mL氯仿萃取两次,饱和氯化钠溶液洗两次,收集有机相,经过无水硫酸钠干燥后过滤得有机相,旋干,再经过硅胶柱层析分离纯化(流动相:二氯甲烷:甲醇=500:1;氨水0.5%)得0.75g淡黄色固体。
产率72%。m.p.216.0-217.2℃;1H NMR(400MHz,CDCl3)δ8.35(d,J=7.7Hz,1H),8.21(d,J=8.5Hz,1H),7.90(d,J=8.5Hz,1H),7.66(t,J=7.6Hz,1H),7.62–7.55(m,2H),7.44(dt,J=14.0,6.7Hz,2H),5.22(s,1H),4.83(dd,J=5.8,2.3Hz,2H),2.31(t,J=1.9Hz,1H).13C NMR(101MHz,CDCl3)δ158.3,147.4,146.8,134.1,132.9,130.1,129.7,127.9,124.2,123.2,123.2,122.1,120.0,118.2,112.0,80.8,72.5,35.6.HRMS(ESI)m/z:calcd for C18H12N2O,[M+H]+273.1022,found 273.1022.
实施例2:化合物CK1的合成
取化合物S4(0.25g,1mmol)置于50mL单口瓶中,加入10mL四氢呋喃,加入2mL预先配制好的含有(25mg,0.1mmol)五水硫酸铜溶液,2mL现配现用的含有(50mg,0.2mmol)的抗坏血酸钠溶液,最后加入1.2当量的:N,N-二甲基-2-叠氮乙胺。于35℃搅拌反应,TLC监测反应。反应完毕后,旋干溶剂,经柱层析纯化得到淡黄色固体CK1(流动相:二氯甲烷:甲醇=200~50:1;氨水0.5%)。
产率88%。m.p.121.5-122.6℃;1H NMR(400MHz,CDCl3)δ8.41(d,J=7.7Hz,1H),8.18(dd,J=8.5,0.7Hz,1H),7.94(d,J=8.5Hz,1H),7.71(s,1H),7.66–7.58(m,3H),7.43(ddd,J=15.3,7.1,1.2Hz,2H),5.94(s,1H),5.36(d,J=5.8Hz,2H),4.38(t,J=6.2Hz,2H),2.69(t,J=6.2Hz,2H),2.19–2.14(s,6H).13C NMR(101MHz,CDCl3)δ158.1,147.1,146.9,145.5,133.7,130.0,129.5,128.0,124.0,123.5,123.2,122.5,122.2,120.4,118.2,111.8,58.6,48.1,45.2,41.0.HPLC purity:99.8%.HRMS(ESI)m/z:calcd for C22H22N6O,[M+H]+,387.1928found 387.1915.
实施例3:化合物CK2的合成
方法同实施例2,所不同的是用:N,N-二乙基-2-叠氮乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2。
产率83%。m.p.133.1-134.3℃;1H NMR(400MHz,CDCl3)δ8.39(d,J=6.9Hz,1H),8.19(d,J=8.4Hz,1H),7.93(d,J=8.5Hz,1H),7.63(dt,J=19.1,7.5Hz,4H),7.45(t,J=7.3Hz,2H),5.81(s,1H),5.36(d,J=5.8Hz,2H),4.33(s,2H),2.78(s,2H),2.40(d,J=6.9Hz,4H),0.79(t,J=6.9Hz,6H).13C NMR(101MHz,CDCl3)δ158.1,146.9,146.7,145.3,133.8,133.7,130.1,129.4,128.1,124.1,123.3,123.2,122.8,122.2,120.4,118.1,111.8,52.7,49.0,47.1,40.9,11.7.HPLC purity:99.2%.HRMS(ESI)m/z:calcd for C24H26N6O,[M+H]+,415.2241found 415.2246.
实施例4:化合物CK3的合成
方法同实施例2,所不同的是用2-叠氮基乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK3。
产率72%。m.p.130.4-131.5℃;1H NMR(400MHz,CDCl3)δ8.36(d,J=7.6Hz,1H),8.17(d,J=8.4Hz,1H),7.93(d,J=8.4Hz,1H),7.68–7.55(m,4H),7.44(t,J=7.6Hz,2H),5.83(t,J=5.9Hz,1H),5.34(d,J=6.1Hz,2H),4.36–4.27(m,2H),3.20–3.08(m,2H).13C NMR(101MHz,DMSO-d6)δ157.9,147.2,146.6,146.4,135.2,133.2,130.7,129.4,128.4,123.8,123.7,123.6,123.5,122.8,122.0,118.6,112.7,53.0,42.4,40.5.HPLC purity:99.9%.HRMS(ESI)m/z:calcd for C20H18N6O,[M+H]+,359.1615found 359.1620.
实施例5:化合物CK4的合成
方法同实施例2,所不同的是用N-(2-叠氮基乙基)吗啉代替N,N-二甲基-2-叠氮乙胺,得白色固体CK4。
产率92%。m.p.209.1-210.8℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.5Hz,1H),8.18(dd,J=8.5,0.9Hz,1H),7.93(d,J=8.0Hz,1H),7.69–7.64(m,1H),7.63–7.57(m,3H),7.48–7.43(m,2H),5.76(t,J=6.3Hz,1H),5.35(d,J=6.3Hz,2H),4.37(t,J=6.1Hz,2H),3.50–3.43(m,4H),2.71(t,J=6.1Hz,2H),2.39–2.29(m,4H).13C NMR(101MHz,CDCl3)δ158.1,147.2,147.0,145.8,133.7,133.6,130.1,129.7,128.0,124.1,123.5,123.3,122.3,122.2,120.3,118.2,111.8,67.0,66.7,57.8,53.4,47.3,40.9.HPLC purity:99.7%.HRMS(ESI)m/z:calcd for C24H24N6O2,[M+H]+429.2034,found 429.2021.
实施例6:化合物CK5的合成
方法同实施例2,所不同的是用N-(2-叠氮基乙基)吡咯烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK5。
产率79%。m.p.198.7-199.0℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.7Hz,1H),8.18(d,J=8.5Hz,1H),7.92(d,J=8.4Hz,1H),7.67(d,J=11.3Hz,2H),7.60(t,J=7.3Hz,2H),7.45(dd,J=13.9,6.8Hz,2H),5.71(t,J=5.4Hz,1H),5.36(d,J=6.1Hz,2H),4.41(t,J=6.3Hz,2H),2.87(t,J=6.3Hz,2H),2.43(s,4H),1.64(s,4H).13C NMR(101MHz,CDCl3)δ158.1,147.1,146.9,145.6,133.7,133.6,130.0,129.6,128.0,124.1,123.5,123.2,122.4,122.2,120.3,118.1,111.7,55.3,53.9,49.4,40.98,23.5.HPLC purity:99.4%.HRMS(ESI)m/z:calcd for C24H24N6O,[M+H]+413.2084,found 413.2070.
实施例7:化合物CK6的合成
方法同实施例2,所不同的是用N-(2-叠氮基乙基)哌啶代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK6。
产率88%。m.p.222.5-223.1℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.7Hz,1H),8.18(d,J=8.4Hz,1H),7.92(d,J=8.3Hz,1H),7.65(dd,J=4.4,3.0Hz,2H),7.64–7.56(m,3H),7.47–7.41(m,2H),5.76(s,1H),5.36(d,J=6.2Hz,2H),4.37(t,J=6.2Hz,2H),2.66(t,J=6.2Hz,2H),2.29(s,4H),1.32(s,6H).13C NMR(101MHz,CDCl3)δ158.1,147.1,146.9,145.5,133.7,130.0,129.6,128.0,124.1,123.4,123.2,122.5,122.2,120.3,118.1,111.8,58.0,54.4,47.7,41.0,25.8,24.1.HPLC purity:100.0%.HRMS(ESI)m/z:calcd for C25H26N6O,[M+H]+427.2241,found 427.2221.
实施例8:化合物CK7的合成
方法同实施例2,所不同的是用1-(2-叠氮基乙基)-4-甲基哌嗪代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK7。
产率82%。m.p.214.8-215.7℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=8.5Hz,1H),8.18(d,J=9.3Hz,1H),7.92(d,J=8.0Hz,1H),7.68–7.64(m,1H),7.63(s,1H),7.61(dt,J=7.5,3.6Hz,2H),7.49–7.42(m,2H),5.73(t,J=6.1Hz,1H),5.36(d,J=6.3Hz,2H),4.37(t,J=6.1Hz,2H),2.71(t,J=6.1Hz,2H),2.39(s,4H),2.17(s,8H).13C NMR(101MHz,CDCl3)δ158.1,147.2,147.0,145.7,133.7,133.6,130.1,129.7,128.0,124.1,123.5,123.3,122.4,122.2,120.3,118.2,111.8,57.2,54.8,52.9,47.5,45.8,41.0.HPLC purity:98.8%.HRMS(ESI)m/z:calcd for C25H27N7O,[M+H]+442.2350,found 442.2344.
实施例9:化合物CK8的合成
方法同实施例2,所不同的是用N,N-二甲基-3-叠氮丙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK8。
产率89%。m.p.188.0-188.9℃;1H NMR(400MHz,CDCl3)δ8.38(d,J=7.6Hz,1H),8.19(d,J=8.5Hz,1H),7.94(d,J=8.5Hz,1H),7.69–7.58(m,3H),7.54(s,1H),7.46(td,J=8.0,1.5Hz,2H),5.75(s,1H),5.37(d,J=6.1Hz,2H),4.39(t,J=6.8Hz,2H),2.24(t,J=6.8Hz,2H),2.16(s,6H),2.07–2.02(m,2H).13C NMR(101MHz,CDCl3)δ158.1,147.2,147.0,145.6,133.7,133.6,130.0,129.7,128.0,124.1,123.5,123.2,122.1,122.1,120.3,118.1,111.8,55.7,48.05,45.2,41.0,28.1.HPLC purity:99.7%.HRMS(ESI)m/z:calcd for C23H24N6O,[M+H]+401.2084,found 401.2089.
实施例10:化合物CK9的合成
方法同实施例2,所不同的是用N,N-二乙基-3-叠氮丙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK9。
产率80%。m.p.150.2-151.1℃;1H NMR(400MHz,CDCl3)δ8.36(d,J=7.5Hz,1H),8.18(d,J=9.3Hz,1H),7.93(d,J=8.0Hz,1H),7.68-7.57(m,3H),7.49(s,1H),7.45(dtd,J=8.0,6.2,1.5Hz,2H),5.73(t,J=6.1Hz,1H),5.36(d,J=6.2Hz,2H),4.35(t,J=7.0Hz,2H),2.41(q,J=7.1Hz,4H),2.34(t,J=6.8Hz,2H),1.99(p,J=6.9Hz,2H),0.89(t,J=7.1Hz,6H).13C NMR(101MHz,CDCl3)δ158.1,147.3,147.0,145.7,133.7,133.6,130.0,129.7,128.0,124.1,123.5,123.2,122.1,122.0,120.3,118.2,111.8,49.2,48.4,46.5,41.0,27.9,11.4.HPLC purity:99.9%.HRMS(ESI)m/z:calcd for C25H28N6O,[M+H]+429.2397,found 429.2401.
实施例11:化合物CK10的合成
方法同实施例2,所不同的是用3-叠氮基-1-丙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK10。
产率72%。m.p.129.8-130.5℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.6Hz,1H),8.18(d,J=7.8Hz,1H),7.93(d,J=8.4Hz,1H),7.69–7.64(m,1H),7.61(dt,J=8.8,4.3Hz,2H),7.51–7.49(m,1H),7.48–7.42(m,2H),5.69(s,1H),5.36(d,J=6.2Hz,2H),4.41(t,J=6.9Hz,2H),2.63(t,J=6.6Hz,2H),1.95(p,J=6.8Hz,2H).13C NMR(101MHz,MeOD)δ157.9,146.9,146.2,146.2,135.4,132.9,130.1,128.2,127.4,123.6,123.0,122.5,122.3,121.5,121.3,118.0,111.7,47.4,40.00,37.7,32.4.HPLC purity:98.8%.HRMS(ESI)m/z:calcd for C21H20N6O,[M+H]+373.1771,found 373.1756.
实施例12:化合物CK11的合成
方法同实施例2,所不同的是用N-(3-叠氮基丙基)吗啉代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK11。
产率88%。m.p.192.6-193.5℃;1H NMR(400MHz,CDCl3)δ8.47(d,J=8.2Hz,1H),8.19(d,J=8.5Hz,1H),7.95(d,J=8.6Hz,1H),7.61(dt,J=12.6,8.0Hz,4H),7.43(dt,J=25.4,7.5Hz,2H),5.40(d,J=5.9Hz,2H),4.40(t,J=6.8Hz,2H),3.64–3.55(m,4H),2.25(dd,J=17.5,10.9Hz,6H),2.03(dt,J=13.4,6.5Hz,2H).13C NMR(101MHz,CDCl3)δ158.1,147.1,146.9,145.7,133.6,133.6,130.1,129.6,128.1,124.2,123.4,123.3,122.2,122.0,120.2,118.1,111.7,66.8,54.7,53.4,48.0,41.0,26.9.HPLC purity:99.9%.HRMS(ESI)m/z:calcd for C25H26N6O2,[M+H]+443.2190,found 443.2196.
实施例13:化合物CK12的合成
方法同实施例2,所不同的是用N-(3-叠氮基丙基)吡咯烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK12。
产率84%。m.p.194.7-195.3℃;1H NMR(400MHz,CDCl3)δ8.36(d,J=7.6Hz,1H),8.17(dd,J=8.5,0.7Hz,1H),7.93(d,J=8.2Hz,1H),7.68–7.62(m,1H),7.62–7.56(m,2H),7.49(s,1H),7.47–7.41(m,2H),5.77(t,J=6.1Hz,1H),5.35(d,J=6.2Hz,2H),4.37(t,J=6.9Hz,2H),2.40–2.30(m,6H),2.01(p,J=6.9Hz,2H),1.74–1.61(m,4H).13C NMR(101MHz,CDCl3)δ158.1,147.2,147.0,145.7,133.7,133.6,130.0,129.6,128.0,124.0,123.5,123.2,122.1,122.1,120.3,118.2,111.8,53.9,52.4,48.3,40.9,29.3,23.4.HPLC purity:99.8%.HRMS(ESI)m/z:calcd for C25H26N6O,[M+H]+427.2241,found 427.2243.
实施例14:化合物CK13的合成
方法同实施例2,所不同的是用N-(3-叠氮基丙基)哌啶代替N,N-二甲基-2-叠氮乙胺,得白色固体CK13。
产率86%。m.p.193.9-194.7℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.6Hz,1H),8.18(d,J=8.5Hz,1H),7.92(d,J=8.5Hz,1H),7.63(dt,J=17.0,8.1Hz,3H),7.51–7.41(m,3H),5.72(s,1H),5.36(d,J=5.4Hz,2H),4.35(t,J=6.4Hz,2H),2.31(s,6H),2.22(s,6H),1.99(dt,J=12.6,6.2Hz,2H).13C NMR(101MHz,CDCl3)δ158.1,147.2,146.9,145.7,133.7,133.6,130.1,129.6,128.1,124.1,123.4,123.3,122.2,122.1,120.3,118.1,111.8,55.1,54.4,48.3,41.0,27.3,25.8,24.3.HPLC purity:99.8%.HRMS(ESI)m/z:calcd for C26H28N6O,[M+H]+441.2397,found441.2396.
实施例15:化合物CK14的合成
方法同实施例2,所不同的是用1-(3-叠氮基丙基)-4-甲基哌嗪代替N,N-二甲基-2-叠氮乙胺,得白色固体CK14。
产率70%。m.p.158.0-161.1℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.6Hz,1H),8.18(d,J=8.5Hz,1H),7.92(d,J=8.5Hz,1H),7.63(dt,J=17.0,8.1Hz,3H),7.46(s,3H),5.72(s,1H),5.36(d,J=5.4Hz,2H),4.35(t,J=6.4Hz,2H),2.31(s,6H),2.21(d,J=12.2Hz,6H),2.07–1.91(m,3H).13C NMR(101MHz,CDCl3)δ158.1,147.1,146.9,145.7,133.6,133.6,130.1,129.6,128.0,124.1,123.4,123.3,122.2,122.1,120.3,118.1,111.8,54.9,54.1,52.8,48.0,45.9,40.9,27.2.HPLC purity:99.5%.HRMS(ESI)m/z:calcd for C26H29N7O,[M+H]+456.2506,found 456.2516.
实施例16:化合物CK15的合成
方法同实施例2,所不同的是用2-叠氮基-1-乙醇代替N,N-二甲基-2-叠氮乙胺,得白色固体CK15。
产率76%。m.p.180.9-181.8℃;1H NMR(400MHz,DMSO)δ8.47(d,J=8.3Hz,1H),8.27(d,J=7.6Hz,1H),8.03(d,J=8.3Hz,1H),7.99(s,1H),7.81(d,J=8.5Hz,1H),7.73(d,J=5.8Hz,2H),7.52(dd,J=14.5,7.4Hz,2H),5.25(d,J=6.2Hz,2H),4.92(t,J=5.1Hz,1H),4.31(t,J=5.3Hz,2H),3.69(dd,J=9.8,4.6Hz,2H).13C NMR(101MHz,DMSO)δ157.4,146.7,146.1,145.9,134.7,132.7,130.1,128.9,127.9,123.3,123.2,123.1,123.0,122.3,121.4,118.1,112.3,59.8,52.0,40.0.HPLC purity:99.3%.HRMS(ESI)m/z:calcd for,[M+H]+,360.1455,found 360.1449.
实施例17:化合物CK16的合成
方法同实施例2,所不同的是用3-叠氮基-1-丙醇代替N,N-二甲基-2-叠氮乙胺,得白色固体CK16。
产率75%。m.p.191.2-192.6℃;1H NMR(400MHz,CDCl3)δ8.37(d,J=7.7Hz,1H),8.18(d,J=8.4Hz,1H),7.92(d,J=8.4Hz,1H),7.70–7.64(m,1H),7.61(dd,J=11.4,4.9Hz,2H),7.51(s,1H),7.46(ddd,J=9.4,9.0,4.9Hz,2H),5.65(s,1H),5.36(d,J=6.2Hz,2H),4.46(t,J=6.7Hz,2H),3.56(t,J=4.7Hz,2H),2.11–2.03(m,2H).13C NMR(101MHz,DMSO-d6)δ157.9,147.1,146.6,146.5,135.2,133.1,130.7,129.3,128.4,123.8,123.8,123.4,123.3,122.9,122.0,118.6,112.8,57.9,47.0,40.5,33.5.HPLC purity:99.5%.HRMS(ESI)m/z:calcd for C21H19N5O2,[M+H]+374.1612,found 374.1611.
实施例18:化合物CK17的合成
方法同实施例2,所不同的是用苄基叠氮代替N,N-二甲基-2-叠氮乙胺,得白色固体CK17。
产率55%。m.p.190.9-191.9℃;1H NMR(400MHz,CDCl3)δ8.36(d,J=7.6Hz,1H),8.18(d,J=8.6Hz,1H),7.91(d,J=8.6Hz,1H),7.66(ddd,J=8.3,6.8,1.2Hz,1H),7.59(ddd,J=8.4,7.2,1.3Hz,1H),7.52–7.43(m,3H),7.41(s,1H),7.30(dd,J=5.0,1.9Hz,3H),7.19(dd,J=6.5,3.0Hz,2H),5.63(s,1H),5.47(s,2H),5.33(d,J=6.1Hz,2H).13C NMR(101MHz,CDCl3)δ158.1,147.2,146.9,146.2,134.4,133.7,133.5,130.1,129.6,129.1,129.1,128.8,128.0,128.0,127.9,124.1,123.4,123.2,122.2,121.7,120.2,118.1,111.8,54.2,41.0.HPLC purity:99.9%.HRMS(ESI)m/z:calcd for C25H19N5O,[M+H]+406.1662,found 406.1647.
实施例19:化合物CK18的合成
方法同实施例2,所不同的是用2-(叠氮基乙基)苯代替N,N-二甲基-2-叠氮乙胺,得白色固体CK18。
产率60%。m.p.172.5-173.8℃;1H NMR(400MHz,DMSO-d6)δ8.41(d,J=8.4Hz,1H),8.22(d,J=7.5Hz,1H),8.02(d,J=8.3Hz,1H),7.85(d,J=16.0Hz,2H),7.70(dt,J=11.2,7.7Hz,3H),7.47(t,J=6.9Hz,2H),7.02–6.94(m,4H),5.16(d,J=5.8Hz,2H),4.49(t,J=7.0Hz,2H),3.01(t,J=7.0Hz,2H).13C NMR(101MHz,DMSO-d6)δ157.9,146.6,138.0,135.1,133.,130.7,129.4,128.9,128.6,128.4,126.8,123.8,123.5,123.0,122.8,122.0,118.6,112.8,50.8,40.6,40.4,40.2,40.0,39.8,39.6,39.4,36.2.HPLC purity:99.8%.HRMS(ESI)m/z:calcd for C26H21N5O,[M+H]+420.1819,found 420.1818.
实施例20:化合物CK19的合成
方法同实施例2,所不同的是用3-(叠氮基丙基)苯代替N,N-二甲基-2-叠氮乙胺,得白色固体CK19。
产率58%。m.p.160.3-161.2℃;1H NMR(400MHz,CDCl3)δ8.38(d,J=7.6Hz,1H),8.17(d,J=8.4Hz,1H),7.94(d,J=8.4Hz,1H),7.68–7.54(m,3H),7.48–7.39(m,3H),7.25–7.13(m,3H),7.06(d,J=7.0Hz,2H),5.87(s,1H),5.35(d,J=5.8Hz,2H),4.27(t,J=7.1Hz,2H),2.57(t,J=7.5Hz,2H),2.21–2.15(m,2H).13C NMR(101MHz,CDCl3)δ158.1,147.2,146.9,145.8,139.9,133.7,133.6,130.1,129.6,128.6,128.3,128.0,126.3,124.1,123.5,123.2,122.,121.6,120.3,118.1,111.8,49.5,41.0,32.4,31.5.HPLC purity:99.9%.HRMS(ESI)m/z:calcd for C27H23N5O,[M+H]+434.1975,found 434.1976.
实施例21:化合物CK20的合成
方法同实施例2,所不同的是用1-叠氮基丙烷代替N,N-二甲基-2-叠氮乙胺,得白色固体CK20。
产率58%。m.p.178.9-181.2℃;1H NMR(400MHz,CDCl3)δ8.35(d,J=7.8Hz,1H),8.14(d,J=8.5Hz,1H),7.94(d,J=8.3Hz,1H),7.64–7.52(m,3H),7.50(s,1H),7.44–7.35(m,2H),5.98(d,J=5.8Hz,1H),5.31(d,J=5.8Hz,2H),4.41–4.29(m,1H),2.12(d,J=12.7Hz,2H),1.85(d,J=13.5Hz,2H),1.67(dd,J=26.5,14.1Hz,3H),1.39(dd,J=26.0,12.9Hz,2H),1.21(dd,J=24.6,11.9Hz,1H).13C NMR(101MHz,CDCl3)δ158.0,147.0,146.8,145.9,133.9,133.6,130.0,129.4,128.0,124.0,123.4,123.2,122.1,121.7,120.6,118.1,111.8,51.9,40.9,23.6,11.0.HPLC purity:98.3%.HRMS(ESI)m/z:calcd for C21H19N5O,[M+H]+358.1662,found 358.1657.
实施例22:化合物CK21的合成
方法同实施例2,所不同的是用1-叠氮基-3-甲基丁烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK21。
产率62%。m.p.149.1-152.0℃;1H NMR(400MHz,CDCl3)δ8.38(d,J=7.7Hz,1H),8.18(d,J=9.3Hz,1H),7.93(d,J=8.0Hz,1H),7.68–7.56(m,3H),7.48(s,1H),7.47–7.41(m,2H),5.82(s,1H),5.35(d,J=5.9Hz,2H),4.33–4.28(m,2H),1.73(dd,J=14.9,7.1Hz,2H),1.55–1.44(m,1H),0.89(d,J=6.6Hz,6H).13C NMR(101MHz,CDCl3)δ158.1,147.0,146.8,145.8,133.7,133.6,130.1,129.4,128.1,124.1,123.3,123.2,122.2,121.5,120.4,118.1,111.8,48.7,40.9,38.9,25.4,22.1.HPLC purity:96.9%.HRMS(ESI)m/z:calcd for C23H23N5O,[M+H]+386.1975,found386.1969.
实施例23:化合物CK22的合成
方法同实施例2,所不同的是用1-叠氮基环戊烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK22。
产率56%。m.p.156.6-157.9℃;1H NMR(400MHz,CDCl3)δ8.38(t,J=8.6Hz,1H),8.17(t,J=8.0Hz,1H),7.94(d,J=8.5Hz,1H),7.68–7.55(m,3H),7.53(d,J=7.7Hz,1H),7.42(dt,J=14.5,7.2Hz,2H),5.92(s,1H),5.38–5.27(m,2H),4.92–4.81(m,1H),2.27–2.14(m,2H),2.05–1.93(m,2H),1.85(tt,J=11.1,5.8Hz,2H),1.72(dt,J=11.1,4.7Hz,2H).13C NMR(101MHz,CDCl3)δ158.0,147.0,146.7,145.4,133.9,133.6,130.1,129.3,128.1,124.0,123.3,123.2,122.2,120.4,120.4,118.0,111.7,61.9,40.9,33.3,24.0.HPLC purity:96.3%.HRMS(ESI)m/z:calcd for C23H21N5O,[M+H]+384.1819,found 384.1815.
实施例24:化合物CK23的合成
方法同实施例2,所不同的是用1-叠氮基环己烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK23。
产率62%。m.p.156.6-157.9℃;1H NMR(400MHz,CDCl3)δ8.38(t,J=8.6Hz,1H),8.17(t,J=8.0Hz,1H),7.94(d,J=8.5Hz,1H),7.68–7.55(m,3H),7.53(d,J=7.7Hz,1H),7.42(dt,J=14.5,7.2Hz,2H),5.92(s,1H),5.38–5.27(m,2H),4.92–4.81(m,1H),2.27–2.14(m,2H),2.05–1.93(m,2H),1.85(tt,J=11.1,5.8Hz,2H),1.72(dt,J=11.1,4.7Hz,2H).13C NMR(101MHz,CDCl3)δ158.1,147.1,146.9,145.2,133.8,133.6,130.1,129.4,128.0,124.0,123.4,123.2,122.2,120.4,119.6,118.1,111.8,60.2,41.0,33.5,25.1,25.0.HPLC purity:98.7%.HRMS(ESI)m/z:calcd for C24H23N5O,[M+H]+398.1975,found 398.1976.
实施例25:化合物CK24的合成
方法同实施例2,所不同的是用1-叠氮基-2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK24。
产率78%。m.p.210.7-211.1℃;1H NMR(400MHz,CDCl3)δ8.38(d,J=7.7Hz,1H),8.19(dd,J=8.5,0.7Hz,1H),7.93(d,J=8.3Hz,1H),7.78(s,1H),7.65(ddd,J=4.9,4.2,1.1Hz,1H),7.63–7.58(m,2H),7.45(ddd,J=7.9,7.2,1.5Hz,2H),5.85–5.80(m,1H),5.71(s,1H),5.43–5.31(m,4H),5.19(ddd,J=9.5,5.4,3.9Hz,1H),4.25(dd,J=12.6,4.9Hz,1H),4.10(dd,J=12.6,2.0Hz,1H),3.97(ddd,J=10.1,4.9,2.1Hz,1H),2.05(s,3H),2.01(s,3H),2.00(s,3H),1.67(s,3H).13C NMR(101MHz,CDCl3)δ170.5,169.9,169.4,168.8,158.2,147.0,146.6,146.6,133.7,133.6,130.2,129.3,128.1,124.1,123.3,123.2,122.2,120.4,120.2,118.0,111.9,85.7,75.1,72.5,70.1,67.6,61.5,40.9,20.6,20.5,20.5,19.9.HPLC purity:99.7%.HRMS(ESI)m/z:calcd for C32H31N5O10,[M+H]+646.2144,found 646.2152.
实施例26:化合物CK25的合成
方法同实施例2,所不同的是用1-叠氮基-2,3,5-三-O-乙酰基-β-D-核糖代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK25。
产率88%。m.p.214.7-215.6℃;1H NMR(400MHz,DMSO-d6)δ8.42(d,J=8.5Hz,1H),8.22(d,J=7.6Hz,1H),8.17(s,1H),8.01(d,J=8.4Hz,1H),7.78(d,J=8.3Hz,1H),7.68(t,J=7.8Hz,2H),7.47(t,J=7.4Hz,2H),5.46(d,J=9.3Hz,1H),5.26(t,J=5.4Hz,3H),5.19(d,J=4.9Hz,1H),5.09(d,J=5.5Hz,1H),4.52(t,J=5.4Hz,1H),3.73(td,J=9.1,6.1Hz,1H),3.62(dd,J=10.0,5.5Hz,1H),3.16(td,J=9.0,5.7Hz,1H).13C NMR(101MHz,DMSO-d6)δ157.4,145.9,135.0,132.6,130.3,128.5,128.1,123.4,123.3,122.7,122.4,122.2,121.5,118.0,112.4,87.3,79.9,77.0,71.9,69.5,60.7.HPLC purity:99.5%.HRMS(ESI)m/z:calcd for C24H23N5O6,[M+H]+478.1721,found 478.1725.
实施例27:化合物CK26的合成
方法同实施例2,所不同的是用1-叠氮基-β-D-吡喃葡萄糖代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK26。
产率68%。m.p.159.5-160.3℃;1H NMR(400MHz,CDCl3)δ8.40(d,J=7.7Hz,1H),8.18(d,J=7.8Hz,1H),7.94(d,J=8.0Hz,1H),7.76(s,1H),7.61(tt,J=12.5,7.1Hz,3H),7.48–7.41(m,2H),6.09(d,J=3.8Hz,1H),5.84(dd,J=5.2,3.8Hz,1H),5.59(t,J=5.3Hz,1H),5.40(t,J=5.3Hz,2H),4.44(td,J=4.9,3.2Hz,1H),4.35(dd,J=12.3,3.1Hz,1H),4.19(dd,J=12.3,4.7Hz,1H),2.11(s,3H),2.08(s,3H),1.96(s,3H).13C NMR(101MHz,CDCl3)δ170.3,169.4,169.2,158.1,1467.0,146.6,146.2,133.7,130.2,129.4,128.2,124.2,123.3,123.2,122.3,121.4,120.3,118.0,111.9,90.0,81.0,74.2,70.8,62.9,40.9,20.5,20.5,20.4.HPLC purity:99.1%.HRMS(ESI)m/z:calcd for C29H27N5O8,[M+H]+574.1932,found 574.1948.
实施例28:化合物CK27的合成
方法同实施例2,所不同的是用1-叠氮基-β-D-核糖代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK27。
产率82%。1H NMR(400MHz,DMSO-d6)δ8.42(d,J=8.5Hz,1H),8.30(s,1H),8.21(d,J=7.5Hz,1H),8.01(d,J=8.1Hz,1H),7.84(t,J=6.3Hz,1H),7.78(d,J=8.3Hz,1H),7.66(td,J=7.4,3.2Hz,2H),7.47(td,J=7.4,2.6Hz,2H),5.88(d,J=4.7Hz,1H),5.49(d,J=6.1Hz,1H),5.20(dd,J=10.2,5.9Hz,3H),4.90(t,J=5.3Hz,1H),4.32(dd,J=10.5,5.0Hz,1H),4.07(dd,J=9.5,4.8Hz,1H),3.91(q,J=4.2Hz,1H),3.53(dt,J=11.4,4.7Hz,1H),3.47–3.39(m,1H).13C NMR(101MHz,DMSO-d6)δ172.8,157.9,147.2,135.2,133.1,130.7,129.4,128.4,123.8,123.5,122.9,122.2,122.0,118.6,112.8,92.4,86.3,75.5,70.9,61.9,40.4.HPLC purity:99.4%.HRMS(ESI)m/z:calcd for C23H21N5O5,[M+H]+448.1615,found 448.1613.
本发明所述的喹啉类衍生物的制备方法,当X为O,Y为甲基,n=1时为CK1系列化合物,其合成方法包括以下步骤:
SM4.化合物S3以环丁砜作为溶剂经碘甲烷于60℃甲基化得到
SM5.以乙二醇乙醚作溶剂,化合物与炔丙胺于120℃发生取代反应得
SM6.将与不同叠氮侧链在一价铜的催化下发生点击反应(1,3-偶极环加成反应)经柱层析纯化后得到一系列目标产物喹啉类衍生物
实施例29:化合物SM5的合成
取1mmol SM4步骤得到的化合物置于100mL耐压管中,加入约3mmol的炔丙胺,40mL乙二醇乙醚作溶剂,密封加热到120℃反应30分钟。停止反应后冷却,加入50mL乙醚超声后冷冻,析出固体,过滤收集固体。将所得固体用硅胶柱层析纯化(流动相:二氯甲烷:甲醇=200:1;氨水0.5%)得到浅黄色固体。
产率:88%。1H NMR(400MHz,CDCl3)δ8.68(d,J=8.1Hz,1H),7.95(d,J=7.9Hz,1H),7.52(d,J=7.9Hz,1H),7.46(dd,J=13.9,6.3Hz,2H),7.31(t,J=7.6Hz,1H),7.22(d,J=8.4Hz,1H),7.14(t,J=7.3Hz,1H),4.92(s,2H),3.91(s,3H),2.30(t,J=2.5Hz,1H).13C NMR(101MHz,CDCl3)δ154.7,146.7,139.5,136.4,130.7,130.3,127.8,126.7,124.8,123.0,122.00,121.8,118.9,113.7,112.9,84.87,70.0,41.0,35.1,29.7.HRMS(ESI)m/z:calcd for C19H15N2O+,[M-I]+287.1179,found 287.1180.
实施例30:化合物CK1-1的合成
取中间体SM5(0.27g,1mmol)置于50mL单口瓶中,加入10mL四氢呋喃,加入2mL预先配制好的含有(25mg,0.1mmol)五水硫酸铜溶液,2mL现配现用的含有(50mg,0.2mmol)的抗坏血酸钠溶液,最后加入1.2当量的:N,N-二甲基-2-叠氮乙胺。于35℃搅拌反应,TLC监测反应。反应完毕后,旋干溶剂,经柱层析纯化得到淡黄色固体CK1(流动相:二氯甲烷:甲醇=100~30:1;氨水0.5%)。
产率61%。1H NMR(400MHz,CDCl3)δ8.59(d,J=7.9Hz,1H),7.80(d,J=13.8Hz,2H),7.40–7.27(m,3H),7.20–7.10(m,2H),6.99(t,J=7.5Hz,1H),5.27(s,2H),4.36(t,J=6.7Hz,2H),3.78(s,3H),2.72(t,J=6.7Hz,2H),2.19(s,6H).13C NMR(101MHz,CDCl3)δ154.1,148.4,144.0,138.0,134.3,130.8,129.7,127.7,125.2,122.3,122.2,121.8,121.4,121.2,117.3,113.3,111.9,57.9,47.3,45.3,44.5,34.4.HRMS(ESI)m/z:calcd for C23H25N6O+,[M-I]+401.2084,found401.2083.
实施例31:化合物CK1-2的合成
方法同实施例30,所不同的是用N,N-二乙基-2-叠氮乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK1-2。
产率70%。1H NMR(400MHz,CDCl3)δ8.60(d,J=8.0Hz,1H),7.86(d,J=13.0Hz,2H),7.48–7.28(m,3H),7.22–7.12(m,2H),7.00(t,J=7.5Hz,1H),5.37(d,J=6.1Hz,2H),5.26(d,J=5.8Hz,2H),3.78(s,3H),4.34(t,J=6.8Hz,2H),2.40(d,J=6.9Hz,4H),0.79(t,J=6.9Hz,6H).13C NMR(101MHz,CDCl3)δ154.1,148.4,144.0,138.0,134.3,130.8,129.7,127.7,125.2,122.3,122.2,121.8,121.4,121.2,117.3,113.3,111.9,57.9,50.0,47.1,41.0,11.8.HRMS(ESI)m/z:calcd for C25H29N6O+,[M-I]+429.2397,found429.2397.
实施例32:化合物CK1-3的合成
方法同实施例30,所不同的是用N-(2-叠氮基乙基)吡咯烷代替N,N-二甲基-2-叠氮乙胺,得橙红色固体CK1-3。
产率75%。1H NMR(400MHz,CDCl3)δ8.69(d,J=7.8Hz,1H),7.96(d,J=11.9Hz,1H),7.86(s,1H),7.50(dd,J=22.6,7.3Hz,3H),7.31(d,J=7.5Hz,2H),7.18(d,J=7.1Hz,1H),5.47(s,2H),4.48(d,J=12.4Hz,2H),4.11–3.87(m,3H),3.67(s,4H),2.85(t,J=6.3Hz,2H),2.50(s,4H).13C NMR(101MHz,CDCl3)δ154.0,148.8,144.0,138.3,134.8,131.0,129.7,127.8,125.3,123.3,122.2,121.8,121.5,121.2,117.3,113.5,111.8,55.3,54.7,49.4,47.0.43.2,25.5.HRMS(ESI)m/z:calcd for C25H27N6O2+,[M-I]+443.2190,found443.2194.
实施例33:化合物CK1-4的合成
方法同实施例30,所不同的是用2-叠氮基乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK1-4。
产率55%。1H NMR(400MHz,CDCl3)δ8.66(d,J=7.6Hz,1H),8.17(d,J=8.4Hz,1H),7.95(d,J=8.0Hz,1H),7.78–7.58(m,4H),7.15(t,J=7.6Hz,2H),5.83(t,J=5.9Hz,1H),5.34(d,J=6.1Hz,2H),4.36–4.27(m,2H),3.78(s,3H),3.20–3.12(m,2H).13C NMR(101MHz,CDCl3)δ154.0,148.6,144.2,138.2,134.3,130.6,127.7,125.2,123.1,122.6,122.2,121.5,121.4,121.1,116,7,113.3,111.9,54.2,47.3,42.4,40.9.HRMS(ESI)m/z:calcd for C21H21N6O+,[M-I]+373.1771,found373.1769.
实施例34:化合物CK1-5的合成
方法同实施例30,所不同的是用N-(2-叠氮基乙基)哌啶代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK1-5。
产率60%1H NMR(400MHz,CDCl3)δ8.69(d,J=8.2Hz,1H),7.93(d,J=24.8Hz,2H),7.49(dd,J=19.7,7.7Hz,3H),7.31(d,J=7.1Hz,2H),7.15(d,J=7.2Hz,1H),5.43(d,J=8.5Hz,2H),4.47(t,J=6.6Hz,2H),3.94(s,3H),2.81(t,J=6.6Hz,2H),2.44(s,4H),1.64–1.33(m,6H).13C NMR(101MHz,CDCl3)δ154.5,148.1,144.8,137.2,135.0,131.1,123.0,127.8,125.3,123.6,122.0,121.5,121.2,121.0,117.3,113.5,112.0,58.0,54.8,47.7,47.0,41.3,26.2,24.5.HRMS(ESI)m/z:calcd for C26H29N6O+,[M-I]+441.2397,found441.2398.
本发明所述的喹啉类衍生物的制备方法,当X为N,Y为氢,n=2或3时为CK2系列化合物,其合成方法包括以下步骤:
DM1.以邻氨基苯甲酸为起始原料,与氯乙酰氯发生取代反应得到化合物
DM2.以DMF为溶剂,取化合物在碘化钾的催化下与苯胺发生取代反应得到化合物
DM3.于130℃,在PPA催化下关环得到化合物
DM4.在DMF催化下,用氯化亚砜氯代得到化合物
DM5.在一水合对甲苯磺酸的催化下于120℃与炔丙胺发生取代反应得到化合物
实施例35:化合物DM5的合成
取10mmol邻氨基苯甲酸置于500ml圆底烧瓶中加入150ml丙酮溶解,冰浴下滴加氯乙酰氯丙酮溶液。滴加完毕后,冰浴下继续搅拌1小时后转为室温反应过夜。旋干丙酮,加入适量冷水,过滤收集固体,干燥,得到DM1。将10mmolDM1与1.2当量的苯胺发生取代反应,旋干溶剂水洗过滤后得到DM2。将所得到的DM2,在10倍质量的PPA作用下环合得到DM3。DM3于氯化亚砜中在DMF催化下80℃发生氯代反应得到化合物DM4。而后于耐压管中将2.2g一水合对甲苯磺酸加热至120℃后加入5mmol DM4,搅拌10分钟,冷却至室温。加入10mmol炔丙胺,120℃反应6小时。反应完成后冷却,用30mL氯仿:甲醇=2:1溶解固体,1N NaOH溶液调节pH至12,再用50mL氯仿萃取两次,饱和氯化钠溶液洗两次,收集有机相,经过无水硫酸钠干燥后过滤得有机相,旋干,再经过硅胶柱层析分离纯化(流动相:二氯甲烷:甲醇=300:1;氨水0.5%)得DM5,0.75g淡黄色固体。
产率70%。m.p.230.0-231.3℃;1H NMR(400MHz,CDCl3)δ8.53(d,J=7.4Hz,1H),8.31(d,J=8.0Hz,1H),8.12(d,J=8.0Hz,1H),7.79(t,J=7.5Hz,1H),7.68-7.61(m,2H),7.50(t,J=6.5Hz,2H),5.20(s,1H),4.93(d,J=2.3Hz,2H),2.38(t,J=1.9Hz,1H).13C NMR(101MHz,CDCl3)δ156.2,149.3,147.6,135.1,134.3,132.1,120.0,127.9,124.2,123.2,123.0,122.1,120.0,119.2,112.2,79.5,72.8,35.0.HRMS(ESI)m/z:calcd for C18H13N3,[M+H]+272.1179,found272.1173.
实施例36:化合物CK2-1的合成
取中间体DM5(0.25g,1mmol)置于50mL单口瓶中,加入10mL四氢呋喃,加入2mL预先配制好的含有(25mg,0.1mmol)五水硫酸铜溶液,2mL现配现用的含有(50mg,0.2mmol)的抗坏血酸钠溶液,最后加入1.2当量的:N,N-二甲基-2-叠氮乙胺。于35℃搅拌反应,TLC监测反应。反应完毕后,旋干溶剂,经柱层析纯化得到淡黄色固体CK2-2(流动相:二氯甲烷:甲醇=100~50:1;氨水0.5%)。
产率82%。m.p.128.6-129.6℃;1H NMR(400MHz,CDCl3)δ8.41(d,J=7.7Hz,1H),8.18(dd,J=8.5,0.7Hz,1H),7.94(d,J=8.5Hz,1H),7.9(s,1H),7.66–7.60(m,3H),7.33(ddd,J=15.3,7.1,1.2Hz,2H),5.94(s,1H),5.36(d,J=5.8Hz,2H),4.38(t,J=6.2Hz,2H),2.69(t,J=6.2Hz,2H),2.19–2.14(s,6H).13C NMR(101MHz,CDCl3)δ160.1,150.1,147.0,146.7,133.7,130.0,129.5,128.0,124.0,123.5,123.2,122.5,122.2,120.4,118.2,111.8,58.8,48.4,45.4,41.5.HPLC purity:99.9%.HRMS(ESI)m/z:calcd for C22H23N7,[M+H]+,386.2022found 386.2020.
实施例37:化合物CK2-2的合成
方法同实施例36,所不同的是用:N,N-二乙基-2-叠氮乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-2。
产率85%。m.p.140.1-140.3℃;1H NMR(400MHz,CDCl3)δ8.44(d,J=6.9Hz,1H),8.24(d,J=8.4Hz,1H),7.90(d,J=8.5Hz,1H),7.63(dt,J=19.1,7.5Hz,4H),7.45(t,J=7.3Hz,2H),5.90(s,1H),5.38(d,J=5.8Hz,2H),4.50(s,2H),2.80(s,2H),2.35(d,J=6.9Hz,4H),0.82(t,J=6.9Hz,6H).13C NMR(101MHz,CDCl3)δ158.8,147.2,146.9,145.5,134.0,133.7,130.1,129.6,128.1,124.1,124.3,123.2,122.8,122.2,121.4,118.1,111.8,52.9,50.0,49.0,41.0,12.0.HPLC purity:99.0%.HRMS(ESI)m/z:calcd for C24H27N7,[M+H]+,413.2328found 413.2326.
实施例38:化合物CK2-3的合成
方法同实施例36,所不同的是用2-叠氮基乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-3。
产率70%。m.p.134.4-135.5℃;1H NMR(400MHz,CDCl3)δ8.46(d,J=7.6Hz,1H),8.32(d,J=8.4Hz,1H),7.90(d,J=8.4Hz,1H),7.75–7.65(m,4H),7.40(t,J=7.6Hz,2H),5.90(t,J=5.9Hz,1H),5.38(d,J=6.1Hz,2H),4.39–4.29(m,2H),3.25–3.13(m,2H).13C NMR(101MHz,DMSO-d6)δ158.2,147.8,146.8 146.4,136.1,134.1,131.5,129.6,128.5,124.2,123.9,123.7,123.5,122.8,122.0,119.8,112.9,53.7,43.2 41.2.HPLC purity:99.5%.HRMS(ESI)m/z:calcd for C20H19N7,[M+H]+,357.1779found 357.1772.
实施例39:化合物CK2-4的合成
方法同实施例36,所不同的是用N-(2-叠氮基乙基)吡咯烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-4。
产率75%。m.p.215.5-216.8℃;1H NMR(400MHz,CDCl3)δ8.50(d,J=7.8Hz,1H),8.23(d,J=8.4Hz,1H),7.98(d,J=8.2Hz,1H),7.70(d,J=11.3Hz,2H),7.60(t,J=7.3Hz,2H),7.58(dd,J=14.0,7.0Hz,2H),5.78(t,J=5.4Hz,1H),5.36(d,J=6.1Hz,2H),4.50(t,J=6.3Hz,2H),2.92(t,J=6.3Hz,2H),2.50(s,4H),1.70(s,4H).13C NMR(101MHz,CDCl3)δ160.5,150.1,149.9,146.8,134.8,133.6,130.0,130.6,128.0,124.1,123.5,123.2,122.4,122.2,120.3,118.1,111.7,55.3,53.9,49.8,41.2,23.8.HPLC purity:99.0%.HRMS(ESI)m/z:calcd for C24H25N7,[M+H]+412.2241,found 412.2240.
实施例40:化合物CK2-5的合成
方法同实施例36,所不同的是用N,N-二甲基-3-叠氮丙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-5。
产率89%。m.p.193.0-194.9℃;1H NMR(400MHz,CDCl3)δ8.40(d,J=7.5Hz,1H),8.29(d,J=8.5Hz,1H),7.98(d,J=8.5Hz,1H),7.72–7.60(m,3H),7.58(s,1H),7.48(td,J=8.0,1.5Hz,2H),5.80(s,1H),5.37(d,J=6.1Hz,2H),4.42(t,J=6.8Hz,2H),2.33(t,J=6.5Hz,2H),2.26(s,6H),2.08–2.02(m,2H).13C NMR(101MHz,CDCl3)δ159.1,148.2,148.0,146.5,133.7,133.6,130.3,129.8,128.0,124.1,123.5,123.2,123.2,123.0,120.3,119.3,111.6,55.7,48.2,45.6,41.2,28.2.HPLC purity:99.5%.HRMS(ESI)m/z:calcd for C23H25N7,[M+H]+400.2241,found 400.2239.
实施例41:化合物CK2-6的合成
方法同实施例36,所不同的是用N,N-二乙基-3-叠氮丙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-6。
产率80%。m.p.155.8-155.1℃;1H NMR(400MHz,CDCl3)δ8.40(d,J=7.5Hz,1H),8.26(d,J=9.0Hz,1H),8.00(d,J=8.0Hz,1H),7.76-7.66(m,3H),7.58(s,1H),7.54(m,2H),5.76(t,J=6.0Hz,1H),5.42(d,J=6.0Hz,2H),4.35(t,J=7.0Hz,2H),2.39(q,J=7.0Hz,4H),2.34(t,J=6.8Hz,2H),2.05(p,J=6.9Hz,2H),0.92(t,J=7.3Hz,6H).13C NMR(101MHz,CDCl3)δ159.1,149.3,148.3,146.2,134.5,133.9,130.8,123.0,128.8,124.5,123.5,123.2,122.6,122.5,120.3,118.2,112.0,50.2,48.8,46.5,41.2,27.8,11.6.HPLC purity:99.8%.HRMS(ESI)m/z:calcd for C25H29N7,[M+H]+428.2554,found 428.2550.
实施例42:化合物CK2-7的合成
方法同实施例36,所不同的是用3-叠氮基-1-丙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-7。
产率78%。m.p.145.3-144.3℃;1H NMR(400MHz,CDCl3)δ8.40(d,J=7.6Hz,1H),8.25(d,J=8.0Hz,1H),7.93(d,J=8.4Hz,1H),7.70–7.68(m,1H),7.61(dt,J=8.8,4.3Hz,2H),7.50(s,1H),7.48–7.42(m,2H),5.70(s,1H),5.36(d,J=6.2Hz,2H),4.41(t,J=6.9Hz,2H),2.63(t,J=6.9Hz,2H),2.00(p,J=6.8Hz,2H).13C NMR(101MHz,MeOD)δ159.0,148.2,148.1,146.5,133.8,133.6,132.9,130.1,128.2,127.4,123.6,123.0,122.8,122.5,121.5,121.3,118.6,113.2,49.4,48.0,37.7,32.4.HPLC purity:98.8%.HRMS(ESI)m/z:calcd for C21H21N7,[M+H]+372.1928,found373.1924.
实施例43:化合物CK2-8的合成
方法同实施例36,所不同的是用N-(3-叠氮基丙基)吡咯烷代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK2-8。
产率80%。m.p.224.8-223.6℃;1H NMR(400MHz,CDCl3)δ8.36(d,J=7.6Hz,1H),8.20(d,J=8.5,1H),7.98(d,J=8.2Hz,1H),7.66(s,1H),7.62–7.56(m,2H),7.56(s,1H),7.47–7.41(m,2H),5.77(t,J=6.1Hz,1H),5.35(d,J=6.2Hz,2H),4.40(t,J=6.9Hz,2H),2.55–2.50(m,6H),2.00(p,J=6.9Hz,2H),1.80–1.68(m,4H).13C NMR(101MHz,CDCl3)δ159.0,148.4,148.0,146.5,133.7,133.5,130.3,129.6,128.0,124.0,123.5,123.2,122.1,122.1,120.3,118.2,111.8,53.9,52.4,48.3,40.9,29.3,23.4.HPLC purity:99.8%.HRMS(ESI)m/z:calcd for C25H27N7,[M+H]+426.2398,found 426.2390.
本发明所述的喹啉类衍生物的制备方法,当X为N,Y为甲基,n=2时为CK3系列化合物,其合成方法包括以下步骤:
FM4.化合物S3以环丁砜作为溶剂经碘甲烷于60℃甲基化得到
FM5.以乙二醇乙醚作溶剂,化合物与炔丙胺于120℃发生取代反应得
FM6.将与不同叠氮侧链在一价铜的催化下发生点击反应(1,3-偶极环加成反应)经柱层析纯化后得到一系列目标产物喹啉类衍生物
实施例44:化合物FM5的合成
取1mmol FM4置于100mL耐压管中,加入约3mmol的炔丙胺,40mL乙二醇乙醚作溶剂,密封加热到120℃反应30分钟。停止反应后冷却,加入50mL乙醚超声后冷冻,析出固体,过滤收集固体。将所得固体用硅胶柱层析纯化(流动相:二氯甲烷:甲醇=100:1;氨水0.5%)得到浅黄色固体。
产率:74%。1H NMR(400MHz,CDCl3)δ8.68(d,J=8.1Hz,1H),7.95(d,J=7.9Hz,1H),7.52(d,J=7.9Hz,1H),7.46(dd,J=13.9,6.3Hz,2H),7.31(t,J=7.6Hz,1H),7.22(d,J=8.4Hz,1H),7.14(t,J=7.3Hz,1H),4.92(s,2H),3.91(s,3H),2.30(t,J=2.5Hz,1H).13C NMR(101MHz,CDCl3)δ154.7,146.7,139.5,136.4,130.7,130.3,127.8,126.7,124.8,123.0,122.00,121.8,118.9,113.7,112.9,84.87,70.0,41.0,35.1,29.7.HRMS(ESI)m/z:calcd for C19H15N2O+,[M-I]+287.1179,found 287.1180.
实施例45:化合物CK3-1的合成
取中间体SM5(0.27g,1mmol)置于50mL单口瓶中,加入10mL四氢呋喃,加入2mL预先配制好的含有(25mg,0.1mmol)五水合硫酸铜溶液,2mL现配现用的含有(50mg,0.2mmol)的抗坏血酸钠溶液,最后加入1.5当量的N,N-二甲基-2-叠氮乙胺。于35℃搅拌反应,TLC监测反应。反应完毕后,旋干溶剂,经柱层析纯化得到淡黄色固体CK1(流动相:二氯甲烷:甲醇=100~30:1;氨水0.5%)。
产率57%。1H NMR(400MHz,CDCl3)δ9.26(d,J=7.9Hz,1H),8.20(d,J=13.0Hz,2H),7.60-7.53(m,3H),7.44–7.32(m,2H),6.99(t,J=7.5Hz,1H),5.40(s,2H),4.36(t,J=6.0Hz,2H),4.30(s,3H),2.85(m,2H),1.19(s,6H).13C NMR(101MHz,CDCl3)δ150.1,146.2,144.0,138.6,135.2,132.8,130.0,127.7,125.9,122.9,122.2,121.8,121.4,120.2,117.3,113.3,111.9,57.9,42.2,42.2,37.9,24.6..HRMS(ESI)m/z:calcd for C23H26N7+,[M-I]+400.2244,found 400.2247.
实施例46:化合物CK3-2的合成
方法同实施例45,所不同的是用N,N-二乙基-2-叠氮乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK3-2。
产率68%。1H NMR(400MHz,CDCl3)δ9.20(d,J=8.7Hz,1H),8.30(d,J=8.4Hz,2H),7.88(m,3H),7.22–7.12(m,2H),7.00(t,J=7.5Hz,1H),5.37(d,J=6.1Hz,2H),5.26(d,J=5.8Hz,2H),4.34(t,J=6.6Hz,2H),4.32(s,3H),2.52(d,J=6.8Hz,4H),1.13(t,J=6.3Hz,6H).13C NMR(101MHz,CDCl3)δ154.1,148.4,144.0,138.0,134.3,131.6,129.6,127.7,125.2,123.8,123.7,122.9,120.4,121.2,117.3,113.3,111.9,57.9,50.0,46.5,41.9,39.8,10.7.HRMS(ESI)m/z:calcd for C25H30N7+,[M-I]+428.2557,found428.2553.
实施例47:化合物CK3-3的合成
方法同实施例45,所不同的是用N-(2-叠氮基乙基)吡咯烷代替N,N-二甲基-2-叠氮乙胺,得橙红色固体CK3-3。
产率78%。1H NMR(400MHz,CDCl3)δ8.69(d,J=7.8Hz,1H),8.35(d,J=8.7Hz,1H),,7.80(s,1H),7.63(m,3H),7.31(d,J=7.5Hz,2H),7.22(d,J=7.8Hz,1H),5.50(s,2H),4.48(d,J=12.0Hz,2H),4.23(s,3H),3.67(s,4H),2.85(t,J=6.3Hz,2H),2.50(s,4H).13C NMR(101MHz,CDCl3)δ154.0,150.8,146.0,143.7,142.4,137.0,135.4,132.2,130.5,124.3,124.0,122.2,121.8,121.5,121.2,117.3,113.5,111.8,55.8,55.0,49.8,47.0.42.9,28.3.HRMS(ESI)m/z:calcd for C25H28N7O+,[M-I]+442.2350,found442.2351.
实施例48:化合物CK3-4的合成
方法同实施例45,所不同的是用2-叠氮基乙胺代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK3-4。
产率48%。1H NMR(400MHz,CDCl3)δ8.70(d,J=8.0Hz,1H),8.20(d,J=8.6Hz,1H),7.95(d,J=8.0Hz,1H),7.80–7.62(m,4H),7.20(t,J=8.0Hz,2H),5.86(t,J=6.0Hz,1H),5.34(d,J=6.1Hz,2H),4.42–4.36(m,2H),3.80(s,3H),3.36–3.28(m,2H).13C NMR(101MHz,CDCl3)δ154.2,149.6,146.2,138.2,137.7,132.9,132.5,131.2,129.2,123.6,123.2,121.5,121.4,121.1,116,5,113.6,112.7,55.0,47.8,42.6,41.5.HRMS(ESI)m/z:calcd for C21H22N7+,[M-I]+372.1931,found372.1931.
实施例49:化合物CK3-5的合成
方法同实施例45,所不同的是用N-(2-叠氮基乙基)哌啶代替N,N-二甲基-2-叠氮乙胺,得淡黄色固体CK3-5。
产率58%1H NMR(400MHz,CDCl3)δ8.69(d,J=8.2Hz,1H),7.93(d,J=24.8Hz,2H),7.50(dd,J=20.0,7.7Hz,3H),7.31(d,J=7.1Hz,2H),7.15(d,J=7.2Hz,1H),5.43(d,J=8.5Hz,2H),4.47(t,J=6.6Hz,2H),3.94(s,3H),2.80(t,J=6.6Hz,2H),2.50(s,4H),1.58–1.39(m,6H).13C NMR(101MHz,CDCl3)δ154.5,150.1,145.6,137.2,135.4,131.2,123.2,127.8,125.3,123.6,122.0,121.5,121.2,121.0,117.3,113.5,112.0,58.8,55.2,48.0,47.1,40.6,25.2,24.6.HRMS(ESI)m/z:calcd for C26H30N7+,[M-I]+440.2557,found440.2559.
实施例50:本发明所述喹啉类衍生物对癌基因c-myc转录表达具有抑制作用
本发明的喹啉类衍生物可用于制备以c-myc启动子区域G-四链体结构为靶点的抗癌药物。选择图1中实施例制备的化合物,采用RT-PCR实验将不同浓度(0~2μM)的化合物加入到处于对数的生长期Raji细胞中培养6h后,收集细胞,提取细胞内总RNA,进行逆转录并用c-myc的特异引物进行扩增,检测191bp大小的产物的量并以β-actin作为内参,以未加药细胞中内参β-actin基因转录量为基准计算得到的c-myc基因相对转录量。
图1结果表明本发明所述化合物在浓度为2.0μM时,在Raji细胞内对c-myc基因的转录具有明显的抑制作用。
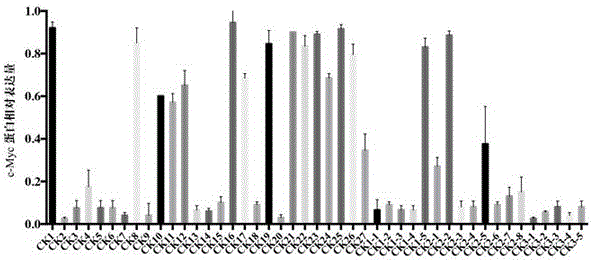
实施例51:选择图2中实施例制备的化合物,将不同浓度(0~2μM)的化合物加入到处于对数的生长期Raji细胞中培养6h后,收集细胞提取总蛋白,用c-myc蛋白和β-actin蛋白(内参)的抗体进行western bolt实验,以未加药细胞中内参β-Actin蛋白表达量为基准计算得到的c-Myc蛋白相对表达量(化合物加入细胞中的处理时间为12小时),检测化合物对c-myc蛋白表达的影响。图2结果表明本发明所述化合物在浓度为2.0μM时,在Raji细胞内对c-myc基因的翻译,c-MYC蛋白的表达具有明显的抑制作用。
实施例52:本发明所述喹啉类衍生物对肿瘤细胞生长的抑制作用
选择表1中实施例制备的化合物,以Raji(淋巴瘤细胞)、CA46(淋巴瘤细胞)(但本发明的应用不限于此),Cc大鼠肾小球系膜细胞(正常细胞)采用MTT法进行体外细胞毒测定。对数生长期细胞加入所述喹啉类衍生物,作用48小时后,测定其吸光度。分别计算抑制细胞生长达50%时的化合物浓度以IC50值表示,结果如表1所示。结果表明本发明所述化合物在体外对人淋巴癌细胞株具有较强的抑制作用。因此本发明所述的喹啉类衍生物极具有开发前景,可用于制备抗癌的药物。
表1本发明所述衍生物对癌细胞株和正常细胞株的生长抑制的IC50值(μM)
- 还没有人留言评论。精彩留言会获得点赞!