一种土霉素降解菌株的筛选方法与流程
本发明涉及一种土霉素降解菌株的筛选方法,属于微生物降解抗生素残留技术领域。
背景技术:
土霉素(Oxytetracycline),又称地霉素,氧四环素,属于四环素类抗生素。化学名称为:(4s,4аR,5S,5аR,6S,12аS)-N-4-二甲胺基-1,4,4а,5,5а,6,11,12а-八氢,5,6,10,12,12а-六羟基-6-甲基-1,11-二氧代并四苯-2-甲酰胺,分子式:C22H24N2O9,相对分子质量:460.58,化学结构式为:
土霉素为广谱抗生素,许多立克次体属、支原体属、衣原体属、螺旋体、阿米巴原虫和某些疟原虫对其敏感。其他如放线菌属、炭疽杆菌、单核细胞增多性李斯特菌、梭状芽孢杆菌、奴卡菌属、弧菌、布鲁菌属、弯曲杆菌、耶尔森菌等也对其敏感。
目前,土霉素环境残留问题已经成为国内外普遍关注的热点环境问题之一。至今,国内外有关土霉素生物降解与降解菌株筛选方面的研究报道也不是很多。
显然,研究并提出一种快速、高效、并能同时获得降解不同浓度土霉素菌株的筛选方法,特别是降解低浓度或贫营养级土霉素的高效菌株,以获得最大程度地降解效果,在抗生素生物降解理论与方法的研究上具有重要的科学意义与应用前景。
技术实现要素:
本发明的目的是提供一种快速、高效、并能同时获得降解不同浓度土霉素菌株的筛选方法。
一种土霉素降解菌株的筛选方法,包括以下过程:
1)土霉素降解菌株的分离
采集土霉素菌肥,然后将菌肥加入到蒸馏水中,混合均匀,提取菌肥浸出液;菌肥和蒸馏水的添加比例为1g:10ml;
分别吸取100ul菌肥浸出液,涂布于土霉素含量不同的无机盐固体培养基上,置于30℃条件下遮光培养2天,得到菌落;培养基中土霉素含量为25mg/l-100mg/l;
2)菌株纯化
将步骤1)分离得到的菌落,在含有土霉素的无机盐固体培养基平板划线,进一步分离和纯化;此步骤可重复2-3次,直至得到单一菌落;然后将单菌落接入含有土霉素的无机盐液体培养基中,置于30℃,150r/min震荡条件下,遮光培养2天,得到单一菌落培养液;
3)菌株降解功能验证
将步骤2)得到的培养液,在土霉素为唯一碳源且土霉素浓度不同的无机盐固体培养基平板上划线,30℃遮光培养2天;能够生长的菌株即为能够以土霉素为唯一碳源的降解菌株;通过观察可以得到菌株能够利用和降解土霉素的浓度范围;
4)菌株降解活性验证
将步骤3)得到的能够以土霉素为唯一碳源生长的菌株,接到活化培养基上进行活化;然后将活化的菌液按1%的接种量,转接到以土霉素为唯一碳源且浓度适宜的无机盐液体培养基中,30℃,150r/min震荡暗培养培养2天,最后用高效液相色谱法测定菌株对土霉素的降解率;试管斜面保存不同浓度降解率高的菌株,4℃储存。
以上各个步骤所用到的培养基为:
步骤1)中无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌;在倒平板前,在培养基中添加土霉素,添加浓度依次为25、50、100mg/l,摇匀。
步骤2)中无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌;在倒平板前,在培养基中添加土霉素,添加浓度依次为25mg/l,摇匀。
步骤2)中无机盐液体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,蒸馏水1000ml,调节pH至7.0,高压灭菌;在冷却到室温后,在培养基中添加土霉素,添加浓度为25mg/l,摇匀。
步骤3)中无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌;在倒平板前,在培养基中添加土霉素,添加浓度依次为50mg/l、100mg/l,摇匀。
步骤4)中细菌活化培养基为牛肉膏蛋白胨培养基,其配方为:牛肉膏3g,蛋白胨5g。氯化钠5g,琼脂18g,蒸馏水定容至1000ml,用1mol/l氢氧化钠调节pH至7.0-7.2后灭菌。
其中,步骤1)和步骤2)包括以下过程:
a)菌种富集
采集菌肥,称取菌肥10g,加至装有100ml灭菌蒸馏水的三角瓶中(250ml,内含玻璃珠),在恒温摇床上以30℃,200r/min震荡30min,取出后静置;吸取1ml菌肥浸出液,
装入100ml富集培养基的500ml的三角瓶中,30℃,150r/min震荡条件下,暗培养2天;然后取10ml培养液转入新的相同的培养基中,在相同的条件下继续富集培养一次;
无机盐液体富集培养基组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,分装到250ml三角瓶中,高压灭菌,在超净工作台中添加土霉素,添加浓度依次为25、50、100mg/l,摇匀;
b)菌株分离
吸取100ul上述富集培养液,分别一一对应涂布于上面所述3种不同土霉素浓度的无机盐固体培养基平板上,置于30℃条件下遮光培养2天;
无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌;在倒平板前,在培养基中添加土霉素,添加浓度与无机盐液体富集培养基相同。
该土霉素降解菌即假单胞菌属(Pseudomonas sp.),保藏在中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,邮编100101,保藏编号为CGMCC No13051,保藏日期为2016年9月28。附件提供保藏证明文件。
本发明采用一种土霉素降解菌株的筛选方法,筛选方法快速易行,经济廉价,所得到的菌株可用于制备土霉素菌剂菌剂;本发明利用土霉素菌肥为筛选的最初原料,所得到的菌株及制成的菌剂可直接应用于土霉素企业废弃物的处理,也有可能应用于周边被土霉素污染的土壤与水体环境的修复;本发明采用高效液相色谱法测定菌株降解活性,所得结果的准确度和精度较高。
附图说明
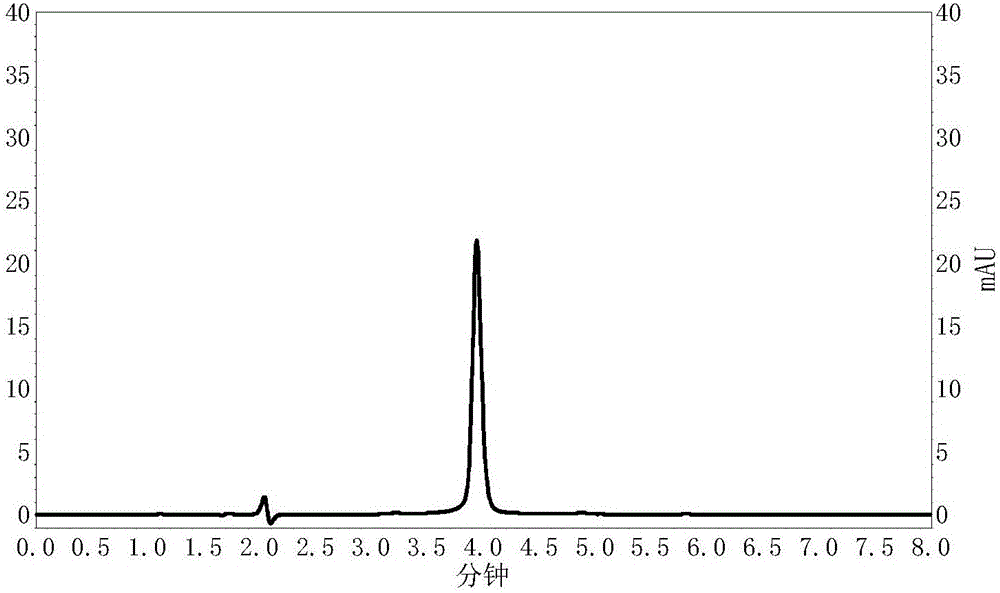
图1为土霉素标准溶液高效液相色谱图;
图2为土霉素高效液相色谱标准曲线图;
图3为土霉素降解菌株降解效率测定图。
具体实施方式
结合实施例说明本发明的具体实施方式。
实施例1
菌样品采集与处理
采集菌肥生产企业的菌肥,并称取菌肥10g,加至装有100ml灭菌蒸馏水的三角瓶中(250ml,内含玻璃珠),在恒温摇床上以30℃,200r/min震荡30min,取出后静置;
菌株分离
吸取100ul菌肥浸出液,涂布于无机盐固体培养基平板上,置于30℃条件下遮光培养2天。无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌。在倒平板前,在培养基中添加土霉素,添加浓度依次为25、50、100mg/l,摇匀。
菌株纯化
取平板上分离得到的单菌落,在含有土霉素的无机盐固体培养基平板划线,进一步分离和纯化;此步骤可重复2-3次,直至得到单一菌落;然后将单菌落接入含有土霉素的无机盐液体培养基中,置于30℃,150r/min震荡条件下,遮光培养2天;
无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌。在倒平板前,在培养基中添加土霉素,添加浓度依次为25mg/l,摇匀。
无机盐液体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,蒸馏水1000ml,调节pH至7.0,高压灭菌。在冷却到室温后,在培养基中添加土霉素,添加浓度为25mg/l,摇匀。
菌株降解功能验证
首先,对纯化得到的菌株进行活化培养,用牛肉膏蛋白胨培养基活化培养2天,得到菌株培养液。然后取培养液,在以土霉素为唯一碳源且土霉素浓度不同的无机盐固体培养基平板上划线,在30℃条件下,遮光培养2天。能够生长的菌株即为能够以土霉素为唯一碳源的降解菌株。观察菌株在不同浓度土霉素平板上生长状况,可以得到菌株适宜的降解土霉素的浓度与范围。部分菌株实验结果见表1。
无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌。在倒平板前,在培养基中添加土霉素,添加浓度依次为50mg/l/100mg/l,摇匀。
牛肉膏蛋白胨培养基,其配方为:牛肉膏3g,蛋白胨5g。氯化钠5g,琼脂18g,蒸馏水定容至1000ml,用1mol/l氢氧化钠调节pH至7.0-7.2后灭菌。
表1不同土霉素浓度下菌株生长状况
注:+代表生长;++代表大量生长;—代表未生长。
由表1可知,土霉素的浓度范围在低浓度(≤25mg/l)、中低浓度(25-50mg/l)、中高浓度(50-100mg/l)、高浓度(≥100mg/l)时,都可得到降解菌株;
5)菌株降解活性鉴定
将具有降解土霉素的菌株转接到无机盐液体培养基上进行活化,并将活化的菌液按1%的接种量转接到以土霉素为唯一碳源且浓度适宜的无机盐液体培养基中,30℃,150r/min震荡暗培养培养2天,最后用高效液相色谱法测定菌株对土霉素的降解率;试管斜面保存不同浓度降解率高的菌株,4℃储存。
土霉素溶液全波段扫描实验
取土霉素标准液2ml,加入比色管中。在紫外-可见分光光度计上进行全光谱扫描,发现355nm附近有吸收峰。因此,土霉素测定波长采用355nm。其高效液相色谱图见图1。
标准曲线的绘制
准确称取土霉素标准品0.050g,加入少量甲醇溶解,然后转移到10mL棕色容量瓶中,用甲醇定容,配制成5mg·mL-1的标准储备液。标准溶液(3.125、6.25、12.5、25、50、100和200mg·L-1)均由储存标样加甲醇稀释配制而成。以上标准储备液和标准溶液均保存在4℃冰箱中。用高效液相色谱仪进行测定,得到土霉素浓度x与峰面积y的线性回归方程为y=351612.1066x+877658.5417,R2=0.99995,见图2。
色谱条件:采用Sunfire C18色谱柱(150mm×4.6mm,3.5um,Waters,USA);流动相为0.05%磷酸水溶液(A)和乙腈(B);流速为1.0mL·min-1;柱温35℃;进样体积20ul;检测波长为355nm。洗脱程序:0-17min,93.2%A,6.8%B。
样品上机检测,得到精确的降解率
取待测液1ml,加入5ml甲醇,摇匀,10000r/mim离心15min,取上清液,用0.22um针筒式微孔滤膜过滤得到滤液,然后用高效液相色谱仪进行测定,根据线性回归方程计算出土霉素的含量与降解率。
实施例2
土霉素降解菌株的富集、分离与纯化
菌种富集
采集菌肥,称取菌肥10g,加至装有100ml灭菌蒸馏水的三角瓶中(250ml,内含玻璃珠),在恒温摇床上以30℃,200r/min震荡30min,取出后静置;吸取1ml菌肥浸出液,装入100ml富集培养基的500ml的三角瓶中,30℃,150r/min震荡条件下,暗培养2天;然后取10ml培养液转入新的相同的培养基中,在相同的条件下继续富集培养一次;
无机盐液体富集培养基组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,分装到250ml三角瓶中,高压灭菌,在超净工作台中添加土霉素,添加浓度依次为25、50、100mg/l,摇匀。
菌株分离
吸取100ul上述富集培养液,分别一一对应涂布于上面所述3种不同土霉素浓度的无机盐固体培养基平板上,置于30℃条件下遮光培养2天;
无机盐固体培养基的组成为:氯化铵1g,磷酸二氢钾0.5g,磷酸氢二钾1.5g,硫酸镁0.2g,氯化钠1g,琼脂20g,蒸馏水1000ml,调节pH至7.0,高压灭菌。在倒平板前,在培养基中添加土霉素,添加浓度与无机盐液体富集培养基相同。之后的操作步骤同实施例1。
实施例3
土霉素降解菌株降解效率测定
在无机盐液体培养基中添加100mg/l土霉素,摇匀,接入单菌落,置于30℃,150r/min条件下,遮光培养。色谱条件:采用Sunfire C18色谱柱(150mm×4.6mm,3.5um,Waters,USA);流动相为0.05%磷酸水溶液(A)和乙腈(B);流速为1.0mL·min-1;柱温35℃;进样体积20ul;检测波长为355nm。洗脱程序:0-17min,93.2%A,6.8%B。取待测液1ml,加入5ml甲醇,摇匀,10000r/mim离心15min,取上清液,用0.22um针筒式微孔滤膜过滤得到滤液,然后用高效液相色谱仪进行测定,如图3,根据线性回归方程计算出土霉素降解率。
- 还没有人留言评论。精彩留言会获得点赞!