一种抗菌肽的制作方法
本发明属于生物医药领域,具体涉及一种抗菌肽。
背景技术:
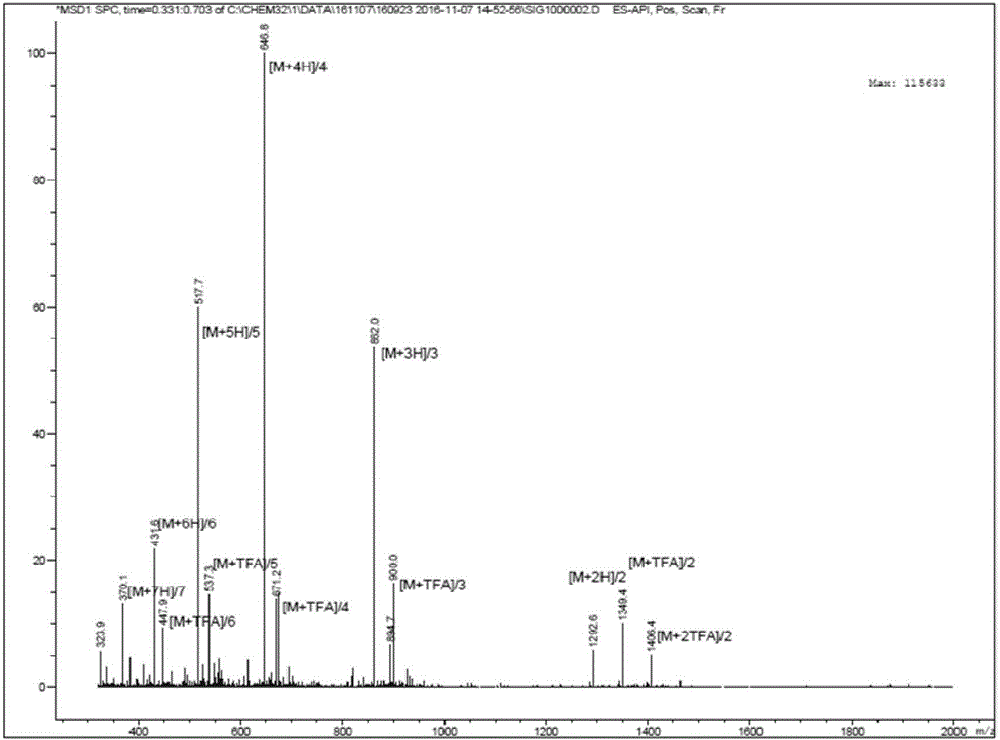
:抗生素作为一类重要的临床用药,自被应用以来已拯救了无数人的生命。但近年来,抗生素滥用及耐药菌的层出不穷,特别是多药耐药菌(超级细菌)的出现成为当今世界医疗领域面临的主要难题之一,也使得越来越多的国家开始寻求抗生素替代品。多肽类抗菌药物因其抗菌活性高,不易产生耐药性等原因,被认为将会在医药工业上有着广阔的应用前景,也是人们解决耐药菌、促进人类健康的希望所在。抗菌肽又称抗微生物肽(antimicrobialpeptide)或肽抗生素(peptideantibiotics),在动植物体内分布广泛,是天然免疫防御系统的一部分。抗菌肽和常规的抗生素不同,它是某个特定基因编码的蛋白产物,因此具有独特的抗菌机制。抗菌肽来源于多种生物,如哺乳动物、无脊椎动物、植物、真菌、细菌等,目前已发现的抗菌肽有2000多种。抗菌肽具有广谱抗细菌、真菌、病毒、螺旋体、寄生虫的活性,而且具有不易产生耐药的特性。近年来,抗生素的广泛使用造成了多药耐药菌感染在临床的蔓延,因而抗菌肽低耐药性在预防与治疗耐药菌感染方面具有广阔的应用前景,其研究及应用已成为当前生物制药的热点。同时作为最具潜力的抗生素替代品之一,抗菌肽在新型食品、药品、护肤品以及化妆品防腐剂中的应用也越来越广泛,具有良好的发展前景。虽然天然抗菌肽具有普遍的优点,但也存在着某些明显的不足。例如,相当一部分天然的抗菌肽抑菌活性较低、稳定性较差、毒性较高,例如导致真核细胞发生溶血等;另外,部分天然抗菌肽对耐药菌的抑制效果差,不能满足实际应用的要求。技术实现要素:本发明针对上述问题,提供一种抗菌肽,该抗菌肽的序列为:Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg-X1-X2-Arg-Arg-Leu-Trp-Gly-Ala,其中,X1选自Lys、Arg、Trp、Leu、Phe、Tyr;X2选自Trp、Arg、Lys、Phe、Ser、His。实验结果表明,本发明的抗菌肽对耐甲氧青霉素金葡菌(MRSA)、耐万古霉素肠球菌(VRE)、耐碳青霉烯铜绿假单胞菌(CRPA)、耐药肺炎克雷伯杆菌(KPN)有明显的抑制作用,而且具有很低的溶血活性,稳定性好,抗菌活性强,具有高效广谱抑菌作用。根据本发明的一个方面,本发明提供了一种抗菌肽,其序列为:Tyr-Gly-Arg-Lys-Lys-Arg-Arg-Gln-Arg-Arg-Arg-X1-X2-Arg-Arg-Leu-Trp-Gly-Ala,其中,X1选自Lys、Arg、Trp、Leu、Phe、Tyr;X2选自Trp、Arg、Lys、Phe、Ser、His;优选,X1为Arg;优选,X2为Lys。根据本发明的另一个方面,本发明提供了一种组合物,含有本发明的抗菌肽。在本发明中,该组合物包括但不限于洗面奶、洗手液、沐浴液、洗发香波、漱口水、牙膏、香皂、化妆品、女性护理洗液、洗衣皂、洗衣液、洗衣粉、洗涤灵、消毒液或洁厕液等。根据本发明的另一个方面,本发明提供了一种织物,含有本发明的抗菌肽。在本发明中,织物包括但不限于衣物、床上用品、消毒纸巾、辅料或绷带等。根据本发明的另一个方面,本发明提供了一种食品或饲料,含有本发明的抗菌肽。根据本发明的另一个方面,本发明提供了一种卫生巾、卫生护垫、尿不湿或尿垫,含有本发明的抗菌肽。根据本发明的另一个方面,本发明提供了一种药物组合物,含有本发明的抗菌肽。根据本发明的另一个方面,本发明提供了本发明的抗菌肽在制备具有抑菌和或杀菌性能的产品中的应用。这些产品包括但不限于洗面奶、洗手液、沐浴液、洗发香波、漱口水、牙膏、香皂、化妆品、女性护理洗液、洗衣皂、洗衣液、洗衣粉、洗涤灵、消毒液、洁厕液、衣物、床上用品、消毒纸巾、辅料、绷带、卫生巾、卫生护垫、尿不湿、尿垫、食品、饲料等。根据本发明的另一个方面,本发明提供了本发明的抗菌肽在制备用于预防和/或治疗感染的药物中的应用。优选,所述感染由细菌、真菌、病毒、螺旋体或寄生虫引起。根据本发明的另一个方面,本发明提供了本发明的抗菌肽用作防腐剂的应用。在本发明的上述组合物、食品或饲料、药物组合物中,抗菌肽可以是使其具有抑菌和/或杀菌性能的活性成分,也可以仅用作防腐剂。如果抗菌肽为具有抑菌和/或杀菌性能的活性成分,其含量应当是抑菌和/或杀菌有效量的;如果抗菌肽用作防腐剂,其含量应当是防腐有效量的。本领域技术人员具有能力确定上述组合物、食品或饲料、药物组合物中抗菌肽的合适含量。在本发明的上述织物、卫生巾、卫生护垫、尿不湿或尿垫中,抗菌肽为提供抑菌和/或杀菌性能的活性成分。本领域技术人员具有能力确定抗菌肽的合适含量。本领域技术人员知晓,在本发明的各种组合物、食品或饲料、药物组合物中,可进一步含有常规的各种辅料和/或活性成分,并且能够根据本领域的常规方法确定本发明的抗菌肽、各种辅料和火星成分的合适含量。本领域技术人员同样知晓如何制备含有本发明的抗菌肽的织物、卫生巾、卫生护垫、尿不湿、尿垫,包括但不限于将织物、卫生巾、卫生护垫、尿不湿、尿垫,或者制造织物、卫生巾、卫生护垫、尿不湿、尿垫的材料在含有本发明抗菌肽的溶液中浸渍。本发明的抗菌肽可以采用本领域技术人员已知的方法(例如固相合成方法)制备得到,以及可以采用本领域已知的分离纯化方法(例如高效液相色谱法)分离纯化。附图说明图1为抗菌肽BT315的溶血活性图2为抗菌肽BT315的质谱鉴定图图3为抗菌肽BT315的HPLC纯度鉴定图具体实施方式下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,应理解,在阅读了本发明所记载的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本发明所限定的范围。实施例1.抗菌肽的合成与纯化1.按照Fmoc固相多肽合成法合成X1为Arg、X2为Lys的抗菌肽BT315,合成步骤如下所示:1.1为保证多肽C-端为-CONH2结构,选用RinkAmide树脂类作为高分子固相载体。1.2去Fmoc保护基团:1.2.1将所需高分子固相载体放入合成柱中,加入有机溶剂DMF(二甲基甲酰胺)浸泡10分钟后排放;通入20%的哌啶/DMF溶液盖过树脂表面,通N2反应10分钟后排放;重复一遍通入20%哌啶/DMF、通N2反应10分钟后排放。1.2.2N2保护下,通入DMF溶剂5遍,以彻底洗涤上述树脂。1.3缩合反应:氨基酸活化:称取所需摩尔量3倍的Fmoc-保护氨基酸,溶解于DMF溶剂中,配制成其饱和溶液,加入等摩尔量1-羟基苯并三唑(HOBT)及二异丙基碳二亚胺(DIC),如果需要再加入DMF直至完全溶解,形成氨基酸活化液。在N2环境下,氨基酸活化液通入合成柱中,与其中高分子树脂充分接触,使高分子树脂上活性基团与活化的氨基酸发生(脱水)缩合反应生成肽键;室温下缩合反应时间为30分钟至1小时;反应后排放废液;1.4按照多肽序列,重复步骤1.2至1.3操作直至完成整个肽链的合成。1.5裂解及侧链保护基团的移除:1.5.1配制三氟乙酸(TFA)混合裂解液“K”,配方如下:三氟乙酸(TFA)(82.5%v/v)苯酚(phenol)(5%v/v)水(water)(5%v/v)苯基甲基硫醚(thioanisole)(5%v/v)1,2-乙二硫醇(1,2-ethanedithiol)(2.5%v/v)1.5.2实施步骤:1.5.2.1按照步骤1.2所叙,先除去与固相载体相连的多肽N-端的Fmoc保护基团,用二氯甲烷洗去残余DMF,干燥,转入一干燥玻璃容器中;1.5.2.2导入上述TFA裂解液“K”(30ml/克树脂),在室温下温和搅拌反应4小时。1.5.2.3反应完毕后,将树脂滤出,裂解液直接进入事先(-20℃)冷却的甲基异丁基醚中(30ml:5mlv/v)沉淀;1.5.2.4高速离心(4000rmp,4℃)5分钟,弃去清液,用95%TFA溶解瓶底沉淀,再倒入冷却的甲基异丁基醚中(30ml:5mlv/v)沉淀;1.5.2.5弃去清液,通入N2至甲基异丁基醚基本挥发,用少量的去离子水溶解沉淀物,经-80℃冷冻,在冷冻干燥机上干燥后,得到粉状微黄色粗肽。2.多肽的分析和纯化:由岛津LC-10ATVP型输液泵、岛津DGU-14A型脱气机、岛津SPD-10A型紫外检测器、Rheodyne7725I进样阀、PhenomenexNucleosilC18色谱柱(250×4.6mmI.D.)、WDL-95型色谱工作站构成HPLC分离系统。样品进样后以1.0mL/min的流速0-30分钟内,含0.1%三氟乙酸的5%乙腈水溶液至含0.1%三氟乙酸的60%乙腈水溶液线性梯度淋洗,UV220nm检测的色谱条件,进行分离监测。色谱峰流出液收集于离心管留待随后的质谱分析。质谱所用仪器为BrukerDaltonics公司BIFLEX型MALDI-TOF质谱仪,氮激光器,激光波长337nm,采用延时(引出Delayedextraction)和反射(Reflection)的工作方式,加速电压19.5kV,反射电压20kV,延时引出电压14.5kV,延时时间为50~200ns,正离子检测。将色谱峰收集液与适量的基质溶液混合后取约1微升溶液,滴加在样品靶上,待溶剂挥发样品结晶后,送入质谱仪进行质谱分析,累加30次单次扫描信号得到质谱图。图2为其质谱鉴定图,图3为其HPLC纯度鉴定图。抗菌肽BT315的纯度大于98%,含19个氨基酸,分子量2584Da,等电点是12.55。按照上述相同的方法制备得到了X1为Arg、X2为Arg;X1为Phe、X2为Trp的多肽。上述抗菌肽由宁波康贝生化有限公司合成。实施例2.抗菌肽BT315的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定用无菌培养液将实施例1制备得到的抗菌肽BT315倍比稀释制成1mL浓度分别为512、256、128、64、32、16、8、4、2、1、0.5、0.25μg/mL的抗菌肽溶液。将受试菌株接种至2mL培养液中,37℃培养8h,用无菌培养液稀释成菌落数约为5×105CFU/mL左右的菌液。取1mL的菌液分别加至上述制备好的抗菌肽溶液中,此时,各溶液中抗菌肽浓度分别为256、128、64、32、16、8、4、2、1、0.5、0.25、0.125μg/mL。同样的方法制备抗生素万古霉素及亚胺培南溶液,作为阳性对照;另设不含药组作为阴性对照。置37℃普通空气孵箱中孵育16~20h,观察抗菌效果,无细菌生长的最低抗菌肽浓度为最小抑菌浓度MIC值;依次将未见细菌生长各管培养物分别吸取0.1mL倾倒于营养琼脂平皿上,37℃再培养18h,平皿上菌落小于5个的最低抗菌肽浓度即为最小杀菌浓度MBC值。结果见下表1。表1抗菌肽BT315的最小抑菌浓度(MIC)和最小杀菌浓度(MBC)其中,MRSA为耐甲氧青霉素金葡菌,VRE为耐万古霉素肠球菌,这两种为革兰氏阳性菌;CRPA为耐碳青霉烯铜绿假单胞菌,KPN为耐药肺炎克雷伯杆菌,这两种为革兰氏阴性菌。从上表可以看出,抗菌肽BT315对革兰氏阴性和阳性菌都有较好的抑菌和杀菌效果,其中对耐药金黄色葡萄球菌的效果最好。实施例3.pH值对抗菌肽BT315的MIC值的影响分别将含有不同样品浓度的培养基的pH调整至5.0、6.0、7.0、8.0、9.0,室温静置1h后,调节pH值至7.0,再用无菌培养基将其体积调整一致,按实施例2所述方法测定MIC值。结果见下表2。表2抗菌肽BT315在不同pH下的最小抑菌浓度(MIC)从上表可以看出抗菌肽BT315在不同pH值时抗菌活性比较稳定,其中在pH中性时活性最高。这表明抗菌肽BT315稳定性较好。实施例4.抗菌肽BT315的溶血活性检测按《中华人民共和国药典》2010年版一部附录92页制备2%红细胞混悬液。取新鲜兔全血约20ml,加入含玻璃珠的锥形瓶中振摇10分钟,或用玻璃搅动血液,除去纤维蛋白,使成脱纤血液。加入0.9%氯化钠溶液约10倍量,摇匀,以每分钟1500~2000转离心5分钟,除去上清液,沉淀的红细胞再用0.9%氯化钠溶液按上述方法洗涤2~3次,至上清液不显红色为止。将所得红细胞用0.9%氯化钠溶液配成2%的红细胞混悬液。取1mL红细胞混悬液分别加入7种不同浓度的抗菌肽BT315溶液,轻混后置37℃的恒温箱中温浴。阴性对照组用生理盐水,阳性对照组用蒸馏水,处理同上。3h后离心,取上清,测545nm处吸光值,计算溶血率(%)=(试验管吸光度-阴性对照管吸光度)/(阳性对照管吸光度-阴性对照管吸光度)×100%,以抗菌肽BT315样品浓度为横坐标、溶血率为纵坐标作曲线。表3不同浓度BT-315的溶血率样品浓度3ug/ml10ug/ml30ug/ml100ug/ml300ug/ml600ug/ml1000ug/ml溶血率0.00%0.14%0.69%2.76%14.23%48.20%66.85%由表3和图1可见,抗菌肽BT315的溶血活性比较低,在样品浓度远超样品MIC及MBC浓度的情况下,溶血率依旧很低,表明其具有较好的安全性。以上,对本发明的实施方式进行了说明。但是,本发明不限定于上述实施方式。凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1