一种检测百合斑驳病毒的LAMP引物组、试剂盒及检测方法与流程
本发明属于植物病毒检测技术领域,具体涉及一种检测百合斑驳病毒的lamp引物组、试剂盒及检测方法。
背景技术:
百合斑驳病毒(lilymottlevirus,lmov)是马铃薯y病毒属(potyvirus)成员,基因组为单分子正链rna,约9.6kb,编码一个相对分子质量约350kda的多聚蛋白,通过自我剪切后形成外壳蛋白cp、细胞质内含体蛋白ci等10个不同大小的功能蛋白。
lmov仅侵染百合科的郁金香属和百合属植物,可由摩擦接种或由蚜虫非持续性传播感染寄主,引起百合斑驳病。该病的相关报道最早见于1944年,症状主要表现为百合叶片有斑驳条纹甚至坏死斑,后期发展为花、叶片卷曲畸形,开碎色花,并常伴随植株矮小、花与球茎的减产等。由于扦插和分球等无性繁殖手段是百合种球生产的主要方式,使得百合一旦感染lmov病毒后,在开放的环境中,病毒就会在该范围内积累扩散传播,造成更大的经济损失。百合斑驳病毒在我国百合主要产区的自然发病率在20~30%,有些甚至达到70%,从荷兰引进的种球带毒率就在30%以上。
目前针对lmov,传统的诊断方法主要有:病毒分离以及免疫学方法诊断抗原,包括常规的rt-pcr、酶联免疫吸附试验(elisa)以及基因芯片技术。
pcr技术虽然操作简单,特异性强,但是,pcr检测中某些关键性限制因素极易造成假阳性或假阴性结果出现。在lmov的rna病毒逆转录的过程中,极易受到rna酶的污染,出现假阴性。而在pcr过程中,样品的非特异性扩增都有可能出现假阳性结果。而且,rt-pcr反应体系中含有各种复杂的基质,使得整个反应受多方面影响。
酶联免疫吸附试验(elisa)是外源基因所表达的特殊形式及蛋白质的检测采用的主要方法。在对样品的加工中,蛋白质很容易遭到破坏,从而影响检测结果准确性。抗原抗体反应的专一性,但不同百合植株中抗原会有所差异,更是给实验增加难度。
另外,目前普遍看好的基因芯片技术存在难以推广应用的障碍。基因芯片除制作昂贵外,还需价格高昂的激光共聚焦扫描仪。在操作复杂、费时,对操作人员的专业要求也比较高,这极大的限制了该技术的推广。
环介导等温扩增(loop-mediatedisothermalamplification,lamp)是由notomi在2000年提出的一种等温核酸扩增技术。该技术主要依靠一种具有链置换特性的bstdna聚合酶(bacillusstearothermophilusdnapolymerase)和四条能够识别靶序列上六个特异区域的引物,在恒温条件下就能实现目标条带的109-1010倍扩增。4条引物fip/bip、f3/b3需在靶基因上的6个不同部位完全匹配才进行扩展,具有高特异性。
此外,lamp比传统pcr灵敏度高,还少受培养介质和生物学物质的影响。lamp阳性扩增反应时,产生大量的类似花椰菜结构的产物和白色焦磷酸絮状沉淀,可以采取多种检测方法,如凝胶电泳电泳检测和浊度仪定量检测。浊度仪根据产物浑浊度的不同对原始核酸分子进行实时定量分析。还可以直接肉眼检测或者在反应体系加入荧光染料,观察变色情况。
该方法成本低廉,操作简单,只需台水浴锅、pcr仪就可在基层推广,lamp技术因其快速、高效、特异性好、灵敏度高和经济等优点,已广泛应用于病原菌、寄生虫、病毒、疾病和转基因产品检测领域,具有广阔的发展应用空间。
然而,百合斑驳病毒是rna单链病毒,容易发生变异,而且不同变异株之间会有许多突变位点,因此,利用lamp技术检测百合斑驳病毒的难点在于保守序列的选择和引物的设计,方法灵敏度较高时,还需要严格的防污染措施来避免假阳性结果。
目前,lamp技术还没有被应用于百合斑驳病毒的检测。
技术实现要素:
本发明提供一种检测百合斑驳病毒的lamp引物组、试剂盒及检测方法,该引物特异性强,与常见侵染百合的7种病毒无交叉,灵敏度高,可在模板纯度只有101拷贝数下进行扩增,依此建立的百合斑驳病毒的lamp诊断方法,具有反应条件简单、操作简便快速、结果判定方便、准确等优点。
为了达到上述目的,本发明提供的技术方案如下:
一种用于检测百合斑驳病毒的lamp引物组,其包括外引物f3和b3,内引物fip和bip,从5’端到3’端,具体序列如下:
f3:5’-aatggcgtgtggctcatg-3’;
b3:5’-ggtgagatttcgctgaaggc-3’;
fip:5’-cgtcggttttgcgtgttcaagttttttggacggagatcagcaagtt-3’;
bip:5’-gcgcatttctcaaacctcgctgttttcgtacctaggcatgtacggt-3’。
本发明提供一种包含所述lamp引物组的百合斑驳病毒的lamp检测试剂盒。
进一步,所述lamp检测试剂盒含有lamp反应体系,该lamp反应体系包括:内引物fip、内引物bip、外引物f3、外引物b3、10×buffer、mg2+、dntps、甜菜碱和bstdna聚合酶,其中,内引物与外引物的浓度之比范围为1-16:1。
进一步,所述的lamp反应体系中,各成分的终浓度为:内引物fip0.8-1.6μm,内引物bip0.8-1.6μm,外引物f30.1-0.8μm,外引物b30.1-0.8μm,mg2+1.0-2.0mm,dntps0.2-0.4mm,甜菜碱0.4-0.8m,bstdna聚合酶0.16-0.48u/μl,其中,内引物与外引物的浓度比为1-16:1。
优选地,lamp反应体系中,各成分的终浓度为:内引物fip0.8-1.0μm,内引物bip0.8-1.0μm,外引物f30.5-0.8μm,外引物b30.5-0.8μm,mg2+1.3-1.7mm,dntps0.3-0.4mm,甜菜碱0.4-0.6m,bstdna聚合酶0.32-0.48u/μl,其中,内引物与外引物的浓度比范围为1-16:1。
更优选地,lamp反应体系中,各成分的终浓度为:内引物fip0.8μm,内引物bip0.8μm,外引物f30.8μm,外引物b30.8μm,mg2+1.5mm,dntps0.4mm,甜菜碱0.4m,bstdna聚合酶0.32u/μl。
一种百合斑驳病毒的lamp快速检测方法,包括以下步骤:
1)提取待测样品rna,将总rna的50ng-5μg用全式基因逆转录试剂盒进行逆转录,获得cdna;
2)配制lamp反应体系
以ddh2o为阴性对照,以包含百合斑驳病毒目的序列的质粒为阳性对照,配制lamp反应体系;
所述lamp反应体系中,各成分的终浓度为:内引物fip0.8-1.6μm,内引物bip0.8-1.6μm,外引物f30.1-0.8μm,外引物b30.1-0.8μm,10×buffer,mg2+1.0-2.0mm,dntps0.2-0.4mm,甜菜碱0.4-0.8m,bstdna聚合酶0.16-0.48u/μl,逆转录获得的cdna模板1μl,其中,内引物与外引物的浓度之比为1-16:1;
3)进行lamp扩增反应
lamp扩增反应反应程序为:57-62℃30-60min,80-85℃3-5min;
4)鉴定扩增结果
步骤3)lamp扩增反应结束后,向扩增产物中加入显色剂sybrgreeni染料,观察颜色变化:显色为绿色的样品为阳性,含有百合斑驳病毒;显色为橘色的样品为阴性,不含百合斑驳病毒;
或者取lamp扩增产物,在goldview染色的琼脂糖凝胶上进行电泳,在凝胶成像仪器的紫外光下显影观察,若出现特征性的梯状条带,则样品为阳性,含有百合斑驳病毒;无条带出现的样品为阴性,不含百合斑驳病毒。
进一步,所述lamp反应体系中,各成分的成分的终浓度为:内引物fip0.8-1.0μm,内引物bip0.8-1.0μm,外引物f30.5-0.8μm,外引物b30.5-0.8μm,mgcl21.3-1.7mm,dntps0.3-0.4mm,甜菜碱0.4-0.6m,bstdna聚合酶0.32-0.48u/μl,逆转录获得的cdna模板1μl。
将本发明所述的lamp引物用于百合斑驳病毒的rt-lamp检测中。
进一步,所述的rt-lamp检测反应体系中,以待测样品rna为模板,反应体系中各成分的终浓度为:内引物fip1.6-2.0μm,内引物bip1.6-2.0μm,外引物f30.5-0.8μm,外引物b30.5-0.8μm,10×buffer,mg2+1.3-1.7mm,dntp0.3-0.4mm,甜菜碱0.4-0.6m,bst酶0.27-0.55u/μl,dtt0.15-0.2mm,逆转录酶3-4u/μl,待测样品rna20ng-5μg,反应程序为:60-65℃30-60min,80-85℃3-5min。
本发明的lamp或rt-lamp反应体系中,10×buffer的添加遵循本领域中的常规添加原则,通常为反应总体积的十分之一。
本发明根据百合斑驳病毒(lmov)cp基因序列(genbank登录号为aj564637.1),在选择保守区域时避开所有的突变位点,使引物具有高特异性,设计筛选出2对引物,其为内引物fip、bip和外引物f3、b3。
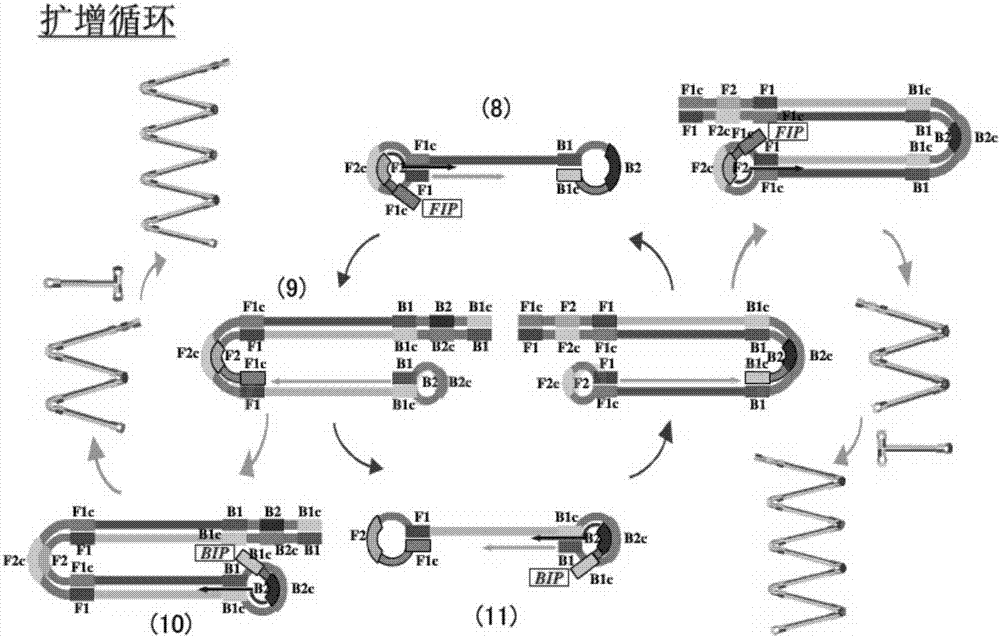
利用本发明的fip、bip、f3和b3引物,在恒温条件下,经过高活性链置酶bst酶的作用,dna不断循环扩增,主要可分2个阶段,启动阶段和循环扩增阶段,lamp扩增原理参见图1和图2。
在启动阶段,引物向双链dna的互补部位进行碱基配对延伸时,另一条链就会解离,释放单链。如图1所示,双链dna模板在等温(60-65℃)的条件下,内部引物fip退火,fip中的f2序列跟模板链上flc位点结合,在具有链置换活性的dna聚合酶作用下启动核酸的合成。外部引物f3与模板f3c区域结合并延伸,置换出完整的fip连接的互补单链,并置换释放一条单链dna;单链dna一端自动形成环的结构,可作为bip引物的模板,bip启动链的合成,随后b3引物退火,同模板链杂交,引导链置换反应产生一条双链dna和一条两端成环的单链dna,形成一个哑铃环的结构;此后,3’端自动引导dna的合成,快速形成一种茎环的结构,该结构作为lamp反应中循环反应的起始结构,进入lamp反应的循环扩增阶段。
第2阶段是扩增循环阶段,主要由内部引物fip和bip作用,如图2所示:以茎环状结构为模板,引物fip退火,与茎环的f2c区结合,开始链置换合成,解离出的单链核酸上也会形成环状结构,迅速以3’末端的b1区段为起点,以自身为模板,进行dna合成延伸及链置换,形成长短不一的2条新茎环状结构的dna,bip引物上的b2区域与其杂交,启动新一轮扩增,且产物dna长度增加一倍。扩增的最后产物是具有不同个数茎环结构、不同茎长度茎结构的dna和带有许多环的类似花椰菜结构dna的混合物,且产物dna为扩增靶序列的交替反向重复序列,因此lamp电泳条带为一系列不同大小的梯状条带。
本发明对lamp反应温度和反应体系进行了详尽、可靠的研究。由于反应中bstdna聚合酶的最佳反应温度为60℃左右,温度过高或过低都会对酶的活性产生较大影响,本发明对百合斑驳病毒的lamp反应温度在55℃-65℃之间进行了筛选优化,确定合适的退火温度范围为:57-62℃,在该温度范围内,lamp反应效率和产物产量较高。
lamp反应中,不同的引物比例的扩增效率不同,本发明对引物比例进行优化筛选,最终确定的内引物与外引物比例范围为1-16:1,在该引物比例范围内,可以使用凝胶电泳法检测出明显的阳性梯状条带。
本发明对lamp反应体系中各物质的终浓度进行了四因素三水平优化,最终确定各物质的终浓度范围为:dntps0.2-0.4mm,甜菜碱0.4-0.8m,bstdna聚合酶0.16-0.48u/μl,在该浓度范围内,能获得良好的反应效率和产物产量。
利用本发明的lamp引物组,可以直接采用样品中提取的总rna进行环介导逆转录等温实验rt-lamp,利用逆转录酶revertraace(toyobo)和bst酶,将lamp和逆转录实验相结合,极大地缩短了反应时间。以rna作为模板,减少了将rna逆转录成cdna的步骤,既减少了逆转录的中间过程和人为操作带来的误差,又克服了以往lamp易出现的假阳性结果。
与现有技术对比,本发明具有如下有益效果:
本发明的百合斑驳病毒lamp引物特异性强,与常见侵染百合的7种病毒,具体包括百合无症病毒样品、黄瓜花叶病毒样品、苹果茎沟病毒样品、南芥菜花叶病毒样品、蚕豆萎蔫病毒样品、百合x病毒样品和水仙花叶病毒样品,经过测试,不会产生交叉感染。
本发明的lamp检测方法特异性好,灵敏度高,在百合斑驳病毒的诊断中,可在模板纯度只有101拷贝数下进行扩增,具有反应条件简单、操作简便快速、结果判定方便、准确等优点。
将本发明的lamp引物组和反应体系制成lamp试剂盒,在试剂盒中设置阴性对照以证明反应体系未被百合斑驳病毒目的序列污染,设置阳性对照以对比测定结果的正确性,进行lmov的lamp可视化快速检测,操作简捷,向产物中直接加入荧光染料,依据颜色变化进行结果判定,实现反应结果的可视化、易判定、易于推广应用。
本发明可用于环介导逆转录等温扩增(rt-lamp),直接检验百合样品总rna,减少实验假阴性或假阳性实验结果发生,在保证实验结果准确性的同时,更加经济节约,高效,非常易于临床推广。
附图说明
图1为本发明中lamp扩增中第1扩增阶段示意图。
图2为本发明中lamp扩增中第2扩增阶段示意图。
图3为本发明实施例2中lamp扩增结果可视化结果示意图。
图4为本发明实施例2中lamp扩增结果电泳检测示意图。
图5为对比例的lamp扩增示意图。
图6为本发明实施例4中lamp灵敏度电泳结果示意图。
图7为本发明实施例4中pcr灵敏度电泳结果示意图。
图8为本发明实施例4中lamp灵敏度可视化结果示意图。
图9为本发明实施例5中lamp特异性电泳示意图。
图10为本发明实施例5中lamp特异性可视化结果示意图。
图11为本发明实施例6中rt-lamp电泳结果示意图。
具体实施方式
以下结合具体实施例对本发明作进一步说明。
实施例1一种用于检测百合斑驳病毒的lamp引物组的获得
根据genbank中查找到lmov的coatproteingene(cp)序列(genbank登录号为aj564637.1)进行引物设计,设计原理如下:
由于lamp主要依靠链置换而成,所以靶序列长度应小于300bp,若是大于500bp将很难扩增,本发明根据靶基因的6个不同区域(3’端的f3c、f2c和flc区以及5’端的bl、b2和b3区),设计了4条特异性引物fip、bip、f3和b3。
fip引物为上游内部引物(forwardinnerprimer),由tttt序列链接f2区和f1c区域组成,f2区与靶基因3’端的f2c区域互补,f1c区与靶基因5’端的flc区域序列相同。bip引物为下游内部引物(backwardinnerprimer),由tttt序列连接b1c和b2区域组成,b2区与靶基因3’端的b2c区域互补,b1c域与靶基因5’端的blc区域序列相同。
f3引物为上游外部引物(forwardouterprimer),由f3区组成,并与靶基因的f3c区域互补。b3引物为下游外部引物(backwardouterprimer),由b3区域组成,和靶基因的b3c区域互补。
具体序列如下:
f3:5’-aatggcgtgtggctcatg-3’;
b3:5’-ggtgagatttcgctgaaggc-3’;
fip:5’-cgtcggttttgcgtgttcaagttttttggacggagatcagcaagtt-3’;
bip:5’-gcgcatttctcaaacctcgctgttttcgtacctaggcatgtacggt-3’。
实施例2一种百合斑驳病毒的lamp检测方法
1)使用总rna提取试剂盒(上海博满生物科技有限公司),并参照试剂盒说明书,提取感染百合斑驳病毒的百合植株样品总rna。
2)将提取的50ng-5μg总rna使用全式基因逆转录试剂盒,进行逆转录,获得cdna;
3)配制lamp反应体系
设置阴性对照(ddh2o)体系和阳性对照(包含百合斑驳病毒目的序列的质粒)体系,设置阴性对照以证明反应体系未被百合斑驳病毒目的序列污染,设置阳性对照以对比测定结果的正确性。
为防止实验出现假阳性结果,配制lamp反应体系和两个对照体系时,进行分区操作。
配制反应体系时,不添加模板,先将ddh2o、dntps、10×buffer、fip、bip、f3、b3和甜菜碱配制好,分成三组,分别加入阴性对照(ddh2o)、待测样品cdna模板和阳性对照(包含百合斑驳病毒目的序列的质粒),加入阴性对照的成为阴性对照体系,加入待测样品的成为反应体系,加入阳性对照的成为阳性对照体系,将各体系的混合物涡旋混匀、瞬离,在95℃水浴锅中加热5min,再冰浴5min后,再加入bst酶,其中,bst酶需与dna模板和阳性对照质粒隔离放置。
25μl的lamp反应体系中,包括:ddh2o5.9μl,浓度2.5mm的1×dntps3.0μl,10×buffer(含mg2+)2.5μl,浓度10μm的fip4.0μl,浓度10μm的引物bip4.0μl,浓度10μm的引物f30.5μl,浓度10μm的引物b30.5μl,浓度5m甜菜碱2.1μl,逆转录所得cdna1μl,8u/μl的bst酶1.5μl。
4)进行lamp扩增反应
配制好反应体系后进行lamp扩增反应,反应程序为:58.5℃59min,
80℃3min;
5)鉴定扩增结果
步骤3)lamp扩增反应结束后,向扩增产物中加入2μlsybrgreeni染料,观察颜色变化:显色绿色的样品为阳性,含有百合斑驳病毒;显色橘色的样品为阴性,不含百合斑驳病毒,结果参见图3。
或者取5μllamp扩增产物在goldview染色的2%的琼脂糖凝胶上进行电泳后在凝胶成像仪器的紫外光下显影观察。出现特征性梯状条带的样品为阳性,含有百合斑驳病毒;无条带出现的样品为阴性,不含百合斑驳病毒,结果参见图4。
由图3-4可以看出,电泳结果和显色结果表明百合斑驳病毒(lmov)和阳性对照质粒(p)均显示为阳性结果,阴性对照(n)均表现为阴性结果,且百合斑驳病毒的lamp可视化快速检测与电泳结果一致。
对比例
除lamp反应体系与本实施例不同外,其余操作及反应条件与实施例2相同。
其中,所用的lamp反应体系为:ddh2o9.5μl,浓度2.5mm的1×dntps3.0μl,10×buffer(含mg2+)2.5μl,浓度10μm的fip0.5μl,浓度10μm的引物bip0.5μl,浓度10μm的引物f32.0μl,浓度10μm的引物b32.0μl,浓度5m甜菜碱3μl,8u/μl的bst酶1μl,逆转录所得cdna1μl。
所扩增的产物经过琼脂糖凝胶电泳检测,结果参见图5,其中,泳道lmov为使用本对比例反应体系来检测百合斑驳病毒。
结果表明,利用对比例的反应体系,扩增产物经过琼脂糖凝胶电泳,梯状条带在紫外光下几乎不能识别,反应效率很低。
实施例3百合斑驳病毒的lamp检测试剂盒组装
1、包装规格:200次
2、试剂盒组成表1:
表1
*:内含buffer、dntpmix和甜菜碱。
3、运输及保存方法:
低温运输,避光保存。短期使用放至4℃避光保存,长期保存请置于-20℃或-80℃冰箱避光保存。
4、使用注意事项:
(1)全部的物品,凡是接触过病毒材料的,为不将实验室污染和对检测人员造成影响都需要被合理处理。
(2)把整个实验分区域进行操作,严禁器材和试剂倒流,以免污染。
(3)显色剂低毒,应于室温条件避光保存,操作时应戴上手套。
(4)注意不要让试剂盒中的各个成分受到污染,可进行分装使用。
(5)操作过程中移液取样、定时等全部过程必须精确。严格遵守操作说明可以获得最好的结果。
实施例4灵敏度验证
本实施例将经测序验证过lmov的质粒按照靠拷贝数进行稀释实验,分别按照lmov质粒107拷贝、106拷贝、105拷贝、104拷贝、103拷贝、102拷贝、101拷贝分别进行lamp和pcr检测。
lamp反应体系:ddh2o6.5μl,浓度2.5mm的1×dntps4.0μl,10×buffer(含mg2+)2.5μl,浓度10μm的fip2.0μl,浓度10μm的引物bip2.0μl,浓度10μm的引物f32.0μl,浓度10μm的引物b32.0μl,浓度5m甜菜碱2μl,逆转录所得cdna1μl,8u/μl的bst酶1.0μl。
pcr反应体系:ddh2o17μl,浓度2.5mm的1×dntps2.0μl,10×buffer(含mg2+)2.5μl,浓度10μm的引物f31.0μl,浓度10μm的引物b31.0μl,浓度逆转录所得cdna1μl,5u/μl的taqdna聚合酶0.5μl。
pcr反应程序为:95℃预变性10min,进入pcr反应循环:95℃变性60s,51℃退火40s,72℃延伸35s,共进行35个循环,72℃总延伸7min。
lamp反应程序和结果显示方法参见实施例2,pcr结果采用琼脂糖凝胶电泳法进行检测,目的片段长为188bp,检测结果如图6-8所示,其中,107为lmov质粒107拷贝,106为lmov质粒106拷贝,105为lmov质粒105拷贝,104为lmov质粒104拷贝,103为lmov质粒103拷贝,102为lmov质粒102拷贝,101为lmov质粒101拷贝,n为阴性对照。
图6-7结果表明,本发明的lamp可以检验出101而pcr只能检验出103拷贝,说明本发明lamp检测法能够检测出的最低浓度比pcr检测低2个数量级,这证明本发明中lamp方法具有极高的灵敏度。
由于使用lamp技术检测百合斑驳病毒的灵敏度较高,采用良好的防污染措施可避免假阳性结果。
同时,由图8可以看出,百合斑驳病毒的lamp可视化快速检测与电泳结果一致,且呈一定的梯度变化。
实施例5特异性验证
百合在田间栽培过程中,常因病毒侵染,导致百合叶片过早脱落花芽和花早衰,寿命缩短等现象,严重影响其产量和品质,在侵染百合的病毒中,除百合斑驳病毒外,还有黄瓜花叶病毒(cucumbermosaicvirus,cmv)、百合无症病毒(lilysymptomlessvirus,lsv)等。据沈淑琳统计,侵染百合的病毒种类有14种,王继华统计有16种。
本实施例为验证lamp引物的特异性,除百合斑驳病毒外,选取常见侵染百合的7种病毒进行测试,具体包括百合无症病毒样品、黄瓜花叶病毒样品、苹果茎沟病毒样品、南芥菜花叶病毒样品、蚕豆萎蔫病毒样品、百合x病毒样品和水仙花叶病毒样品。
本实施例采用含lamp引物的试剂盒进行,反应体系为:ddh2o6.2μl,浓度2.5mm的1×dntps3.0μl,10×buffer(含mg2+)2.5μl,浓度10μm的fip3.8μl,浓度10μm的引物bip3.8μl,浓度10μm的引物f30.25μl,浓度10μm的引物b30.25μl,浓度5m甜菜碱3μl,逆转录所得cdna模板1μl,8u/μl的bst酶1.2μl。
结果判定方法参见实施例2,电泳结果图9,显色结果图10,其中,lmov为百合斑驳病毒cdna,p为lmov质粒,n为阴性对照,lsv为百合无症病毒样品,cmv为黄瓜花叶病毒样品,asgv为苹果茎沟病毒样品,armv为南芥菜花叶病毒样品,bbwv为蚕豆萎蔫病毒样品,lvx为百合x病毒样品,nmv为水仙花叶病毒样品。
电泳结果图9和显色结果图10表明,百合斑驳病毒(lmov)和阳性对照质粒(p)均显示为阳性结果,阴性对照(n)和其他感染百合的病毒样品均表现为阴性结果,且,百合斑驳病毒的lamp可视化快速检测与电泳结果一致。
因此,本发明百合斑驳病毒的lamp可视化快速检测试剂盒的特异性好,不会与其他病毒产生交叉感染,同时说明,加入荧光染料后,可视化结果与电泳结果一致。
实施例6利用lmov的lamp检测试剂盒进行rt-lamp检测
百合斑驳病毒lmov为rna病毒,在现有技术中进行常规pcr检测时,需要先提取总rna,再进行逆转录成cdna进行实验。
本发明直接采用样品中提取的总rna,进行环介导逆转录等温实验rt-lamp,将lamp和逆转录实验相结合,具体步骤如下:
全部反应体系共29.5μl,包括:ddh2o0μl,浓度2.5mm的1×dntps4.0μl,10×buffer(含mg2+)2.5μl,浓度10μm的fip4.0μl,浓度10μm的引物bip4.0μl,浓度10μm的引物f32.0μl,浓度10μm的引物b32.0μl,浓度5m甜菜碱2μl,8u/μl的bst酶2.0μl,5mmdtt1μl,待测样品rna50ng,100u/μl的revertraace(toyobo)1μl。
将所有反应体系于冰上加入pcr管后,涡旋,混匀,然后立即放入pcr仪。
rt-lamp反应程序:65℃59min,80℃3min。
产物用2%的琼脂糖凝胶进行检测,观察是否出现梯状条带,若出现梯状条带,则证明rt-lamp实验成功,结果参见图11,其中,rna表示百合斑驳病毒rna经过rt-lamp所得产物,n为阴性对照。
由图11可见,百合斑驳病毒lmovrna经过rt-lamp反应后显示为阳性,说明本发明rt-lamp方法检测百合斑驳病毒具有良好的特异性。
由于百合斑驳病毒本身属于易降解的rna病毒,易受到空气或者是实验器具上rna酶的作用,所以在提取和逆转录过程中要时时刻刻小心rna酶的污染,给实验增加了很多繁琐的步骤,如使用的移液器等器具需用depc-h2o处理,枪头要多次灭菌等等,即使再小心,也易出现假阴性结果。
而本发明则可极大的减轻这些繁琐的步骤,直接采用样品中提取的总rna进行环介导逆转录等温实验rt-lamp,将lamp和逆转录实验相结合,利用逆转录酶revertraace(toyobo)和bst酶极大地缩短了反应时间。以rna作为模板,既减少了逆转录的中间过程和人为操作带来的误差,又克服了以往lamp易出现的假阳性结果。
- 还没有人留言评论。精彩留言会获得点赞!
- 李坏死环斑病毒LAMP引物、试剂盒及检测方法与流程
- 一种检测脑炎病毒的引物组合及应用、试剂盒的制作方法与工艺
- 一种犬博卡病毒的通用型PCR检测引物、试剂盒和检测方法与流程
- 检测辣椒叶脉黄化病毒的引物组合物、试剂盒及其应用的制作方法与工艺
- 多重PCR检测七种腹泻病毒用引物组和试剂盒及其检测方法与流程
- 一种检测鲑鱼甲病毒的引物对、SYBR GreenⅠ荧光定量PCR试剂盒及其应用的制作方法与工艺
- 一种用于检测犬圆环病毒的引物和高效CL‑RCA‑PCR检测试剂盒及方法与流程
- 黄瓜花叶病毒LAMP引物、试剂盒及检测方法与流程
- 香蕉束顶病毒LAMP引物、试剂盒及检测方法与流程
- 一种锦鲤疱疹病毒CPA检测引物及应用的制作方法与工艺
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用