miR-139-3p及其拮抗剂在诊断和治疗骨骼系统疾病中的应用的制作方法
本发明涉及分子生物医学领域,具体涉及mir-139-3p及其拮抗剂在诊断和治疗骨骼系统疾病中的应用。
背景技术:
骨质疏松是一种因骨量降低,骨组织微结构破坏,骨脆性增加,易发生骨折为特征的全身性骨病。随着世界人口老龄化趋势日益严重,骨质疏松的发病率越来越高。据第六次人口普查显示,我国65岁以上的老年人已占总人口的7.5%,预计到2020年我国骨质疏松患者将超过2.5亿,占全世界骨质疏松患者的一半以上。世界卫生组织已将骨质疏松症与糖尿病、心血管病共同列为危害老年人健康的三大杀手。
成骨细胞是骨形成的基本功能单位,在骨不断的自我更新过程中是重要的功能细胞。成骨细胞主导的骨形成与破骨细胞主导的骨吸收两者间保持的动态平衡是骨量维持正常的基础。成骨细胞来源于造血干细胞分化而成的骨髓间充质干细胞,成熟的成骨细胞进入分泌骨质阶段时就不再进行细胞分裂,增殖达到一定数量的成骨细胞即进入分化阶段,经过分化成熟才能进行矿化作用。
microrna是一类长度约22个核苷酸的单链rna,可通过结合mrna的3’utr区从而阻止mrna的翻译过程或直接降解mrna,进而调控细胞功能。microrna在成骨细胞的起源、分化、成熟以及行使功能的过程中均起到重要的调控作用。目前对mir-139-3p的功能报道较少,只发现有些肿瘤中表达水平出现异常,但目前尚未见关于mir-139-3p调控成骨细胞分化的任何报道。
技术实现要素:
针对现有技术中存在的问题,本发明的目的在于提供一种mir-139-3p及其拮抗剂在诊断和治疗骨骼系统疾病中的应用,mir-139-3p可作为诊断骨质疏松等骨骼系统疾病的标志基因,mir-139-3p的拮抗剂可作为治疗骨质疏松等骨骼系统疾病药物作用的靶点。
为了达到上述目的,本发明采用以下技术方案予以实现。
(一)mir-139-3p在制备诊断诊断骨骼系统疾病的药物的应用。
优选的,所述骨骼系统疾病为骨质疏松、炎症性骨质丢失、关节退行性变或股骨头坏死疾病。
优选的,所述mir-139-3p的特异性引物序列为5’-gcggccctgttggagaaaaa-3’。
(二)mir-139-3p在制备诊断骨质疏松症的药物中的应用。
优选的,所述mir-139-3p的特异性引物序列为5’-gcggccctgttggagaaaaa-3’。
(三)mir-139-3p的特异性引物在制备检测骨组织中mir-139-3p表达水平的检测试剂盒中的应用。
优选的,所述mir-139-3p的特异性引物序列为5’-gcggccctgttggagaaaaa-3’。
(四)mir-139-3p的拮抗剂在制备治疗骨骼系统疾病的药物中的应用。
优选的,所述mir-139-3p的拮抗剂的序列为5’-cuccaacagggccgcgucucca-3’。
优选的,所述骨骼系统疾病为骨质疏松、炎症性骨质丢失、关节退行性变或股骨头坏死疾病。
(五)mir-139-3p的拮抗剂在制备治疗骨质疏松症的药物中的应用。
优选的,所述mir-139-3p的拮抗剂的序列为5’-cuccaacagggccgcgucucca-3’。
上述(一)、(二)、(四)、(五)中所述药物的应用中,药物包括药学上可接受的一种或多种载体,所述载体包含稀释剂、粘合剂、吸附载体、填充剂和崩解剂。
进一步优选的,所述药物还包括添加剂,所述添加剂包含稳定剂、杀菌剂、缓冲剂、等渗剂、螯合剂、ph控制剂和表面活性剂。
与现有技术相比,本发明的有益效果为:
本发明的mir-139-3p及其拮抗剂在诊断和治疗骨骼系统疾病中的应用,mir-139-3p可作为诊断各种因素引起的骨质疏松等骨骼系统疾病的标志基因,mir-139-3p可用于制备诊断骨质疏松等骨骼系统疾病的药物。mir-139-3p的特异性引物可制成检测试剂盒,用于检测骨组织中mir-139-3p表达水平。mir-139-3p的拮抗剂可作为治疗各种因素引起的骨质疏松等骨骼系统疾病药物作用的靶点,mir-139-3p的拮抗剂可用于制备治疗骨质疏松等骨骼系统疾病的药物。
附图说明
下面结合附图和具体实施例对本发明做进一步详细说明。
图1是本发明的qpcr技术检测mir-139-3p在hu后肢去负荷骨质疏松小鼠模型骨组织中表达的结果图;
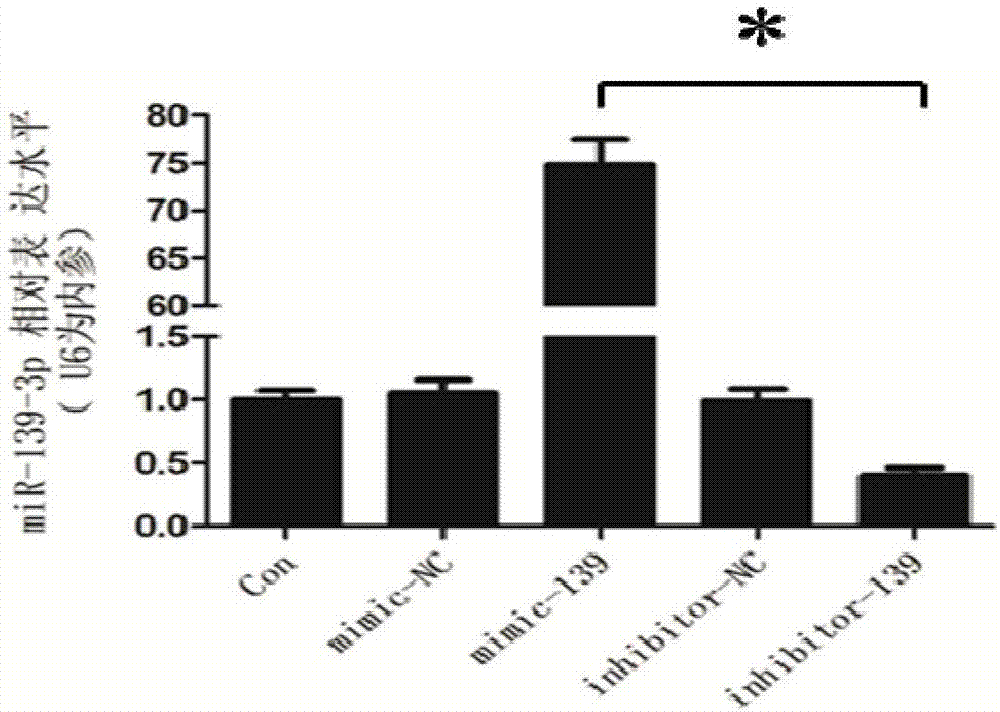
图2是本发明的mimic-139-3p、inhibitor-139-3p在小鼠前成骨细胞mc3t3-e1中的表达结果图;
图3是本发明的mimic-139-3p、inhibitor-139-3p对mc3t3-e1成骨分化标志基因的调控作用图;其中,a图为mimic-139-3p、inhibitor-139-3p对mc3t3-e1成骨分化标志基因alp的调控作用图;b图为mimic-139-3p、inhibitor-139-3p对mc3t3-e1成骨分化标志基因runx2的调控作用图;
图4是茜素红染色技术检测转染mimic-139-3p、inhibitor-139-3p对小鼠前成骨细胞mc3t3-e1矿化结节形成的调控结果图;其中,a图为茜素红染色矿化结节图;b图为茜素红染色技术检测结果的吸光度图;
图5是本发明利用生物信息学预测mir-139-3p的靶分子结果图;
图6是本发明的westernblot技术检测转染mir-139-3p的模拟物mimic-139-3p和拮抗剂inhibitor-139-3p对前成骨细胞中elk1表达结果图;其中,a图为化学发光检测成像图;b图为mir-139-3p的模拟物mimic-139-3p和拮抗剂inhibitor-139-3p在前成骨细胞elk1中的表达图。
以上图中:数值以“均值±标准差”表示,两组间的显著性采用students't检验,*p<0.05。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域的技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。
实施例1
mir-139-3p在制备诊断骨质疏松症药物中的应用,包括以下步骤:
步骤1,设计并制备mir-139-3p特异性引物序列,mir-139-3p特异性引物序列为5’-gcggccctgttggagaaaaa-3’。
步骤2,构建hu后肢去负荷骨质疏松小鼠模型:
将6月龄雄性c57bl/6j小鼠用小鼠固定器固定,露出尾部并均匀涂抹安息香酊止痒并涂抹松香,将尾部缠上胶布并连接一小环,注意不要缠得过紧,露出尾尖以观察血运。之后将小鼠放进尾吊笼,尾部通过小环挂在横杆上,调整横杆高度使小鼠后肢完全离地,并使其前肢着地,使小鼠能够活动并进食水。每天观察小鼠情况,确保其后肢完全离地,尾吊21d后处死小鼠,收集小鼠股骨样本。
步骤3,提取小鼠股骨样本rna,包含以下步骤:
子步骤3.1,取小鼠股骨样本,将肌肉剥离干净,得骨组织;将所得骨组织置于研钵中,向其中边加液氮边迅速研磨,直至将骨组织完全磨为粉末,得骨组织粉末,备用。
子步骤3.2,rna提取
1)将骨组织粉末和rnaiso加入匀浆器中,骨组织粉末和rnaiso的比例为(50-100)mg:1ml,匀浆,将匀浆后所得的上清液移入1.5ml无rna酶的ep管中。
2)在rnaiso中加入20%体积的三氯甲烷,充分震荡混匀约30s;冰上静置5min后,在4℃下离心15min,转速为12000rpm,使用无rna酶枪头将ep管中离心后的上清液移入另一无酶ep管中,冰上静置。
3)向另一无酶ep管的上清液中加入等体积的异丙醇,充分震荡混匀,在4℃下离心15min,转速为12000rpm,弃去上清液,保留沉淀物。
4)向无酶ep管的沉淀物中加入足量预冷的70%depc水配制的酒精,震荡混匀,洗涤沉淀,在4℃离心10min,转速为7500rpm,弃去上清液,倒扣无酶ep管使无酶ep管内酒精充分挥发,根据所提rna量加入15-30μl的depc水,接着进行充分地吹打与静置,使rna充分溶解。
5)使用紫外分光光度计分别检测rna在260nm与280nm处的吸光度值od260和od280,od260/od280的比值在1.8-2.0之间,则说明rna的纯度较好可用于后续试验。
步骤4,利用qpcr技术检测mir-139-3p在后肢去负荷骨质疏松小鼠模型骨组织样本中的表达水平:
1)cdna合成:使用takara反转录试剂盒,先将提取的rna反转录为cdna,反转录条件为:37℃1h;85℃5min。
2)qpcr检测:取cdna为模板,以u6为内参,采用qpcr检测mir-139-3p分子在后肢去负荷骨质疏松小鼠模型骨组织样本中的表达水平,qpcr反应条件为:95℃30s,变性;95℃5s;60℃30s,40个循环,其中,mir-139-3p特异性引物序列为5’-gcggccctgttggagaaaaa-3’。
qpcr检测mir-139-3p分子在后肢去负荷骨质疏松小鼠模型骨组织样本中的表达水平结果如图1所示,结果表明mir-139-3p在后肢去负荷骨质疏松小鼠模型骨组织样本中高度表达,说明mir-139-3p在骨组织中的表达量与骨质疏松相关,mir-139-3p可用于制备诊断骨质疏松症等骨骼系统疾病的药物。
实施例2
mir-139-3p分子的模拟物和拮抗剂在调控成骨细胞分化中的应用,包括以下步骤:
(1)设计并制备mir-139-3p的模拟物和拮抗剂
从mirbase获得mir-139-3p的核苷酸序列,设计、制备并进行化学修饰,获得mir-139-3p分子的模拟物和拮抗剂,即mimic-139-3p和inhibitor-139-3p;将2od260的mimic-139-3p及其阴性对照(mimic-nc)、inhibitor-139-3p及其阴性对照(inhibitor-nc)分别用250μldepc水稀释,使其终浓度为20μmol/l,分装后于-80℃冻存。mimic-139-3p、mimic-nc、inhibitor-139-3p和inhibitor-nc的序列表如表1所示。
表1microrna序列
(2)转染
将前成骨细胞分为五组,分别为:
1)空白对照组(con):正常培养;
2)mimic-139组:骨质疏松的前成骨细胞转染mimic-139-3p;
3)mimic-nc组:骨质疏松的前成骨细胞转染mimic-nc;
4)inhibitor-139组:骨质疏松的前成骨细胞转染inhibitor-139-3p;
5)inhibitor-nc组:骨质疏松的前成骨细胞转染inhibitor-nc。
每孔的配置,取前成骨细胞mc3t3-e1,以1×106/孔的细胞数接种于6孔板中,2ml含10%胎牛血清、1%双抗,dmem细胞培养基;24小时内细胞汇合约达到60-70%;在250μl的dmem无血清培养基加入20μmol/lmimic5μl或inhibitor10μl柔和混匀;用250μl无血清的dmem稀释5μllipofectamin2000试剂,轻轻混匀,室温放置5分钟;将稀释好的microrna和lipofectamin2000试剂混合,轻柔混匀,室温放置20分钟,以便形成microrna/lipofectamin复合物;将500μl复合物加到含有细胞的培养板孔内,补加1.5ml的dmem无血清培养基,来回轻柔摇晃细胞培养板。将细胞在37℃的co2培养箱中孵育6小时后,更换培养基,继续孵育;待48h后,进行转染后的其它检测步骤。
(3)提取转染后小鼠mc3t3-e1细胞的rna
在含有转染细胞的培养板每孔中加入rnaiso,待细胞充分裂解后,转移到新的1.5mlep管,其余提取步骤同实施例1中的mir-139-3p在制备诊断和治疗骨质疏松药物中的应用中rna的提取。
(4)qpcr检测mir-139-3p表达水平,具体检测步骤参考实施例1中mir-139-3p在制备诊断和治疗骨质疏松药物中的应用中qpcr技术检测方法。
试验结果如图2所示,结果表明mir-139-3p的模拟物mimic-139-3p和拮抗剂inhibitor-139-3p可有效改变mir-139-3p在小鼠前成骨细胞mc3t3-e1中的表达。
实施例3
采用上述mir-139-3p的模拟物mimic-139-3p和拮抗剂inhibitor-139-3p对前成骨细胞中成骨分化标志基因runx2和alp的表达水平进行试验分析,具体如下:
前成骨细胞的分组、转染及rna提取同实施例2,接着取各组的cdna为模板,以gapdh作为内参,采用qpcr检测成骨分化标志基因runx2和alp的表达。所用gapdh、runx2和alp引物序列如表2所示:
表2内参引物及成骨标志基因序列
试验结果如图3所示,结果表明,mimic-139-3p和inhibitor-139-3p可有效调控成骨分化标志基因runx2和alp的表达,且mimic-139-3p抑制成骨分化标志基因runx2和alp的表达,inhibitor-139-3p促进成骨分化标志基因runx2和alp的表达,说明mir-139-3p可抑制成骨细胞分化,inhibitor-139-3p可促进成骨细胞分化,表明inhibitor-139-3p可作为治疗骨质疏松症疾病的药物靶点。
实施例4
采用mir-139-3p的模拟物mimic-139-3p和拮抗剂inhibitor-139-3p对前成骨细胞的矿化功能进行试验分析,具体如下:
茜素红染色及其半定量检测:
前成骨细胞的分组同实施例2,将细胞接种于12孔板,细胞汇合约达到60-70%时进行相应转染处理。转染完成后更换为成骨诱导液对细胞继续培养,每两天换液一次。在培养第7天时对各组细胞再次进行转染处理,之后继续诱导培养。在第一次转染后第21天进行茜素红染色,首先移弃原有培养基,用dpbs对细胞轻轻漂洗3遍。每孔加入足量预冷的70%酒精固定15min,而后双蒸水轻柔漂洗3次。之后每孔加入300μl配好的茜素红染液(40mm),室温孵育15min,双蒸水轻柔地漂洗3次。加入足量的dpbs进行孵育,室温下静置15min,而后将液体吸干即可观察红色结节,红色结节的结果如图4a所示。观察并拍摄完成后,在每孔中加入150μlcpc脱色液,其浓度为10%,摇床上晃动15min。将所得脱色液吸入96孔板中,使用酶标仪检测其562nm处的吸光度,吸光度如图4b所示。
由图4可知,mimic-139-3p和inhibitor-139-3p可有效干预前成骨细胞矿化功能,表明inhibitor-139-3p可作为治疗骨质疏松等骨骼系统疾病药物作用靶点。
实施例5
利用生物信息学,通过mirbase和miranda数据库分析,预测得到mir-139-3p的靶分子,结果如图5所示,由图5可知,转录激活因子ets样蛋白1(elk1)是mir-139-3p的靶分子之一。
利用westernblot技术检测转染mir-139-3p的模拟物mimic-139-3p和拮抗剂inhibitor-139-3p,分析其对前成骨细胞中elk1表达的影响,具体如下:
取前成骨细胞mc3t3-e1,以1×106/孔的细胞数接种于6孔板中,转染48h后(前成骨细胞的分组、转染同实施例2),采用细胞裂解液裂解细胞、提取蛋白质。采用bca法检测蛋白浓度,之后加上样缓冲液,将各样本的蛋白浓度调为相等,并加入loadingbuffer煮沸10min;将完成蛋白变性的样本,以30μg蛋白量上样至预制胶上,恒压90v电泳30min,而后120v电泳90min;将蛋白转移至nc膜上,恒流250ma,2h;5%脱脂奶粉封闭4h;加入elk1相应一抗,4℃孵育过夜;tbst洗膜6次,5min/次;加入二抗,室温孵育2h;tbst洗膜6次,5min/次;然后滴加适当ecl发光液进行化学发光检测及成像分析,结果如图6a所示,并使用imagej对蛋白表达进行半定量统计分析,结果如图6b所示。
由图6可知,mir-139-3p通过靶向elk1调节成骨细胞分化,且mimic-139-3p抑制elk1表达,inhibitor-139-3p促进elk1表达。
上述试验都是按照重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用spss统计软件来进行统计分析的,两组之间的差异采用t检验,认为当*p<0.05时具有统计学意义。
上述实施例中,mir-139-3p的特异性引物可用于制备检测试剂盒,通过试剂盒检测检测骨组织中mir-139-3p表达水平,进而对骨质疏松症等骨骼系统疾病进行诊断。骨骼系统疾病为骨质疏松、炎症性骨质丢失、关节退行性变或股骨头坏死等;药物包括药学上可接受的一种或多种载体,包括但不限于稀释剂、粘合剂、吸附载体、填充剂、崩解剂等;药物还包括添加剂,添加剂包含稳定剂、杀菌剂、缓冲剂、等渗剂、螯合剂、ph控制剂及表面活性剂。
虽然,本说明书中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!