一种分子印迹微球及其制备方法以及一种过氧化氢酶抑制剂与流程
本发明属于高分子生物材料技术领域,具体涉及一种分子印迹微球及其制备方法以及一种过氧化氢酶抑制剂。
背景技术:
近年来,活性氧物种(ROS)在癌症治疗中引起了广泛的关注,因为癌细胞内的ROS浓度很高时,能够诱导癌细胞的衰老和凋亡(P.Huang et al.,Nature Reviews Drug Discovery 2009,8,579.)。细胞内的ROS包括羟基自由基、超氧离子、过氧化氢、单线态氧等等,然而在正常情况下,癌细胞内产生的ROS会被细胞自身的还原系统迅速分解。过氧化氢酶(CAT)就是细胞还原系统中的重要活性成分之一,它能催化过氧化氢分解成水和氧气,从而降低细胞内的ROS水平,有助于癌细胞的生长和增殖。因此,研究人员花费大量精力致力于开发CAT的抑制剂,以抑制或降低其生物活性,从而使癌细胞内可以维持较高的ROS水平,直至癌细胞死亡。到目前为止,已报道的CAT的抑制剂基本都是小分子化合物,如抗坏血酸,3-氨基-1,2,4-三唑等(C.Saha et al.,Plos One 2014,9,102460.)。然而这些小分子药物在体内的循环周期较短、细胞摄入率低,使其在临床应用中受到很大程度上限制(A.Ghorpade et al.,Cell Death and Disease 2013,4,903.)。
另一方面,纳米粒子介导调控细胞内ROS水平也被广泛用于癌症治疗研究。这主要是由于纳米粒子具有较长的体内循环周期,并且还可以通过实体瘤的高通透性和滞留效应(EPR)快速穿透细胞膜进入细胞。例如,Nicholas A.Kotov等发现,ZnO微球进入癌细胞后,可以抑制β-半乳糖苷酶的活性,大幅度提高癌细胞内活性氧的浓度,最终导致癌细胞凋亡(N.A.Kotov et al.,ACS Nano 2015,9,9097.)。但纳米粒子介导调控ROS水平的专一性较差,不能在细胞内特定地吸附目标蛋白质,容易引起其他蛋白的失活(P.Baudhuin et al.,Journal of Histochemistry&Cytochemistry 1987,35,1197.)。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种分子印迹微球及其制备方法以及一种过氧化氢酶抑制剂,本发明提供的分子印迹微球不仅对CAT表现出高的选择性吸附能力,同时还具有抑制CAT生物活性的性能。
本发明提供了一种分子印迹微球的制备方法,包括以下步骤:
A)将环己烷、异丙醇、水、乳化剂、催化剂和前驱体混合得到的乳液体系依次进行加热反应、离心、洗涤、干燥和煅烧,得到单分散纤维状二氧化硅微球;
B)将所述单分散纤维状二氧化硅微球、3-氨丙基三乙氧基硅烷和甲苯混合进行加热反应,得到氨基功能化的二氧化硅微球;
C)将所述氨基功能化的二氧化硅微球、弱碱性的缓冲溶液、过氧化氢酶和多巴胺混合,进行聚合反应后离心洗涤,得到分子印迹微球。
优选的,所述乳化剂为十六烷基三甲基溴化铵,所述前驱体为正硅酸四乙酯,所述催化剂为尿素。
优选的,所述乳化剂、催化剂、水、前驱体、异丙醇和环己烷的摩尔比为0.28:1:167:(28~40):1.31:(0.67~1.78)。
优选的,步骤A)中,所述加热反应的温度为65~80℃,所述加热反应的时间为12~16小时。
优选的,所述煅烧的温度为350~600℃,所述煅烧的时间为2~8小时。
优选的,所述单分散纤维状二氧化硅微球与3-氨丙基三乙氧基硅烷的质量比为(0.5~6):1。
优选的,步骤B)中,所述加热反应的温度为80~115℃,所述加热反应的时间为12~24h。
优选的,所述氨基功能化的二氧化硅微球与多巴胺的质量比为(0.15~1.5):1。
本发明还提供了一种上述制备方法制备得到的分子印迹微球。
本发明还提供了一种过氧化氢酶抑制剂,所述过氧化氢酶抑制剂包括上述制备方法制备得到的分子印迹微球或上述分子印迹微球。
与现有技术相比,本发明提供了一种分子印迹微球的制备方法,包括以下步骤:A)将环己烷、异丙醇、水、乳化剂、催化剂和前驱体混合得到的乳液体系依次进行加热反应、离心、洗涤、干燥和煅烧,得到单分散纤维状二氧化硅微球;B)将所述单分散纤维状二氧化硅微球、3-氨丙基三乙氧基硅烷和甲苯混合进行加热反应,得到氨基功能化的二氧化硅微球;C)将所述氨基功能化的二氧化硅微球、弱碱性的缓冲溶液、过氧化氢酶和多巴胺混合,进行聚合反应后离心洗涤,得到分子印迹微球。本发明提供的制备方法先合成出粒径为100~200nm的纤维状二氧化硅纳米微球,经过氨基化改性后,在微球表面原位聚合包覆一层对过氧化氢酶具有特异性识别和吸附能力的聚多巴胺分子印迹层。该方法所制备的分子印迹微球可以从水溶液中特异性地捕捉过氧化氢酶,并使其失去活性。本发明合成的过氧化氢酶分子印迹微球可作为过氧化氢酶抑制剂使用,并克服了传统小分子过氧化氢酶抑制剂的低效和复杂的合成步骤等缺陷,有望应用于在癌症治疗中。
附图说明
图1为实施例1制备的具有纤维状结构的二氧化硅微球(F-SiO2)的TEM照片;
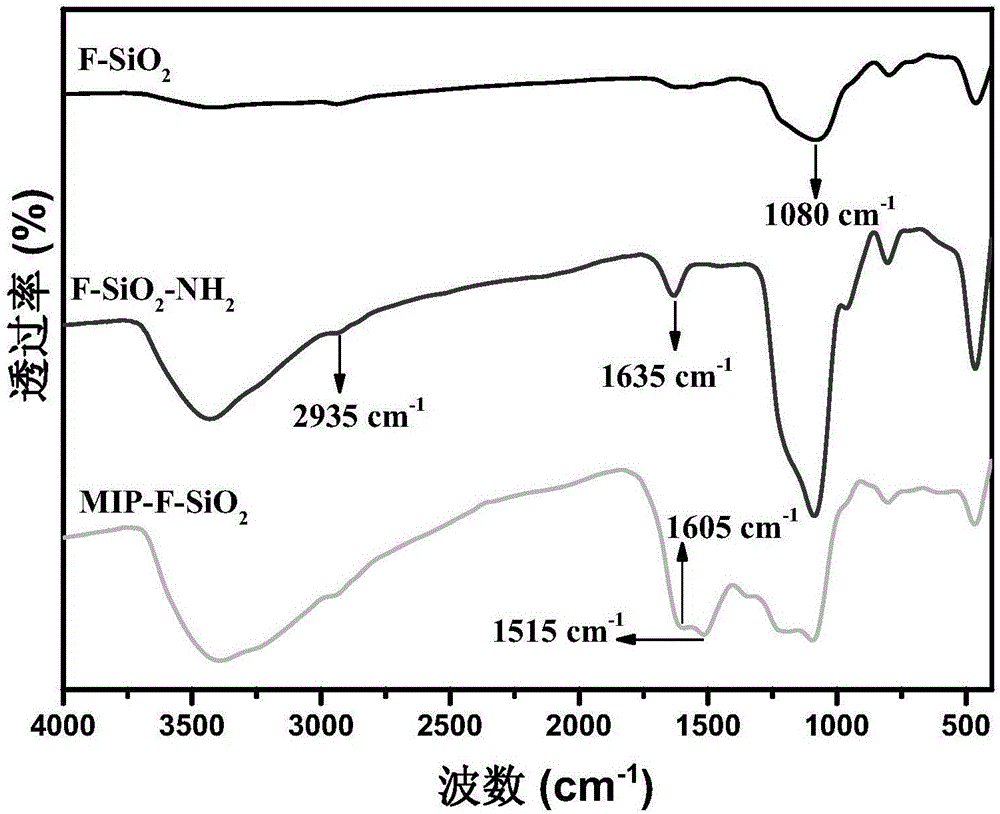
图2为实施例1制备的F-SiO2微球,氨基修饰F-SiO2微球(F-SiO2-NH2)和MIP-F-SiO2微球的红外光谱图;
图3为实施例1制备的分子印迹微球的TEM照片;
图4为实施例2制备的具有纤维状结构的二氧化硅微球(F-SiO2)的TEM照片;
图5为实施例2制备的分子印迹微球的TEM照片;
图6为实施例3制备的具有纤维状结构的二氧化硅微球(F-SiO2)的TEM照片;
图7为实施例3制备的分子印迹微球的TEM照片;
图8为实施例1制备的MIP-F-SiO2和NIP-F-SiO2微球对CAT,HRP和BHb的吸附性能;
图9为MIP-F-SiO2和NIP-F-SiO2微球对CAT活性的影响。
具体实施方式
本发明提供了一种分子印迹微球的制备方法,包括以下步骤:
A)将环己烷、异丙醇、水、乳化剂、催化剂和前驱体混合得到的乳液体系依次进行加热反应、离心、洗涤、干燥和煅烧,得到单分散纤维状二氧化硅微球;
B)将所述单分散纤维状二氧化硅微球、3-氨丙基三乙氧基硅烷和甲苯混合进行加热反应,得到氨基功能化的二氧化硅微球;
C)将所述氨基功能化的二氧化硅微球、弱碱性的缓冲溶液、过氧化氢酶和多巴胺混合,进行聚合反应后离心洗涤,得到分子印迹微球。
本发明首先将环己烷、异丙醇、水、乳化剂、催化剂和前驱体混合,得到乳液体系。
其中,乳化剂为十六烷基三甲基溴化铵(CTAB),所述前驱体为正硅酸四乙酯(TEOS),所述催化剂为尿素。所述乳化剂、催化剂、水、前驱体、异丙醇和环己烷的摩尔比为0.28:1:167:(28~40):1.31:(0.67~1.78),优选为0.28:1:167:(30~38):1.31:(0.8~1.5),更优选为0.28:1:167:(32~36):1.31:(1.0~1.3)。
本发明对所述混合的顺序并没有特殊限制,优选按照如下方法进行混合:
将乳化剂和催化剂溶解于去离子水中,再加入环己烷、异丙醇和前驱体混合,得到乳液体系。
得到乳液体系后,将所述乳液体系依次进行加热反应、离心、洗涤、干燥和煅烧,得到单分散纤维状二氧化硅微球。
在本发明中,所述加热反应的温度为65~80℃,所述加热反应的时间为12~16小时。
加热反应后,得到反应液。将所述反应液进行离心,去除上层清液后,采用无水乙醇洗涤下层产物,再重复多次离心洗涤后,将得到的产物进行干燥和煅烧。其中,所述煅烧的温度优选为350~600℃,更优选为400~500℃,所述煅烧的时间优选为2~8小时,更优选为4~6小时。
煅烧结束后,得到单分散纤维状二氧化硅微球。所述单分散纤维状二氧化硅微球的粒径为100~200nm。
得到单分散纤维状二氧化硅微球后,将所述单分散纤维状二氧化硅微球、3-氨丙基三乙氧基硅烷和甲苯混合进行加热反应,得到氨基功能化的二氧化硅微球。
本发明选用3-氨丙基三乙氧基硅烷作为单分散纤维状二氧化硅微球的表面改性剂,其中,所述单分散纤维状二氧化硅微球与3-氨丙基三乙氧基硅烷的质量比为(0.5~6):1,优选为6:1。
本发明先将单分散纤维状二氧化硅微球分散于甲苯中,然后再加入3-氨丙基三乙氧基硅烷混合后,进行加热反应,其中,所述加热反应的温度为80~115℃,优选为90~110℃,所述加热反应的时间为12~24h,优选为24h。
加热反应结束后,将产物进行离心洗涤和干燥后,得到氨基功能化的二氧化硅微球。本发明对所述离心洗涤和干燥的方法并没有特殊限制,本领域及技术人员公知的方法即可。
将所述氨基功能化的二氧化硅微球、弱碱性的缓冲溶液、过氧化氢酶和多巴胺混合,进行聚合反应后离心洗涤,得到分子印迹微球。
具体的,将所述氨基功能化的二氧化硅微球与过氧化氢酶与弱碱性缓冲溶液混合,置于0℃的冰浴中,磁力搅拌4~12h后,再加入多巴胺,得到混合溶液。
将所述混合溶液在室温条件下搅拌4~12h进行聚合反应,所述室温条件优选为20~30℃。所述聚合反应在空气氛围下进行。
其中,所述氨基功能化的二氧化硅微球与多巴胺的质量比为(0.15~1.5):1,优选为(0.5~1.2):1。
所述氨基功能化的二氧化硅微球与过氧化氢酶的质量比为(4~8):1。
聚合反应后得到反应液,将所述反应液进行离心,去除上层清液后,得到下层产物,将所述下层产物进行多次洗涤离心后,将得到的产物干燥,得到分子印迹微球。其中,本发明优选采用10%十二烷基硫酸钠和5%乙酸的水溶液进行下层产物的洗涤。
本发明对所述干燥的方法并没有特殊限制,本领域技术人员公知的方法即可。
本发明还提供了一种采用上述制备方法制备得到的分子印迹微球。
本发明还提供了一种过氧化氢酶抑制剂,所述过氧化氢酶抑制剂包括上述制备方法制备得到的分子印迹微球或上述分子印迹微球。
具体的,将上述分子印迹微球配成一定浓度的分散液,得到过氧化氢酶抑制剂,用于测定分子印迹微球对特异性吸附以及对CAT活性的抑制效率,所述过氧化氢酶抑制剂有望应用于在癌症治疗中。
本发明提供的制备方法先合成出粒径为100~200nm的纤维状二氧化硅纳米微球,经过氨基化改性后,在微球表面原位聚合包覆一层对过氧化氢酶具有特异性识别和吸附能力的聚多巴胺分子印迹层。该方法所制备的分子印迹微球可以从水溶液中特异性地捕捉过氧化氢酶,并使其失去活性。本发明合成的过氧化氢酶分子印迹微球可作为过氧化氢酶抑制剂使用,并克服了传统小分子过氧化氢酶抑制剂的低效和复杂的合成步骤等缺陷,有望应用于在癌症治疗中。
为了进一步理解本发明,下面结合实施例对本发明提供的分子印迹微球及其制备方法以及过氧化氢酶抑制剂进行说明,本发明的保护范围不受以下实施例的限制。
实施例1
1)合成具有纤维状结构的二氧化硅微球(F-SiO2)。
首先将1.0g十六烷基三甲基溴化铵(CTAB)和0.6g尿素溶解在30mL去离子水中,再依次加入30mL环己烷,1mL异丙醇和1.8mL正硅酸四乙酯。上述混合液在室温下机械搅拌30min(250rpm)后,加热至75℃反应16h。将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用无水乙醇浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述乙醇洗涤-离心分离步骤两次后,将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干,得到白色粉末。将上述白色粉末放入450℃的马弗炉中煅烧6h,彻底除去残留的CTAB。冷却至室温得到F-SiO2微球,其形貌如图1所示,图1为实施例1制备的具有纤维状结构的二氧化硅微球(F-SiO2)的TEM照片。F-SiO2微球的平均粒径约为110nm。产物的红外光谱图如图2所示,图2为实施例1制备的F-SiO2微球,氨基修饰F-SiO2微球(F-SiO2-NH2)和MIP-F-SiO2微球的红外光谱图,由图2可知,样品几乎只有Si-O-Si的特征伸缩振动峰(1080cm-1),表明产物为SiO2。
2)F-SiO2微球的氨基化修饰(F-SiO2-NH2)。
称取0.5g步骤1)中制备的F-SiO2微球,倒入250mL单口瓶中,并加入100mL甲苯。将单口瓶放入KUDOS型超声机中,超声分散10min。向单口瓶中逐滴加入3mL 3-氨基丙基三乙氧基硅烷(APTES)后,放入油浴锅(DF-101S)中,加热至115℃,反应24h。冷却至室温,将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用甲苯浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述甲苯洗涤-离心分离步骤两次后,将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干。产物的红外光谱图如图2所示,与F-SiO2相比,在3000~2850cm-1为C-H的特征振动峰,在3400cm-1附近出现N-H的特征吸收峰,表明APTES成功改性到F-SiO2微球的表面。
3)制备过氧化氢酶(CAT)分子印迹微球(MIP-F-SiO2)。
将100mg步骤2)中制备的F-SiO2-NH2微球粉末和25mg CAT加入40mL Tris-HCL缓冲溶液中(pH=8.0),放入冰水浴中,保持0℃,磁力搅拌8h后,加入30mg多巴胺。取出,在磁力搅拌下室温反应12h。将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用含有10%十二烷基硫酸钠和5%乙酸的水溶液浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述溶液洗涤-离心分离步骤五次。再将产物用去离子水洗涤并离心分离三次,最后将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干,得到黑色粉末状最终产物,其形貌如图3所示,图3为实施例1制备的分子印迹微球的TEM照片。所述分子印迹微球的平均粒径约为125nm。产物的红外光谱图如图2所示,可以看到聚多巴胺中苯环在的吸收峰(1500cm-1~1610cm-1),表明聚多巴胺包覆在F-SiO2微球的表面。
实施例2
1)合成具有纤维状结构的二氧化硅微球(F-SiO2)。
首先将1.0g十六烷基三甲基溴化铵(CTAB)和0.6g尿素溶解在30mL去离子水中,再依次加入30mL环己烷,1mL异丙醇和2.5mL正硅酸四乙酯。上述混合液在室温下机械搅拌30min(250rpm)后,加热至75℃反应16h。将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用无水乙醇浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述乙醇洗涤-离心分离步骤两次后,将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干,得到白色粉末。将上述白色粉末放入450℃的马弗炉中煅烧6h,彻底除去残留的CTAB。冷却至室温得到F-SiO2微球,其形貌如图4所示,图4为实施例2制备的具有纤维状结构的二氧化硅微球(F-SiO2)的TEM照片;所述微球的平均粒径约为240nm。
2)F-SiO2微球的氨基化修饰(F-SiO2-NH2)。
称取0.5g步骤1)中制备的F-SiO2微球,倒入250mL单口瓶中,并加入100mL甲苯。将单口瓶放入KUDOS型超声机中,超声分散10min。向单口瓶中逐滴加入3mL 3-氨基丙基三乙氧基硅烷(APTES)后,放入油浴锅(DF-101S)中,加热至115℃,反应24h。冷却至室温,将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用甲苯浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述甲苯洗涤-离心分离步骤两次后,将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干。
3)制备过氧化氢酶(CAT)分子印迹微球(MIP-F-SiO2)。
将100mg步骤2)中制备的氨基化F-SiO2微球粉末和25mg CAT加入40mL Tris-HCL缓冲溶液中(pH=8.0),放入冰水浴中,保持0℃,磁力搅拌8h后,加入30mg多巴胺。取出,在磁力搅拌下室温反应12h。将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用含有10%十二烷基硫酸钠和5%乙酸的水溶液浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述溶液洗涤-离心分离步骤五次。再将产物用去离子水洗涤并离心分离三次,最后将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干,得到黑色粉末状最终产物,其形貌如图5所示,图5为实施例2制备的分子印迹微球的TEM照片,所述分子印迹微球的平均粒径约为255nm。
实施例3
1)合成具有纤维状结构的二氧化硅微球(F-SiO2)。
首先将1.0g十六烷基三甲基溴化铵(CTAB)和0.6g尿素溶解在30mL去离子水中,再依次加入30mL环己烷,1mL异丙醇和1.8mL的正硅酸四乙酯。上述混合液在室温下机械搅拌30min(250rpm)后,加热至75℃反应16h。将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用无水乙醇浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述乙醇洗涤-离心分离步骤两次后,将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干,得到白色粉末。将上述白色粉末放入450℃的马弗炉中煅烧6h,彻底除去残留的CTAB。冷却至室温得到F-SiO2微球,其形貌如图6所示,为实施例3制备的具有纤维状结构的二氧化硅微球(F-SiO2)的TEM照片;所述微球的平均粒径约为110nm。
2)F-SiO2微球的氨基化修饰(F-SiO2-NH2)。
称取0.5g步骤1)中制备的F-SiO2微球,倒入250mL单口瓶中,并加入100mL甲苯。将单口瓶放入KUDOS型超声机中,超声分散10min。向单口瓶中逐滴加入3mL 3-氨基丙基三乙氧基硅烷(APTES)后,放入油浴锅(DF-101S)中,加热至115℃,反应24h。冷却至室温,将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用甲苯浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述甲苯洗涤-离心分离步骤两次后,将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干。
3)制备过氧化氢酶(CAT)分子印迹微球(MIP-F-SiO2)。
将100mg步骤2)中制备的氨基化F-SiO2微球粉末和25mg CAT加入40mL Tris-HCL缓冲溶液中(pH=8.0),放入冰水浴中,保持0℃,磁力搅拌8h后,加入100mg多巴胺。取出,在磁力搅拌下室温反应12h。将反应液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),将上层滤液倒入废液桶,用含有10%十二烷基硫酸钠和5%乙酸的水溶液浸泡洗涤沉于离心管底部的产物,再进行相同条件的离心分离。重复上述溶液洗涤-离心分离步骤五次。再将产物用去离子水洗涤并离心分离三次,最后将产物收集在玻璃培养皿中,置于Boxun GZX-9070MBE型鼓风烘箱中50℃烘干,得到黑色粉末状最终产物,其形貌如图7所示,图7为实施例3制备的分子印迹微球的TEM照片;所述分子印迹微球的平均粒径约为140nm。
实施例4
MIP-F-SiO2微球印迹性能的研究
为考察CAT分子印迹微球的印迹性能,选取实施例1中的微球进行吸附试验。称取实施例1中步骤3)所制备的MIP-F-SiO2和没有加入CAT模板分子制备的非印迹微球(NIP-F-SiO2)各10mg加入到25mL单口烧瓶中,并加入10mL PBS缓冲溶液中(pH=7.4)。将单口瓶放入KUDOS型超声机中,超声分散10min,得到1mg/mL的微球分散液。再称取5mg CAT溶解在上述分散液中,室温下吸附12h后,将混合液倒入离心管中,在8000rpm的转速下离心10min(飞鸽TGL-16C离心机),收集上层液体,并用UV-2041紫外可见分光光度计测定上层液体中蛋白质的吸光度,从而计算出其吸附量。在考察MIP-F-SiO2微球的特异性性吸附时,选取辣根过氧化物酶(HRP)和牛血红蛋白(BHb)作为对照组,操作与上述吸附步骤相同。微球对三种蛋白的吸附量如图8所示,图8为实施例1制备的MIP-F-SiO2和NIP-F-SiO2微球对CAT,HRP和BHb的吸附性能,由图8可以看出MIP-F-SiO2微球对CAT的吸附量最高,对其他两种蛋白的吸附量都很低,而NIP-F-SiO2微球对三种蛋白质的吸附量都不高,由此可见,所制备的MIP-F-SiO2微球对CAT分子呈现出特异性的吸附性能。为了更直观的表示这种差异性的吸附,我们定义参数印迹指数(IF)见式(I)所示的公式:
IF=QMIP/QNIP 式(I)
其中,式(I)中QMIP和QNIP分别表示MIP-F-SiO2和NIPF-SiO2微球对特定蛋白的吸附量。IF值越大,表明这种特异性吸附越明显。从图8中也可以看出MIP-F-SiO2微球对CAT的印迹指数可达7.53,而对其他两种蛋白的IF都接近1。
实施例5
MIP-F-SiO2微球对CAT生物活性抑制效率的研究
为研究合成的MIP-F-SiO2微球对CAT生物活性的抑制效果,本研究选取CAT催化过氧化氢分解的过程做为模板反应。称取实施例1中步骤3)所制备的MIP-F-SiO2和NIP-F-SiO2微球各2mg加入到15mL塑料离心管中,并向离心管中加入10mL Tris-HCl缓冲溶液中(pH=8)。将塑料离心管放入KUDOS型超声机中,超声分散10min,得到0.2mg/mL的微球分散液。再称取5mg CAT溶解在上述分散液中,室温下吸附20h。取20μL上述的分散液加入到2mL的H2O2溶液中(0.036wt%),并立刻用UV-2041紫外可见分光光度计测定分散液在波长为241nm处的吸光度。对照组中,不加入微球,其他条件与样品组一致。分散液的吸光度如图9所示,图9为MIP-F-SiO2和NIP-F-SiO2微球对CAT活性的影响,图9中,1为水,2为MIP-F-SiO2组对CAT活性的影响;3为NIP-F-SiO2组对CAT活性的影响,4为对照组对CAT活性的影响,可以看出对照组中溶液的吸光度迅速降低,表明过氧化氢快速分解成氧气和水。NIP-F-SiO2组中吸光度降低有所减慢,而MIP-F-SiO2组中吸光度降低的最慢。为进一步表明合成的MIP-F-SiO2微球对CAT的抑制效果,定义反应的半衰期τ,即反应体系在特定波长处(241nm)的吸光度降低到初始值一半时所需要的时间。从图9可以看出,对照组中τ=11s,NIP-F-SiO2组中τ=29s,而MIP-F-SiO2组中半衰期要远大于实验测定的时间量程。因此上述合成的MIP-F-SiO2微球能够很好的减缓了该催化反应,也表明MIP-F-SiO2微球能够有效的抑制CAT的生物活性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!