一种蛋白质O‑GlcNAc糖基转移酶活性电化学传感检测方法与流程
本发明涉及一种蛋白质o-glcnac糖基转移酶活性的电化学传感检测方法,属于生物分析领域。
背景技术:
蛋白质糖基化是蛋白质翻译后修饰中最常见、最重要的一种共价修饰方式,是蛋白质功能的一种重要调节机制,它涉及细胞免疫、信号传导、蛋白翻译调控、蛋白降解等诸多生物过程(wongc.h.j.org.chem.,2005,70(11):4219-4225.)。作为一种普遍存在的翻译后修饰,糖基化对蛋白质的结构和功能有着重要影响。在生物体中50%以上的蛋白质存在糖基化现象(apweilerr.etal.biochim.biophys.acta,1999,1473(1):4-8.),糖基化对于蛋白质的折叠、运输、定位起着重要作用(heleniusa.science,2001,291(5512):2364-2369.),免疫系统中几乎所有的关键分子都是糖蛋白(ruddp.m.etal.science,2001,291(5512):2370-2376.)。糖基化异常会导致疾病的发生。在帕金森病、风湿性关节炎和其他与自由基相关的疾病患者体内,检测到铁转移蛋白糖基化水平异常,铁转移蛋白是一种糖基化的金属转运血清蛋白,糖基化稳定了铁转移蛋白,间接地调节了铁离子的平衡(vanrensburgs.j.etal.metab.braindis.,2004,19(1-2):89-96.)。另有文献报道糖基化的紊乱与肌营养不良症相关,muntonif等通过对糖基转移酶活性的鉴定,发现导致肌肉营养失调的新机制,在所有病例中,普遍存在着肌营养不良蛋白糖基化异常(muntonif.etal.curr.opin.neurol.,2004,17(2):205-209.)。蛋白质糖基化是由糖基转移酶催化的低聚糖以糖苷的形式与蛋白质上特定的氨基酸残基共价结合的过程,糖基化形成的糖蛋白分子中的糖残基一般有2~10个,涉及到的单糖种类主要有葡萄糖(glu)、半乳糖(gal)、甘露糖、n-乙酰半乳糖胺(galnac)、n-乙酰葡糖胺(glcnac)、岩藻糖、n-乙酰神经氨酸等。蛋白质糖基化按照氨基酸和糖的连接方式主要分为两大类:n位糖基化和o位糖基化。n位糖基化是在内质网上由糖基转移酶催化,在内分泌蛋白和膜结合蛋白的天冬酰胺残基的氨基上结合寡糖的过程。普遍认为n位糖基化发生在蛋白特定氨基酸序列asn-x-ser/thr(x为除脯氨酸以外的任何氨基酸)上。o位糖基化多发生在丝氨酸(ser)或苏氨酸(thr)残基的羟基位点上,糖基化位点处的蛋白多为β构型,o位低聚糖以逐步加接单糖的形式形成,目前没有发现特异的氨基酸序列作为o位糖基化位点。其中,o位糖基化形式在生物体内分布最广。在哺乳动物体内最常见的o位糖基化形式是o-galnac和o-glcnac。o-galnac糖基化是由n-乙酰氨基半乳糖转移酶(ppgalnac-t)催化n-乙酰半乳糖胺(galnac)结合到蛋白质ser或thr的羟基位点上。ppgalnac-t是一个酶家族,表达产物均为ii型膜蛋白ppgalnac-t酶家族作为催化o位糖基化起始的糖基转移酶,已有文献报道它在肿瘤的发生、转移等过程中起着重要作用,且与某些重大疾病密切相关。o-glcnac则是由n-乙酰氨基葡萄糖转移酶催化n-乙酰葡糖胺(glcnac)结合到蛋白质ser或thr残基上。o-glcnac是单糖修饰,不能被进一步延长。已有文献报道o-glcnac糖基化与信号传导有密切关系(wellsl.etal.science,2001,291(5512):2376-2378.)。o-glcnac糖基化从构象上分为两类:o-α-glcnac和o-β-glcnac,且此糖基化过程可逆。它主要有三个特征:糖基化位点与蛋白激酶作用位点相似;糖基化与磷酸化相互抑制,对很多蛋白有去磷酸化作用;o-glcnac糖基化高度动态,对细胞信号等能做出快速反应。目前研究表明,o-glcnac修饰的蛋白质超过1000多种,分布在细胞质和细胞核,生物体内蛋白质的o-glcna糖基化,赋予了蛋白质不同的生物学功能(hartg.w.etal.nature,2007,446(7139):1017-1022.),如参与信号转导、参与基因转录与翻译、调节细胞周期、介导应激反应通路等。并且o-glcnac调节紊乱将引起糖尿病、神经退行性疾病、心血管疾病以及肿瘤(如乳腺癌、肺癌)等的发生。基于糖基化在生物体内的重要作用,以糖基化作为治疗靶点的药物也相继问世,治疗机制是对相应的酶进行调节(dwekr.a.etal.nat.rev.drugdiscov.,2002,1(1):65-75.)。
目前研究蛋白质糖基化已有的检测方法主要有质谱(ms)(cortesd.f.etal.electrophoresis,2011,32(1):14-29.)、核磁共振(nmr)(hashimotor.etal.chem.-eur.j.,2011,17(8):2393-2404.)、同位素标记(shakeyq.etal.anal.chem.,2010,82(18):7722-7728.)、毛细管电泳(ce)(amons.etal.electrophoresis,2008,29(12):2485-2507.)、荧光法(zarob.w.etal.bioorg.med.chem.lett.,2011,21(17):5062-5066.)等。ms的最大优势是具有较高的灵敏度,可以精确地测定质量,但是仪器昂贵,且操作繁琐,需要经过多步裂解步骤。
nmr是唯一能够提供蛋白质糖基化结构方面所有信息的技术,但是仪器昂贵、灵敏度低,需要样品量较大,且对样品的纯度要求较高,目前在天然样品的分析中无法得到广泛应用。同位素标记法直接、灵敏度高,但是也存在耗样量大、放射性污染等缺点。ce主要根据糖蛋白的独特性质把它从蛋白混合物中分离出来,但是需要和其他技术联用,如ce-ms、ce-荧光法等,操作繁琐、耗时长等。荧光法是利用双向凝胶电泳技术先分离总蛋白,然后再结合一些特殊荧光染料对糖蛋白进行染色,但是荧光染液的价格较昂贵。最近,grossbj等发展了一种荧光法,通过将能够产生荧光共振能量转移的给体和受体分别标记于多肽两端,利用多肽糖基化前后,蛋白酶对其水解能力的差异,导致体系荧光信号的改变,实现了多肽糖基化的分析检测(grossb.j.etal.j.am.chem.soc.,2008,130(2):440-441.),在此基础上,作者将建立的方法应用于糖基转移酶抑制剂的高通量筛选,效果令人满意。该方法的最大优势是实现了高通量检测。缺点是由于该方法中涉及到多肽两端荧光探针标记时的化学合成,操作复杂,不具普适性。综上所述,虽然已经发展了一些蛋白质糖基化分析检测方法,但是这些方法还存在着诸多缺陷,不能满足实际要求,有待于新方法和新技术的进一步研究与开发。
技术实现要素:
本发明的目的是提供一种蛋白质o-glcnac糖基转移酶活性的电化学传感检测方,本发明简单、快速、免标记的电化学生物传感器检测蛋白质o-glcnac糖基转移酶活性的方法。
本发明提供的一种蛋白质o-glcnac糖基转移酶活性的电化学传感检测方法,包括如下步骤:
(1)采用共价固定技术,在电极表面构筑蛋白质o-glcnac糖基转移酶的底物多肽分子的膜,得到表面固定有多肽分子的膜的电极;
(2)将所述表面固定有多肽分子的膜的电极与糖基化反应液采用蛋白质o-glcnac糖基转移酶催化进行共孵育,使所述多肽分子发生糖基化反应,得到表面固定有糖基化多肽分子的膜的电极;
(3)将所述表面固定有多肽分子的膜的电极和所述表面固定有糖基化多肽分子的膜的电极分别依次进行如下述1)-3)的处理,得到的体系分别测定各自体系中酪氨酸残基电催化氧化电流,分别得到未糖基化的催化氧化电流和糖基化的催化氧化电流;
1)置于蛋白酶反应液中水解;
2)用水清洗电极;
3)以酪氨酸残基作为电化学信号探针,将电极置于电子媒介体中进行电化学氧化反应;
(4)根据所述未糖基化的催化氧化电流和所述糖基化的催化氧化电流,即可定量分析蛋白质o-glcnac糖基转移酶的活性。
上述的方法中,所述电极为金属氧化物电极;
所述多肽分子为含有酪氨酸残基且所述酪氨酸残基位于c端的多肽,具体可为pggstpvsranmyyyyyy;
所述多肽分子的浓度可为0.1~0.5mg/ml,具体可为0.2mg/ml。
上述的方法中,所述金属氧化物电极为表面功能化修饰的氧化铟锡电极;
所述多肽分子为糖基化位点和蛋白酶水解位点相邻。
上述的方法中,所述氧化铟锡电极采用的表面功能化修饰的物质为硅烷化试剂;
所述硅烷化试剂为含环氧基团的有机硅烷试剂,具体地,所述含环氧基团的有机硅烷试剂为3-缩水甘油醚氧基丙基三甲氧基硅烷。
上述的方法中,所述糖基化反应液包括如下组分:
20~30mm三羟甲基氨基甲烷(tris);
5~15mm氯化钙;
0.02vv%~0.08vv%吐温20;
0.02vv%~0.08vv%乙基苯基聚乙二醇(np-40);
40~60μm尿苷二磷酸-n-乙酰氨基葡萄糖(udp-glcnac);
碱性磷酸酶;
蛋白质o-glcnac糖基转移酶(简称ogt);
其中,所述碱性磷酸酶的浓度为0.05~0.15u/ml;所述碱性磷酸酶的1个酶活力单位,是指在37℃条件、ph值为10.4下,在1分钟内能水解1微摩尔的底物4-硝基苯磷酸酯所需的酶量;
所述蛋白质o-glcnac糖基转移酶的浓度可为20~600u/ml;所述蛋白质o-glcnac糖基转移酶的1个酶活力单位,是指在37℃条件、ph值为7.5下,在1分钟内能催化1皮摩尔glcnac从udp-glcnac结合到多肽底物上所需的酶量。
本发明所述糖基化反应液中,所述吐温20和所述乙基苯基聚乙二醇均以体积百分比计,各组分的摩尔浓度和体积百分比均是混合之后的数值;
所述糖基化反应液具体组成如下:25mm三羟甲基氨基甲烷;10mm氯化钙;0.05vv%吐温20;0.05vv%乙基苯基聚乙二醇(np-40);50μm尿苷二磷酸-n-乙酰氨基葡萄糖(udp-glcnac);0.1u碱性磷酸酶;250u/ml蛋白质o-glcnac糖基转移酶。
上述的方法中,所述蛋白酶反应液包括如下组分:
5~15mm三羟甲基氨基甲烷-盐酸(tris-hcl);
0.5~1.5mm醋酸钙;
蛋白酶k(英文名称proteinasek)的浓度为3~300u/ml;所述蛋白酶k的1个酶活力单位,是指在37℃条件、ph值为7.5下,在1分钟内能分解酪蛋白中1.0微摩尔酪氨酸所需的酶量。
本发明中,所述蛋白酶反应液有具体由如下组分组成:10mm三羟甲基氨基甲烷-盐酸(tris-hcl);1mm醋酸钙;蛋白酶k的浓度具体为150u/ml。
上述的方法中,所述糖基化反应的时间可为40~90min;
所述糖基化反应的温度可为30~40℃,具体可为37℃;
所述水解的时间可为60~90min;
所述水解的温度可为30~40℃,具体可为37℃。
上述的方法中,所述电子媒介体为金属/有机配体络合物;
所述电化学氧化反应的条件如下:扫描速率为30mv/s,电势为0.2~1.2v,20mm磷酸盐缓冲溶液;所述磷酸盐缓冲溶液的ph值为7.4。
上述的方法中,所述金属为锇;
所述有机配体为含氮的芳香族杂环,具体地,所述有机配体为联吡啶、联吡嗪、联三吡啶、取代的联吡啶、取代的联三吡啶和二吡啶并[3,2-a;2’,3’-c]吩嗪中的至少一种。
上述的方法中,所述酪氨酸残基电催化氧化电流采用循环伏安法测定。
本发明具有以下优点:
本方法具有操作步骤简单、可以实现高通量的优点;同时,本发明方法利用多肽内源的酪氨酸的电化学电流作为检测信号,保留了无标记的特色;引入电子媒介体催化放大信号,也保证了检测的高灵敏性。
附图说明
图1为电化学传感器对蛋白质o-glcnac糖基转移酶(ogt)活性的检测原理示意图。
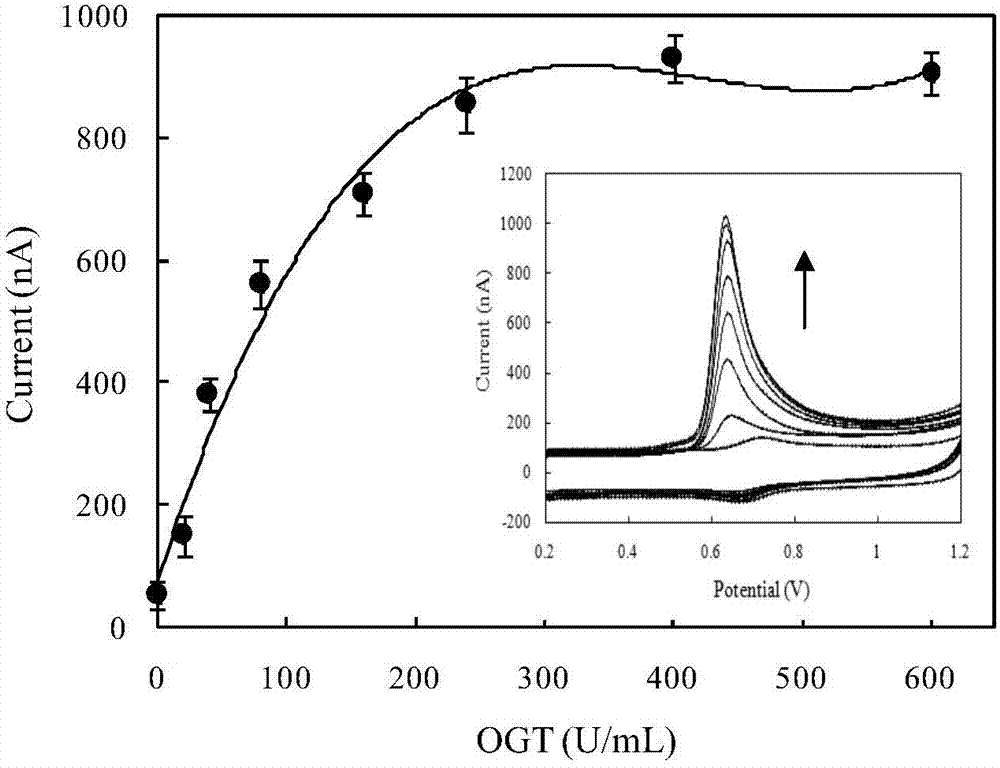
图2为本发明电化学传感器检测蛋白质o-glcnac糖基转移酶活性的结果。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中,1、氧化铟锡半导体电极的制备:
将氧化铟锡导电玻璃分别用洗涤剂(15分钟)、纯水(2分钟,两次)、丙酮(5分钟)、异丙醇(5分钟)和纯水(10分钟,两次)超声洗涤,氮气吹干,置于烘箱50℃烘干,并用大气等离子体表面处理系统处理60s,然后裁成0.5cm×2.5cm的小电极片,即获得氧化铟锡半导体电极。
2、金属/有机配体的制备
在50ml圆底烧瓶中,以摩尔比为1:3.5的比例加入0.25g(nh4)2[oscl]6(0.56mm)和0.262g2,2’-联吡啶(1.68mm),反应溶剂为30ml乙二醇,在氮气保护的环境中,油浴加热和快速搅拌条件下反应一个小时,然后冷却到室温,将含有1.68mmnh4pf6的水溶液加入到冷却的反应液中,得到目标产物为深绿色沉淀,再用冷水和乙二醇的混合溶液重结晶。得到的产物再通过活化的中性氧化铝层析柱分离纯化(乙腈作为流动相),收集深绿色条带部分,再用丙酮和二乙醚的混合溶剂重结晶。得到最终产物为[os(bpy)3](pf6)2。将得到的反应产物分别进行了质谱、紫外-可见分光光谱分析和电化学方法的表征。质谱法采用esi正离子扫描,检测到质量数330的基峰为os(bpy)32+的分子离子峰。电化学方法采用循环伏安法对产物进行了表征,观察到一对os(bpy)32+的氧化还原峰,氧化峰电位约在0.71v,还原峰电位约在0.66v。紫外-可见光谱法检测到了480nm处os(bpy)32+的特征吸收峰。
下述实施例中多肽分子的序列为pggstpvsranmyyyyyy。
实施例1、
1、半导体电极表面的功能化修饰
对氧化铟锡(ito)电极表面进行功能化修饰,能使用的修饰物一般是导电性差的有机化合物,有可能抑制电子媒介体的电化学响应。对电极表面进行了不同程度的硅烷化修饰,分别将ito电极置于含1vv%3-缩水甘油醚氧基丙基三甲氧基硅烷的甲苯溶液中反应不同时间(0.5,1,2,4,8,10,12,16,20,24小时)。反应完毕,依次在甲苯和无水乙醇中各超声5分钟,然后,氮气吹干,置于115℃马弗炉中烘20小时。x射线光电子能谱(xps)表征发现修饰物的表面含量随修饰反应时间而增加。虽然修饰层对经典电化学探针铁氰化钾的电化学响应有明显的抑制作用,但对电子媒介体os(bpy)32+的电化学反应几乎没有影响。
2、多肽分子膜在氧化铟锡表面的共价固定
先将功能化修饰的ito电极裁成2.5cm×0.5cm大小的尺寸,纯水中清洗,氮气吹干,将10μl不同浓度的多肽溶液(2.0m磷酸缓冲溶液,ph7.4)均匀覆盖平铺于0.5cm×0.5cm尺寸的ito电极上,置于一个潮湿的容器中25℃反应24小时。表面反应结束后,电极依次在含0.1%的tween-20的20mm磷酸缓冲液、含150mm氯化钠的20mm磷酸缓冲液以及20mm磷酸缓冲液中震荡清洗5分钟,氮气吹干。最后,ito电极静置于tris-hcl溶液中,用于封闭电极表面残留的反应位点。去离子水洗净,氮气吹干。采用xps和循环伏安法测定多肽固定量和多肽的电化学活性。综合考虑硅烷化修饰层对电极表面多肽固定量和电子传递速率两方面因素的影响,给出了最佳的硅烷化有机膜覆盖率(通过电流强度的大小来判断最优的条件)。硅烷化修饰ito电极1小时,多肽最优浓度为0.2mg/ml。
3、蛋白质o-glcnac糖基转移酶活性的检测
根据优化的条件(电极硅烷化1小时,多肽浓度0.2mg/ml,反应24小时固定多肽),将表面固定有底物多肽的ito电极依次置于糖基化反应液(含25mmtris,10mmcacl2,0.05%tween-20,0.05%np-40,50μmudp-glcnac,0.1u碱性磷酸酶(碱性磷酸酶1个酶活力单位,是指在37℃条件、ph值为10.4下,在1分钟内能水解1微摩尔的底物4-硝基苯磷酸酯所需的酶量)和250u/mlogt(ogt1个酶活力单位,是指在37℃条件、ph值为7.5下,在1分钟内能催化1皮摩尔glcnac从udp-glcnac结合到多肽底物上所需的酶量)、蛋白酶反应液(10mmtris-hcl,1mmca(oac)2和150u/mlproteinasek(所述蛋白酶k的1个酶活力单位,是指在37℃条件、ph值为7.5下,在1分钟内能分解酪蛋白中1.0微摩尔酪氨酸所需的酶量)中,37℃下反应1小时。电极依次在含0.1%tween-20的20mm磷酸缓冲液、含150mm氯化钠的20mm磷酸缓冲液以及20mm磷酸缓冲液中震荡清洗5分钟,氮气吹干,进行电化学检测。
4、电化学检测
电化学装置采用三电极体系:ito电极为工作电极,ag/agcl电极为参比电极(3mkcl),铂片为辅助电极。电化学检测在含3μm电子媒介体三联吡啶锇的20mm磷酸缓冲溶液中进行循环伏安扫描,扫速为30mv/s。比较糖基转移酶催化反应发生前后,蛋白酶对多肽水解能力的差异,引起体系电化学信号的变化,来对糖基转移酶的活性进行定量分析和检测;测得糖基化反应液中蛋白质o-glcnac糖基转移酶的活性为为250u/ml。
- 还没有人留言评论。精彩留言会获得点赞!