利用沙冬青幼嫩侧根诱导沙冬青愈伤组织形成的方法与流程
本发明涉及一种利用沙冬青幼嫩侧根诱导沙冬青愈伤组织形成的方法。
背景技术:
沙冬青属于豆科沙冬青属,其作为一种超旱生沙漠常绿灌木,能适宜沙漠各种极端环境(干旱、高温、低温和风蚀等),同时又是第三纪古老的残遗种,属于濒危物种,所以沙冬青是带有较好抗逆有益基因资源植物,并同时具有基因和植物生物学性状遗传进化研究价值。前人只是开展了大量关于其自然保护、群落分布、生物学特性及遗传背景分析等研究工作,直到近期,有部分的研究报道是关于沙冬青的基因克隆与转录组测序分析工作,其研究目标也是在于发掘沙冬青所蕴藏的宝贵抗逆基因资源及其抗逆机制,以解决当前农业生产和气候变化问题。
但由于沙冬青生长周期长,种子结实率和发芽率低,同时易遭受虫害,所以沙冬青繁殖能力弱;其成熟组织较老化,发芽后的幼苗生长后期也易于老化及木质化均不利于DNA和RNA提取等,而且科研人员无法在室内种植繁育沙冬青,必须每年采摘大量新种子开展科研,这在很大程度上限制了分子生物技术在沙冬青的基因克隆与功能研究方面的应用。目前还没有关于沙冬青组织培养和愈伤诱导的专利报道,仅有部分中文期刊有少量有关沙冬青愈伤组织诱导的报道,但诱导效率偏低且不稳定(3%~80%),方法可重复性差。
技术实现要素:
本发明的主要目的在于克服现有技术的不足,提供一种利用沙冬青幼嫩侧根诱导沙冬青愈伤组织形成的方法,简便、高效、低成本和稳定地获得沙冬青愈伤组织。
为实现上述目的,本发明采用以下技术方案:
一种利用沙冬青幼嫩侧根诱导沙冬青愈伤组织形成的方法,包括以下步骤:a.利用沙冬青种子进行无菌育苗,通过1/2MS培养基不断诱导带根毛的侧根形成;b.然后剪取幼嫩的毛状侧根作为外植体,在暗处于CDB1 培养基上诱导形成愈伤组织,并在光下或暗处于CDB6-2培养基上继代和扩繁所诱导出的愈伤组织。
进一步地:
在含有1/2MS固体培养基的培养皿中使种子发芽,然后转至装有1/2MS培养基的无菌培养瓶中诱导幼苗,待幼苗长出许多侧根后,移栽到新的装有1/2MS培养基的无菌培养瓶中,使部分侧根露在培养基表面,诱导侧根形成大量带有根毛的短侧根。
步骤a中利用沙冬青种子进行无菌育苗的过程包括:
(1)挑选成熟度好、外形完好、未被虫子吃过的沙冬青种子,装到已灭菌、密闭的瓶或管中;
(2)在瓶或管中,先用75%乙醇消毒沙冬青种子10min;
(3)去除乙醇,然后用6%次氯酸钠消毒沙冬青种子30min;
(4)去除次氯酸钠,用无菌水清洗灭菌种子5~6次;
(5)去除无菌水,稍微沥干水分,即可转接种子到含有固体1/2MS培养基的培养皿中;
(6)在22℃~28℃条件下培养2~5天,使种子发芽。
步骤a中通过1/2MS培养基不断诱导带根毛的侧根形成的过程包括:
(1)挑选发芽势好的种子转接到装有固体1/2MS培养基的灭菌培养瓶中,以利于发芽种子的生长;
(2)当沙冬青幼苗长出多条侧根后,开展第二次转接,将生长健壮的幼苗移栽到新的装有固体1/2MS培养基的灭菌培养瓶中,并露出部分侧根在培养基表面;
(3)生长20~40天后,露在培养基表面的侧根会长出许多带有根毛的短侧根,以此作为诱导愈伤组织的外植体材料。
步骤b中在暗处于CDB1培养基上诱导形成愈伤组织的过程包括:
在无菌条件下,剪取部分毛状侧根置于CDB1培养基上,在暗处28℃条件下诱导培养20~35天,其中CDB1培养基成分为:MS+1.0mg/L 2,4-D+0.1mg/L 6-BA,pH5.8~7.5。
步骤b中在光下或暗处于CDB6-2培养基上继代和扩繁所诱导出的愈伤组织的过程包括:
将诱导出的愈伤组织转接到CDB6-2培养基上,在28℃有光条件或暗处下培养,每隔10~15天继代一次,其中CDB6-2培养基成分为:MS+0.2 mg/L IBA+0.1mg/L KT+0.5mg/L GA3,pH5.8~7.5。
本发明的有益效果:
利用本发明形成沙冬青愈伤组织,可以开展沙冬青DNA和RNA提取,进行基因组测序或基因克隆与功能研究等分子生物学研究,而不需要再额外采种育苗,因而可以降低研究成本,提高研究效率,同时保护原生地国家濒危植物沙冬青的种群。
本发明的优势具体体现在以下方面:
(1)沙冬青无菌育苗长出许多侧根后,通过无菌条件再移栽,并留部分根系露在1/2MS无菌培养基表面,可以诱导其侧根上再长出许多带根毛的短侧根,剪取幼嫩的毛状侧根即可作为沙冬青愈伤组织培养的外植体材料。该取材方法不会影响无菌瓶中该单株的正常生长,又能长期获得幼嫩的外植体材料,供后续愈伤组织诱导之用。
(2)幼嫩的毛状侧根易于诱导愈伤形成(诱导率≥80%),愈伤诱导稳定,而且无需再采种育苗。
(3)本发明仅需要在暗处用CDB1培养基诱导愈伤,再转到光下或暗处用CBD6-2培养基将愈伤组织继代与扩繁培养,步骤简单。
(4)可获得大量无菌、均一、稳定的沙冬青愈伤组织,供沙冬青分子生物学研究(如基因克隆与功能研究)之用,无需再去野外采种或育苗。
(5)沙冬青愈伤组织可用于DNA或RNA提取,用于有益基因资源发掘。
(6)如果愈伤组织能再生成苗,可以实现沙冬青的分子遗传改良,获得繁殖力强、抗逆性强的沙冬青,实现沙冬青种质的保护,和用于防风固沙、园林绿化等。
附图说明
图1为沙冬青灭菌种子接种在1/2MS培养基的实验样本示意图;
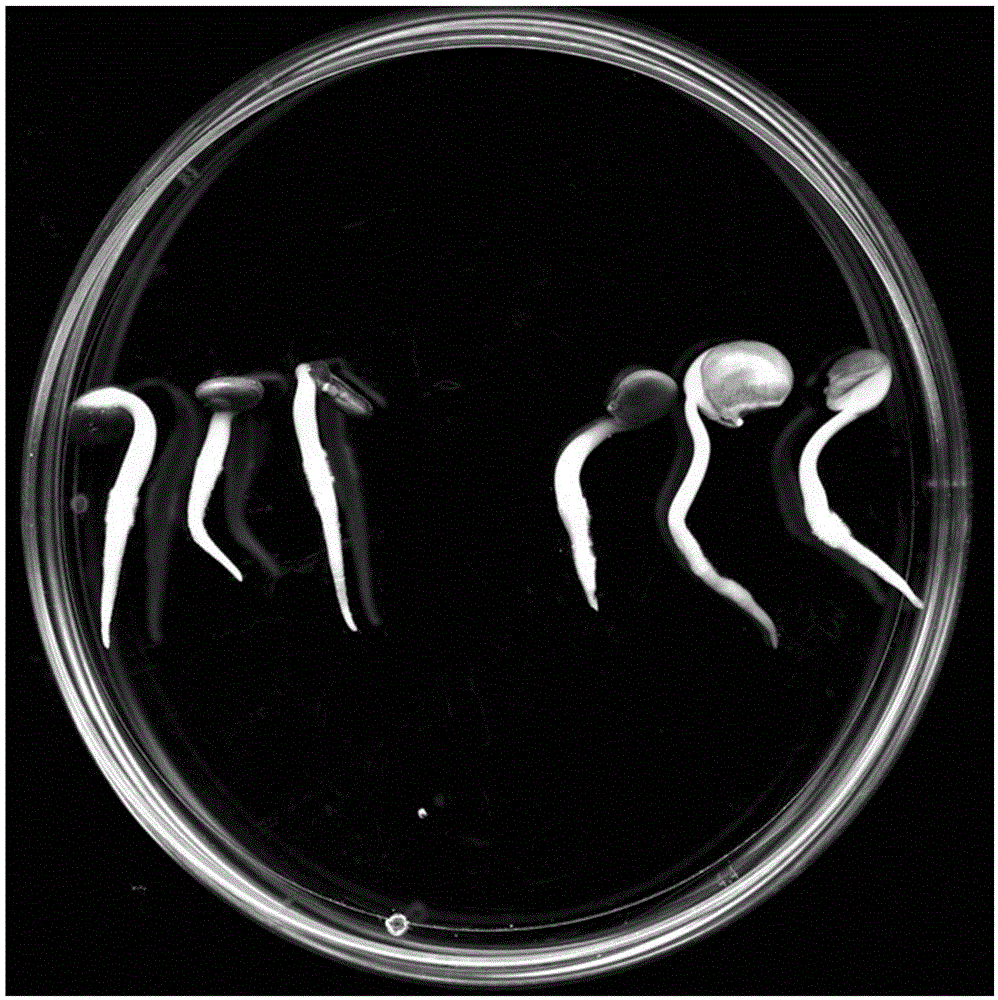
图2为沙冬青种子在1/2MS培养基上发芽5天表型的实验样本示意图;
图3为无菌培育的带根毛短侧根沙冬青幼苗(35天)的实验样本示意图;
图4为带根毛侧根在CDB1培养基上诱导出愈伤组织(20天)的实验样本示意图;
图5为沙冬青愈伤组织在CDB6-2培养基上继代与扩繁的实验样本示意图(光照培养)。
图6为沙冬青愈伤组织在CDB6-2培养基上继代与扩繁的实验样本示意图(暗培养)。
具体实施方式
以下对本发明的实施方式作详细说明。应该强调的是,下述说明仅仅是示例性的,而不是为了限制本发明的范围及其应用。
在一种实施例中,一种利用沙冬青幼嫩侧根诱导沙冬青愈伤组织形成的方法,包括以下步骤:a.利用少量沙冬青种子进行无菌育苗,通过1/2MS培养基不断诱导带根毛的侧根形成;b.然后剪取幼嫩的毛状侧根作为外植体,在暗处于CDB1培养基上诱导形成愈伤组织,并在光下或暗处于CDB6-2培养基上继代和扩繁所诱导出的愈伤组织。
在优选的实施例中,步骤a包括:通过无菌育苗,在含有1/2MS固体培养基的培养皿中使种子发芽,然后转至装有1/2MS培养基的无菌培养瓶中诱导幼苗,待幼苗长出许多侧根后,移栽到新的装有1/2MS培养基的无菌培养瓶中,使部分侧根露在培养基表面,诱导侧根形成大量带有根毛的短侧根。步骤b中,将此带根毛短侧根作为幼嫩外植体,在CDB1培养基诱导愈伤组织和在CDB6-2培养基上继代与扩繁,从而获得大量均一的沙冬青愈伤组织,供开展沙冬青后续相关研究之用。优选地,在暗处用CDB1(MS+1.0mg/L 2,4-D+0.1mg/L 6-BA,pH5.8~7.5)培养基诱导愈伤组织形成,然后在光下或暗处用CBD6-2(MS+0.2mg/L IBA+0.1mg/L KT+0.5mg/L GA3,pH5.8~7.5)培养基进行愈伤组织的继代与扩繁培养。
在优选的实施例中,沙冬青无菌育苗过程具体包括以下步骤:
(1)挑选成熟度好、外形完好、未被虫子吃过的沙冬青种子,装到已灭菌、密闭的瓶或管中;
(2)在瓶或管中,先用75%乙醇消毒沙冬青种子10min;
(3)倒掉75%乙醇,然后用6%次氯酸钠消毒沙冬青种子30min;
(4)倒掉6%次氯酸钠,用无菌水清洗灭菌种子5~6次;
(5)倒掉无菌水,稍微沥干水分,即可转接种子到含有固体1/2MS培养基的培养皿中;
(6)在22℃~28℃条件下培养2~5天,使种子发芽。
在优选的实施例中,沙冬青毛状侧根诱导过程具体包括以下步骤:
(1)沙冬青种子发芽后,挑选发芽势好的种子转接到装有固体1/2MS培养基的灭菌培养瓶中,以利于发芽种子的生长;
(2)当沙冬青幼苗长出多条侧根后,可以开展第二次转接,将生长健壮的幼苗移栽到新的装有固体1/2MS培养基的灭菌培养瓶中,并露出部分 侧根在培养基表面;
(3)生长20~40天后,露在培养基表面的侧根会长出许多带有根毛的短侧根,以此作为诱导愈伤的外植体材料。
在优选的实施例中,沙冬青愈伤组织诱导过程具体包括以下步骤:
在无菌条件下,剪取部分毛状侧根置于CDB1(MS+1.0mg/L 2,4-D+0.1mg/L 6-BA,pH5.8~7.5)愈伤诱导培养基上,在暗处28℃条件下诱导培养20~35天。
在优选的实施例中,沙冬青愈伤组织继代与扩繁过程具体包括以下步骤:
将诱导出的愈伤组织再转接到CDB6-2(MS+0.2mg/L IBA+0.1mg/L KT+0.5mg/L GA3,pH5.8~7.5)愈伤组织继代与扩繁培养基上,在28℃有光或暗处条件下培养,每隔10~15天继代一次。
实例
(1)挑选外形完好,未被虫吃过的沙冬青种子,装到50mL已灭菌离心管中;
(2)在无菌操作台上,先加入40mL 75%乙醇消毒沙冬青种子10min,期间不时振荡;
(3)倒掉75%乙醇,然后用40mL高乐氏漂白水(含6.25%次氯酸钠活性)消毒沙冬青种子30min,期间不时振荡;
(4)倒掉高乐氏漂白水,用无菌水清洗灭菌种子5~6次;
(5)倒掉无菌水,在无菌操作台上,用灭菌的镊子,从离心管中取出种子直接接种到含有固体1/2MS培养基的培养皿(90×15mm)中(如图1所示);
注:1/2MS培养基,2.22g/L MS(含Gamborg's vitamins)(Sigma);2g/100mL Sucrose(Caisson);8g/L phytoblend(Caisson),用1M KOH调pH至5.7;
(6)22℃光照培养条件下培养3天,使种子发芽;
(7)沙冬青种子发芽后,挑选发芽整齐的种子(如图2所示)转接到装有固体1/2MS培养基的灭菌培养瓶中,以利于发芽种子的生长;
(8)当沙冬青幼苗长出多条侧根后,可以开展第二次转接,将生长健壮的幼苗移栽到新的装有固体1/2MS培养基的灭菌培养瓶中,并露出部分侧根在培养基表面;
(9)35天后,露在培养基表面的侧根会长出许多带有根毛的短侧根(如图3所示),以此作为愈伤诱导的外植体材料;
(10)在无菌操作台上,剪取部分毛状侧根于CDB1(MS+1.0mg/L2,4-D+0.1mg/L 6-BA,pH5.8~7.5)愈伤诱导培养基上,在暗处28℃条件下诱导培养20天,诱导出的愈伤组织如图4所示;
(11)将诱导出的愈伤组织再转接到CDB6-2(MS+0.2mg/L IBA+0.1mg/L KT+0.5mg/L GA3,pH5.8~7.5)愈伤组织继代与扩繁培养基上,在28℃有光条件(或暗处)下愈伤组织扩繁,每隔15天继代一次,扩繁的愈伤组织如图5(光照培养,20天,培养基pH5.8),图6(暗培养,40天,左图pH7.5,右图pH5.8)所示。
以上内容是结合具体/优选的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,其还可以对这些已描述的实施方式做出若干替代或变型,而这些替代或变型方式都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!