利用枯草芽孢杆菌菌株以增强动物健康的方法与流程
本申请是2009年9月17日提交的发明名称为“利用枯草芽孢杆菌菌株以增强动物健康的方法”的第200980136277.4号发明专利申请的分案申请。与相关申请的交叉引用根据35u.s.c.第119(e)款,本申请要求2008年9月17日递交的美国临时申请no.61/192,436的优先权。前述申请在此以其全部通过引用而并入。本发明涉及益生菌领域及其增强动物健康或动物的一般身体状况的能力。
背景技术:
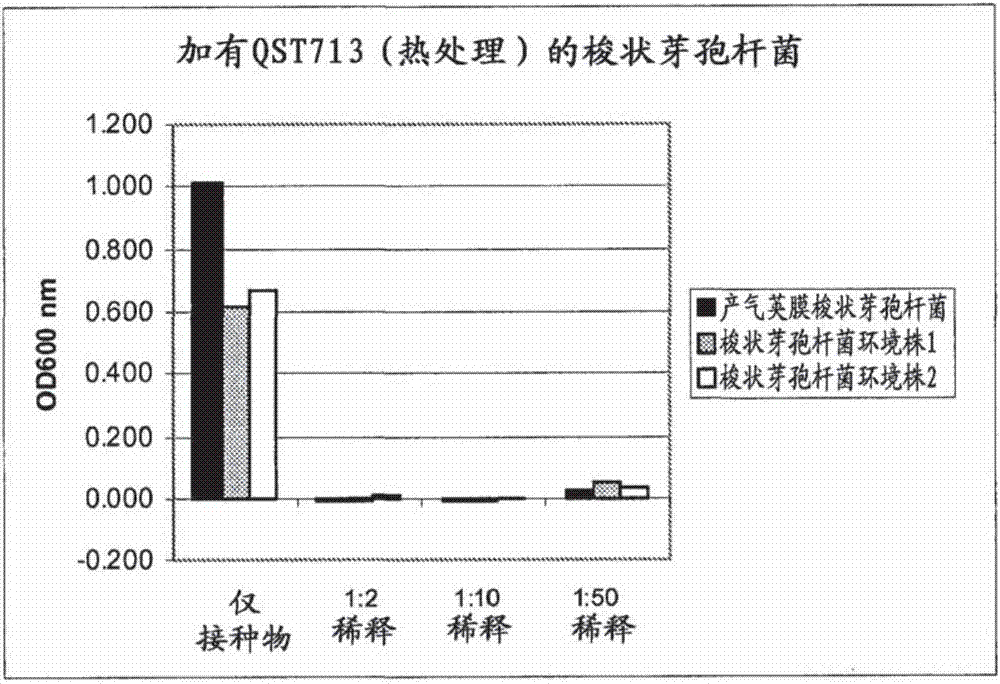
:芽孢杆菌(bacillus)属包含众多在农业和动物营养等领域中具有繁多用途的内生孢子形成细菌。数种芽孢杆菌株目前在市场上用作动物饲料中的益生菌而作为抗生素的替代品。这些益生菌通过调整胃肠道菌群来增强动物健康,包括改善动物生长及饲料效率。由于对用于人类消费的动物产品中的抗生素残余物及对抗生素耐药性的发展的担忧,增加了对此类益生菌的使用。近年来已进行了工作来筛选用作益生菌的孢子形成细菌。尽管各种商业产品中含有枯草芽孢杆菌(bacillussubtilis)、藓样芽孢杆菌(bacilluslicheniformis)及凝结芽孢杆菌株(bacilluscoagulans),此种筛选揭示出并非所有的芽孢杆菌株均是有效的饲料添加剂。技术实现要素:本发明提供这样的枯草芽孢杆菌株,当将其施用给动物时,增强此动物的健康。具体而言,本发明涉及用于增强非昆虫且非人的动物的健康或改善此类动物的一般身体状况的方法,所述方法通过在饲料或饮用水中饲喂(非通过强饲法)此类动物包含下列物质的组合物:(i)枯草芽孢杆菌qst713,(ii)(i)的突变体、(i)或(ii)的无细胞制备物、或(i)或(ii)的代谢物。在一个实施方式中,本发明的组合物包含枯草芽孢杆菌713或其突变体,及由所述细菌产生的代谢物。在另一个实施方式中,所述组合物包含主要为其孢子形式的枯草芽孢杆菌qst713。在本发明的一些实施方式中,贯穿动物的生命或在动物生命中的特定阶段或部分,于若干天内在饲料中向动物施用所述组合物。例如,在一些实施方式中,仅在家畜的起始饮食或仅在结束饮食中施用所述组合物。本发明的方法可用于提高动物的重量增加、提高饲料利用效率、降低发病率、增加疾病抵抗力、提高存活率、提高动物的免疫应答及维持健康的肠微生物菌群。在一个实施方式中,本发明的方法用于在为了治疗目的施用一程抗生素后,协助重建健康的肠的微生物菌群平衡。在一个实施方式中,本发明的组合物包含枯草芽孢杆菌qst713或其突变体,并以下列比率向动物施用:约1x103cfu/g饲料或ml饮用水,或约1x104cfu/g饲料或ml饮用水,或约1x105cfu/g饲料或ml饮用水,或约1x106cfu/g饲料或ml饮用水,或约1x107cfu/g饲料或ml饮用水,或约1x108cfu/g饲料或ml饮用水,或约1x109cfu/g饲料或ml饮用水,或约1x1010cfu/g饲料或ml饮用水,或约1x1011cfu/g饲料或ml饮用水。在另一个实施方式中,本发明的组合物以有效减少动物肠中的病原性细菌生长的量被施用或饲喂给动物。这类病原性细菌包括梭状芽孢杆菌(clostridia)、利斯特菌(listeria)、沙门氏菌(salmonella)、弯曲杆菌(campylobacter)、大肠杆菌(escherichiacoli)及弧菌(vibrio)。相关地,本发明的方法可用于减少动物粪便中排出的病原性细菌的量。本发明的方法也可用于维持或增加动物肠中的有益细菌(例如乳酸菌)的生长。通过减少病原性细菌和/或增加或维持有益细菌,本发明的组合物能够维持整体而言健康的肠微生物菌群。本发明的方法可用于所有非人和非昆虫的动物。可受益于本发明方法的动物包括但不限于禽类、猪、反刍动物、宠物和外来的动物(exoticanimal)、动物园的动物、水生动物及马等。在一个实施方式中,所述动物为经饲养用于消费或作为食物产生者的家畜,例如肉鸡和产蛋鸡。本发明还提供适应于增强动物健康或改善动物的身体状况的组合物。因此,本发明的组合物可包括枯草芽孢杆菌qst713或其突变体、其无细胞制备物或其代谢物以及使所述组合物适于作为饲料添加剂或作为饮用水添加剂而饲喂动物的载体。备选地,枯草芽孢杆菌qst713或其突变体,其无细胞制备物或其代谢物可与动物饲料成分(包括饲料蛋白和/或饲料碳水化合物)一起配制。此类组合可以是通过标准的造粒过程挤出的丸粒形式。本发明的组合物还包含下列物质与其他益生菌和/或益生元的组合:枯草芽孢杆菌qst713或其突变体,qst713或其突变体的无细胞制备物,和qst713及其突变体的代谢物。本发明还包括用于制备含有直接饲喂的微生物的动物饲料的方法,所述方法包括在造粒过程之前,将在饲喂动物时有效增强动物健康的量的枯草芽孢杆菌qst713孢子加入标准的饲料组分(例如碳水化合物和蛋白质)中。附图说明图1显示枯草芽孢杆菌qst713的无细胞制备物对抗各种梭状芽孢杆菌分离株的效力的测试结果。图2表示经热处理的枯草芽孢杆菌qst713无细胞制备物对抗各种梭状芽孢杆菌分离株的效力的测试结果。图3显示枯草芽孢杆菌qst713的无细胞制备物对抗各种利斯特菌分离株的效力的测试结果。图4表示经热处理的枯草芽孢杆菌qst713无细胞制备物对抗各种利斯特菌分离株的效力的测试结果。图5显示枯草芽孢杆菌qst713的无细胞制备物对抗各种沙门氏菌分离株的效力的测试结果。图6表示经热处理的枯草芽孢杆菌qst713无细胞制备物对抗各种沙门氏菌分离株的效力的测试结果。图7显示琼脂板,在其上将枯草芽孢杆菌qst713(垂直)和各种产气荚膜梭状芽孢杆菌(clostridiumperfringens)(水平)分离株进行交叉划线,以测试qst713对抗所述病原体的效力。图8显示琼脂板,在其上将枯草芽孢杆菌qst713(垂直)和各种空肠弯曲杆菌(campylobacterjejuni)(水平)分离株进行交叉划线,以测试qst713对抗所述病原体的效力。具体实施方式本申请中的所有出版物、专利及专利申请(包括任何附图和附录)均通过引用而并入,其并入程度如若各单独的出版物或专利申请被特别且单独指明通过引用而并入一样。下列说明包括在理解本发明方面可能有用的信息。这并非承认本申请所提供的任何信息为现有技术或与当前要求保护的发明相关,或任何特别引用或含蓄引用的出版物为现有技术。本发明涉及作为益生菌而有效增强动物健康的枯草芽孢杆菌株qst713和/或其代谢物的新用途。益生菌用于动物健康应用中以维持健康的肠微生物菌群,包括减少有害细菌(例如梭状芽孢杆菌和弯曲杆菌)及增加有益细菌(例如乳杆菌属(lactobacillusspp.)和双歧杆菌(bifidobacterium))。益生菌非常适合用于维持病原性细菌和有益细菌之间的健康平衡,因为,不像抗生素,所述益生菌不会不加区别地消灭细菌也不导致病原性细菌的抗生素耐药性株。有许多被认为是益生菌用于维持健康的肠微生物菌群的机制:竞争排斥病原性细菌、通过产生抗微生物物质来减少病原性细菌、增强有益的肠微生物菌群的生长和存活,以及刺激动物中的系统性免疫应答。本发明包括通过向动物施用组合物以增强动物健康的方法,所述组合物包含(i)枯草芽孢杆菌qst713、(ii)枯草芽孢杆菌qst713的突变体、(iii)(i)或(ii)的无细胞制备物、或(iv)(i)或(ii)的代谢物。美国专利nos.6,060,051、6,103,228、6,291,426、6,417,163及6,638,910中充分描述了枯草芽孢杆菌qst713、其突变体、其上清液及其脂肽代谢物,以及用它们控制植物病原体和昆虫的方法。在这些专利中,所述菌株被称为aq713。枯草芽孢杆菌qst713已在1997年3月7日,在布达佩斯条约对为了专利程序目的的微生物保藏的国际认可的条款下,保藏于nrrl,编号为b21661。本说明书中对qst713的任何引用均指枯草芽孢杆菌qst713。枯草芽孢杆菌qst713株具有某些特性,令人惊讶地,这些特性已被发现使该菌株非常适合用于增强动物的健康。qst713的孢子在低ph值下可存活且qst713的细胞可在低至4.5的ph值下生长(若存在有益的营养条件)。此外,如下列实施例8和4中所分别描述的,qst713能够在高盐条件下生长至少10天且可在对于粒化动物饲料而言必需的高温下生存。如实施例2中所示,qst713还具有聚集或群集的能力,从而竞争过并减少病原性细菌。不欲受限于任何特定理论,枯草芽孢杆菌qst713被认为通过多方面性的作用模式来增强动物健康,包括产生抗菌代谢物及通过使用较病原体更多的营养物和附着空间来与病原体竞争,从而预防病原性细菌在肠中的有效建立。在本发明的一方面,施用给动物的组合物包含具有qst713的所有鉴别特征的枯草芽孢杆菌qst713突变体。此类突变体可具有与qst713至少约95%、至少约96%、至少约97%、至少约98%、或至少约99%的dna序列一致性。在一些实施方式中,突变体为自发性突变体。术语自发性突变体指不刻意使用诱变剂而产生自qst713的突变体。此类自发性突变体可通过经典的方法获得,例如使枯草芽孢杆菌株在母菌株对其敏感的某种抗生素的存在下生长,并针对改善的生物学活性(或者,在本申请中,针对改善的增强一或多种下述动物健康标记的能力)测试任何抗性突变体。其他用于鉴别自发性突变体的方法将为本领域一般技术人员所知。本申请中对枯草芽孢杆菌qst713或其突变体的所有引用均指已从自然中分离的,并且由人在,例如实验室中或工业条件下生长的细菌。枯草芽孢杆菌qst713细胞可作为孢子(其为休眠的)、作为营养细胞(其为生长的)、作为过渡状态细胞(其从生长期向孢子形成期过渡)、或所有这些类型的细胞的组合,存在于本发明的组合物中。在一些实施方式中,所述组合物主要包含孢子。qst713或其突变体的代谢物包括脂肽,例如伊枯草菌素、枯草菌表面活素、plipastatins和agrastatins,及其他具有抗菌特性的化合物。在美国专利nos.6,291,426和6,638,910中详细描述了qst713的脂肽代谢物。本发明的组合物可根据本领域公知的方法(包括使用美国专利no.6,060,051中所描述的培养基和其他方法),通过培养枯草芽孢杆菌qst713或其突变体而获得。传统的大规模微生物培养方法包括深层发酵、固态发酵、或液体表面培养。将近发酵结束时,随着营养耗尽,枯草芽孢杆菌qst713细胞开始从生长期向孢子形成期的过渡,从而使发酵的最终产物主要为孢子、代谢物及残余的发酵培养基。孢子形成是此枯草芽孢杆菌的自然生命周期的一部分且通常由细胞响应于营养限制而起始。发酵被配置为用以获得高水平的枯草芽孢杆菌qst713的菌落形成单位并促进孢子形成。由发酵产生的培养基中的细菌细胞、孢子及代谢物可被直接使用或通过传统的工业方法(如离心、切向流过滤、深度过滤及蒸发)而被浓缩。在一些实施方式中,所述经浓缩的发酵培养液被清洗(例如通过渗滤过程)以去除残留的发酵培养液和代谢物。可利用传统干燥过程或方法(例如喷雾干燥、冷冻干燥、盘干燥、流化床干燥、滚筒干燥、或蒸发),添加或不添加载体来干燥发酵培养液或培养液浓缩液。所产生的干燥产物可被进一步加工(例如通过研磨或造粒),以达到特定的颗粒大小或物理格式。下述的载体也可在干燥后加入。qst713发酵培养液的无细胞制备物可通过任何本领域已知的方式(例如萃取、离心和/或过滤发酵培养液)获得。本领域技术人员将了解,根据所使用的用于移除细胞的技术(例如,离心速度),所谓的无细胞制备物可能不是全无细胞,而是大致上无细胞或基本上无细胞。所产生的无细胞制备物可以被干燥和/或与辅助其对动物的施用的成分一起配制。上述用于发酵培养液的浓缩方法和干燥技术也可用于无细胞制备物。可根据美国专利no.6,060,051中所示的方法获得qst713的代谢物。本申请中所使用的术语“代谢物”指半纯的、和纯的或基本上纯的代谢物,或者指未与枯草芽孢杆菌qst713分离的代谢物。qst713的脂肽及其他杀菌代谢物在600千道尔顿和100道尔顿之间。因此,在一些实施方式中,通过离心qst713的发酵培养液来制备无细胞制备物后,可通过基于分子量筛截(molecularweightcut-off)而将代谢物分组为不同级分(例如分子量少于600kda、少于500kda、少于400kda,等等)的尺寸排阻过滤纯化所述代谢物。上述用于配制发酵培养液的浓缩方法和干燥技术也可用于代谢物。本发明的组合物可包含载体,所述载体为添加到包含细胞、无细胞制备物或代谢物的组合物中的惰性制剂成分,以改善回收率、效力或物理特性和/或辅助包装和施用。此类载体可单独加入或组合加入。在一些实施方式中,所述载体为抗结块剂、抗氧化剂、填充剂和/或保护剂。有用的载体的实例包括:多糖(淀粉,麦芽糊精,甲基纤维素,蛋白质、例如乳清蛋白,肽,树胶),糖类(乳糖、海藻糖、蔗糖),脂质(卵磷脂、植物油、矿物油)、盐类(氯化钠、碳酸钙、柠檬酸钠)及硅酸盐(粘土、无定形硅、火成/沉淀二氧化硅、硅酸盐)。用于动物饲料添加剂的合适载体列于每年出版的美国饲料控制官员公司官方出版物(americanfeedcontrolofficials,inc.’sofficialpublication)中。参见例如美国饲料控制官员的官方出版物,编辑为sharonkrebs,2006版,isbn1-878341-18-9。在一些实施方式中,所述载体在浓缩发酵培养液后及在干燥期间和/或干燥后被加入。在其中所述组合物被配制为饲料添加剂的实施方式中,在所配制的组合物中,(i)枯草芽孢杆菌qst713或其突变体、(ii)qst713或其突变体的无细胞制备物、(iii)qst713或其突变体的代谢物、或(iv)细胞及代谢物的组合的浓度(基于重量/重量(w/w))可以是约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、或约95%。在一些实施方式中,例如,当浓缩的配制培养液经清洗且不经加热而被干燥(例如通过冷冻干燥)时,在最终的组合物中,枯草芽孢杆菌qst713或其突变体的浓度可以是约90%至约100%。本发明的组合物可被施用/饲喂于非昆虫且非人的动物以改善动物健康或改善此类动物的一般整体身体状况。对于治疗性和非治疗性应用均可施用所述组合物。组合物的有效量是,相比于未施用所述组合物但除此之外施用了与接受本发明组合物的动物相同的饮食(包括饲料及其他化合物)的动物,有效增强动物健康的量。健康增强的标记包括下列的一或多项:重量增加的提高(其可包括动物特定部分的重量增加或整体重量增加);维持肠的微生物菌群;增加饲料的利用效率;降低死亡率的风险;提高疾病抵抗力;降低发病率;提高免疫应答;减少腹泻的发生;提高生产率;和/或减少病原体排出。因此,与上述一致,本申请的实施方式是针对非治疗性方法的,例如通过施用/饲喂给动物包含枯草芽孢杆菌qst713、枯草芽孢杆菌qst713的突变体、源自枯草芽孢杆菌qst713或其突变体的无细胞制备物、或qst713或其突变体的代谢物的组合物来增加动物的重量、维持肠的微生物菌群或增加饲料利用效率。在其中本发明的组合物被施用/饲喂给家畜的一些实施方式中,施用所述组合物以改善家畜的生长表现。如在本申请中所使用的,改善生长表现指与未施用本发明组合物的动物相比,生长增加(重量或长度)和/或饲料利用效率增加和/或死亡率下降/存活率增加。在本发明的一个方面,达到了重量增加约1%至约20%、或约1%至约15%、或约1%至9%。本发明的方法还可增加动物中的饲料利用效率(与未施用本发明组合物的动物相比)。典型地,利用饲料转化率评估饲料效率,所述饲料转化率为饲料消耗与重量增加的比率。此比率的降低与提高的饲料效率相关。饲料效率可改善约1%至15%、约2%至约10%、及约3%至约8%。本发明的方法还可降低死亡率。可达到存活率改善约1%至约20%、或约2%至17%、或约4%至约13%、或约5%至约10%。增加的生长、饲料效率改善和降低的死亡率可与动物饲养业领域中已知的平均值比较而分别确定,或者可通过比较年龄大致相同的家畜组的生长表现数据的平均值而确定,所述家畜组典型地被一起饲养和/或在相似的条件下饲养,其中某些未接受本发明的组合物。维持肠的微生物菌群指与未施用本发明的方法的动物相比,减少(通过杀死或抑制生长)公共卫生所关注的有害的、致病微生物和/或增加有益细菌(例如乳酸杆菌(lactobacilli)和双歧杆菌)。不欲受任何特定理论的约束,有益细菌的增加被认为可能是通过刺激此类细菌的生长而引起的,或是仅仅通过选择性地减少病原性细菌,从而给予有益细菌更多的生长及附着至肠壁的空间而引起的。可通过本发明的方法减少的有害的致病细菌包括梭状芽孢杆菌属(clostridiaspp.)(例如产气荚膜梭状芽孢杆菌和艰难梭状芽孢杆菌(clostridiadificile))、利斯特菌属(listeriaspp.)(例如单核细胞增生利斯特菌(listeriamoncytogenes)、斯氏利斯特菌(listeriaseeligeri)和威氏利斯特菌(listeriawelshimeri))、沙门氏菌属(salmonellaspp.)(例如肠沙门氏菌(salmonellaenterica)、亚利桑那沙门氏菌(salmonellaarizonae)、鼠伤寒沙门氏菌(salmonellatyphimurium)、肠炎沙门氏菌(salmonellaenteritidis)和邦戈尔沙门氏菌(salmonellabongori))、大肠杆菌、肠球菌属(enterococcusspp.)(例如粪肠球菌(enterococcusfaecalis)和屎肠球菌(enterococcusfaecium))、弯曲杆菌(campylobacter)、气单胞菌属(aeromonasspp.)、金黄色葡萄球菌(staphylococcusaureus)及弧菌属(vibriospp.)。在一些实施方式中,有害的致病微生物可减少约0.5个对数、约1个对数、约2个对数、约3个对数、约4个对数、或约5个对数。上述病原性细菌导致动物中的各种疾病。例如,在家禽中,坏死性肠炎(或肠壁中的坏死损伤)在鸡中的爆发牵涉被产气荚膜梭状芽孢杆菌污染的饲料。有趣地,虽然此细菌常见于鸡的肠道中,其并不总是引起坏死性肠炎,虽然增加的水平已被与所述疾病相关联。如下列实施例中所示,通过使用益生菌来减少此病原体引起健康增强及重量增加。因此,通过降低此类细菌在肠中生长的能力来控制这些细菌,降低由其引起的疾病的发病率。下表1显示各种微生物及与其相关联的疾病或病况。表1维持健康的肠微生物菌群,尤其是,减少一或多种上述有害细菌,也引起通过动物粪便排出的病原体减少。病原体的量可通过数种本领域技术人员已知的方法确定,包括分析动物粪便中排出的病原体或通过在研究期间杀死动物并分析其肠中的细菌群体(有益的和病原性的)。本发明的方法还可通过抑制病原性细菌的生长和/或增加或维持有益细菌的生长而在施用治疗量的抗生素后被用于恢复正常的肠内平衡。术语“治疗量”指足以改善或逆转动物中疾病状态的量。通过本发明的方法所获得的提高的生产率指下列任一项:生产更多或更高质量的鸡蛋、奶或肉,或增加产生断奶的后代。本发明的方法可被用于任何动物,包括脊椎动物(例如哺乳动物和水生动物)、甲壳类动物(例如虾),但不包括昆虫和人。可以本发明的组合物治疗的哺乳动物包括:家畜;用于体育、休闲或工作的动物,例如马,包括赛马;家庭宠物,包括狗、猫、禽类和外来种(exotics);和动物园的动物。家畜指经饲养用于消费或作为食物产生者的动物。在一个实施方式中,所述方法被应用于单胃动物,例如家禽和猎禽。家禽可包括鸡、火鸡、鸭、鹅、珠鸡和走鸟(ratite)(例如鸵鸟和鸸鹋)。猎禽可包括鹌鹑、欧石鸡(chukar)、雉鸡、松鸡、童子鸡(cornishhens)和鹧鸪。鸡指肉用鸡,其包括经饲养用于屠宰的鸡(也称肉鸡)和产蛋鸡(其是用于生产供人消费的蛋的鸡)。在另一个实施方式中,所述方法可被应用于哺乳动物,例如猪。在另外的实施方式中,所述方法可被应用于多胃动物,例如牛、山羊和绵羊,其在本申请中也称为反刍动物。在一个实施方式中,可将本发明的组合物饲喂给幼年反刍动物(preruminants)以增强其健康,尤其是,减少这些动物中腹泻的发病率。幼年反刍动物是年龄为从出生到约12周范围内的反刍动物,包括小牛。本发明的组合物可与乳替代品联合施用于幼年反刍动物。乳替代品指在幼年反刍动物的乳饲喂阶段意在取代初乳的配制饲料。一方面,本发明的组合物是在饲喂前加入受试动物的饲料或饮用水中的饲料添加剂。在这种情况下,如上所述,可将所述组合物与载体(例如碳酸钙或乳清蛋白)一起配制。在本发明的一个方面,此类载体为疏水的。在另一个方面,包含枯草芽孢杆菌qst713、其突变体、qst713及其突变体的无细胞制备物、以及qst713及其突变体的代谢物的组合物可与促进和维持动物生长所需的动物饲料成分相组合而被配制。此类动物饲料成分可包括下列的一种或多种:蛋白质、碳水化合物、脂肪、维生素、矿物质、抗球虫药、基于酸的产品和/或药物(例如抗生素)。在一些实施方式中,还将存在载体(例如上面所述的载体)。促进和维持动物生长所需的蛋白质和碳水化合物应被称为饲料蛋白质和饲料碳水化合物,以将其与任何可能从细菌发酵过程中余留的残余蛋白质和/或碳水化合物区分开。另一方面,包含枯草芽孢杆菌qst713、其突变体、qst713及其突变体的无细胞制备物,以及qst713及其突变体的代谢物的本发明组合物可进一步包括其他益生菌,例如饲喂给动物以增强动物健康或改善动物的一般身体状况的其他芽孢杆菌品种及菌株。示例性的菌株包括由kemin所售的、商标为的枯草芽孢杆菌pb6(如美国专利no.7,247,299中所述、并以atcc编号pta-6737保藏),或由calpis作为所售的枯草芽孢杆菌c-3102(如美国专利no.4,919,936中所述,作为fermbp-1096保藏于日本工业科学与技术局的发酵研究所),或由chr.hansen所售的、商标为的藓样芽孢杆菌与枯草芽孢杆菌孢子的混合物,凝结芽孢杆菌(包括美国专利no.6,849,256中所描述的菌株),藓样芽孢杆菌,迟缓芽孢杆菌(bacilluslentus),短小芽孢杆菌(bacilluspumilus),侧孢芽孢杆菌(bacilluslaterosporus)和蜂房芽孢杆菌(bacillusalvei)。其他非芽孢杆菌益生菌(例如酿酒酵母(saccharomycescerevisiae))也可用于本发明的组合物中。如果此类其他益生菌未被配制为本发明的组合物的一部分,其可与本发明的组合物一起被施用(同时施用或在不同时间施用)。另一方面,本发明的组合物可包含下列物质或与下列物质一起施用(同时施用或在不同时间施用):帮助饲料消化的酶(例如淀粉酶、葡聚醣酶、葡糖淀粉酶、纤维素酶、木聚醣酶、葡聚醣酶、淀粉酶及果胶酶);免疫调节剂,例如抗体、细胞因子、喷雾干燥的血浆;白介素、干扰素;和/或寡糖,例如寡聚果糖、寡聚甘露糖、寡聚半乳糖、菊糖、富含果寡糖的菊糖、塔格糖和聚葡萄糖。在其中所述组合物包含qst713或其突变体的实施方式中,细菌应以有效增强动物健康的量被添加到饲料或饮用水中并饲喂给动物。在一个实施方式中,可以约1x104cfu枯草芽孢杆菌/g饲料或ml饮用水至约1x1010枯草芽孢杆菌/g饲料或ml饮用水的包含率加入所述细菌。在另一个实施方式中应施用约1x105cfu枯草芽孢杆菌/g饲料或ml饮用水至约1x109枯草芽孢杆菌/g饲料或ml饮用水。在又一个实施方式中应施用约1x105cfu枯草芽孢杆菌/g饲料或ml饮用水至约1x109枯草芽孢杆菌/g饲料或ml饮用水。在又一个实施方式中应施用约1x106cfu枯草芽孢杆菌/g饲料或ml饮用水至约1x108枯草芽孢杆菌/g饲料或ml饮用水。在一些实施方式中,所述包含率为约1x103cfu枯草芽孢杆菌/g饲料或ml饮用水,或约1x104、或约1x105、或约1x106、或约1x107、或约1x108、或约1x109、或约1x1010、或约1x1011cfu枯草芽孢杆菌/g饲料或ml饮用水。在其中含有qst713或其突变体的组合物以饲料添加剂的形式提供的实施方式中,此类组合物应含有在加入动物饲料或饮用水中时允许稀释到上述范围的cfu计数。包含枯草芽孢杆菌qst713或其突变体、其无细胞制备物、或其代谢物的组合物可在造粒过程之前被加入动物饲料中,从而使上述方法中所用的组合物形成动物饲料丸粒的一部分。在这方面,如果将细菌细胞用于所述组合物中,其通常在造粒过程之前以孢子形式被加至动物饲料的其他组分中。可使用本领域技术人员已知的标准造粒过程,包括干燥或半湿润饲料的挤出加工。在一些实施方式中,所述造粒过程涉及的温度为至少约65℃。在其他实施方式中,造粒温度为约65℃至约120℃。在另外的实施方式中,造粒温度为约80℃至约100℃。在其他实施方式中,造粒温度为约60℃、约65℃、约70℃、约75℃、约80℃、约85℃、约90℃或约100℃。本发明的组合物还可与药学上可接受的载体组合而作为药物经口施用。用于各种动物的最佳剂量水平可由本领域技术人员通过评估特别是所述组合物的下列能力容易地确定:(i)在不同剂量下抑制或减少肠中的病原性细菌的能力,(ii)增加或维持有益细菌的水平的能力和/或(ii)在不同剂量下增强动物健康的能力。对于水生动物(包括鲑鱼、鳟鱼、虾和观赏鱼),在一个实施方式中,本发明的组合物可以有效增强鱼的健康的量被加入鱼养殖水中(而非加入鱼饲料中,或除了加入鱼饲料中之外)。此有效量可为约104至约1010cfu枯草芽孢杆菌qst713/ml养殖水,或者,在另一个实施方式中为约105至约109cfu枯草芽孢杆菌qst713/ml养殖水,或在又一个实施方式中为约106至约108cfu枯草芽孢杆菌qst713/ml养殖水。下列实施例用于单纯地阐释而非限制本发明的目的。实施例实施例1–qst713的无细胞制备物对抗动物病原体效力的体外研究利用kirby-bauer及最低抑制浓度(mic)技术测试qst713的无细胞制备物对抗梭状芽孢杆菌(产气荚膜梭状芽孢杆菌atcc13124和产气荚膜梭状芽孢杆菌的两种环境分离株);利斯特菌(单核细胞增生利斯特菌atcc19116及19111、斯氏利斯特菌atcc35968及威氏利斯特菌atcc35897);沙门氏菌(肠沙门氏菌atcc10398、亚利桑那沙门氏菌atcc13314及邦戈尔沙门氏菌atcc43975);以及大肠杆菌的抗微生物活性。通过使qst713生长在对应于靶病原体在其中生长的培养基的培养基中,将培养物在23℃,3000rpm离心15分钟并通过0.45μm的nalgene过滤装置对其进行过滤来制备无细胞制备物(如下表1所示)。为了测试热稳定性,在各kirby-bauer和mic测试前将一部分无细胞制备物加热至50℃一小时。表2在kirby-bauer实验中,将2毫米的无菌滤纸盘浸于qst713上清液中并在无菌条件下风干。然后,将这些盘置于靶病原体的菌苔上,过夜孵育并测量抑制区。针对梭状芽孢杆菌和利斯特菌靶标观察抑制区。在mic技术中,在微量滴定板的孔中接种75μl的各靶病原体,稀释至1x105。以1:2、1:10和1:50的最终稀释度将上述无细胞制备物加至各孔中。在37℃下过夜孵育所述板,且od600用wallach微量滴定阅读器进行读取。所述无细胞制备物(经热处理的和未经热处理的)显著有效地对抗梭状芽孢杆菌和利斯特菌靶标,并抑制沙门氏菌和大肠杆菌的生长,虽然在kirby-bauer板上并未观察到这最后二种病原体的抑制区。梭状芽孢杆菌、利斯特菌及沙门氏菌的数据显示在图1-6中。实施例2–qst713对抗各种细菌的效力的体外研究测试枯草芽孢杆菌qst713的粉末制剂对抗下列细菌的各种环境分离株的效力:产气荚膜梭状芽孢杆菌、大肠杆菌、肠炎沙门氏菌、空肠弯曲杆菌和单核细胞增生利斯特菌。如上文的发明详述中所描述的,通过发酵枯草芽孢杆菌qst713,浓缩该发酵培养液及干燥来制备所述粉末制剂。其具有14.6%浓缩的、干燥的培养液及85.4%制剂惰性物质(选自上文描述的可能性),并含有最少约7.3x109cfu枯草芽孢杆菌/g和最多约1x1010cfu枯草芽孢杆菌/g。此制剂在本申请中应称为组合物1。通过将0.2g所配制的粉末加入1.8ml无菌蒸馏水中,从而使所述溶液含有约1x109cfu枯草芽孢杆菌/ml,来制备组合物1的储液。将测试生物体划在含有5%山羊血的胰酶解大豆酪蛋白胨琼脂上,将至多4种生物体划在单一琼脂板上,各生物体以单一线平分琼脂板。允许所述生物体干燥过夜。然后,以上述所配制的qst713悬浮液在经接种的板上划线,垂直于测试生物体擦抹。在campy气体气氛(10%co2,5%o2,8%n2)中,于41±2℃下,过夜孵育产气荚膜梭状芽孢杆菌和空肠弯曲杆菌分离株。无campy气体,在36±2℃下,过夜孵育其他好氧分离株。qst713引起对数种产气荚膜梭状芽孢杆菌、肠炎沙门氏菌、空肠弯曲杆菌及单核细胞增生利斯特菌的分离株的抑制,虽然不抑制大肠杆菌。此外,在某些情况下,枯草芽孢杆菌qst713显示出对于病原性细菌的侵略性竞争性过度生长。结果总结在下表中。表中所记录的抑制区是从芽孢杆菌的生长边缘测量至测试生物体的生长起始处。此外,产气荚膜梭状芽孢杆菌和空肠弯曲杆菌板的照片分别显示在图7和图8中。表3实施例3-在肉鸡中对qst713的体内研究将组合物1加入肉鸡的起始和结束饮食中并观察重量增加和饲料效率。将252只jumbocornishcross肉鸡随机分为4组并饲喂以下列饮食之一。仅基础饮食-对照基础饮食+(0.5g/kg;106cfu/g)(在下表中称为cs)基础饮食+0.05%组合物1(0.5g/kg;106cfu/g)(在下表中称为组合物1-106)基础饮食+0.0005%组合物1(0.5mg/kg;103cfu/g)(在下表中称为组合物1-103)所述基础饮食由用于第1-22天的下列起始饮食和用于第22-42天的下列结束饮食组成。表4–用于肉鸡的起始(第1至21天)和结束(第22至42天)基础饮食的成分组成成分%起始结束玉米45.649.2大豆粉(48%cp)23.516.8干酒糟5.05.0玉米麸粉2.04.0鱼粉1.02.5紫花苜蓿粉--0.5维生素、矿物质、其他22.922.0表5中的下列结果显示,组合物1在106cfu/g的水平下改善禽类的重量增加。在21-42天期间及全部生长期(1-42天)中饲料效率得到改善。下列图表中,adg指平均日增重,adfi指平均日饲料摄入。表5-饮食治疗对肉鸡表现的影响实施例4–qst713在饲料制粒过程中的稳定性为了测定枯草芽孢杆菌qst713在动物饲料造粒过程中的稳定性,制备含组合物1的动物饲料丸粒并在各种温度下测试样品。对照饲料含有表6中所示的成分,而实验饲料被补充以8%的组合物1。表6在foberg混合器中、在环境温度下混合成分,然后加热至各靶温度并将其在该温度维持约30秒,再将其以约2000lbs/小时通过5/32”x11/4”的制粒模(pelletdie)进行造粒。从整个混合器的10个不同的地方取10个样品。在65℃、75℃、80℃及85℃的靶温度下从同一750磅的批次中取丸粒样品。将混合物样品稀释并静置5分钟至其完全湿润。将丸粒样品在磷酸盐缓冲液中浸泡30分钟,以回收qst713细胞。将经稀释的样品进行涂板以确定菌落形成单位。如下表7所示,从混合物至造粒阶段的菌落形成单位减少不明显。表7实施例5-在猪中对qst71的体内研究利用750头乳猪设置中的猪进行使用饲料丸粒形式的qst713的试验。在将饲料通过标准过程进行造粒前将组合物1加入饲料中。标准造粒过程之前和之后对qst713的cfu的研究与上述实施例4中所得的结果相符,并显示出qst713的cfu在造粒后并没有显著减少。近似起始重量/猪为10lbs,目标是使猪增长至约40lbs。将由没有任何抗生素或芽孢杆菌的标准饮食组成的对照处理饲喂给约250头猪。另250头猪接受标准饮食加上1x106cfu枯草芽孢杆菌qst713/g饲料。第三组的250头猪则被饲喂1x107cfu枯草芽孢杆菌qst713/g饲料。与对照组相比,第三组中被剔除的猪的数目明显减少。剔除的实施涉及将不太健康或大小不足的猪从饲喂中移除,给予其治疗产品或使其安乐死。实施例6-在家禽中对qst713的体内研究利用肉鸡进行使用组合物1作为饲料添加剂的试验,每窝地面圈栏使用50只禽类,每次治疗使用6个圈栏。将组合物1以每吨饲料中91克组合物1的比例(约6.64x1011cfu/吨)加入家禽的标准饲料(不含其他益生菌或抗生素)中。在研究的第19、20和21天以产气荚膜梭状芽孢杆菌攻击对照组之一以及施用了补充以组合物1的饲料的禽类组。在整个研究中记录重量并显示在下表8中。确定了饲料效率并以饲料转化率记录在下表9中。以死亡的和移除的禽的重量调整饲料转化率。在此研究的第22天,自各圈栏选出5只禽类,杀死并称重,并检测出现坏死性肠炎(ne)损伤的程度。基于0到3的记分等级对ne进行计分,0为正常而3为最严重。在表8和9中,栏中具有不同上标的平均值差异显著(p<.05)。sem为lsmeans的标准误差。表8.在产气荚膜梭状芽孢杆菌的攻击模式中,饮食治疗对同窝地面圈栏中的肉鸡重量增加的影响表9.在产气荚膜梭状芽孢杆菌的攻击模式中,饮食治疗对同窝地面圈栏中的肉鸡的饲料转化率及坏死性肠炎损伤的影响实施例7–组合物2用于各种研究利用枯草芽孢杆菌qst713的第二种制剂进行试验,以测试生长表现的改善。均如上文所述,通过发酵、浓缩该发酵培养液、干燥并通过渗滤过程清洗以去除残余的发酵培养基和代谢物来制备此粉末制剂,从而使得所述组合物主要包含细胞-主要是孢子和一些营养细胞。此组合物含有14.6%浓缩的、干燥的经清洗的培养物及85.4%制剂惰性物质(选自上面发明详述中所描述的可能性)及约1.0x1010cfu枯草芽孢杆菌/g,且在本申请中应称为组合物2。在实施例3-6中所述的试验中以组合物2代替组合物1且预料结果将与以组合物1所达到的结果相同。实施例8-qst713孢子在海水中的生存力测试组合物1以确定在海水和nacl中的生存力。以三种浓度制备的人工海水;10ppt、30ppt、50ppt;每种浓度为25ml的4管。制备具三种nacl浓度的营养培养液;1%、3%及5%;每种浓度为25ml的4管。在接种前将海水及营养培养液均通过高压灭菌消毒。将0.5g组合物1溶解在10mldi水中以制备组合物1的悬浮液。将等分的(0.5ml)悬浮液接种在所述三种浓度的海水及培养液的每一种中。估计管中含有>107cfu/ml(cfu=菌落形成单位)。制备1%营养培养液和1%nacl的稀释瓶(每瓶99ml)并通过高压灭菌消毒。根据制造商的说明制备营养琼脂;制备15x100mm的板用于板计数测试,1个板/测试加上未经接种的对照。将管在摇动培养箱中,以125rpm在28℃下孵育14天。在第0、2、10天取用于次培养的样品。在第0天测试所有的管;在第2及10天仅测试海水和nacl的2种最高浓度。通过在第0天将10μl原始管中的稀释液(=10-2稀释),以及在第2及10天将100μl在1%营养培养液/1%nacl中配制的10-2和10-4稀释液进行涂板以获得平板计数。因此,所得的计数实际上在10-3和10-5的水平。将板在28℃孵育。在24和48hr观察菌落。利用spectronic20d+仪器,以12x75聚苯乙烯级分收集管作为比色皿,通过在660波长下测量各样品的吸光率来获得浊度读数。测试样品在第0天、通过从各管制备1:10的稀释液(将0.5ml加入4.5ml的1%盐水中,并在第2和10天时测试5ml的10-2和10-4稀释液的24hr次培养液)而被制成。此外,浊度读数在将第2天的稀释液孵育第8天时获得。平板培养及浊度读数均表示孢子持续至少10天,伴以很少的数目减少或无数目减少。在24和48hr时读取培养板。在24hr时,10-3板均以细菌生长而铺满。10-5板较淡,但仍有个菌落/板。48hr时,所有的板均有大量的汇合生长,因此,在原始管中为超过108cfu/ml。第0、2及10天维持此数目。在一浓度范围的海水或nacl中生长的培养物中未观察到差异。组合物1的培养物在所测试的所有范围内均生长良好。在未经接种的海水或在含有nacl的营养培养液中,在任何时候均无生长。浊度测试(吸光率读数)给出类似的结果,但更难以解释。不能对原始管直接进行读数,因其太混浊,尤其在最高浓度的海水时。使用1:10的稀释液来获得第0天的读数。第2和10天,在用于接种培养板的稀释液上读数,且可从稀释瓶中取得。由于第2和第10天的估计数目高于108/ml,有很少、或没有任何归因于盐水浓度的对生长的不利影响。在3种浓度(10ppt、30ppt和50ppt)的人工海水及营养培养液中的3种nacl浓度(1%、3%及5%)中测试组合物1的持久性。益生菌在所有浓度下生长且以大于108/ml的高数量存活至少10天。海水或培养液中的盐浓度不影响孢子萌发和生长的能力。实施例9-在鳟鱼中对qst713的体内研究将约14g的虹鳟鱼分为两组,每组各20条鱼。以标准鱼饲料饲喂对照组,而治疗组接受鱼饲料及1x106cfu枯草芽孢杆菌qst713/g饲料。与对照组相比,预期治疗组显示体重增加。实施例10-在虾中的体内研究为了确定qst713对抗对虾科(penaedae)和长臂虾科(palaemonidae)的虾和对虾的已知病原体的抑制作用,测试组合物1和2对抗分离自养殖虾的三种细菌病原体:副溶血性弧菌(vibrioparahaemolyticus)、溶藻弧菌(v.alginolyticus)和创伤弧菌(v.vulnificus),以及来自虾的病原性真菌,茄病镰刀菌(fusariumsolani)。通过将0.2g所配制的粉末加入1.8ml无菌蒸馏水中来制备组合物1和组合物2的储液,从而各溶液含有约1x109cfu枯草芽孢杆菌/ml。将来自生长在萨布罗右旋糖(sabouraud-dextrose)琼脂上的茄病镰刀菌的5天大培养物的分生孢子收集在无菌2%nacl中。使弧菌在37℃的luria液体培养基(luriabrothmedium)上生长。于30℃、在马-欣二氏琼脂(muellerhintonagar)或海洋2216液体培养基上富集海洋细菌亚株,然后在30℃下、在补充以1-3%nacl的胰蛋白酶大豆培养液(tsb)中进行培养。在42℃,使副溶血性弧菌菌株选择性地生长在硫代硫酸盐柠檬酸盐胆盐琼脂上,然后于30℃、在补充以3%nacl的tsb上培养。将测试生物体弧菌和镰刀菌(fusarium)在单一的支持性琼脂板上划线(各在平分琼脂板的单一线上)。允许生物体干燥过夜。然后,以上述的组合物1或组合物2的悬浮液在二组经接种的琼脂板上划线,垂直于测试生物体擦抹。将经划线的板在36±2℃下孵育过夜。预期qst713引起对数种病原性弧菌和镰刀菌分离株的抑制。此外,在某些情况下,预期枯草芽孢杆菌qst713显示对于病原性细菌的侵略性竞争性过度生长。除非另有规定,本申请中的所有技术和科学术语具有与本发明所属领域中的普通技术人员所通常理解的相同的含义。虽然任何类似或等同于本申请中所描述的方法和材料的方法与材料均可用于实施或测试本发明,优选的方法和材料为本申请中所述的。所有引用的出版物、专利和专利出版物均在本申请中,为一切目的,以其全部通过引用而并入。本申请中所讨论的出版物仅以其在本申请递交日之前的公开而被提供。本申请中的任何内容均不应被解释为承认本发明不能由于在先发明而有权先于此类出版物。虽然联系了本发明的特定实施方式来对其进行描述,将会理解,能够进行进一步的修改,且本申请意在涵盖任何一般而言依循本发明的原理的变化、用途或改编,且包括这样的偏离当前公开的内容:其在本发明所属领域的已知或惯常操作内、且可用于此前所示的关键特征,并遵循所附的权利要求的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1