一种新型GLP‑1受体激动剂的制备方法及其在神经退行性疾病治疗领域的应用与流程
本发明属于生物医药技术领域,尤其是涉及一种新型GLP-1受体激动剂及其在神经退行性疾病治疗领域中的应用。
背景技术:
神经退行性疾病是一类进行性发展的致残严重可致死的复杂疾病,可分为急性神经退行性病和慢性神经退行性病,前者主要包括中风(stroke)、脑损伤(brain injury);后者主要包括阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病(HD)、肌萎缩侧索硬化症(ALS)等,随着时间的推移而恶化,出现功能障碍。这类疾病的脑病理改变主要有两种表现形式:一种是由细胞凋亡引起的大量神经元丢失;另一种则是神经系统没有明显细胞胞体数量减少,但神经细胞出现结构和功能的进行性、退行性变性。随着对神经退行性疾病研究的不断深入,发现越来越多的因素与神经退行性疾病发生和发展有关。其中包括:氧化应激、线粒体功能障碍、兴奋性毒素、免疫炎症、Ca2+失衡、细胞凋亡等衰老基因调控异常,脑代谢障碍等机制。目前神经系统疾病治疗的药物主要有,脑细胞活化剂、神经保护剂(钙离子拮抗剂、抗氧化药物、NMDA受体拮抗剂、抗炎药物、抗凋亡药物)、激素替代疗法,对神经退行性疾病的治疗主要是延缓病情的发展,无法逆转其病情,疗效十分有限。
胰高血糖素样多肽-1(Glucagon-like peptide-1,GLP-1)是近年来具有较高关注度的用于糖尿病治疗的药物,它是由肠粘膜内分泌细胞产生的一种多肽类激素,是胰高血糖素原转录后的修饰产物,由37个氨基酸组成,它有2种活性形式:GLP-1-(7-37)和GLP-1-(7-36)NH2,分子量分别为3355.7和3297.7道尔顿。GLP-1受体属于G蛋白偶联受体B家族中的胰高血糖素受体亚家族,在人和鼠的胰岛、脑以及其它脏器中都有所表达。GLP-1受体激动剂已经成为临床治疗2型糖尿病的重要手段之一。现有已经批准上市的GLP-1受体激动剂有Exenatide(艾塞纳肽)、Liraglutide(利拉鲁肽)、Lixisenatide(利西拉来)、Bydureon(艾塞那肽微球缓释制剂)、Albiglutide(阿必鲁泰)、Dulaglutide(度拉糖肽)等。
近来研究表明GLP-1受体激动剂除具有控制血糖的作用以外,还具有神经保护和抗炎作用。特别地,GLP-1受体激动剂是目前已知唯一的可穿过血脑屏障(blood–brain barrier,BBB)发挥神经保护作用的神经营养因子,在神经退行性疾病治疗领域具有重大的开发潜力。例如,在AD模型动物试验中,艾塞那肽、利拉鲁肽和利西拉来在大脑中可减少Aβ斑块的形成、防止神经突触的损失和记忆损伤,减少氧化压力和炎症对大脑的损伤。在PD动物模型中,艾塞那肽在脑黑质体表现出多巴胺神经保护和在基底神经节的抗多巴胺损失。在Tau蛋白病小鼠模型中,利拉鲁肽减轻病理特异的tau磷酸化负担,减轻后肢抱紧行为的严重程度,降低与抱紧行为相关的致死率[1]。在亨廷顿病动物模型中,艾塞纳肽改善外周葡萄糖调控异常,抑制脑和胰腺中的细胞病理学进程,改善运功机能,延长亨廷顿病小鼠的存活时间,这些临床症状的改善与胰岛和脑细胞中的mhtt(突变亨廷顿)蛋白聚合物减少有关[2]。
基于以上研究成果的进一步临床试验也已经展开。例如,艾塞那肽针对PD的小规模临床II期单盲试验(NCT01174810),每日皮下注射2次,通过对45例中度PD病人的12个月的治疗和2个月的洗脱期,主要研究结果显示,药物组和对照组的MDS-UPDRS(运动障碍的社会统一帕金森病评定量表)运动评分有显著差异;次要结果显示,治疗组的认知效率比对照组有所提高,但与健康相关的生活质量两组没有差异[3]。进一步的随机、双盲、安慰剂对照的艾塞那肽针对PD的临床II期试验(NCT01971242)将在2016年结束。艾塞那肽针对AD的临床试验(NCT01255163)也已经展开,最后一次数据收集时间是2015年12月,但尚未公布结果。利拉鲁肽针对AD的一个小规模随机双盲临床II期试验(NCT01469351)已经完成,主要评价指标是PET扫描检测淀粉样蛋白沉积、脑葡萄糖代谢和WMS-IV(Wechsler Memory Scale,韦氏记忆量表)评价认知功能,结果显示治疗组内的淀粉样蛋白沉积与基线相比没有发生显著变化,治疗组和对照组间的淀粉样蛋白沉积没有显著差异,治疗组的脑葡萄糖代谢水平有所升高但不显著,两组内及两组间的总认知评分均没有发生显著变化[4]。另一项大规模的利拉鲁肽对AD(NCT01843075)的临床II期试验正在进行,旨在评价其安全性和对早期AD患者的有效性,预计最后一次主要数据的收集时间是2016年7月。
根据已公开的临床前或临床阶段的研究数据,现有的GLP-1受体激动剂中的艾塞那肽,利拉鲁肽和利西拉来已经显示出对于神经退行性疾病的治疗潜力。值得注意的是,这3个GLP-1受体激动剂的分子量均小于5000Da,与人源GLP-1分子量相仿。这极有可能是它们仍然能够经由人源GLP-1转运蛋白跨越血脑屏障的重要原因。但由于这些GLP-1受体激动剂在体内的半衰期短,其能够跨越血脑屏障到达脑内的有效浓度低。这有可能是导致这些品种在临床试验中的结果较动物实验不显著的原因。而且,这些品种均需要每日注射,患者依从性差。
目前,拥有更长半衰期的新型GLP-1受体激动剂已经出现,但往往采用传统的HSA(血清白蛋白)/Fc融合或者PEG偶联的长效化技术,远远超过了人源GLP-1的分子量,因此很难跨越血脑屏障,仅能用于2型糖尿病治疗,而无法在神经退行性疾病领域发挥作用。例如,阿必鲁泰是一种每周注射型的长效GLP-1受体激动剂,是2个GLP-1多肽与HSA的融合蛋白,分子量为72970道尔顿。研究表明,阿必鲁泰不能或只能很有限地透过血脑屏障[5],因而无法在中枢神经系统内发挥治疗作用。
近年来出现了一种新型的长效化技术,通过改造non-antibody protein scaffolds来使之获得对于HSA、FcRn、TfR等靶点的亲和力。将这类改造后的scaffolds与GLP-1或艾塞纳肽结合,能够获得显著延长的体内半衰期,达到药效持久的目的。例如:Amylin公司通过化学合成的方法,将[Leu14]艾塞纳肽分别与1400Da的白蛋白结合肽(ABP)和5000Da的白蛋白结合域(ABD)scaffold通过一个三肽偶联(ABP和ABD来自于Affibody AB的ABD035 scaffold),得到的两个新分子在多个种属中对白蛋白的结合力分别为纳摩尔和皮摩尔级别,在大鼠中的单次静脉注射循环半衰期分别为11和16小时[6]。专利ZL201210186485.9在艾塞那肽肽链的末端加上人脂肪酸结合蛋白scaffold,没有对艾塞那肽的活性造成影响,从而允许以融合蛋白的形式针对特定靶点进行筛选[7]。专利201380075612.0在艾塞那肽肽链的末端加上经由人纤连蛋白结构域改造而成的血清白蛋白靶向多肽,可与血清白蛋白可逆性结合,消除半衰期为26小时[8]。特别地,这类scaffolds的分子量(仅有1万-2万道尔顿)仅是人源GLP-1分子的2-4倍。因此,我们推测可以用该类scaffolds产生的长效GLP-1受体激动剂,有效地跨越血脑屏障,在神经退行性疾病治疗领域发挥作用。
参考文献
[1]Hansen HH,Barkholt P,Fabricius K,et al.The GLP-1 receptor agonist liraglutide reduces pathology-specific tau phosphorylation and improves motor function in a transgenic hTauP301L mouse model of tauopathy,Brain Res.2016 Mar 1;1634:158-70
[2]Martin B,Golden E,Carlson OD,et al.Exendin-4 Improves Glycemic Control,Ameliorates Brain and Pancreatic Pathologies,and Extends Survival in a Mouse Model of Huntington’s Disease.Diabetes.2009Feb;58(2):318-28
[3]Aviles-Olmos I,Dickson J,Kefalopoulou Z,et al.Exenatide and the treatment of patients with Parkinson's disease.J Clin Invest.2013 Jun;123(6):2730-6
[4]Gejl M,Gjedde A,Egefjord L,et al.In Alzheimer's Disease,6-Month Treatment with GLP-1 Analog Prevents Decline of Brain Glucose Metabolism:Randomized,Placebo-Controlled,Double-Blind Clinical Trial.Front Aging Neurosci.2016
[5]Bassil F,Fernagut PO,Bezard E,Meissner WG.Insulin,IGF-1and GLP-1 signaling in neurodegenerative disorders:targets for disease modification?Prog Neurobiol 2014 Jul;1181-18
[6]Levy OE,Jodka CM,Ren SS,et al.(2014)Novel Exenatide Analogs with Peptidic Albumin Binding Domains:Potent Anti-Diabetic Agents with Extended Duration of Action.PLoS ONE 9(2):e87704
[7]北京华金瑞清生物医药技术有限公司,一类人工靶向融合蛋白和蛋白偶联物及其制备方法和应用(专利号ZL201210186485.9)
[8]北京华金瑞清生物医药技术有限公司,一种改造非抗体类蛋白产生结合分子的方法、所产生的产品和一种长效GLP-1受体激动剂(专利申请号201380075612.0)
技术实现要素:
本发明选用的是一种基于人纤连蛋白结构域(FN3)改造而成的血清白蛋白靶向多肽与GLP-1受体激动剂结合形成新型GLP-1受体激动剂融合蛋白(EHL)。它是在现有GLP-1受体激动剂分子肽链的末端加上血清白蛋白靶向多肽,可与血清白蛋白(Albumin)可逆性结合,从而达到稳定结构、延长半衰期的目的。经过本发明的方法改造的新型GLP-1受体激动剂,能够通过血脑屏障,在神经退行性疾病领域具有治疗作用。
本发明公开了一种新型GLP-1受体激动剂,该激动剂为GLP-1受体激动剂分子与非抗体蛋白支架基因重组而成的融合蛋白,该融合蛋白能够通过血脑屏障,在中枢神经系统发挥作用。
进一步,所述GLP-1受体激动剂分子与非抗体蛋白支架之间还包括连接分子。
更具体地,所述连接分子为肽类或非肽类分子,分子量在300(Da)-5500(Da)之间。
所述连接分子可以以融合蛋白形式连在一起或者以共轭(conjugation)形式连在一起。
所述连接分子为非多肽分子时,非多肽分子可以是(但并不限于)以下分子之一或任何组合:聚乙二醇、聚丙二醇、(乙烯/丙烯)共聚乙二醇、聚氧乙烯、聚氨酯、聚磷腈、多糖、右旋糖酐、聚乙烯醇、聚乙烯基吡咯烷酮、聚乙烯基乙基醚、聚丙烯酰胺、聚丙烯、聚氰基、脂质聚合物、几丁质、透明质酸和肝素。
所述连接分子为多肽分子时,该多肽可以由天然或非天然氨基酸组成。所述天然氨基酸可以是可以形成蛋白质的天然氨基酸。所述天然氨基酸可以是由遗传密码直接编码的天然氨基酸。
进一步,所述GLP-1受体激动剂分子为艾塞纳肽(SEQ ID:1)。
艾塞那肽是一种GLP-1受体激动剂多肽,由39个氨基酸残基组成,来源于蜥蜴唾液,与GLP-1有53%的同源性,具有较强的生物活性,半衰期延长至了2.4小时。
进一步,所述非抗体蛋白支架来自于人纤连蛋白结构域。
更具体地,所述非抗体蛋白支架来自于改造后的人纤连蛋白结构域,该蛋白支架具有血清白蛋白靶向作用,可与人血清白蛋白可逆性结合。
更具体地,所述非抗体蛋白支架的蛋白序列为SEQ ID:2。
进一步,以上所述GLP-1受体激动剂分子为现有GLP-1受体激动剂的多肽经过氨基酸置换或删除或插入修饰所得的变体;或(和)非抗体蛋白支架为SEQ ID:2经过氨基酸置换或删除或插入修饰所得的变体,所述插入、删除和置换的氨基酸为天然氨基酸。
以上所述新型GLP-1受体激动剂,在神经退行性疾病领域具有治疗作用。
进一步,所述神经退行性疾病领域为阿尔兹海默病。
本发明所述融合蛋白的分子量大于5000Da,能够穿过血脑屏障发挥对神经退行性疾病的治疗作用。更具体地,融合蛋白的分子量大于15000Da。更优选地,5000Da≤融合蛋白的分子量≤25000Da。融合蛋白是借助人源GLP-1转运蛋白跨越血脑屏障,分子量太大会阻碍其穿过血脑屏障,而降低神经保护的作用。
进一步,该融合蛋白可制备成药学上可接受的药物制剂。该制剂还包括药学上可接受的辅料。优选地,制剂中的辅料包括稀释剂、缓冲剂、稳定剂、助溶剂、赋形剂。
所述新型GLP-1受体激动剂的连接分子为肽类时,能够在大肠杆菌胞内可溶表达,并保持生物学活性。
以上融合蛋白的构建和表达方法为:现有的GLP-1受体激动剂分子与非抗体蛋白支架通过基因重组,构建到带有His标签的质粒载体上;然后转入表达性大肠菌株,进行摇瓶表达,得到表达有融合蛋白的菌体。
融合蛋白的纯化方法为:菌体超声破碎,目的蛋白依次通过镍柱亲和层析、离子交换层析纯化,该方法所得到目的蛋白电泳纯度在95%以上。
纯化方法中,在经过离子交换层析纯化前还经过浓缩、脱盐和肠激酶切除标签步骤。具体地,脱盐采用Sephadex G-25脱盐柱。
所述新型GLP-1受体激动剂具体是序列为SEQ ID:3的融合蛋白。
所述新型GLP-1受体激动剂,在小鼠体内的半衰期为21小时。
所述药效通过5XFAD转基因小鼠(转染了人的五种家族遗传性AD突变基因)动物模型进行评估。
本发明所述新型GLP-1受体激动剂对神经退行性疾病具有改善认知障碍和空间记忆能力的作用。
本发明所述新型GLP-1受体激动剂治疗AD转基因小鼠时,每日给药一次,在脑内能够积累药物达到治疗浓度。
所述新型GLP-1受体激动剂治疗神经退行性疾病是通过抑制小鼠脑内Aβ蛋白的产生、促进其降解产生作用。具体为所述新型GLP-1受体激动剂对Aβ蛋白中的Aβ42残基亚型起抑制作用。
所述新型GLP-1受体激动剂通过抑制转基因小鼠脑内小胶质细胞的过度激活发挥作用;具体地,新型GLP-1受体激动剂对小胶质细胞的作用是通过改变小胶质细胞的分型和功能来实现的。更具体地,新型GLP-1受体激动剂下调小鼠脑内M1型激活小胶质细胞的数量及抑制其促炎功能,上调M2型激活小胶质细胞数量及增强其抗炎和吞噬作用。
新型GLP-1受体激动剂可使小鼠脑内M1型小胶质细胞标志分子IFN-γ减少,M2型小胶质细胞标志分子CD204、Arg-1增加,小胶质细胞向M2型转化。
所述新型GLP-1受体激动剂增加小胶质细胞的数量及表面标志物(CD11b、CD86)的表达量,增强其吞噬功能和迁移的能力。
所述新型GLP-1受体激动剂在小鼠脑内,促进抑炎因子的分泌,抑制部分致炎因子的释放,进一步地,所述抑炎因子为TGF-β、IL-12p,所述致炎因子为TNF、MCP-1。
新型GLP-1受体激动剂在小鼠脑内,在mRNA水平影响小胶质细胞的转录,下调炎症介质mRNA的表达量,增加M2型标志物mRNA水平,减少M1型标志物mRNA水平。
所述新型GLP-1受体激动剂在制备预防或治疗或减轻阿尔茨海默病及其他神经退行性疾病如阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩性侧索硬化、不同类型脊髓小脑共济失调、Pick病等中的应用。因神经退行性疾病有共同的发病机理,且GLP-1受体激动剂类药物已证实在神经退行性疾病方面的治疗作用,但是因其半衰期短而在临床试验中未达到满意疗效,而本发明选用新型的白蛋白靶向多肽——非抗体蛋白支架,使其半衰期得到延长,且该融合蛋白可以穿过血脑屏障发挥治疗神经退行性疾病的作用。
Aβ尤其是其可溶性的低聚体形式,具有神经毒性,可导致突触和神经元的变性、丢失。抑制Aβ生成或促进Aβ清除、降低脑内Aβ水平是AD治疗的重要靶点,AD脑内淀粉样蛋白主要是以Aβ40和Aβ42的形式存在,其中,Aβ42比Aβ40具有更强的疏水性,更容易形成纤维化,是构成淀粉样斑块的主要成分,因此,本发明以Aβ作为主要的疗效观察指标,通过测定转基因小鼠脑内老年斑的数量和面积及Aβ40和Aβ42含量的变化,观察新型GLP-1受体激动剂对Aβ代谢的影响。发现新型GLP-1受体激动剂通过抑制小鼠脑内Aβ蛋白的产生、促进其降解产生作用。具体为所述新型GLP-1受体激动剂对Aβ蛋白中的Aβ42残基亚型起抑制作用,发挥神经保护作用的可能机制。
炎症反应是主要神经病理改变之一,提示脑内炎症可能参与了神经退行性疾病的病理过程,也是AD的主要病理机制之一。神经炎症、小胶质细胞的激活在AD发病过程中发挥了不可忽视的作用。Aβ沉积激活小胶质细胞引起的中枢神经系统免疫反应参与AD的发病机制。小胶质细胞(microglia,MG)是中枢神经系统(CNS)内固有的免疫细胞,来源于单核巨噬细胞系统,占中枢神经系统脑实质胶质细胞数量的10%-20%,是中枢的第一道防护屏障。静息状态下的小胶质细胞呈分枝状分布并形成密集的网络,具有高度的活动能力,能够对脑部进行动态扫描,吞噬细胞碎片和有害物质,将抗原呈递给淋巴细胞,维持CNS内环境的稳定。大量研究表明小胶质细胞在神经退行性疾病中起着“双刃剑”的作用:一方面,活化的小胶质细胞能够分泌大量细胞毒性物质如一氧化氮、炎性因子、活性氧自由基等,参与神经元的变性,发挥M1型作用,加速疾病的进展。另一方面,老年斑周围小胶质细胞的聚集和活化是机体对不利因素的自我防御反应,活化的小胶质细胞能够对Aβ发挥吞噬和清除作用,发挥M2型作用,在疾病的进展中起到有利的保护作用。小胶质细胞在AD的不同阶段发挥着不同的功能。因此,本发明通过实验证明:GLP-1对于AD的治疗作用是通过改变小胶质细胞的分型和功能来实现的。
本发明中,新型GLP-1受体激动剂不仅可以显著减少模型小鼠脑内淀粉样斑块的数量和面积,同时也能有效降低脑内可溶性Aβ42的浓度。因此,能作用于不同状态的Aβ淀粉样蛋白,减少其对神经元的毒性作用,应该是新型GLP-1受体激动剂对AD治疗作用显著的主要原因。
采用本发明的方法制备的新型GLP-1受体激动剂,其非抗体蛋白支架部分的分子量为12000Da左右,其连接GLP-1受体激动剂后分子量为16000-20000Da,因此形成的融合蛋白分子量较小,可以穿过血脑屏障而发挥神经保护和治疗退行性神经系统疾病的作用。
利用本发明提供的方法对艾塞那肽进行优化,形成的新型GLP-1受体激动剂半衰期可以达到改构前的10倍,治疗AD转基因小鼠时,可以采取每日腹腔注射一次的方法,大大方便了治疗同时稳定了血药浓度,在脑内能够积累药物达到治疗浓度,这对于AD的治疗是至关重要的,而且本发明所用新型GLP-1受体激动剂为原核表达的蛋白,其生产成本低,工艺简单更适合大规模生产。
本发明中序列为:
SEQ ID:1
HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPS
SEQ ID:2
VSSVPTNLEVVAATPTSLLISWDAPYAYSAAAVDYYRITYGETGGNSPVQEFTVPGSKSTATISGLKPGVDYTITVYAEVRSFCTDWPAEKSCKPLRGKPISINYRT
SEQ ID:3
HGEGTFTSDLSKQMEEEAVRLFIEWLKNGGPSSGAPPPSGTGGSGGGSVSSVPTNLEVVAATPTSLLISWDAPYAYSAAAVDYYRITYGETGGNSPVQEFTVPGSKSTATISGLKPGVDYTITVYAEVRSFCTDWPAEKSCKPLRGKPISINYRT
SEQ ID:4
GGTACCGGCGGTAGCGGCGGTGGATCC
SEQ ID:5
GTTTCTTCTGTTCCGACCAACCTGGAAGTTGTTGCTGCGACCCCGACTAGCCTGCTGATCAGCTGGGATGCGCCTTATGCTTATTCTGCTGCTGCTGTTGATTATTACCGTATCACGTACGGTGAAACCGGTGGTAACTCCCCGGTTCAGGAATTCACTGTACCTGGTTCCAAGTCTACTGCTACCATCAGCGGCCTGAAACCGGGTGTCGACTATACCATCACTGTATACGCTGAAGTTCGTTCTTTCTGCACCGACTGGCCGGCGGAAAAATCTTGCAAACCGCTGCGTGGTAAGCCAATCTCGATTAACTACCGTACCTAA
附图说明
注:图中标记,*p<0.05,**p<0.01,***p<0.001。
图1为新型GLP-1受体激动剂的纯化工艺结果图:A为检测目的蛋白表达情况。1:诱导后总蛋白;2:破菌后不溶蛋白;3:破菌后可溶蛋白;B为酶切前融合蛋白的检测。4:纯化后融合蛋白;C为酶切后融合蛋白的检测。5:EK酶切后;6:粗纯目的蛋白;7:精纯目的蛋白;M:蛋白分子量标准。
图2是新型GLP-1受体激动剂与艾塞那肽的时间-血药浓度图。新型GLP-1受体激动剂半衰期为21小时,艾塞那肽半衰期为2.3小时。
图3是5XFAD转基因小鼠PCR鉴定图。
图4是四组动物行为学实验结果的比较,Morris水迷宫(A-E),新物体识别实验(F)。A为四组小鼠Morris水迷宫寻找隐藏平台路径示意图。B为获得性训练四组小鼠潜伏期的比较。C-D为探索实验中四组小鼠穿越平台次数、目标象限停留时间比例的比较。E为四组小鼠平均游泳速度的比较。F为新物体识别实验中,新物体识别指数的比较。
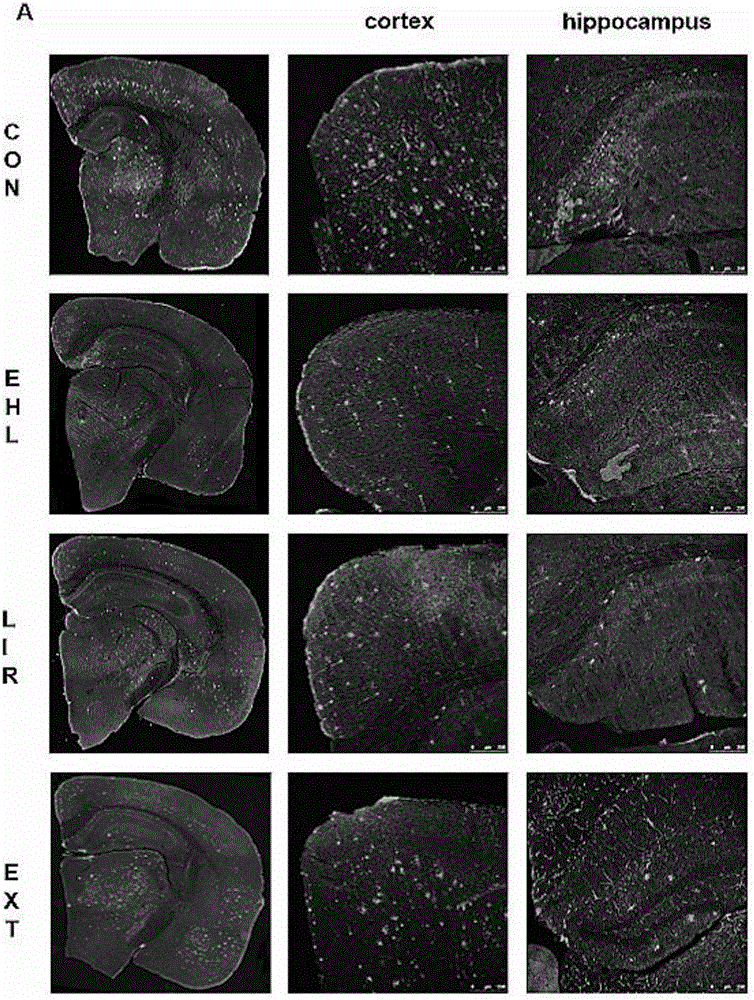
图5是四组7月龄转基因小鼠脑内Aβ沉积的对比图。
图6是四组皮层(A-C)和海马(D-F)Aβ沉积数量、总面积、平均光密度的比较。
图7是四组转基因小鼠脑内可溶性Aβ42及Aβ40浓度的比较。
图8是小胶质细胞免疫荧光染色结果。A为免疫荧光双标小胶质细胞(红色)和Aβ沉积(绿色);B为四组小胶质细胞免疫荧光结果比较;C为小胶质细胞(绿色)与MHC(红色)共定位情况。
图9是四组流式细胞术检测结果比较。A为四组小胶质细胞总比例的比较;B-D为小胶质细胞表面标志物(MHC2、CD204、CD86)的分型结果。
图10是CBA法检测细胞因子(IL-12p、IL-10、MCP-1、IL-6)的结果比较。
图11是ELISA法检测细胞因子(TFG-β、MCP-1、IL-1)的结果比较。
图12是用QPCR的方法检测与小胶质细胞分型相关的表面标志物的基因表达情况。其中IFNG为M1型标志物。CD204、CD206、Arg-1、CHIL3为M2型标志物。
图13是用QPCR的方法测量与小胶质激活相关的表面标志物(CD11b(ITGAM)、CD86、CD74)和GLP-1R的基因表达情况。
图14是用QPCR的方法测量炎症因子(TNF、CCL2、IL-1b、IL-6ra、S100a9、TGF-β)的基因表达情况。
具体实施方式
为了更好地理解本发明,本发明的实施例选择GLP-1受体激动剂的代表药物-艾塞那肽为例,神经退行性疾病的典型病种-阿尔茨海默病为例,说明新型GLP-1受体激动剂的制备方法和在退行性神经系统疾病中的应用。本发明的技术方案并不限定本具体实施例部分。
本实施例选用的阿尔茨海默病模型为5XFAD转基因小鼠。由于转染了人的五种家族遗传性AD突变基因([APPK670N/M671L(Swedish)+I716V(Florida)+V717I(London)+PS1M146L+L286V]),5XFAD转基因小鼠在2月龄左右就出现神经元内Aβ聚集,伴随着胶质细胞活化,随着月龄增加,相继出现淀粉样斑块沉积、神经元退行性改变、神经元丢失,4-6月龄可出现海马依赖的空间记忆障碍,具有大部分的AD病理学和行为学特点,是AD发病机制研究和药物研发较为理想的动物模型。
实施例1新型GLP-1受体激动剂EHL的制备
1.1 EHL表达载体的构建
基因合成EHL重组蛋白的基因序列,艾塞那肽基因序列的3’端通过连接肽(SEQ ID:4)连接到具有血清白蛋白靶向作用的人纤连蛋白结构域突变体(SEQ ID:5)的5’端,得到EHL基因片段,然后构建到带有His标签的表达载体上,转入大肠杆菌。
1.2 EHL的诱导表达
首先对转化有EHL重组质粒的大肠杆菌BL21(DE3)表达菌株,用2YT-Km培养基进行第一次扩大培养),作为种子液。然后按0.1-0.5%的比例,将种子液接种至含2L 2YT培养基的摇瓶中进行第二次发酵培养,生长到对数生长期时加入终浓度为1mM的IPTG后25度进行过夜诱导表达,收集菌体,离心,弃培养基上清,得到胞内表达有EHL融合蛋白的大肠杆菌菌体。
1.3 EHL融合蛋白的纯化
⑴超声破菌
150ml破菌液(50mM Tris,0.5M NaCl,pH7.5)重悬10g菌体并搅匀,超声破碎仪进行冰浴超声破碎,超声3s,间隔3s,超声时间设置为20min。8000r/min,4度离心50min,取上清液,电泳检测蛋白,结果见图1A。
⑵Ni亲和层析捕获
使用10ml GE Ni Sepharose 6 FF介质,用平衡液(配方同上述破菌液)平衡填料,然后将上述上清液上样后,再次用平衡液清洗掉与填料非特异结合的杂质,然后用冲洗液(50mM Tris,0.5M NaCl,150mM咪唑,pH7.4)冲洗掉结合力较弱的杂蛋白,最后用洗脱液洗脱融合蛋白(0.5M NaCl,50mM EDTA,pH7.2),收取洗脱峰溶液,即为融合蛋白,除去了大部分的大肠杆菌宿主蛋白及其他杂质。
⑶肠激酶酶切
首先将上一步的蛋白洗脱液用超滤浓缩管浓缩至约10ml,然后使用150ml GE Sephadex G-25脱盐柱,将上述镍柱洗脱峰溶液,换液至酶切缓冲液(20mM Tris,150mM NaCl,pH7.4)中,得到约20ml换液后蛋白溶液,按照0.8mg蛋白/EU肠激酶的比例加入肠激酶,混匀后4度酶切过夜。
⑷Ni亲和层析粗纯
将步骤⑴中用到的镍柱重生挂镍后,在纯化仪上用平衡液(同酶切缓冲液配方)平衡填料,然后将上述蛋白酶切液上样,然后用平衡液冲洗掉不与填料结合的蛋白,同时收集到约40ml的穿透峰溶液,即为不带组氨酸标签的EHL粗纯品。电泳检测结果见图1B,最后用洗脱液洗脱结合在镍柱上的肠激酶及标签蛋白。
⑸QHP离子交换层析精纯
首先将上一步的穿透峰溶液用超滤浓缩管进行浓缩至约15ml,然后使用GE Sephadex G-25脱盐柱脱盐换液至新的平衡液A(10mM Tris,pH9.0)中,得到蛋白溶液。
选用8ml的GE QHP层析柱,在纯化仪上用平衡液A进行平衡,然后上样,再次平衡至UV平稳后进行线性洗脱:100%平衡液A-100%平衡液B(10mM Tris,1M NaCl,pH9.0),分峰收集洗脱蛋白溶液。15%SDS-PAGE电泳检测后选取纯度最高的部分,即为EHL的纯品。电泳检测结果见图1C,目的蛋白的分子量为16304.1Da。所得重组EHL电泳纯度在95%以上的共计有8.1mg。
1.4 EHL制剂的制备
将EHL原液用原液缓冲液稀释至一定浓度后,加入终浓度为1%的甘露醇后得到EHL半成品,每支西林瓶分装500ul后经过冷冻干燥得到EHL制剂。
实施例2新型GLP-1受体激动剂EHL半衰期检测
2.1实验动物分组及标本制备
(1)选择5月龄雄性SPF级C57BL/6J小鼠,随机分为两组:新型GLP-1受体激动剂组(EHL组)和艾塞那肽组(EXT组),每组5-6只,单次腹腔注射EHL/EXT(125nmol/kg)。于给药后的7个时间点(0.5、1、3、6、12、24、48小时)眼眶取血100μl置于1.5ml离心管,4℃过夜。
(2)1000g离心20分钟,取上清标记、分装,置于-80℃保存,避免反复冻融。
2.2 ELISA检测血清中Exendin-4的浓度
(1)在使用试剂盒(美国PHOENIX公司)之前的25分钟-45分钟,使试剂盒中的所有物件均达到室温条件。
(2)稀释50ml的20×缓冲液,用蒸馏水定容至1000ml。稀释后成1×缓冲液溶液。
(3)用1ml 1×缓冲液离心并稀释多肽标准品,震荡摇匀。如此做出的储存液浓度是1,000ng/ml。使该溶液至少在室温中(20-23度)中静置10分钟,以确保完全溶解。在使用前迅速震荡和离心。
(4)用5ml 1×缓冲液再水化一抗,使其静置至少5分钟以充分溶解,摇匀。用5ml1×缓冲液再水化生物素化多肽,使其静置5分钟以充分溶解,摇匀。用200ul 1×缓冲液离心和再水化阳性对照,使其静置至少5分钟以充分溶解,摇匀。
(5)A1和A2孔留作空白BLANK对照。加50ul 1×缓冲液至B1和B2孔作为总结合。按#5-#1的顺序,分别加入50ul配制好的多肽标准品至C1和C2–G1和G2。将50ul再水化阳性对照加入H1和H2孔位。
(6)将50ul样品加入设定好的孔位中,每个样品加两个孔位。将25ul再水化一抗和25ul再水化生物素化多肽加入各个孔位,A1、A2两个空白孔位不加。
(7)用封板膜封好免疫板。在室温(20-23度)中孵育2个小时。在孵育过程中推荐使用微孔板振荡器于300-400rpm震荡。
(8)离心SA-HRP小瓶(3,000-5,000rpm,5秒),移取12ul加入到12ml的1×缓冲液中,做成SA-HRP溶液,充分震荡。
(9)揭开封板膜,弃孔位里的内容物。用350ul 1×缓冲液洗每一个孔位,弃缓冲液,倒置用吸水纸吸干。重复4次。
(10)加入100ul SA-HRP溶液到每个孔位。再次用封板膜封板。在室温(20-23度)孵育1个小时。
(11)揭开封板膜,弃孔位里的内容物。用350ul 1×缓冲液洗每一个孔位,弃缓冲液,倒置用吸水纸吸干。重复4次。
(12)将100ul TMB底物溶液加进每个孔位。加完后要避光。用封板膜封板。在室温(20-23度)孵育1个小时。
(13)揭去封板膜。将100ul 2N HCL加入每个孔位,以终止反应。孔位内的颜色由蓝变黄。如果颜色不均匀,轻拍微孔板混匀。20min中内在OD450nm下读数。
2.3数据的统计分析及实验结果
计量资料的数据以均值士标准误(stand error,S.E)表示,采用GraphPad Prism 6和SPSS 20统计分析数据。采用Levene检验进行组间方差齐性检验,符合正态性分布及方差齐的数据选择单因素方差分析(one-way ANOVA),并采用Tuke法进行多组间差异性统计(Tukey for post hoc analysis)。方差不齐的组间采用Mann-Whitney U检验。计数资料采用率的卡方检验。P<0.05认为比较组之间具有统计学差异,P<0.01认为比较组之间具有显著统计学差异。
ELISA测量血清中Exendin-4的结果显示见图2
经过半衰期公式计算得出:EXT组的半衰期为2.3小时,EHL组半衰期为21小时,改构后的EHL半衰期明显长于艾塞那肽。
实施例3新型GLP-1受体激动剂对AD模型小鼠的治疗作用
3.1试验用动物及其基因型鉴定
5XFAD转基因小鼠在SPF级动物房中于标准条件下饲养、繁殖。温度控制在25℃±2℃,湿度45%-65%,自由饮食和取水,12:12小时昼夜循环光。新生小鼠于出生后7-14天剪尾用于基因型鉴定,出生后21-24天按性别分笼,每笼不多于5只。选用2-3月龄5XFAD(杂合型,HET)雌性小鼠与C57BL/6J雄性小鼠进行配种。育出5XFAD杂合型(HET)小鼠及野生型(WT)小鼠。5XFAD杂合型雄性小鼠用于实验。
提基因组DNA:
(1)小鼠出生后7-14天剪尾,置于1.5mL EP管中;
(2)配DNA裂解液:ddH2O 10mL+1M NaOH 25μL+0.5M EDTA 5μL;
(3)每个样品加入100μL裂解液,确保组织浸入裂解液,95℃水浴30分钟;
(4)加入100μL中和液(Tris-HCl 0.63g+100mL ddH2O=40mM Tris-HCl),离心机10000rpm离心5分钟;
(5)制备好的DNA样品保存于4℃,长期存放置于-20℃。
PCR所用引物:
PCR后跑琼脂糖凝胶电泳对实验结果进行鉴定,紫外检测仪直接观察条带后,用凝胶成像分析系统处理,剪取1周龄小鼠尾巴进行基因型鉴定。结果(图3)中100bp条带为引物二聚体,608bp条带为转基因(PSEN1)扩增片段,324bp条带为阳性对照扩增片段。图中608bp位置有条带的是转基因鼠,没有条带的是野生型鼠。重复3次,确保PCR结果的可靠性。
3.2行为学检测
选择5月龄雄性5XFAD转基因小鼠,随机分为四组:对照组(CON组)、新型GLP-1受体激动剂组(EHL组)、利拉鲁肽组(LIR组)和艾塞那肽组(EXT组),每组15-16只,每日同一时间(10:00am)腹腔注射药物/生理盐水(25nmol/kg),共治疗8周。给药结束后进行行为学实验。
3.2.1新物体识别实验
新物体识别实验在一个旷场实验装置中进行,旷场区域长40cm、宽40cm、高20cm,四壁为不透明,物体A为红色球形硬塑料玩具,直径约4.5cm,B为黄色方形硬塑料玩具,约4cm×4cm×5cm,两物体均足够重以防止小鼠推动。测试环境在隔音、避光的场所。在测试盒上方以60W白光灯照射使盒内无阴影处。
测试主要分适应期、熟悉期和识别期:
第1天为适应期:在上述条件下,将鼠放入测试盒的中间,盒内未放任何物体,让其自行适应性活动5min。
第2天为熟悉期:在测试盒中放入2个相同的玩具(AA),距离两侧壁8cm,将小鼠背朝物体,从盒中距物体等距离处放入,熟悉10min。记录小鼠与这两个物体接触的情况,包括鼻子或嘴巴触及物体的次数和距离物体2-3cm范围内探究的时间(前爪搭在物体上、鼻子嗅物体、舔物体等均属探究物体,摆个架势或爬到物体上不动不能算是对新物体的探究)。
第3天为识别测试期:用新物体B替换其中一个物体A放入盒内(AB),将小鼠背朝物体,从盒中距物体等距离处放入,观察10min。记录小鼠与这两个物体接触的情况。
每只鼠测试完成后,用酒精擦拭物体以消除鼠停留在物体上的气味,并且按次序轮流调换各物体在盒内的位置,以消除鼠对物体在盒内位置喜好程度不同而带来的影响。采用Ethovision XT软件进行检测和数据分析。对物体的识别能力应用识别指数(Discrimination Index DI)表示,识别指数计算公式为:DI=(N-F)/(N+F),公式中N为在探索新物体所用的时间,F为探索旧物体所用的时间。
3.2.2 Morris水迷宫实验
Morris水迷宫由直径120cm,高50cm的圆筒构成。水温控制在21±1℃,在水中加入奶粉将水搅浑以免让动物看清水下平台。周围墙壁上贴上形状不同的图画,作为小鼠寻找平台的参照物,整个实验期间其位置保持不变。摄像机位于水池中央上方200cm,可记录动物的位置、游泳距离和时间(从而可计算出游泳速度)以及游泳路径等。并应用Ethovision XT监测分析系统进行分析。
(1)获得性训练(Acquisition phase):理论上将水池分为4个象限,直径6cm的平台位于水面下1.0cm,置于其中一个象限区的中央,且始终保持位置不变。将小鼠头朝池壁放入水中,放入位置随机取东、西、南、北四个起始位置之一。小鼠找到隐藏平台的时间即为隐藏平台潜伏期(escape latency,s)。每次训练的上限时间为60s,若小鼠在规定时间内无法找到隐藏平台则潜伏期记录为60s,引导其上平台并在平台上停留10s。将动物移开、擦干。放回笼内。每只动物每天训练3次,两次训练之间间隔15-20min,连续训练5d。
(2)探查训练(probe trial):最后一次获得性训练结束后的第二天,将平台撤除,开始60s的探查训练。将动物由原先平台象限的对侧放入水中。记录动物在目标象限(原先放置平台的象限)所花的时间(time in target quadrant)、穿越原平台的次数(platform crossings)、游泳速度(swimming speed)和游泳路径(path length),以此作为空间记忆的检测指标。
3.2.3 EHL可显著改善5XFAD转基因小鼠空间学习和记忆能力
7月龄5XFAD转基因小鼠存在明显的学习记忆功能障碍。5XFAD转基因小鼠的视空间学习记忆能力严重下降,在Morris水迷宫获得性训练中(图4A,B):EHL和LIR组寻找隐藏平台的路径和潜伏期与CON组相比大大缩短(P<0.01),在探查训练中(图4A):CON组游泳轨迹紊乱,多采用边缘式和随机式寻找平台,盲目游泳的现象明显。而EHL和LIR组转基因小鼠游泳轨迹目的性明显增强,多趋向隐蔽平台;穿越原平台次数(图4C)显著增多(P<0.01),在原平台所在象限探寻时间(图4D)明显延长(P<0.001)。平均游泳速度四组未见差异(图4E)。新物体识别试验(图4F)中,EHL组和LIR组与CON组相比新物体识别指数明显升高(P<0.01)。以上实验结果均证明:EHL和LIR能够有效改善该转基因小鼠的视空间学习和记忆能力。
3.3 EHL对5XFAD转基因小鼠皮层和海马Aβ的沉积的影响
3.3.1脑组织取材及切片
6%水合氯醛,6.0ml/kg体重,腹腔注射麻醉小鼠;固定,腹正中线剪开腹腔和前胸皮肤,向两侧腋中线处剪开胸壁及横隔,暴露心脏;将灌流泵管接针头,接通灌流泵电源,用生理盐水排空管内空气,调整灌流速度至1.0ml/分;右手持针,左手持血管钳,于心尖剪一小口,将针头经左心室插入升主动脉,用血管钳夹住房室沟之间的肌肉。迅速剪开右心耳(心右上方暗红色,如脾脏颜色);灌注37℃0.9%生理盐水,当右心耳流出液变清亮后3分钟,以3.5ml/min速度灌注,约20分钟;动物俯卧位,剪开后颈至鼻尖皮肤,向两侧分离头部皮肤,从眼球后剪断眼球后组织和视神经(以免牵拉脑组织),将皮肤翻至两侧颌下,用弯血管钳夹;剔除后颈肌肉及颞肌。用眼科剪剪开枕骨,分块剪去颅骨和颈椎骨后份;仔细分离硬脑膜,向前至嗅球上鼻骨,向后至颈4椎骨。
取脑:从颈4椎骨处用眼科剪横断脊髓,小平镊抬起脊髓,用眼科剪分离未完全剥离的硬膜,剪断颅底神经,取出整脑;整脑做矢状切,分为左半脑和右半脑,右半脑放入4%PFA溶液中后固定48h;左半脑组织匀浆后分装,-80℃保存。第三天将半脑放入30%蔗糖溶液中过夜,待其完全沉底后,在0.01M PBS中洗2次,-80℃保存。
脑组织切片:冰冻切片机预冷,安装固定刀片,待温度稳定在-20℃时,用蒸馏水冻出冰台,切出平面备用;脑组织从-80℃冰箱中取出,调整角度,蒸馏水包埋,参考小鼠脑立体定位图谱,从前额叶到海马,冠状位切脑片成40μm厚度。脑片置于防冻液,-20℃保存。按照每间隔6张片取1片用于免疫化学染色。
3.3.2免疫组织化学染色
(1)切片自冻存液中取出后,在0.01M PBS中漂洗3次,5-10min/次;
(2)3%H2O2溶液室温(RT)孵育30min;
(3)0.01M PBS中漂洗3次,10min/次;
(4)5%驴血清封闭液室温孵育30min;
(5)小鼠抗Aβ抗体(Abcam)孵育,4℃过夜;
(6)0.01M PBS中漂洗3次,10min/次;
(7)生物素标记的山羊抗小鼠二抗室温孵育2h;
(8)0.01M PBS中漂洗3次,10min/次;
(9)HRP标记的链酶卵白素室温孵育2h;
(10)0.01M PBS中漂洗3次,10min/次;
(11)DAB显色液孵育显色。控制显色程度。转入0.01M PBS终止反应。
(12)将切片贴于载玻片,晾干,二甲苯透明处理数秒,中性树胶封片。
3.3.3免疫荧光染色
(1)切片自冻存液中取出后,在0.01M PBS中漂洗3次,5-10min/次;
(2)5%驴血清封闭液孵育30min,RT;
(3)小鼠抗Aβ/羊抗Iba1/兔抗CD86/兔抗MSR1抗体(Abcam)孵育,4℃过夜;
(6)0.01M PBS中漂洗3次,10min/次;
(8)Alexa Fluor 488/594标记的驴抗小鼠/羊/兔荧光二抗(Earthox)室温避光孵育2h;
(9)0.01M PBS中漂洗3次,10min/次,避光;
(10)将切片贴于载玻片,避光晾干,使用含DAPI封片液封片。
3.3.4实验结果
EHL可显著减少5XFAD转基因小鼠皮层和海马Aβ的沉积。
5XFAD转基因小鼠在2月龄左右就会出现神经元内Aβ聚集,随着月龄的增加,逐渐出现淀粉样斑块沉积。免疫荧光结果显示:7月龄5XFAD小鼠皮层和海马均可见大量的Aβ淀粉样蛋白沉积,EHL组和LIR组皮层和海马Aβ的数量与CON组相比均有所减少(图5)。皮层中(图6A-C),EHL组和LIR组Aβ的数量、总面积和平均光密度与CON组和EXT组相比有显著的下降(P<0.01),且EHL组Aβ的数量和平均光密度均比LIR组显著降低(P<0.01),Aβ的总面积也比LIR组低(P<0.05)。EXT组与CON组相比无统计学差异(P>0.05)。海马中(图6D-F),EHL组Aβ的数量和平均光密度与CON组和EXT组相比有显著下降(P<0.01),LIR组Aβ的总面积与EXT组相比降低(P<0.05)。EXT组与CON组相比无统计学差异(P>0.05)。
综上所述,新型GLP-1受体激动剂和阳性对照药利拉鲁肽均可以有效地减少AD模型小鼠皮层和海马的Aβ沉积,但EHL减少Aβ沉积的效果更加显著。
3.4 EHL对小鼠Aβ40和Aβ42含量的变化
3.4.1 ELISA检测Aβ40/42
(1)新鲜组织称重,以2-4μl/mg组织的比例加入RIPA裂解液,以1:100(体积)的比例加入蛋白酶抑制剂,匀浆,冰上静置2h;4℃17000g离心30min,取上清;
(2)按组织匀浆体积的8倍加入400μl溶解液A,超声匀浆,室温静置4小时,取上清标记、分装,-80℃保存。BCA法测蛋白浓度。
(3)按照1:30倍稀释加入BSAT-DPBS缓冲液中,并加入蛋白酶抑制剂(1:50),低温超速离心机13,000rpm,4℃离心20min,取上清置于冰上。
(4)按照试剂盒(Invitrogen)操作说明,加入50μl标准品和稀释好的样品,加入50μl检测抗体,室温摇3h。
(5)洗涤液洗4次。
(6)加入100μl HRP标记抗兔抗体,室温孵育30min。
(7)洗涤液洗4次。
(8)加入100μl底物溶液,避光孵育30min。
(9)加入100μl终止液,轻轻震荡混匀,450nm条件下读取OD值。
3.4.2实验结果
EHL可有效减少5XFAD转基因小鼠脑内可溶性Aβ42的浓度。
ELISA检测5XFAD转基因小鼠脑内Aβ42及Aβ40浓度的结果显示:EHL组脑内Aβ42的浓度显著低于CON组和EXT组(P<0.01),且低于LIR组(P<0.05)。LIR组脑内Aβ42的浓度与CON组和EXT组相比,没有显著区别(P>0.05)(图7A)。脑内Aβ40的浓度四组无统计学差异(P>0.05)(图7B)。EHL可以有效减少5XFAD小鼠脑内可溶性Aβ42的量,但对可溶性Aβ40作用不大。
综上所述,给予EHL治疗后的5XFAD转基因小鼠与CON组和EXT组相比,认知及记忆功能有明显改善。免疫组化及生化结果显示:无论是淀粉样斑块的数量、总面积和平均光密度还是Aβ42水平,较CON组和EXT组均显著下降,对AD模型小鼠治疗效果明显。
实施例4新型GLP-1受体激动剂对小胶质细胞分型及功能的影响
本实施例研究新型GLP-1受体激动剂对AD转基因动物脑内小胶质细胞的分型,进一步这种分型的结果是否与是通过抑制神经炎症反应有而实现的。具体为通过免疫荧光染色的方法观察了5XFAD转基因小鼠脑内小胶质细胞的活化情况,采用流式细胞术检测了小胶质细胞总比例及其表面标志物水平,通过ELISA及CBA的方法检测炎症因子的蛋白水平,利用real-time PCR的方法检测了5XFAD转基因小鼠脑内与小胶质分型相关的表面标志物的基因表达情况、及其激活相关的表面标志物的基因表达情况和炎症介质的mRNA水平,探讨新型GLP-1受体激动剂对小胶质细胞的分型及功能的影响,探讨其抑炎作用的机制。
计量资料的数据以均值士标准误(stand error,S.E)表示,采用GraphPad Prism 6和SPSS 20统计分析数据。采用Levene检验进行组间方差齐性检验,符合正态性分布及方差齐的数据选择单因素方差分析(one-way ANOVA),并采用Tuke法进行多组间差异性统计(Tukey for post hoc analysis)。方差不齐的组间采用Mann-Whitney U检验。计数资料采用率的卡方检验。P<0.05认为比较组之间具有统计学差异,P<0.01认为比较组之间具有显著统计学差异。
4.1 EHL对5XFAD转基因小鼠脑内活化小胶质细胞的数量的影响
通过免疫荧光染色(方法同实施例2.3.3)和共聚焦显微镜观察5XFAD转基因小鼠脑内活化小胶质细胞的数量。
离子钙接头蛋白1(Ionized calcium binding adaptor molecule 1,Iba1)是小胶质细胞特异性标志物,7月龄5XFAD转基因小鼠脑内可见小胶质细胞活化,表现为胞体增大,突起数量增多、变短、增粗。活化的小胶质细胞分布不均匀,免疫荧光双标结果可见其聚集在淀粉样斑块周围,围绕着淀粉样斑块(图8A)。EHL和LIR组5XFAD转基因鼠脑内活化的小胶质细胞数量明显减少,胞体小,突起数量较少、呈分枝状,呈现未激活状态。EXT组脑内活化的小胶质细胞数量与CON组相当(图8B)。提示:EHL和LIR均可以有效减轻AD小鼠脑内的炎症反应。免疫荧光双标小胶质细胞和表面标志物MHC,可见小胶质细胞与MHC抗原复合物共定位(图8C)。
4.2 EHL对5XFAD转基因小鼠脑内小胶质细胞类型的影响
4.2.1小鼠脑组织的原代分离
6%水合氯醛,6.0ml/kg体重,腹腔注射麻醉小鼠;灌注取脑,置于已加双抗的4℃0.1mM PBS中;体视镜下在PBS缓冲液中轻柔剥离脑膜及血管;PBS冲洗取出的脑组织,用滴管轻轻吹打成细小的组织块,继续轻轻吹打混匀,加入PBS稀释混匀后,室温离心1000rpm 10分钟,弃上清,新鲜培养基重悬。过筛400目筛网后,即成小鼠全脑单细胞悬液。
4.2.2小鼠小胶质细胞原代磁珠纯化方法(阳选法)
(1)将分离获得的C57BL/6小鼠全脑单细胞悬液过筛400目筛网,台盼兰染色计数活细胞数量,室温离心1000rpm 5分钟,弃上清,按每107细胞加入10μl的CD11b(microglia)-microbeads(德国美天旎公司)和90μl磁珠分选用缓冲液,重悬,4℃避光孵育15分钟,每5分钟振荡重悬一次。
(2)加入细胞悬液10倍体积的缓冲液,室温离心1000rpm 10分钟.
(3)弃上清,加入3ml缓冲液重悬细胞。
(4)根据细胞数量,选择并安置相应承载量的LS或MS分选柱、分选架、磁铁及滤膜,下面接废液缸。
(5)LS或MS分选柱每次加液体积分别为3ml和0.5ml,最终推动活塞收集细胞前加液体量分别为5ml和1ml。以LS柱为例:将3ml缓冲液在滤膜上方沿着分选柱管壁边缘缓慢加入分选柱中润柱,排出柱内气体,缓冲液即将流空时加入重悬的细胞悬液,同时拿走废液缸,取一个干净的15ml新离心管放在分选柱下面接阴性成分,此过程中,阳性细胞成份由于磁场的作用留在分选柱中,而阴性细胞成份先行流出。取3ml缓冲液加入取空的原标本试管,目的是尽量回收残留在管壁和管底的细胞。等标本即将走空时,再将这3ml液体加到分选柱上,重复3次,每次3ml。等第三个3ml缓冲液走完后,将分选柱移出分选器,放置在一个新的15ml离心管上。在分选柱内加入5ml缓冲液,用分选柱配备的活塞迅速推出磁性标记细胞,即CD11b+的小胶质细胞。
4.2.3原代磁珠分选小胶质细胞流式细胞检测亚型比例
(1)将分离获得的小鼠原代纯化小胶质细胞进行流式细胞染色:将摇床或小鼠脑匀浆分选所得的纯化小胶质细胞离心,弃上清,加入缓冲液,调整细胞密度为106细胞/100μl悬液,每100μl即为一个染色体系,选择搭配识别不同标记物的流式抗体,包括CD45-percp-Cy5.5/APC、CD11b-FITC、CD204-PE、CD80/86-APC(美国eBioscience公司),4℃避光孵育15分钟,加入3ml缓冲液,1200rpm离心5分钟,洗脱未结合抗体。
(2)弃上清,用300ul缓冲液重悬细胞,流式上机进行小胶质细胞亚型比例鉴定。
4.2.4实验结果
EHL可增加5XFAD转基因小鼠脑内小胶质细胞的数量,但减少其M1型的比例,增加小胶质细胞的吞噬功能。
(1)CD45和CD11b作为巨噬细胞标记物,常用CD45/CD11b流式双标细胞技术检测脑内小胶质细胞。流式检测的结果显示:与CON组相比,EHL组和LIR组CD11b和CD45双阳性的细胞比例明显增加(p<0.05),EXT组与CON组无显著差异(p>0.05)(图9A)。提示:EHL和LIR均能够增加小胶质细胞的比例。
(2)小胶质细胞是中枢神经系统内固有的免疫细胞,来源于单核巨噬细胞系统,在中枢神经系统多种病理情况下,如颅脑损伤、脑缺血、感染、中枢神经系统退行性疾病等,小胶质细胞均可从静息状态迅速活化、增殖,表达并上调主要组织相容性抗原复合物(major histocompatibility complex,MHC)类抗原和补体受体3,引发T细胞介导的免疫反应,同时发挥巨噬细胞的吞噬效应。与CON组相比,EHL组和LIR组MHC II阳性细胞(图9B)的比例明显下降(p<0.05),提示EHL和LIR均能够下调AD诱发的MHCII高表达,可能可以减少MHCII免疫反应的细胞毒作用。
(3)CD204阳性细胞(图9C)的比例四组之间未见统计学差异(p>0.05)。
(4)与CON组相比,EHL组和LIR组CD86阳性细胞的比例明显增加(p<0.05),(图9D)。EXT组与CON组无显著差异(p>0.05)。CD86可以在活化的巨噬细胞表面高表达。提示:EHL和LIR可显著增加小胶质细胞的吞噬能力。
4.3 EHL对5XFAD转基因小鼠脑内炎症因子的蛋白水平的影响
4.3.1 CBA法测量炎症因子浓度
使用BD公司的CBA检测试剂盒,按照说明书进行。
4.3.2 ELISA(按照试剂盒说明书,方法同2.4.1)
4.3.3实验结果
EHL可促进抑炎因子的分泌,抑制部分致炎因子的释放。
(1)CBA的检测结果(图10)显示:与其他三组相比,EHL组的IL-12p的分泌量显著增加(p<0.01),IL-10、MCP-1和IL-6的分泌量四组之间没有统计学差异(p>0.05)。
(2)ELISA的检测结果(图11)显示:与CON组相比,EHL组TGF的分泌量显著增加(p<0.001),EHL组和LIR组MCP-1的分泌量明显减少(p<0.05),IL-1β的分泌量四组之间没有统计学差异(p>0.05)。
TGF-β、IL-10、IL-12既能激活B淋巴细胞,又能抑制炎症反应。这些抗炎细胞因子通过抑制促炎细胞因子(如IL-1β、TNF、趋化因子)的基因表达来发挥其抗炎作用,被称为抑炎细胞因子。
IL-1β(白介素1β)和IL-6(白介素6)均属于促炎症因子,MCP-1(单核细胞趋化因子1)也称作CC趋化因子配体2,CCL2),是一种β趋化因子,在中枢神经系统的急性炎症反应中,MCP-1被认为是重要的因子之一,在神经退行性疾病中,其表达增加是一个显著的特征。
4.4 EHL在mRNA水平对5XFAD转基因小鼠小胶质细胞分型及功能的影响
4.4.1总RNA的提取及品质检验
总RNA的提取:根据试剂盒(总RNA提取试剂盒,天根生物)说明书进行总RNA的提取。
RNA品质检验:取1μl RNA+4μl H2O,得到5μl RNA待测液;取2μl RNA待测液检测RNA浓度、260/280值(>1.70为品质良好);1%的琼脂糖凝胶电泳检测2μl RNA待测液于,紫外光下观察电泳条带。
4.4.2 mRNA反转录为cDNA:invitrogen公司反转录试剂盒,根据说明进行转录,转录后核酸电泳检测。
4.4.3 Realtime-PCR
(1)在20μl体系中加入如下试剂:
cDNA,9μl;
TaqMan Gene Expression Assay(ABI),1μl;
Taqman gene expression master mix(ABI),10μl。
(2)PCR反应条件:
A.50℃,2min;
B.95℃,10min;
C.95℃,15sec,60℃,1min;共40个循环。
4.4.4实验结果
各组mRNA水平检测结果如下:
4.4.4.1 EHL可增加M2型标志物mRNA水平,减少M1型标志物mRNA水平
与CON组相比,LIR组CD206(MRC1)表达量明显增高(p<0.05)(图12B),EHL组和LIR组CD204(MSR1)的表达量显著增高(p<0.01),EXT组CD204(MSR1)的表达量也升高(p<0.05)(图12A)。EHL组和LIR组Arg-1的表达量均增高(p<0.05),但LIR组更显著(p<0.01)(图12C)。CHIL3的表达量四组无显著差异(p>0.05)(图12D)。与CON组相比,EHL组IFN-γ的表达量显著降低(p<0.05),EXT组表达量显著增高(p<0.01)(图12E)。LIR组IFN-γ受体基因表达量与CON组相比也显著降低(p<0.01),EHL组IFN-γ受体表达量与CON组比略有下降,但无明显差异(图12F)。
IFN-γ是小胶质细胞M1型特异性诱导剂,可以激活STAT1磷酸化发挥作用。MR(CD206/MRC1)、CD204(MSR1)、精氨酸酶-1(Arg-1)、几丁质酶3样蛋白(Ym1/CHIL3)等分子是M2型小胶质细胞标记物。
4.4.4.2 EHL可增加小胶质细胞激活及迁移标志物的mRNA表达
与CON组相比,EHL组和LIR组CD11b的表达量均增高(p<0.05),但LIR组更显著(p<0.01)(图13A)。LIR组CD86表达量增高(p<0.05)(图13B)。CD11b和CD86均为巨噬细胞标记物。
EHL组CD74表达量较LIR组明显升高(p<0.05),与CON组相比略有升高但无明显差异,EXT组CD74表达量与EHL组相当(图13C)。
上述结果说明EHL组和LIR组小胶质细胞比例明显增加,并且小胶质细胞吞噬和迁移的能力明显增强。
4.4.4.3 GLP-1受体mRNA表达
与CON组相比,EHL组和LIR组GLP-1R的表达量均增高(p<0.05),但LIR组更显著(p<0.01)(图13D)。有文献研究表明,LIR通过与GLP-1受体结合激活cAMP/PKA/CREB通路发挥神经保护作用。EHL和LIR组GLP-1R基因表达上调,说明在本实施例中EHL和LIR可能通过与GLP-1受体结合,激活cAMP/PKA/CREB通路发挥类似的神经保护作用。
4.4.4.4 EHL可部分减少致炎因子mRNA表达。
与CON组相比,EHL组TNF、MCP-1的表达量均明显降低(p<0.01,p<0.05),IL-1β、IL-6、IL-12a、S100a9及TGF-β四组间均未见统计学差异(图14)。IL-10因扩增循环均大于35个,无法纳入统计。
如3.3.3所述,MCP-1、IL-1β、IL-6均为致炎因子,IL-12a、TGF-β、IL-10均为抑炎因子,此外,TNF和S100a9也属致炎因子。
QPCR结果提示:EHL和LIR能有效减少致炎因子的表达量,促进小胶质细胞向M2型转化。增加小胶质细胞激活及迁移表面标志物的表达,增强其吞噬和迁移功能。
本发明实施例小结如下:
5XFAD转基因小鼠脑内小胶质细胞活化,聚集在淀粉样斑块周围。新型GLP-1受体激动剂可以抑制小胶质细胞的过度激活。流式细胞检测结果显示,LIR组和EHL组CD86阳性细胞比例增加,PCR结果显示LIR组和EHL组CD86基因表达量上调与流式细胞检测结果相一致;表明LIR和EHL可以显著增加小胶质细胞吞噬能力。CD204在四组间无明显差异,但LIR组和EHL组CD204基因表达量明显上调。综上结果说明,EHL虽然增加了小胶质细胞的总量,但活化的小胶质细胞数量明显减少,且可以有效减少M1型小胶质细胞的比例,增加M2型小胶质细胞比例。
CBA试剂盒检测结果显示,EHL组与其他三组相比抑炎症细胞因子IL-12p分泌明显增加;ELISA试剂盒检测结果显示,EHL组与其他三组相比抑炎症细胞因子TGF分泌明显增加,EHL和LIR组促炎症细胞因子MCP-1分泌明显低于CON组;PCR结果显示EHL组MCP-1和TNF基因表达量明显下调,在基因水平上证明了EHL可以明显减少MCP-1分泌。综上结果说明,EHL可以有效下调促炎症因子TNF和MCP-1的表达水平,显著上调抑炎细胞因子TGF和IL-12p表达水平,从而减少炎症反应。
以上对本发明的几个实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
- 还没有人留言评论。精彩留言会获得点赞!