一种负载索拉菲尼/siRNA的介孔二氧化硅‑乳糖醛酸靶向纳米颗粒的制作方法
本发明属于抗肿瘤药物制备领域,具体涉及一种负载索拉菲尼/sirna的介孔二氧化硅-乳糖醛酸靶向纳米颗粒及其应用。
背景技术:
近几十年以来,全球环境的恶化导致癌症的发病率越来越高,每年死于癌症的人数高达880万人。目前,化疗依旧是治疗癌症的主要方法。然而,治疗癌症所用的化疗药物大都存在缺少靶向性、多耐药性和生物利用率低的缺陷,这些缺陷在很大程度上限制了他们的临床使用;因而新型给药系统一直是医药学领域研究的热点。
索拉菲尼是一种可以靶向多种生长因子受体的多重激酶抑制剂,包括vegfr-1、vegfr-2、vegfr-3、pdgfr-b、c-kit、flt-3和ret等,其结构式为:
rna干扰(rnainterference,rnai)是指双链rna(double-strandedrna,dsrna)经由特异性核酸内切酶dicer加工成为一种21-25个核苷酸的小分子rna(sirna),sirna通过与靶mrna编码区或utr区完全配对,降解靶mrna,引起基因转录后沉默。rnai技术具有简单、快速、特异性沉默任意基因的特点,使其被广泛用来研究肿瘤、肺动脉高压、先天性遗传病等疾病的靶点治疗,并取得了一定成果。但sirna在血清的环境下很容易被降解,以致其难以在细胞中发挥其rnai作用。此外,游离的sirna无法进入细胞中,需要进行化学修饰或者纳米颗粒负载才能有效进入细胞发挥作用。但鉴于化学修饰的sirna可能会丧失活性,因此,设计合适的载体以提高sirna的治疗效果受到了极大的关注。
介孔二氧化硅纳米材料是一种新型的无机高分子药物载体。它的主要特点是:(1)粒子具有极大的表面积及孔道容量,总比表面积>900m2/g,孔容量>0.9cm3/g,提供了较大的存储和反应空间;(2)粒径可调节,易被肿瘤细胞吞噬,无明显的细胞学毒性,体外生物相容性好;(3)孔径在2nm~10nm间,大小可调节,可通过改变孔径进而调节载药量;(4)具有内表面和外表面,可进行功能化修饰进而制备性能优良的杂化载体。这些特性使介孔二氧化硅纳米粒子拥有巨大的潜在应用价值。
乳糖醛酸(la)是乳糖氧化产生的活性生物分子,其结构式为:
2012年,hartonno,s.b.等(acsnano,6卷,2104页,2012年)合成大孔径(孔径大于10nm)的氧化硅纳米颗粒,并成功在颗粒外表面和孔道内修饰正电性的高分子材料多聚左旋赖氨酸pll(poly-l-lysine),并通过静电作用吸附sirna实现sirna干扰,但是该纳米药物载体输送sirna的效率比较低,且颗粒在低浓度时具备较大毒性,生物相容性不高。专利cn105056239a公布了一种介孔二氧化硅负载药物和sirna的复合材料及其制备和在制备抗癌药物中的应用,通过以负载药物作用的介孔二氧化硅为核,表面通过二硫键连接sirna进行介孔封堵,同时起到负载药物sirna的作用。该纳米材料进入细胞后可以通过癌细胞内高表达的谷胱甘肽响应引起二硫键断裂同时释放出药物和sirna,提高了sirna的稳定性,生物相容性较好,但是其在进入癌细胞前没有很好的靶向作用,不能提高癌细胞对该纳米材料的摄取。此外,专利cn104027821a提供了一种输送sirna的纳米颗粒,其在介孔二氧化硅的表面修饰了聚乙二醇和多肽分子,不仅提高了生物相容性,而且极大的提高了sirna的干扰作用。但是,与专利cn105056239a相似,由于靶向分子的缺乏,包载药物的纳米材料不能实现在肿瘤细胞表面的高度富集,不能得到最佳的疗效。
技术实现要素:
本发明的目的在于提供一种具有靶向抗癌作用的负载有索拉菲尼/sirna的介孔二氧化硅-乳糖醛酸载药纳米颗粒,其通过将sirna吸附到介孔二氧化硅外表面,以提高sirna稳定性,并利用乳糖醛酸对癌细胞的靶向作用,提高索拉菲尼的抗肿瘤活性。
为实现上述目的,本发明采用如下技术方案:
一种负载索拉菲尼/sirna的介孔二氧化硅-乳糖醛酸靶向纳米颗粒,其制备方法包括以下步骤:
1)制备粒径约为100nm的介孔二氧化硅纳米颗粒(msn);
2)将所得介孔二氧化硅纳米颗粒溶于无水乙醇中,加入纳米颗粒重量0.4%的3-氨丙基三乙氧基硅烷,室温搅拌12h后离心,经乙醇洗涤、冷冻干燥,得到表面氨基修饰的介孔二氧化硅纳米颗粒(msn-nh2);
3)将所得msn-nh2溶解在丙酮中,室温下搅拌1h后加入索拉菲尼,再搅拌30min,然后于13000rpm下离心30min,弃去上清液,所得沉淀用去离子水洗涤,冷冻干燥,即得负载索拉菲尼的介孔二氧化硅纳米颗粒(so@msn);其中,氨基化修饰后的介孔二氧化硅与索拉菲尼的重量比为3:2;
4)以n,n-二甲基甲酰胺为溶剂,加入so@msn、edc和nhs(三者重量比为3:10:4),室温下搅拌4h后,按体积比4:1加入质量浓度为2%的乳糖醛酸溶液,继续搅拌12h,然后离心,经去离子水洗涤后冷冻干燥,制得负载索拉菲尼的介孔二氧化硅-乳糖醛酸纳米颗粒(so@msn-la);
5)将so@msn-la加入丙酮中,超声分散10min,然后按质量体积比1:3g/l在溶液中加入sirna,搅拌20min,即得所述靶向纳米颗粒(so/sirna@msn-la)。
步骤4)中所述乳糖醛酸溶液是将40mg乳糖醛酸、100mg二氯乙烷和0.1molmes(ph=6)于室温下搅拌24h制得。
鉴于现有技术的不足,本发明将索拉菲尼负载到介孔二氧化硅的内孔道里,并通过共价键将乳糖醛酸偶联到介孔二氧化硅外表面,最后通过静电电荷作用将sirna吸附到介孔二氧化硅外表面。这一方面提高了sirna的稳定性和载药系统的生物相容性,让其可进入细胞内充分发挥作用;另一方面,乳糖醛酸的高效靶向抗癌作用也可以提高索拉菲尼的抗肿瘤效果。因此,本发明所得靶向纳米颗粒可用于制成肿瘤治疗的靶向药物。
本发明的优点在于:
1、本发明以介孔二氧化硅作为sirna的载体,可显著增强sirna的稳定性,提高了其沉默基因的效率;
2、本发明采用乳糖醛酸为靶向分子,能使索拉菲尼在癌细胞周围富集,并能显著提高细胞对药物的摄取率,从而在提高索拉菲尼抗肿瘤效果的同时,降低了索拉菲尼对正常组织的毒副作用;
3、本发明所构建的纳米载药系统也适用于除索拉菲尼外的其他毒副作用大或者难溶性的抗癌药;
4、本发明所设计的载药体系制备方法简单、材料易得,有利于进一步扩大制备产量。
附图说明
图1为实施例1所制备的介孔二氧化硅纳米颗粒(msn)的tem图。
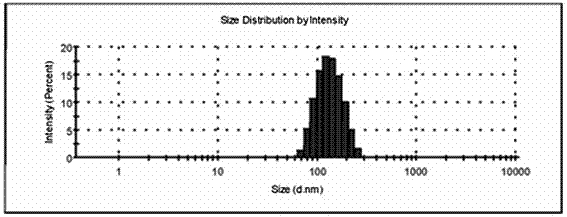
图2为实施例4所制备的负载索拉菲尼的介孔二氧化硅-乳糖醛酸(so@msn-la)的粒径分布图。
图3为介孔二氧化硅(msn)、表面氨基化修饰的介孔二氧化硅(msn-nh2)、活化的乳糖醛酸(la)和负载索拉菲尼的介孔二氧化硅-乳糖醛酸(so@msn-la)的红外吸收光谱图。
图4为介孔二氧化硅(msn)、表面氨基化修饰的介孔二氧化硅(msn-nh2)和负载索拉菲尼的介孔二氧化硅-乳糖醛酸(so@msn-la)的zeta电势图。
图5为不同载药体系中索拉菲尼的累积释放率随时间的变化曲线。
图6为实施例7中mtt实验的结果。
图7为实施例8中细胞凋亡分析实验的结果。
图8为实施例9中细胞摄取实验的结果。
图9为实施例10中细胞转染实验的结果,其中a为在荧光场下的效果图,b为细胞转染率。
具体实施方式
为了使本发明所述的内容更加便于理解,下面结合具体实施方式对本发明所述的技术方案做进一步的说明,但是本发明不仅限于此。
实施例1介孔二氧化硅纳米颗粒的合成
在反应瓶中加入2g十六烷基三乙基溴化铵、0.1g三乙醇胺和20ml去离子水,95℃下反应1h;然后在20-30min内逐滴加入原硅酸四乙酯1.5ml,加毕后于95℃下继续反应1h;反应完后于室温下12000rpm离心15min,得到介孔二氧化硅纳米材料粗品,用去离子水和无水乙醇分别洗涤两次,将所得固体悬浮在酸性乙醇中(浓盐酸:无水乙醇=5:1,v:v),回流24h以除去未反应的十六烷基三乙基溴化铵,离心,用去离子水洗涤,-50℃冷冻干燥,得到介孔二氧化硅纳米颗粒纯品。
图1为所制备介孔二氧化硅纳米颗粒的tem图。从图中可见,其粒径约为100nm。
实施例2表面氨基化修饰的介孔二氧化硅纳米颗粒(msn-nh2)的制备
取100mg实施例1中制得的介孔二氧化硅纳米颗粒溶解于20ml无水乙醇,加入400μg3-氨丙基三乙氧基硅烷,室温搅拌12h,离心,用乙醇多次洗涤以除去未反应的3-氨丙基三乙氧基硅烷,冷冻干燥得到表面氨基修饰的介孔二氧化硅纳米颗粒(msn-nh2)。
实施例3负载索拉菲尼介孔二氧化硅纳米颗粒(so@msn)的制备
取30mg实施例2中制得的msn-nh2溶解在30ml丙酮中,室温下搅拌1h后加入索拉菲尼20mg,再搅拌30min,然后于13000rpm下离心30min,弃去上清液,所得沉淀用去离子水洗涤,冷冻干燥,即得负载索拉菲尼的介孔二氧化硅纳米颗粒(so@msn)。
实施例4负载索拉菲尼的介孔二氧化硅-乳糖醛酸纳米颗粒(so@msn-la)的制备
首先将la活化,即在反应瓶中加入40mg乳糖醛酸、100mg二氯乙烷和0.1mol一水吗啉乙磺酸(mes,ph=6),室温下搅拌24h,即得活化的la。
取30mg实施例3中制得的so@msn、20mln,n-二甲基甲酰胺、100mg1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)和40mgn-羟基琥珀酰亚胺(nhs)于圆底烧瓶中,室温下搅拌4h,然后在混合液中加入2%的la溶液5ml,再搅拌12h,离心,用去离子水洗涤后冷冻干燥,即得负载索拉菲尼的介孔二氧化硅-乳糖醛酸纳米颗粒(so@msn-la)。
图2为所得so@msn-la的粒径分布图。由图2可见,其平均粒径约为150nm。
图3为介孔二氧化硅(msn)、表面氨基化修饰的介孔二氧化硅(msn-nh2)、活化的乳糖醛酸(la)和负载索拉菲尼的介孔二氧化硅-乳糖醛酸(so@msn-la)的红外吸收光谱图。
图4为介孔二氧化硅(msn)、表面氨基化修饰的介孔二氧化硅(msn-nh2)和负载索拉菲尼的介孔二氧化硅-乳糖醛酸(so@msn-la)的zeta电势图。从图4可见,msn的平均zeta电势约为-19mv,msn-nh2的平均zeta电势约为+27mv,即msn氨基化后电势由负值变为正值,表明已成功制备了msn-nh2;而so@msn-la的zeta电势为+17mv。
实施例5负载索拉菲尼/sirna的介孔二氧化硅-乳糖醛酸纳米颗粒(so/sirna@msn-la)的制备
称取20mg实施例4中制得的so@msn-la溶于20ml丙酮中,超声分散10min,然后从中取6μl与2μg的sirna搅拌20min,即得负载索拉菲尼与sirna的介孔二氧化硅-乳糖醛酸纳米颗粒(so/sirna@msn-la)。
实施例6索拉菲尼体外释放度的测定
取索拉菲尼、实施例3制备的so@msn和实施例4制备的so@msn-la各2mg,分别悬浮在2mlph=7.4的pbs缓冲液中,37℃下恒温震荡进行体外释放实验。在不同时间取500μl样液,13000rpm下离心10min后,采用紫外分光光度计在210nm下检测上清液中的索拉菲尼浓度,绘制累积释放百分比与时间的关系图,结果如图5所示。
由图5可知,so@msn与so@msn-la的索拉菲尼释放率没有显著的差异,说明采用乳糖醛酸为靶向分子不会阻碍索拉菲尼的释放。
实施例7mtt实验
首先,分别培养huh7细胞和hepg2细胞,待其处于对数生长期且状态良好时,用胰蛋白酶消化后,血球计数板计数,调整细胞密度为1×105个/ml,配成细胞悬液;按每孔100µl接种到96孔板,周围用pbs封板,置于37℃、5%co2培养箱中隔夜培养;当细胞活性达到80%时加入用培养液孵育的不同浓度梯度的msn-la、so@msn、so@msn-la、so/sirna@msn-la及so,培养24h;去除培养液,加入100μl用无血清无酚红培养基稀释后的mtt溶液,37℃培养4h;取出96孔板,吸出mtt溶液后加入100μldmso,并在摇床上缓慢摇晃10min,摇匀后多功能酶标仪于570nm处检测od值,使用graphpadprism5计算细胞增殖抑制率,结果如图6所示。
由图6可见,msn-la对huh7细胞和hepg2细胞几乎没有抑制作用,而so、so@msn、so@msn-la及so/sirna@msn-la对huh7细胞和hepg2细胞的抑制率依次提高,且随剂量的增加抑制效果更为明显。其中,so@msn-la对huh7细胞和hepg2细胞的细胞抑制效果(处理后细胞活性分别为12%和18%)明显优于so@msn(处理后细胞活性分别为28%和30%),这说明通过在其上偶联乳糖醛酸分子可提高索拉菲尼的抗肿瘤效果;此外,so/sirna@msn-la的抑制效果(处理后细胞活性为4%和7%)较so@msn-la的显著,这说明,与so单独用药相比,so与sirna共负载到纳米粒上可以起到协同增效的治疗效果。
实施例8细胞凋亡分析
细胞凋亡分析由流式细胞法测定。将hepg2细胞接种分别施加到加入有实施例2中制备的msn-nh2(对照)、索拉菲尼、实施例3制备的so@msn、实施例4制备的so@msn-la、实施例5制备的so/sirna@msn-la的6孔板培养液中,调整细胞密度为1×105个/孔板,在37℃下培养24h,然后1500rpm下离心5分钟得到细胞,用pbs洗涤三次,将细胞悬浮在500μl1×结合缓冲液中,用annexin-vfitc与pi体积比为1:1的10μl混合液在黑暗中着色10min,最后得到的样品用流式细胞仪检测,结果如图7所示。
由图7结果表明,无论是早期凋亡还是晚期凋亡,so/sirna@msn-la的促进作用都要比so@msn-la、so@msn以及单独施加索拉菲尼强的多,说明so/sirna@msn-la可以显著提高索拉菲尼和sirna的抗癌效果,即起到协同抗肿瘤的疗效。
实施例9细胞摄取实验
将2mgfitc和20μlaptms加到2ml乙醇中,并在室温下避光搅拌12h,使fitc先与aptes共价偶联;将200mgmsn及msn-la分别溶解在50ml乙醇中并超声30min,再与3mlfitc/aptes乙醇溶液混合,避光搅拌24h,将混合物离心并用纯乙醇洗涤纯化,即得到fitc@msn和fitc@msn-la纳米颗粒。hepg2细胞接种在含dmem培养液400μl的24孔板中,调整细胞密度为5×105个/孔板,37℃下培养24h。当细胞贴壁生长后,弃去培养液,培养盘用pbs洗涤三次,然后,在细胞中分别加入100μg/mlfitc@msn、fitc@msn-la和fitc@msn-la+la,37℃下培养2h。孔板中的细胞用pbs洗涤三次后用hoechst33342将细胞核染色,最后样品用共聚焦显微镜观测,结果如图8所示。
从图8可以看到,fitc@msn-la的荧光强度最大,说明细胞对它的摄取率最高。而fitc@msn-la+la的荧光强度要稍低于fitc@msn-la,说明la能够与fitc@msn-la竞争癌细胞上的受体,进一步证明了la的靶向抗癌作用。
实施例10体外转染实验
将2μgsirna分别加入6μlmsn和6μlmsn-la中,室温下缓慢搅拌20min,即可得到sirna@msn和sirna@msn-la。将hepg2细胞接种到24孔板中,调整细胞密度为5×105个/孔板,培养24h后,在培养液中分别加入sirna及事先制好的sirna@msn和sirna@msn-la,转染48h。转染完毕后,细胞用olympusix71荧光显微镜观测结果并计算转染率,结果如图9所示。
由图9可见,游离sirna的转染率仅为4.5%,低于sirna@msn(23%),说明以纳米颗粒为载体能够提高sirna的稳定性,增强转染率;而sirna@msn-la的转染率高达45%,表明了偶联la可起到靶向抗癌作用。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 大孔径介孔碳/二氧化硅负载金纳米催化剂及其合成方法与流程
- 介孔碳‑二氧化硅复合体负载纳米钯催化剂及其合成方法与流程
- 一种双适配体修饰的介孔二氧化硅靶向载药纳米粒的制作方法与工艺
- 功能化中空介孔二氧化硅纳米微球及其制备方法与在吸附重金属离子中的应用与流程
- 一种原位制备纳米二氧化硅/端羟基聚二甲基硅氧烷杂化材料的方法与流程
- 一种介孔二氧化硅微球的淀粉复合止血敷料的制作方法与工艺
- 介孔二氧化硅负载的高分散镍镧氧化物催化剂的制备方法与流程
- 氨基化介孔二氧化硅‑葡萄糖‑二氧化锰纳米复合材料及其制备方法和应用与流程
- 苯硼酸修饰的介孔二氧化硅/胰岛素纳米粒的制备及应用的制作方法与工艺
- 一种基于介孔纳米二氧化硅的电致化学发光纳米材料及其制备方法与流程